第二章官能团与有机化学反应烃的衍生物单元测试高二下学期鲁科版(2019)化学选择性必修3(含解析)
文档属性
| 名称 | 第二章官能团与有机化学反应烃的衍生物单元测试高二下学期鲁科版(2019)化学选择性必修3(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 416.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:17:50 | ||
图片预览



文档简介
第二章《官能团与有机化学反应 烃的衍生物》检测题
一、单选题(共13题)
1.化合物M叫假蜜环菌甲素,它是香豆素类天然化合物。对M的性质叙述正确的是
A.1molM催化氢化可吸收6molH2
B.1molM在浓H2SO4存在下可与2molCH3COOH反应
C.M可溶于稀NaOH溶液,且加热时发生水解反应
D.M只能与HBr(氢溴酸)发生加成反应
2.下列关于苯酚的叙述中,错误的是
A.其在水中的溶解度随温度的升高而增大,超过65℃可以与水混溶
B.其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗
C.其水溶液显强酸性,俗称石炭酸
D.碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳
3.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物。它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)
A.3 B.4 C.5 D.6
4.有机物M是一种重要的化工原料,结构简式如图所示,下列有关M的说法错误的是
A.分子式为 B.结构中含有三种官能团
C.分子中的所有原子不可能共平面 D.能发生取代反应和加成反应
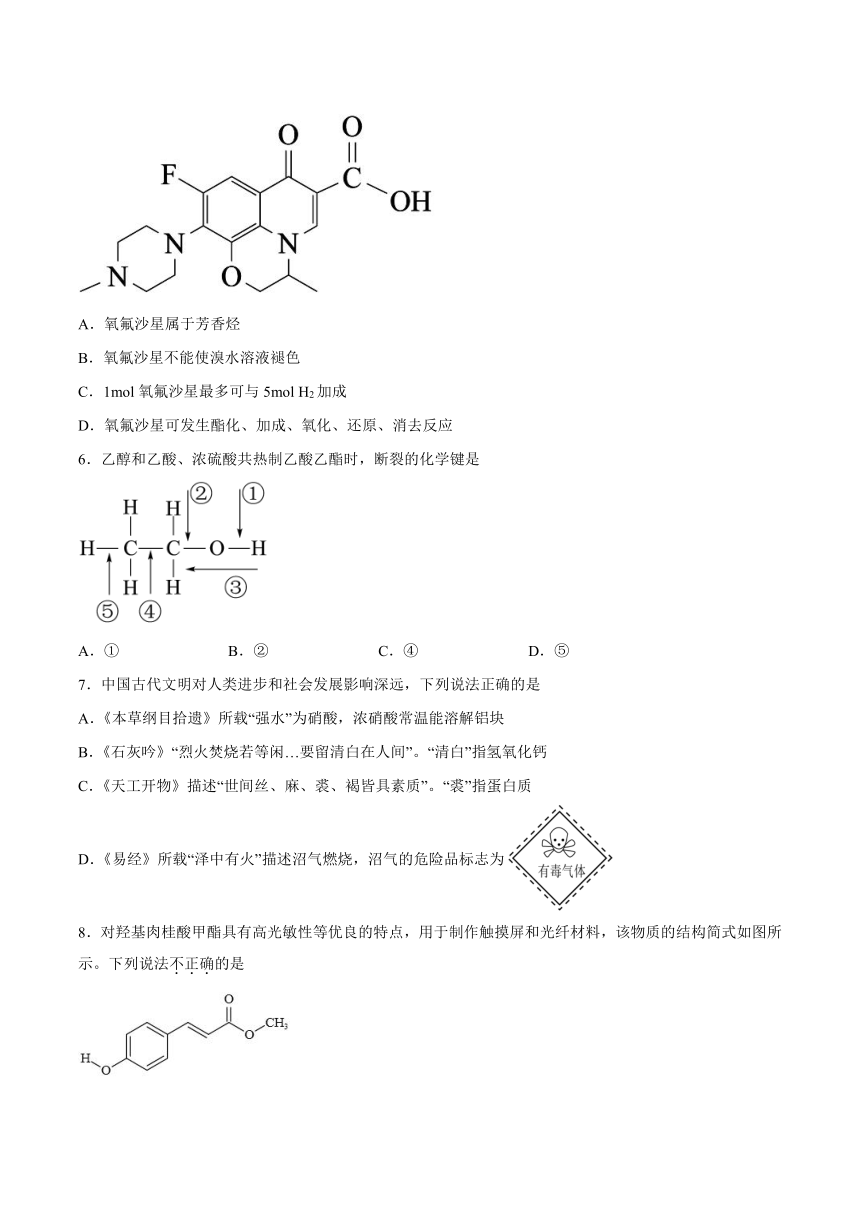
5.氧氟沙星是一种广谱抗菌药物,其结构如图所示,下列有关说法正确的是
A.氧氟沙星属于芳香烃
B.氧氟沙星不能使溴水溶液褪色
C.1mol氧氟沙星最多可与5mol H2加成
D.氧氟沙星可发生酯化、加成、氧化、还原、消去反应
6.乙醇和乙酸、浓硫酸共热制乙酸乙酯时,断裂的化学键是
A.① B.② C.④ D.⑤
7.中国古代文明对人类进步和社会发展影响深远,下列说法正确的是
A.《本草纲目拾遗》所载“强水”为硝酸,浓硝酸常温能溶解铝块
B.《石灰吟》“烈火焚烧若等闲…要留清白在人间”。“清白”指氢氧化钙
C.《天工开物》描述“世间丝、麻、裘、褐皆具素质”。“裘”指蛋白质
D.《易经》所载“泽中有火”描述沼气燃烧,沼气的危险品标志为
8.对羟基肉桂酸甲酯具有高光敏性等优良的特点,用于制作触摸屏和光纤材料,该物质的结构简式如图所示。下列说法不正确的是
A.对羟基肉桂酸甲酯存在顺反异构
B.对羟基肉桂酸甲酯分子与足量加成后分子中含有2个手性碳原子
C.对羟基肉桂酸甲酯分子中化学环境不同的氢原子有6种
D.对羟基肉桂酸甲酯与溶液加热反应,最多消耗
9.X是植物体内普遍存在的天然生长素,在一定条件下可转化为Y,其转化关系如下:
下列说法正确的是
A.X和Y分子中所有原子都可能共平面 B.用溶液可区分X和Y
C.X、Y分子中苯环上一溴代物都只有2种 D.X、Y都能发生水解、加成、取代反应
10.下列关于颜色变化的叙述中, 不正确的是
A.含苯环的蛋白质遇浓硝酸变黄色
B.浓硝酸在光照后变黄色
C.氢气燃烧的火焰因玻璃管口含钠元素而呈黄色
D.苯酚露置较长时间变黄色
11.下列说法中,不正确的是
A.油脂在酸性或碱性条件下水解,都可以得到强亲水性物质甘油
B.用二氧化碳与环氧丙烷制备的高聚物、PLA等产品的广泛使用将有效缓解白色污染
C.合成硝化纤维、醋酸纤维、聚酯纤维均要用到纤维素
D.CH2(NH2)CH2COOH不是α-氨基酸,但它可以缩聚形成高分子化合物
12.实验室制备乙酸丁酯,反应温度要控制在115℃~125℃之间,其他有关数据如下表:
物质 乙酸 1 丁醇 乙酸丁酯 98%浓硫酸
沸点 117.9℃ 117.2℃ 126.3℃ 338.0℃
溶解性 溶于水和有机溶剂 溶于水和有机溶剂 微溶于水,溶于有机溶剂 与水混溶
关于实验室制备乙酸丁酯的叙述正确的是
A.不能边反应边蒸出乙酸丁酯的原因:乙酸丁酯的沸点高
B.不用水浴加热是因为:乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用NaOH溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂分液
13.下列说法中,正确的是
A.甲醇、乙二醇、丙三醇都易溶于水且都有剧毒
B.按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高
C.相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多
D.甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应
二、非选择题(共10题)
14.填空。
(1)1-溴丙烷与2-溴丙烷分别和氢氧化钠醇溶液混合加热,写出所得产物的结构简式:______、______。
(2)1-溴丙烷与2-溴丙烷分别和氢氧化钠水溶液混合加热,写出所得产物的结构简式:_____、______。
15.根据题目要求完成有关填空:
(1)A、B两种有机物分子式都是C9H11NO2。
化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在甲基。则A的结构简式是____________________。
化合物B是某种分子式为C9H12的芳香烃的一硝化后的唯一产物(硝基连在苯环上)。则B的结构简式是____________________。
(2)烷基取代苯()可以被的酸性溶液氧化成()。但若烷基中直接与苯环连接的碳原子上没有键,则不容易被氧化得到羧酸。现有分子式是的一烷基取代苯,已知它可以被氧化为苯甲酸的异构体有7种,其中的3种是:
、、
请写出其它四种同分异构体的结构简式:
_____________________ ; _________________ ;____________________ ;________________________。
三、实验题
16.柠檬酸三正丁酯是微溶于水的无色油状液体,因其无毒、挥发性小的性质可作为环保型增塑剂,已知相对分子质量:柠檬酸-192、 正丁醇-74、柠檬酸三正丁酯-360,实验室制备柠檬酸三正丁酯的原理装置如下:
+ 3CH3CH2CH2CH2OH+3H2O
制备和提纯步骤如下:
①将19.2g柠檬酸固体、45 mL正丁醇(密度0.81 g/mL)和3mL浓硫酸依次加入到仪器A中,并加入几粒沸石;
②加热仪器A中反应液至140~150°C,待反应完成后停止加热;
③把仪器A中液体冷却后用5%的NaOH溶液洗涤并分液;
④有机层减压蒸馏回收正丁醇;
⑤减压蒸馏后的粗产品显淡黄色,依次加入无水氯化钙和活性炭并过滤后得到纯度较高的产品22.5g。
请回答下列问题:
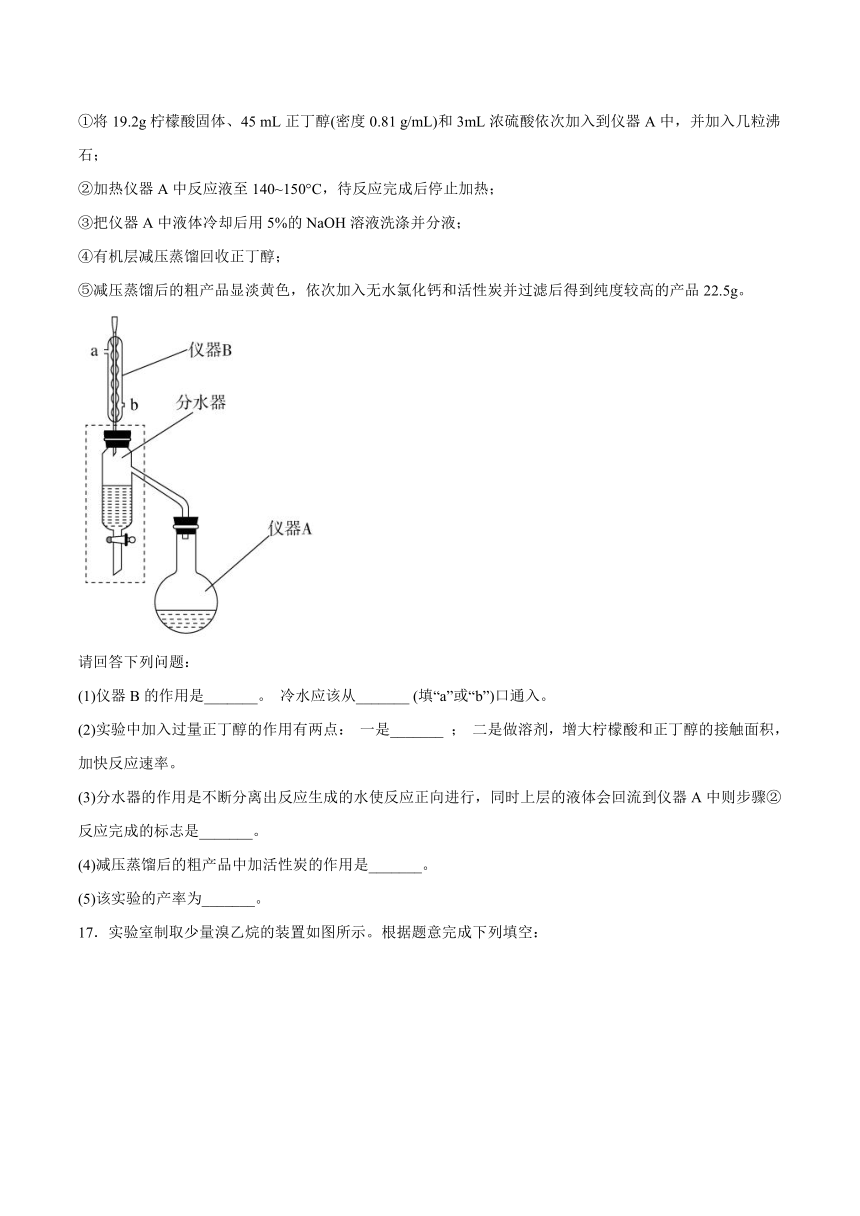
(1)仪器B的作用是_______。 冷水应该从_______ (填“a”或“b”)口通入。
(2)实验中加入过量正丁醇的作用有两点: 一是_______ ; 二是做溶剂,增大柠檬酸和正丁醇的接触面积,加快反应速率。
(3)分水器的作用是不断分离出反应生成的水使反应正向进行,同时上层的液体会回流到仪器A中则步骤②反应完成的标志是_______。
(4)减压蒸馏后的粗产品中加活性炭的作用是_______。
(5)该实验的产率为_______。
17.实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、_______和1:1的硫酸(浓硫酸与水的体积比为1:1)。配制体积比1:1的硫酸所用的定量仪器为______(选填编号)。
a.天平 b.量筒 c.容量瓶 d.碱式滴定管
(2)写出加热时烧瓶中发生的两个主要反应:
请补充完整反应的化学方程式:
①
②________________________。
(3)将生成物导入盛有冰水混合物中,冰水对产物冷却并液封,试管A中的物质分为三层(如上图所示),产物在_______层。
(4)试管A中除了产物和水之外,还可能存在___________(化学式,任意一种)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是____(填序号)。
a.蒸馏 b.用溶液洗涤 c.用萃取 d.用溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是__________________。
(6)实验员老师建议把上述装置中的仪器连接部分的橡胶管改成标准玻璃接口,橡胶塞最好用锡箔包住,其原因是:___________________。
18.己二酸(,相对分子质量为146)是生产尼龙一66的主要原料之一、实验室由环己醇(,相对分子质量为100)制备己二酸的实验原理:3C6H12O(环己醇)+83+8MnO2↓+2OH-+5H2O,实验装置如图(夹持装置等已略)。
实验步骤:
步骤一:向150mL三颈烧瓶内加入50mL0.3mol·L-1氢氧化钠溶液后,置于磁力搅拌器上;边搅拌边将6.320g高锰酸钾(相对分子质量为158)溶解到氢氧化钠溶液中,打开搅拌器的加热开关,在水浴中加热到50~60℃。
步骤二:用滴液漏斗将2.000g环己醇加入三颈烧瓶中,充分反应后,趁热抽滤,洗涤,合并滤液和洗涤液,加浓盐酸至pH为3.0~4.0;分离析出己二酸粗产品。
步骤三:己二酸粗产品经过净化处理,再称重,计算己二酸的产率。
回答下列问题:
(1)装置b的名称为___________,使用时要从___________(填“上口”或“下口”)通入冷水;滴液漏斗的导管a的作用是___________。
(2)步骤二发生的反应是强烈的放热反应,控制反应温度是该步骤的关键,试从试剂投入、装置改进方面,分别提出一条控温的措施:①___________。;②___________。
(3)该反应是强烈的放热反应,但在滴加环己醇之前,要先将高锰酸钾和NaOH混合液预热到50~60℃,其原因是___________。
(4)步骤二中,反应终点的判断方法是用玻璃棒蘸一滴反应混合液点在平铺的滤纸上(点滴试验),若滤纸上呈浅___________色环,表明还有少量KMnO4没有反应完全,再向混合液中加入少量NaHSO3固体,直至点滴试验呈阴性,说明反应达到终点,KMnO4与NaHSO3反应的离子方程式为___________。
(5)将步骤二得到的己二酸粗产品,经步骤三称重,得到其质量为1.533g,则己二酸的产率为___________%。
四、计算题
19.某一氯代烷1.85g,与足量的氢氧化钠溶液混合后加热,充分反应后,用足量硝酸酸化,向酸化后的溶液中加入20mL 1mol L﹣1AgNO3溶液时,不再产生沉淀.
(1)通过计算确定该一氯代烷的分子式_____________________
(2)写出这种一氯代烷的各种同分异构体的结构简式:___________
20.次硫酸钠甲醛(xNaHSO2 yHCHO zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:①准确称取1.5400g样品,完全溶于水配成100mL溶液。②取25.00mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10mol×L-1。③另取25.00mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。次硫酸氢钠和碘反应的方程式如下:xNaHSO2 yHCHO zH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.5825g白色固体时,需要消耗碘的质量为_____。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式_____。
(3)通过计算确定次硫酸氢钠甲醛的组成______(写出计算过程)。
21.将12g某有机物在足量氧气中完全燃烧生成CO2和H2O,并将CO2和H2O通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。
(1)请写出该有机物的分子式___。
(2)请写出该有机物可能的结构简式___。
22.化合物A俗称“吊白块”,年产量上万吨,主要用于染色工艺,具还原性和漂白性,对热不稳定,有毒。近年报道,我国一些不法商人违章地将A添加到米、面、腐竹、食糖等食品中增白,导致多起严重食物中毒事件,如某地曾发生五所学校400余名学生食用含A食品一次性中毒事件。
已知:固体A·2H2O的摩尔质量为154g/mol;
①A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
②A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
③A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1:1),反应产物为A和亚硫酸钠。
④A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式___________。
(2)写出上述制备A的“分子方程式”_____________。
(3)给出A的化学名称_______________。
23.某同学称取9 g淀粉溶于水,测定淀粉的水解百分率。其程序如下:
(1)各步加入的试剂为(写化学式):A________、B________、C________。
(2)若加入A溶液不加入B溶液_______(填“是”或“否”)合理,其理由是_______________。
(3)已知1 mol葡萄糖与新制Cu(OH)2悬浊液反应生成1 mol Cu2O,当生成1.44 g砖红色沉淀时,淀粉的水解率是________。
(4)某淀粉的相对分子质量为13 932,则它是由________个葡萄糖分子缩合而成的。
参考答案:
1.C 2.C 3.B 4.B 5.C 6.A 7.C 8.B 9.B 10.D 11.C 12.A 13.B
14.(1) CH2=CHCH3 CH2=CHCH3
(2) CH3CH2CH2OH CH3CH(OH)CH3
15.(1)
(2)
16.(1) 冷凝回流柠檬酸、正丁醇和柠檬酸三正丁酯 b
(2)增大柠檬酸的转化率
(3)分水器中下层液体(或水面)高度不再发生变化
(4)脱色
(5)62.5%
17.(1) 乙醇 b
(2)
(3)3
(4)
(5) d 乙烯
(6)反应会产生,腐蚀橡胶
18.(1) 冷凝管或球形冷凝管 下口 平衡滴液漏斗液面上方与三颈烧瓶内的气压,使环己醇能够顺利流下
(2) 环己醇要逐滴加入 将三颈烧瓶置于冷水浴中
(3)通过外部加热供给能量,使其达到所需要的活化能
(4) 紫色 2+3+OH-=2MnO2 ↓+3 +2H2O
(5)70
19. C4H9Cl CH3CH2CH2CH2Cl、CH3CH2CHClCH3、CH3CH(CH3)CH2Cl、(CH3)3CCl
20. 1.27g 2HCHO+OH-=CH3OH+HCOO- NaHSO2·HCHO·2H2O
21. C3H8O CH3CH2CH2OH、、CH3CH2OCH3
22.(1)或[HOCH2SO2]- 或或等
(2)Na2S2O4+CH2O+NaOH=HOCH2SO2-Na++Na2SO3或Na2S2O4+CH2O+NaOH=HOCH2SO2Na+Na2SO3或Na2S2O4+CH2O+NaOH=NaSO2CH2OH+Na2SO3
(3)羟甲亚磺酸钠或羟甲基亚磺酸钠
23.(1) H2SO4 NaOH Cu(OH)2
(2) 否 Cu(OH)2悬浊液与葡萄糖的反应必须在碱性条件下进行
(3)18%
(4)86
一、单选题(共13题)
1.化合物M叫假蜜环菌甲素,它是香豆素类天然化合物。对M的性质叙述正确的是
A.1molM催化氢化可吸收6molH2
B.1molM在浓H2SO4存在下可与2molCH3COOH反应
C.M可溶于稀NaOH溶液,且加热时发生水解反应
D.M只能与HBr(氢溴酸)发生加成反应
2.下列关于苯酚的叙述中,错误的是
A.其在水中的溶解度随温度的升高而增大,超过65℃可以与水混溶
B.其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗
C.其水溶液显强酸性,俗称石炭酸
D.碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳
3.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物。它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)
A.3 B.4 C.5 D.6
4.有机物M是一种重要的化工原料,结构简式如图所示,下列有关M的说法错误的是
A.分子式为 B.结构中含有三种官能团
C.分子中的所有原子不可能共平面 D.能发生取代反应和加成反应
5.氧氟沙星是一种广谱抗菌药物,其结构如图所示,下列有关说法正确的是
A.氧氟沙星属于芳香烃
B.氧氟沙星不能使溴水溶液褪色
C.1mol氧氟沙星最多可与5mol H2加成
D.氧氟沙星可发生酯化、加成、氧化、还原、消去反应
6.乙醇和乙酸、浓硫酸共热制乙酸乙酯时,断裂的化学键是
A.① B.② C.④ D.⑤
7.中国古代文明对人类进步和社会发展影响深远,下列说法正确的是
A.《本草纲目拾遗》所载“强水”为硝酸,浓硝酸常温能溶解铝块
B.《石灰吟》“烈火焚烧若等闲…要留清白在人间”。“清白”指氢氧化钙
C.《天工开物》描述“世间丝、麻、裘、褐皆具素质”。“裘”指蛋白质
D.《易经》所载“泽中有火”描述沼气燃烧,沼气的危险品标志为
8.对羟基肉桂酸甲酯具有高光敏性等优良的特点,用于制作触摸屏和光纤材料,该物质的结构简式如图所示。下列说法不正确的是
A.对羟基肉桂酸甲酯存在顺反异构
B.对羟基肉桂酸甲酯分子与足量加成后分子中含有2个手性碳原子
C.对羟基肉桂酸甲酯分子中化学环境不同的氢原子有6种
D.对羟基肉桂酸甲酯与溶液加热反应,最多消耗
9.X是植物体内普遍存在的天然生长素,在一定条件下可转化为Y,其转化关系如下:
下列说法正确的是
A.X和Y分子中所有原子都可能共平面 B.用溶液可区分X和Y
C.X、Y分子中苯环上一溴代物都只有2种 D.X、Y都能发生水解、加成、取代反应
10.下列关于颜色变化的叙述中, 不正确的是
A.含苯环的蛋白质遇浓硝酸变黄色
B.浓硝酸在光照后变黄色
C.氢气燃烧的火焰因玻璃管口含钠元素而呈黄色
D.苯酚露置较长时间变黄色
11.下列说法中,不正确的是
A.油脂在酸性或碱性条件下水解,都可以得到强亲水性物质甘油
B.用二氧化碳与环氧丙烷制备的高聚物、PLA等产品的广泛使用将有效缓解白色污染
C.合成硝化纤维、醋酸纤维、聚酯纤维均要用到纤维素
D.CH2(NH2)CH2COOH不是α-氨基酸,但它可以缩聚形成高分子化合物
12.实验室制备乙酸丁酯,反应温度要控制在115℃~125℃之间,其他有关数据如下表:
物质 乙酸 1 丁醇 乙酸丁酯 98%浓硫酸
沸点 117.9℃ 117.2℃ 126.3℃ 338.0℃
溶解性 溶于水和有机溶剂 溶于水和有机溶剂 微溶于水,溶于有机溶剂 与水混溶
关于实验室制备乙酸丁酯的叙述正确的是
A.不能边反应边蒸出乙酸丁酯的原因:乙酸丁酯的沸点高
B.不用水浴加热是因为:乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用NaOH溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂分液
13.下列说法中,正确的是
A.甲醇、乙二醇、丙三醇都易溶于水且都有剧毒
B.按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高
C.相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多
D.甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应
二、非选择题(共10题)
14.填空。
(1)1-溴丙烷与2-溴丙烷分别和氢氧化钠醇溶液混合加热,写出所得产物的结构简式:______、______。
(2)1-溴丙烷与2-溴丙烷分别和氢氧化钠水溶液混合加热,写出所得产物的结构简式:_____、______。
15.根据题目要求完成有关填空:
(1)A、B两种有机物分子式都是C9H11NO2。
化合物A是天然蛋白质的水解产物,光谱测定显示,分子结构中不存在甲基。则A的结构简式是____________________。
化合物B是某种分子式为C9H12的芳香烃的一硝化后的唯一产物(硝基连在苯环上)。则B的结构简式是____________________。
(2)烷基取代苯()可以被的酸性溶液氧化成()。但若烷基中直接与苯环连接的碳原子上没有键,则不容易被氧化得到羧酸。现有分子式是的一烷基取代苯,已知它可以被氧化为苯甲酸的异构体有7种,其中的3种是:
、、
请写出其它四种同分异构体的结构简式:
_____________________ ; _________________ ;____________________ ;________________________。
三、实验题
16.柠檬酸三正丁酯是微溶于水的无色油状液体,因其无毒、挥发性小的性质可作为环保型增塑剂,已知相对分子质量:柠檬酸-192、 正丁醇-74、柠檬酸三正丁酯-360,实验室制备柠檬酸三正丁酯的原理装置如下:
+ 3CH3CH2CH2CH2OH+3H2O
制备和提纯步骤如下:
①将19.2g柠檬酸固体、45 mL正丁醇(密度0.81 g/mL)和3mL浓硫酸依次加入到仪器A中,并加入几粒沸石;
②加热仪器A中反应液至140~150°C,待反应完成后停止加热;
③把仪器A中液体冷却后用5%的NaOH溶液洗涤并分液;
④有机层减压蒸馏回收正丁醇;
⑤减压蒸馏后的粗产品显淡黄色,依次加入无水氯化钙和活性炭并过滤后得到纯度较高的产品22.5g。
请回答下列问题:
(1)仪器B的作用是_______。 冷水应该从_______ (填“a”或“b”)口通入。
(2)实验中加入过量正丁醇的作用有两点: 一是_______ ; 二是做溶剂,增大柠檬酸和正丁醇的接触面积,加快反应速率。
(3)分水器的作用是不断分离出反应生成的水使反应正向进行,同时上层的液体会回流到仪器A中则步骤②反应完成的标志是_______。
(4)减压蒸馏后的粗产品中加活性炭的作用是_______。
(5)该实验的产率为_______。
17.实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、_______和1:1的硫酸(浓硫酸与水的体积比为1:1)。配制体积比1:1的硫酸所用的定量仪器为______(选填编号)。
a.天平 b.量筒 c.容量瓶 d.碱式滴定管
(2)写出加热时烧瓶中发生的两个主要反应:
请补充完整反应的化学方程式:
①
②________________________。
(3)将生成物导入盛有冰水混合物中,冰水对产物冷却并液封,试管A中的物质分为三层(如上图所示),产物在_______层。
(4)试管A中除了产物和水之外,还可能存在___________(化学式,任意一种)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是____(填序号)。
a.蒸馏 b.用溶液洗涤 c.用萃取 d.用溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是__________________。
(6)实验员老师建议把上述装置中的仪器连接部分的橡胶管改成标准玻璃接口,橡胶塞最好用锡箔包住,其原因是:___________________。
18.己二酸(,相对分子质量为146)是生产尼龙一66的主要原料之一、实验室由环己醇(,相对分子质量为100)制备己二酸的实验原理:3C6H12O(环己醇)+83+8MnO2↓+2OH-+5H2O,实验装置如图(夹持装置等已略)。
实验步骤:
步骤一:向150mL三颈烧瓶内加入50mL0.3mol·L-1氢氧化钠溶液后,置于磁力搅拌器上;边搅拌边将6.320g高锰酸钾(相对分子质量为158)溶解到氢氧化钠溶液中,打开搅拌器的加热开关,在水浴中加热到50~60℃。
步骤二:用滴液漏斗将2.000g环己醇加入三颈烧瓶中,充分反应后,趁热抽滤,洗涤,合并滤液和洗涤液,加浓盐酸至pH为3.0~4.0;分离析出己二酸粗产品。
步骤三:己二酸粗产品经过净化处理,再称重,计算己二酸的产率。
回答下列问题:
(1)装置b的名称为___________,使用时要从___________(填“上口”或“下口”)通入冷水;滴液漏斗的导管a的作用是___________。
(2)步骤二发生的反应是强烈的放热反应,控制反应温度是该步骤的关键,试从试剂投入、装置改进方面,分别提出一条控温的措施:①___________。;②___________。
(3)该反应是强烈的放热反应,但在滴加环己醇之前,要先将高锰酸钾和NaOH混合液预热到50~60℃,其原因是___________。
(4)步骤二中,反应终点的判断方法是用玻璃棒蘸一滴反应混合液点在平铺的滤纸上(点滴试验),若滤纸上呈浅___________色环,表明还有少量KMnO4没有反应完全,再向混合液中加入少量NaHSO3固体,直至点滴试验呈阴性,说明反应达到终点,KMnO4与NaHSO3反应的离子方程式为___________。
(5)将步骤二得到的己二酸粗产品,经步骤三称重,得到其质量为1.533g,则己二酸的产率为___________%。
四、计算题
19.某一氯代烷1.85g,与足量的氢氧化钠溶液混合后加热,充分反应后,用足量硝酸酸化,向酸化后的溶液中加入20mL 1mol L﹣1AgNO3溶液时,不再产生沉淀.
(1)通过计算确定该一氯代烷的分子式_____________________
(2)写出这种一氯代烷的各种同分异构体的结构简式:___________
20.次硫酸钠甲醛(xNaHSO2 yHCHO zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:①准确称取1.5400g样品,完全溶于水配成100mL溶液。②取25.00mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10mol×L-1。③另取25.00mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。次硫酸氢钠和碘反应的方程式如下:xNaHSO2 yHCHO zH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.5825g白色固体时,需要消耗碘的质量为_____。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式_____。
(3)通过计算确定次硫酸氢钠甲醛的组成______(写出计算过程)。
21.将12g某有机物在足量氧气中完全燃烧生成CO2和H2O,并将CO2和H2O通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。
(1)请写出该有机物的分子式___。
(2)请写出该有机物可能的结构简式___。
22.化合物A俗称“吊白块”,年产量上万吨,主要用于染色工艺,具还原性和漂白性,对热不稳定,有毒。近年报道,我国一些不法商人违章地将A添加到米、面、腐竹、食糖等食品中增白,导致多起严重食物中毒事件,如某地曾发生五所学校400余名学生食用含A食品一次性中毒事件。
已知:固体A·2H2O的摩尔质量为154g/mol;
①A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
②A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
③A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1:1),反应产物为A和亚硫酸钠。
④A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式___________。
(2)写出上述制备A的“分子方程式”_____________。
(3)给出A的化学名称_______________。
23.某同学称取9 g淀粉溶于水,测定淀粉的水解百分率。其程序如下:
(1)各步加入的试剂为(写化学式):A________、B________、C________。
(2)若加入A溶液不加入B溶液_______(填“是”或“否”)合理,其理由是_______________。
(3)已知1 mol葡萄糖与新制Cu(OH)2悬浊液反应生成1 mol Cu2O,当生成1.44 g砖红色沉淀时,淀粉的水解率是________。
(4)某淀粉的相对分子质量为13 932,则它是由________个葡萄糖分子缩合而成的。
参考答案:
1.C 2.C 3.B 4.B 5.C 6.A 7.C 8.B 9.B 10.D 11.C 12.A 13.B
14.(1) CH2=CHCH3 CH2=CHCH3
(2) CH3CH2CH2OH CH3CH(OH)CH3
15.(1)
(2)
16.(1) 冷凝回流柠檬酸、正丁醇和柠檬酸三正丁酯 b
(2)增大柠檬酸的转化率
(3)分水器中下层液体(或水面)高度不再发生变化
(4)脱色
(5)62.5%
17.(1) 乙醇 b
(2)
(3)3
(4)
(5) d 乙烯
(6)反应会产生,腐蚀橡胶
18.(1) 冷凝管或球形冷凝管 下口 平衡滴液漏斗液面上方与三颈烧瓶内的气压,使环己醇能够顺利流下
(2) 环己醇要逐滴加入 将三颈烧瓶置于冷水浴中
(3)通过外部加热供给能量,使其达到所需要的活化能
(4) 紫色 2+3+OH-=2MnO2 ↓+3 +2H2O
(5)70
19. C4H9Cl CH3CH2CH2CH2Cl、CH3CH2CHClCH3、CH3CH(CH3)CH2Cl、(CH3)3CCl
20. 1.27g 2HCHO+OH-=CH3OH+HCOO- NaHSO2·HCHO·2H2O
21. C3H8O CH3CH2CH2OH、、CH3CH2OCH3
22.(1)或[HOCH2SO2]- 或或等
(2)Na2S2O4+CH2O+NaOH=HOCH2SO2-Na++Na2SO3或Na2S2O4+CH2O+NaOH=HOCH2SO2Na+Na2SO3或Na2S2O4+CH2O+NaOH=NaSO2CH2OH+Na2SO3
(3)羟甲亚磺酸钠或羟甲基亚磺酸钠
23.(1) H2SO4 NaOH Cu(OH)2
(2) 否 Cu(OH)2悬浊液与葡萄糖的反应必须在碱性条件下进行
(3)18%
(4)86
