第三章有机合成及其应用合成高分子化合物检测题高二下学期化学鲁科版(2019)选择性必修3(含解析)
文档属性
| 名称 | 第三章有机合成及其应用合成高分子化合物检测题高二下学期化学鲁科版(2019)选择性必修3(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 897.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:18:54 | ||
图片预览




文档简介
第三章《有机合成及其应用 合成高分子化合物》检测题
一、单选题(共13题)
1.下列说法正确的是
A.乙烯和聚乙烯均能使酸性高锰酸钾溶液褪色
B.聚丙烯为混合物,由-CH2-CH2-CH2 单元重复连接而成
C.相对分子质量为28000的聚乙烯的聚合度为1000
D.天然橡胶比硫化橡胶具有更好的强度、弹性和化学稳定性
2.山梨酸(CH3-CH=CH-CH=CH-COOH)是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是
A.可与钠、碳酸钠溶液反应 B.可与溴的四氯化碳溶液发生取代反应
C.可与新制 Cu(OH)2悬浊液反应 D.可生成高分子化合物
3.某物质可能含有(a)甲酸、(b)乙酸、(c)甲醇、(d)甲酸甲酯四种物质中的一种或几种,在鉴别时有下列操作和现象:①与银氨溶液反应有银镜产生;②加入新制悬浊液,沉淀不溶解;③与含酚酞的溶液共热,发现溶液中红色逐渐变浅至无色。下列叙述正确的是
A.该物质中a、b、c、d都有 B.该物质中只有a、d
C.该物质中一定有d,无法确定是否有c D.该物质中只有a、c
4.有机物Z是合成药物的中间体,Z的合成路线如下。下列说法正确的是
+
A.该反应为取代反应
B.能最多能与反应
C.化合物Y可以发生加成、取代反应,不能发生氧化反应
D.可以使用溶液鉴别化合物Y和Z
5.香豆素类化合物在生物、医药高分子领域都有非常广泛的应用。q是一种香豆素衍生物。
下列有关物质的叙述正确的是
A.有机物o既是乙醇的同系物也是乙二酸的同系物
B.p和q均可与氢气发生加成反应,且产物中均含有手性碳原子
C.q能发生水解反应,1mol水解产物能与3mol Br2发生加成反应
D.o、p、q分子中均存在2种含氧官能团
6.某有机物X对氢气的相对密度为30,分子中碳的质量分数为40%,氢的质量分数为6.7%,其余为氧,X可与碳酸氢钠反应。下列关于X的说法不正确的是
A.X的相对分子质量为60
B.X的分子式为C2H4O2
C.X的结构简式为CH3COOH
D.X的同分异构体中含的只有一种(不考虑立体异构)
7.异戊酸薄荷酯()是一种治疗心脏病的药物,下列说法中正确的是
A.异戊酸薄荷酯的分子式为C15H26O2
B.该物质属于芳香族化合物
C.异戊酸薄荷酯和油脂互为同系物
D.异戊酸的羧酸类同类异构体有3种(不包括其本身)
8.某有机物的结构为下图所示,这种有机物不可能具有的性质是
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应
A.①②③④ B.④⑤ C.⑤⑥ D.只有⑥
9.有机物A()是制取导电高分子PPV()的原料之一,下列说法正确的是
A.PPV是聚苯乙炔
B.通常条件下1molA最多可与5molBr2发生反应
C.lmolPPV最多可与4nmolH2加成
D.PPV与聚苯乙烯的最小结构单元组成相同
10.下列说法正确的是
A.按系统命名法,化合物CH3CH(C2H5)CH(CH3)2的名称为2—甲基—2—乙基丁烷
B.某有机物含有C、H、O、N四种元素,其球棍模型为,该有机物的结构简式为
C.七叶内酯()和东莨菪内酯()都是某些中草药中的成分,它们具有相同的官能团,互为同系物
D.S—诱抗素的结构简式为:,则1molS—诱抗素与足量氢氧化钠溶液反应时,最多消耗3molNaOH
11.北京冬奥会场馆建设中用到的一种耐腐蚀、耐高温的绿色环保表面涂料是以某双环烯酯为原料制得的,该双环烯酯的结构如图所示。下列说法正确的是
A.该双环烯酯分子中有3个手性碳原子
B.该双环烯酯分子式为
C.该双环烯酯的一氯代物有11种
D.该双环烯酯能发生氧化反应、水解反应、加聚反应
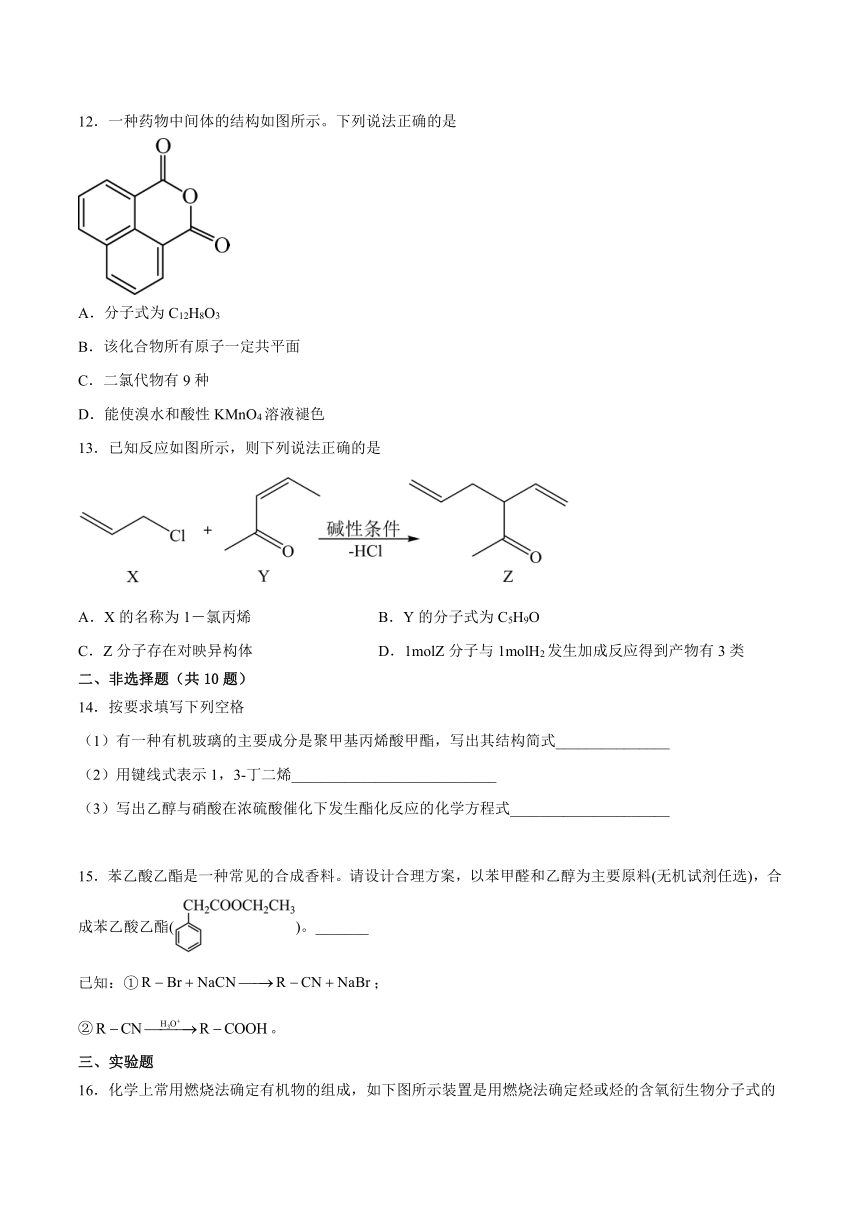
12.一种药物中间体的结构如图所示。下列说法正确的是
A.分子式为C12H8O3
B.该化合物所有原子一定共平面
C.二氯代物有9种
D.能使溴水和酸性KMnO4溶液褪色
13.已知反应如图所示,则下列说法正确的是
A.X的名称为1-氯丙烯 B.Y的分子式为C5H9O
C.Z分子存在对映异构体 D.1molZ分子与1molH2发生加成反应得到产物有3类
二、非选择题(共10题)
14.按要求填写下列空格
(1)有一种有机玻璃的主要成分是聚甲基丙烯酸甲酯,写出其结构简式_______________
(2)用键线式表示1,3-丁二烯___________________________
(3)写出乙醇与硝酸在浓硫酸催化下发生酯化反应的化学方程式_____________________
15.苯乙酸乙酯是一种常见的合成香料。请设计合理方案,以苯甲醛和乙醇为主要原料(无机试剂任选),合成苯乙酸乙酯()。_______
已知:①;
②。
三、实验题
16.化学上常用燃烧法确定有机物的组成,如下图所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
完成下列问题:
(1)A中发生反应的化学方程式为_______________________________________。
(2)B装置的作用是_______________________________________________,燃烧管C中CuO的作用是______________________________________________________。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E的连接顺序是:C→________→__________。
(4)反应结束后,从A装置锥形瓶内的剩余物质中分离出固体,需要进行的实验操作是_____________。
(5)准确称取 1.8 g 烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加 2.64 g ,E管质量增加 1.08 g ,则该有机物的实验式是___________________________。实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为_________________________,1 mol X分别与足量Na、NaHCO 3 反应放出的气体在相同条件下的体积比为1∶1,X可能的结构简式为____________________。
17.通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。如图所示的是用燃烧法确定有机物分子式的常用装置。
现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重1.76g,管增重0.36g。请回答:
(1)用该方法可测定含有哪些元素的有机物:___________。
(2)分离和提纯固体有机物的一个操作方法是重结晶,为何要在静置条件下结晶?_______。
(3)A、B管内均盛有固态试剂,B管的作用是___________。
(4)根据气流方向将装置进行连接,连接的顺序是___________。
(5)E中应盛装的试剂能使硫酸酸化的高锰酸钾溶液褪色,写出该反应的离子方程式_____。
(6)如果把CuO网去掉,A管增重将___________(填“增大”“减小”或“不变”)。
(7)某同学认为A和空气相通,会影响测定结果准确性,应在A后再增加一个A装置,其主要目的是________。
(8)该有机物的最简式为___________。(写出计算过程)。
四、计算题
18.按要求填空:
(1)用系统命法命名
①_______。
② (CH3)2C=C(CH3)2_______。
(2)顺-2-丁烯的结构简式为:_______。
(3)3-甲基-1-丁烯的结构简式为:_______。
(4)燃烧3克某有机物生成0.1mol CO2和1.8克H2O,该有机物的蒸气对H2的相对密度为30,则该有机物的化学式为:_______。
19.5.8g甲完全燃烧可产生0.3mol CO2和0.3mol H2O,甲蒸气对氢气的相对密度是29,
求甲的分子式是?______
20.某有机物A在相同条件下的密度是氢气的23倍,取11.5g A充分燃烧,燃烧产物依次通过浓硫酸和碱石灰,通过分析浓硫酸和碱石灰实验前后质量的变化,测得浓硫酸增重13.5g,碱石灰增重22.0g。
试求:
(1)该有机物A的相对分子量______;
(2)试写出A的分子式______。
21.0.2mol有机物和0.4molO2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,浓H2SO4质量增加10.8g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2g,最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g。
(1)试推断该有机物的分子式。_____________。
(2)若0.2mol该有机物恰好能与9.2g金属钠完全反应,试确定该有机物的结构简式。_____________。
22.图中反应是制备的一种方法,其副产物是优质的镁资源。回答下列问题:
所含元素的简单离子半径由小到大的顺序除外:______。
Mg在元素周期表中的位置;______,的电子式:______。
的化学式为______,反应的必备条件是______。上图中可以循环使用的物质有______。
在一定条件下,由和反应生成和一种固体耐磨材料______写化学式。
为实现燃煤脱硫,向煤中加入浆状,使燃烧产生的转化为稳定的Mg化合物,写出该反应的化学方程式:______。
用Mg制成的格氏试剂 常用于有机合成,例如制备醇类化合物的合成路线如下:
RBrRMgBr:烃基;R’:烃基或
依据上述信息,写出制备所需醛的可能结构简式:______。
23.(1)互为同分异构体的四种有机物A、B、C、D,相对分子质量为74,完全燃烧只生成CO2和H2O,经分析其含氧元素的质量分数为43.3%,则这些有机物的分子式为__________,
(2)已知A、B、C、D分子结构中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
NaOH溶液 银氨溶液 新制Cu(OH)2 金属钠
A 中和反应 —— 溶解 产生氢气
B —— 有银镜 加热后有红色沉淀 产生氢气
C 水解反应 有银镜 加热后有红色沉淀 ——
D 水解反应 —— —— ——
①写出由稀氨水和硝酸银稀溶液制备银氨溶液的化学方程式__________________________
②写出B与新制Cu(OH)2悬浊液反应的化学方程式_____________________________________
③B在浓硫酸存在的条件下能反应生成E,写出以E作原料在一定条件下制备高分子化合物的化学方程式__。
参考答案:
1.C 2.B 3.C 4.B 5.D 6.D 7.D 8.D 9.C 10.B 11.D 12.C 13.C
14. C2H5OH+HO-NO2 C2H5O-NO2+H2O
15.
16. 2H2O2H2O+O2↑ 吸收氧气中的水蒸气(或答:干燥氧气) 使有机物不完全燃烧的产物全部转化为CO2 和H2 O E D 过滤 CH2 O C3 H6 O3 HOCH 2 CH 2 COOH、
17.(1)含C、H或C、H、O元素的有机物
(2)得到较大的晶体,减少吸附的杂质
(3)吸收燃烧后产生的(g)
(4)g接f,e接h,i接c(或d),d(或c)接a(或b)
(5)
(6)减小
(7)吸收空气中的二氧化碳和水蒸气
(8)
18. 3,3,6-三甲基辛烷 2,3-二甲基2-丁烯 C2H4O2
19.C3H6O
20.(1)46
(2)C2H6O
21. C2H6O2 CH2OHCH2OH
22. 第三周期ⅡA族 熔融、电解 、 SiC ,
23. C3H6O2 AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O CH3CH(OH)CHO+2Cu(OH)2+NaOHCH3CH(OH)COONa+Cu2O↓+3H2O nCH2=CHCOOH
一、单选题(共13题)
1.下列说法正确的是
A.乙烯和聚乙烯均能使酸性高锰酸钾溶液褪色
B.聚丙烯为混合物,由-CH2-CH2-CH2 单元重复连接而成
C.相对分子质量为28000的聚乙烯的聚合度为1000
D.天然橡胶比硫化橡胶具有更好的强度、弹性和化学稳定性
2.山梨酸(CH3-CH=CH-CH=CH-COOH)是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是
A.可与钠、碳酸钠溶液反应 B.可与溴的四氯化碳溶液发生取代反应
C.可与新制 Cu(OH)2悬浊液反应 D.可生成高分子化合物
3.某物质可能含有(a)甲酸、(b)乙酸、(c)甲醇、(d)甲酸甲酯四种物质中的一种或几种,在鉴别时有下列操作和现象:①与银氨溶液反应有银镜产生;②加入新制悬浊液,沉淀不溶解;③与含酚酞的溶液共热,发现溶液中红色逐渐变浅至无色。下列叙述正确的是
A.该物质中a、b、c、d都有 B.该物质中只有a、d
C.该物质中一定有d,无法确定是否有c D.该物质中只有a、c
4.有机物Z是合成药物的中间体,Z的合成路线如下。下列说法正确的是
+
A.该反应为取代反应
B.能最多能与反应
C.化合物Y可以发生加成、取代反应,不能发生氧化反应
D.可以使用溶液鉴别化合物Y和Z
5.香豆素类化合物在生物、医药高分子领域都有非常广泛的应用。q是一种香豆素衍生物。
下列有关物质的叙述正确的是
A.有机物o既是乙醇的同系物也是乙二酸的同系物
B.p和q均可与氢气发生加成反应,且产物中均含有手性碳原子
C.q能发生水解反应,1mol水解产物能与3mol Br2发生加成反应
D.o、p、q分子中均存在2种含氧官能团
6.某有机物X对氢气的相对密度为30,分子中碳的质量分数为40%,氢的质量分数为6.7%,其余为氧,X可与碳酸氢钠反应。下列关于X的说法不正确的是
A.X的相对分子质量为60
B.X的分子式为C2H4O2
C.X的结构简式为CH3COOH
D.X的同分异构体中含的只有一种(不考虑立体异构)
7.异戊酸薄荷酯()是一种治疗心脏病的药物,下列说法中正确的是
A.异戊酸薄荷酯的分子式为C15H26O2
B.该物质属于芳香族化合物
C.异戊酸薄荷酯和油脂互为同系物
D.异戊酸的羧酸类同类异构体有3种(不包括其本身)
8.某有机物的结构为下图所示,这种有机物不可能具有的性质是
①可以燃烧;②能使酸性KMnO4溶液褪色;③能跟NaOH溶液反应;④能发生酯化反应;⑤能发生加聚反应;⑥能发生水解反应
A.①②③④ B.④⑤ C.⑤⑥ D.只有⑥
9.有机物A()是制取导电高分子PPV()的原料之一,下列说法正确的是
A.PPV是聚苯乙炔
B.通常条件下1molA最多可与5molBr2发生反应
C.lmolPPV最多可与4nmolH2加成
D.PPV与聚苯乙烯的最小结构单元组成相同
10.下列说法正确的是
A.按系统命名法,化合物CH3CH(C2H5)CH(CH3)2的名称为2—甲基—2—乙基丁烷
B.某有机物含有C、H、O、N四种元素,其球棍模型为,该有机物的结构简式为
C.七叶内酯()和东莨菪内酯()都是某些中草药中的成分,它们具有相同的官能团,互为同系物
D.S—诱抗素的结构简式为:,则1molS—诱抗素与足量氢氧化钠溶液反应时,最多消耗3molNaOH
11.北京冬奥会场馆建设中用到的一种耐腐蚀、耐高温的绿色环保表面涂料是以某双环烯酯为原料制得的,该双环烯酯的结构如图所示。下列说法正确的是
A.该双环烯酯分子中有3个手性碳原子
B.该双环烯酯分子式为
C.该双环烯酯的一氯代物有11种
D.该双环烯酯能发生氧化反应、水解反应、加聚反应
12.一种药物中间体的结构如图所示。下列说法正确的是
A.分子式为C12H8O3
B.该化合物所有原子一定共平面
C.二氯代物有9种
D.能使溴水和酸性KMnO4溶液褪色
13.已知反应如图所示,则下列说法正确的是
A.X的名称为1-氯丙烯 B.Y的分子式为C5H9O
C.Z分子存在对映异构体 D.1molZ分子与1molH2发生加成反应得到产物有3类
二、非选择题(共10题)
14.按要求填写下列空格
(1)有一种有机玻璃的主要成分是聚甲基丙烯酸甲酯,写出其结构简式_______________
(2)用键线式表示1,3-丁二烯___________________________
(3)写出乙醇与硝酸在浓硫酸催化下发生酯化反应的化学方程式_____________________
15.苯乙酸乙酯是一种常见的合成香料。请设计合理方案,以苯甲醛和乙醇为主要原料(无机试剂任选),合成苯乙酸乙酯()。_______
已知:①;
②。
三、实验题
16.化学上常用燃烧法确定有机物的组成,如下图所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
完成下列问题:
(1)A中发生反应的化学方程式为_______________________________________。
(2)B装置的作用是_______________________________________________,燃烧管C中CuO的作用是______________________________________________________。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E的连接顺序是:C→________→__________。
(4)反应结束后,从A装置锥形瓶内的剩余物质中分离出固体,需要进行的实验操作是_____________。
(5)准确称取 1.8 g 烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加 2.64 g ,E管质量增加 1.08 g ,则该有机物的实验式是___________________________。实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为_________________________,1 mol X分别与足量Na、NaHCO 3 反应放出的气体在相同条件下的体积比为1∶1,X可能的结构简式为____________________。
17.通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。如图所示的是用燃烧法确定有机物分子式的常用装置。
现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重1.76g,管增重0.36g。请回答:
(1)用该方法可测定含有哪些元素的有机物:___________。
(2)分离和提纯固体有机物的一个操作方法是重结晶,为何要在静置条件下结晶?_______。
(3)A、B管内均盛有固态试剂,B管的作用是___________。
(4)根据气流方向将装置进行连接,连接的顺序是___________。
(5)E中应盛装的试剂能使硫酸酸化的高锰酸钾溶液褪色,写出该反应的离子方程式_____。
(6)如果把CuO网去掉,A管增重将___________(填“增大”“减小”或“不变”)。
(7)某同学认为A和空气相通,会影响测定结果准确性,应在A后再增加一个A装置,其主要目的是________。
(8)该有机物的最简式为___________。(写出计算过程)。
四、计算题
18.按要求填空:
(1)用系统命法命名
①_______。
② (CH3)2C=C(CH3)2_______。
(2)顺-2-丁烯的结构简式为:_______。
(3)3-甲基-1-丁烯的结构简式为:_______。
(4)燃烧3克某有机物生成0.1mol CO2和1.8克H2O,该有机物的蒸气对H2的相对密度为30,则该有机物的化学式为:_______。
19.5.8g甲完全燃烧可产生0.3mol CO2和0.3mol H2O,甲蒸气对氢气的相对密度是29,
求甲的分子式是?______
20.某有机物A在相同条件下的密度是氢气的23倍,取11.5g A充分燃烧,燃烧产物依次通过浓硫酸和碱石灰,通过分析浓硫酸和碱石灰实验前后质量的变化,测得浓硫酸增重13.5g,碱石灰增重22.0g。
试求:
(1)该有机物A的相对分子量______;
(2)试写出A的分子式______。
21.0.2mol有机物和0.4molO2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,浓H2SO4质量增加10.8g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2g,最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g。
(1)试推断该有机物的分子式。_____________。
(2)若0.2mol该有机物恰好能与9.2g金属钠完全反应,试确定该有机物的结构简式。_____________。
22.图中反应是制备的一种方法,其副产物是优质的镁资源。回答下列问题:
所含元素的简单离子半径由小到大的顺序除外:______。
Mg在元素周期表中的位置;______,的电子式:______。
的化学式为______,反应的必备条件是______。上图中可以循环使用的物质有______。
在一定条件下,由和反应生成和一种固体耐磨材料______写化学式。
为实现燃煤脱硫,向煤中加入浆状,使燃烧产生的转化为稳定的Mg化合物,写出该反应的化学方程式:______。
用Mg制成的格氏试剂 常用于有机合成,例如制备醇类化合物的合成路线如下:
RBrRMgBr:烃基;R’:烃基或
依据上述信息,写出制备所需醛的可能结构简式:______。
23.(1)互为同分异构体的四种有机物A、B、C、D,相对分子质量为74,完全燃烧只生成CO2和H2O,经分析其含氧元素的质量分数为43.3%,则这些有机物的分子式为__________,
(2)已知A、B、C、D分子结构中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
NaOH溶液 银氨溶液 新制Cu(OH)2 金属钠
A 中和反应 —— 溶解 产生氢气
B —— 有银镜 加热后有红色沉淀 产生氢气
C 水解反应 有银镜 加热后有红色沉淀 ——
D 水解反应 —— —— ——
①写出由稀氨水和硝酸银稀溶液制备银氨溶液的化学方程式__________________________
②写出B与新制Cu(OH)2悬浊液反应的化学方程式_____________________________________
③B在浓硫酸存在的条件下能反应生成E,写出以E作原料在一定条件下制备高分子化合物的化学方程式__。
参考答案:
1.C 2.B 3.C 4.B 5.D 6.D 7.D 8.D 9.C 10.B 11.D 12.C 13.C
14. C2H5OH+HO-NO2 C2H5O-NO2+H2O
15.
16. 2H2O2H2O+O2↑ 吸收氧气中的水蒸气(或答:干燥氧气) 使有机物不完全燃烧的产物全部转化为CO2 和H2 O E D 过滤 CH2 O C3 H6 O3 HOCH 2 CH 2 COOH、
17.(1)含C、H或C、H、O元素的有机物
(2)得到较大的晶体,减少吸附的杂质
(3)吸收燃烧后产生的(g)
(4)g接f,e接h,i接c(或d),d(或c)接a(或b)
(5)
(6)减小
(7)吸收空气中的二氧化碳和水蒸气
(8)
18. 3,3,6-三甲基辛烷 2,3-二甲基2-丁烯 C2H4O2
19.C3H6O
20.(1)46
(2)C2H6O
21. C2H6O2 CH2OHCH2OH
22. 第三周期ⅡA族 熔融、电解 、 SiC ,
23. C3H6O2 AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O CH3CH(OH)CHO+2Cu(OH)2+NaOHCH3CH(OH)COONa+Cu2O↓+3H2O nCH2=CHCOOH
