第二章烃单元测试题高二上学期人教版(2019)化学选择性必修3(含解析)
文档属性
| 名称 | 第二章烃单元测试题高二上学期人教版(2019)化学选择性必修3(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 996.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:19:13 | ||
图片预览




文档简介
第二章《烃》测试题
一、单选题(共13题)
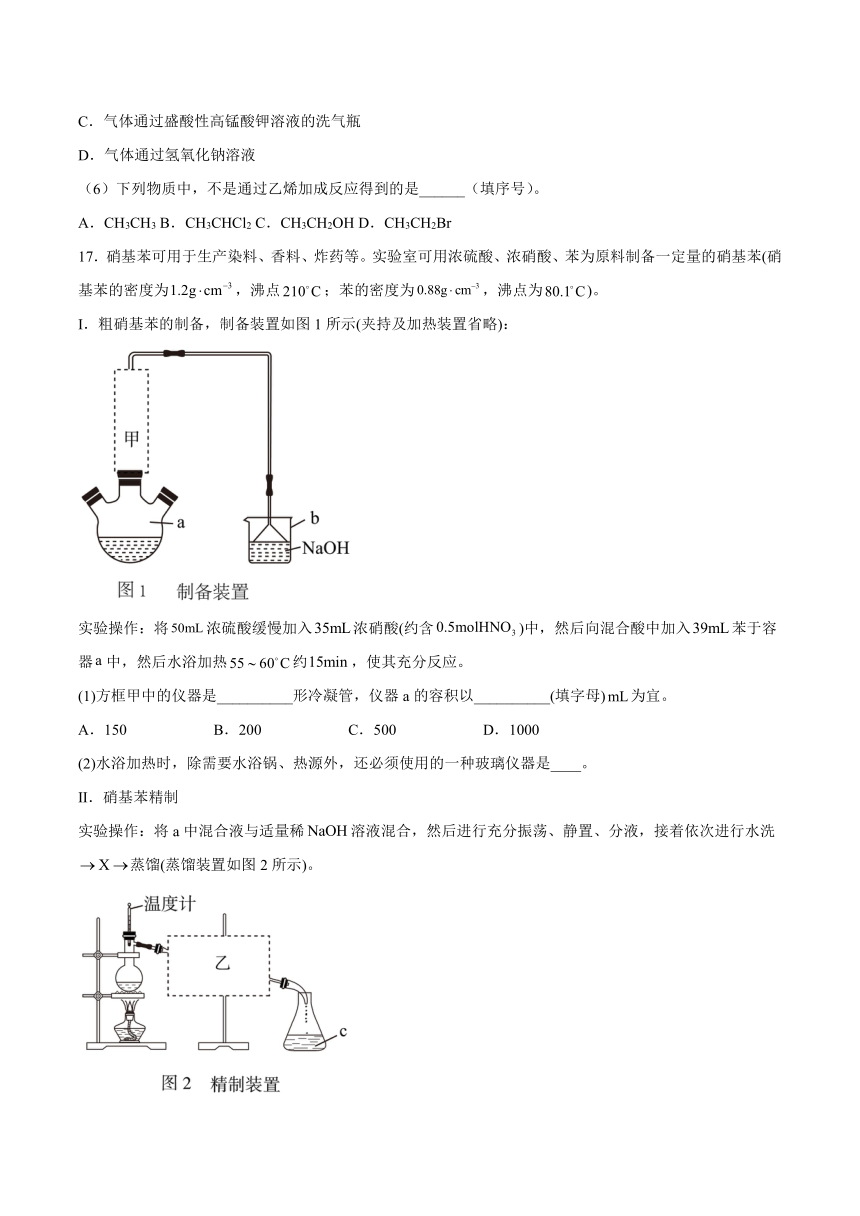
1.溴苯是一种化工原料,实验室合成溴苯的装置如图,关于溴苯的性质及制备,有关说法不正确的是
A.实验开始后,a中上部有白雾生成,下部有褐色油状物生成
B.b为恒压滴液漏斗,便于其中液体顺利滴下
C.c为球形冷凝管,冷凝水应从上口接入
D.粗溴苯的提纯步骤可以是:水洗→NaOH溶液洗→水洗→加CaCl2过滤→蒸馏
2.根据下表中烃的分子式的排列规律,判断空格中烃的同分异构体的数目是( )
1 2 3 4 5 6 7 8
A.3 B.4 C.5 D.6
3.在通常条件下可与乙烯发生反应的物质是
A.食盐溶液 B.稀盐酸
C.氢氧化钠溶液 D.溴的四氯化碳溶液
4.下列各组物质中,能用酸性高锰酸钾溶液鉴别的是
A.乙烯、乙炔 B.己烯、苯 C.己烷、苯 D.己烯、甲苯
5.化学制备萘()的合成过程如图,下列说法正确的是
A.a的分子式是C10H12O B.萘的二氯代物有10种
C.b的所有碳原子可能处于同一平面 D.a→b的反应类型为加成反应
6.室温下,实验室用如图装置探究甲烷与氯气的反应,实验中观察不到的现象是
A.强光照射能较快看到白雾
B.若试管套上黑色纸套,试管内气体颜色逐渐变浅
C.水槽底部可能有少量晶体
D.充分反应后试管中仍有气体
7.下列说法不正确的是
A.乙烯使Br2/CCl4溶液、酸性高锰酸钾溶液褪色的原因是不同的
B.1-丁烯、2-丁烯与H2加成后的产物相同
C.乙烯水化生成乙醇与乙烯氧化生成乙醛的反应条件相同
D.Mg3N2与水反应能生成Mg(OH)2和NH3,则CaC2与水反应能生成Ca(OH)2和CH≡CH
8.下列烷烃中沸点最高的是
A.CH3C(CH3)2CH3 B.CH3CH2CH2CH(CH3)CH3
C.CH3CH(CH3)CH(CH3)CH3 D.CH3(CH2)3CH3
9.下列有关说法不正确的是
A.乙烯的化学性质比乙烷活泼是因为乙烯分子中含有碳碳双键
B.乙烯分子的碳碳双键中有一个键容易断裂,能与溴水发生加成反应
C.1mol乙烯与氯气完全加成后,产物再与氯气彻底取代,两个过程中共消耗氯气5mol
D.四氯乙烯()和聚四氟乙烯()都能使酸性高锰酸钾溶液褪色
10.有机物A的结构简式为,该物质可由炔烃B与H2加成获得。下列有关说法正确的是
A.炔烃B的分子式为C8H16 B.炔烃B的结构可能有3种
C.有机物A的一氯取代物只有5种 D.有机物A与溴水混合后立即发生取代反应
11.实验室中下列做法错误的是
A.将石蜡油蒸气分解得到的气体通入溴水中,溴水褪色,且分层
B.配制Na2SO3溶液时,用新煮沸过并冷却的NaOH溶液溶解Na2SO3固体
C.向含有FeC13的MgC12溶液中,加入氧化镁调pH,搅拌、过滤可除去Fe3+
D.用镊子取绿豆粒大小的钠迅速投入盛有10mL水(含酚酞)的试管中,观察现象
12.异松油烯可以用于制作香精,防腐剂和工业溶剂等,其结构简式如图,下列有关异松油烯的说法正确的是
A.分子式是C10H14 B.能发生加成、氧化、取代反应
C.存在属于芳香烃的同分异构体 D.核磁共振氢谱有7个吸收峰
13.维生素C的结构如图所示。下列说法不正确的是
A.分子式是C6H8O6
B.分子中含有多个羟基,其水溶性较好
C.分子中含有碳碳双键、羟基、醚键3种官能团
D.能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色
二、非选择题(共10题)
14.I.如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间。
(1)假设甲烷与氯气充分反应,且只产生一种有机物,请写出化学方程式___。
(2)经过几个小时的反应后,U形管右端的玻璃管中水柱变化是___。
A.升高B.降低C.不变D.无法确定
(3)试解释U形管右端的玻璃管中水柱变化的原因___。
Ⅱ.(4)相对分子质量为72的烷烃的分子式是___,它可能的结构有___种。
15.已知:
完成下列填空:
(1)分子式为C8H8的某烃,在臭氧作用下发生反应为:,则该烃的结构简式为______________________________________。
(2)若分子式为C8H8的某烃其一氯代物只有一种,写出1种其可能的结构简式_________。
分子式为C8H8的烃有很多,其中有一种苯乙烯,性质活泼,易被氧化,是合成橡胶和塑料的单体,用途广泛。苯乙烯可以通过下列途径制备(反应条件下所有物质均呈气态):
(3)上述流程中各物质,属于苯的同系物的是__________(填结构简式);能与溴水发生加成反应的是___________________(均填结构简式)
(4)反应①是强吸热可逆反应。要既快又多地获取苯乙烯,反应①适宜条件是__________;为了进一步提高反应物的转化率,有研究者用加入O2与H2反应的方法获取了更多的苯乙烯,试推测其中的原因___________(写出一条)。
三、实验题
16.下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。请回答下列问题:
(1)A中碎瓷片的作用是________________。
(2)B装置中反应的化学方程式为:______________________________。
(3)C装置中可观察到的现象是__________________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是__________。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)下列物质中,不是通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
17.硝基苯可用于生产染料、香料、炸药等。实验室可用浓硫酸、浓硝酸、苯为原料制备一定量的硝基苯(硝基苯的密度为,沸点;苯的密度为,沸点为)。
I.粗硝基苯的制备,制备装置如图1所示(夹持及加热装置省略):
实验操作:将浓硫酸缓慢加入浓硝酸(约含)中,然后向混合酸中加入苯于容器中,然后水浴加热约,使其充分反应。
(1)方框甲中的仪器是__________形冷凝管,仪器a的容积以__________(填字母)为宜。
A.150 B.200 C.500 D.1000
(2)水浴加热时,除需要水浴锅、热源外,还必须使用的一种玻璃仪器是____。
Ⅱ.硝基苯精制
实验操作:将a中混合液与适量稀溶液混合,然后进行充分振荡、静置、分液,接着依次进行水洗蒸馏(蒸馏装置如图2所示)。
(3)水洗的目的是__________,操作所用试剂应具有的一种性质是__________。
(4)蒸馏过程中仪器c至少需要使用__________个(次);向乙中通冷却水与加热烧瓶的顺序是__________,若最终得到精制产品,则硝基苯的产率是__________(保留三位有效数字)。
四、计算题
18.以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油。(流程示意图如下,反应③的H2也由反应①得到。)
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油。
(1)通过计算说明上述方案能否得到理想的产品_______________。
(2)当CO2的使用量应控制为反应①中CO2产量的______________(填比例范围),可以得到理想的产品。
19.2021年5月8日,美国化学文摘社(CAS)注册了第1.5亿个独特的化学物质-2-氨基嘧啶甲腈衍生物,新的有机化合物仍在源源不断地被发现或合成出来。有机化合物种类繁多,结构和性质都有其特点。请对下列问题按要求填空。
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为_______。
(2)0.1mol炔烃B完全燃烧,消耗8.96L标准状况下的O2,其分子式为_______。
(3)某单烯烃与氢气加成后产物的结构简式如图,则该烯烃可能的结构有_______种(不考虑立体异构体)。
(4)某有机物的结构简式为,其名称是_______。
(5)已知萘分子的结构简式为,则它的六氯代物有_______种。
(6)分子中最多有_______个碳原子共面。
20.在25℃和101KPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数是_____。
21.A~I是目前我们已学的常见物质,它们的相互转化关系如图所示(有反应条件、反应物和生成物未给出).已知A、D是组成元素相同的无色气体;G、F组成元素也相同,在常温下都是液体,E是最理想能源物质;C是世界上产量最高的金属。
写出、的化学式:________、________.
反应①的化学方程式可能为________,此反应在生产中的应用是________.
若由两种元素组成,反应⑤的化学方程式为________.
反应②的化学反应基本类型是________.
物质的一种用途是________.
22.随着原子序数递增,短周期主族元素(用字母A、B、C等表示)原子半径的相对大小的变化如图所示,根据判断出的元素回答问题。
(1)L在元素周期表中的位置是___________。
(2)M、G、H的简单气态氢化物的稳定性由强到弱的顺序是___________(用化学式表示)。
(3)E、X、Y三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是___________(用化学式表示)。
(4)G和I能形成一种淡黄色的固体,请写出该物质的电子式:___________。
(5)E与A形成的饱和链烃中,有几种物质每个分子的电子总数均为42,符合该条件的有机物共有___________种,其一氯代物有4种的该饱和链烃结构简式为___________。
(6)A与G、与X均可形成18个电子的分子,这两种分子在水溶液中反应后,生成物之一是含10电子的化合物,该反应可观察到现象是___________,原因是___________。(用化学方程式表示)
23.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是__________________。
(2)用电子式表示E2F的形成过程___________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是________。
(4)下列实验操作对应的实验现象中,不正确的是________(填字母)。
选项 实验操作 实验现象
a 将E单质投入到CuSO4溶液中 生成大量红色固体
b 向AlCl3溶液中通入过量C的气态氢化物 先生成白色沉淀,然后沉淀溶解
c 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 下层溶液变为橙色
d 将B的最高价氧化物通入到Na2SiO3溶液中 生成白色沉淀
(5)写出A与B形成的10电子分子的化学式___________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________ (填字母)。
参考答案:
1.C 2.A 3.D 4.B 5.B 6.B 7.C 8.B 9.D 10.C 11.D 12.B 13.C
14. CH4+4Cl2CCl4+4HCl B 左端密封的混合气体,在反应中总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端密封的气体压强小于外界压强 C5H12 3
15. CH3—C≡C—CH=CH—C≡C—CH3 或 、CH2=CH2 适当的温度,低压,催化剂 ①催化剂具有选择性;②氢气和氧气反应导致生成物浓度降低,平衡右移;③氢气和氧气反应放出大量热为合成反应提供了能量,促使平衡右移
16. 催化作用 CH2=CH2+Br2―→BrCH2—CH2Br 紫(红)色褪去 D BC B B
17.(1) 球(蛇) B
(2)温度计
(3) 除去残留的NaOH和生成的可溶性盐 吸水性
(4) 2 通冷却水 79.8%
18. 不能得到理想产品
19. C6H14 C3H4 3 2,3-二甲基-2-戊烯 10 13
20.25%
21. CO H2O2 3CO+Fe2O32Fe+3CO2 炼铁 CH4+2O2CO2+2H2O 置换反应 灭火
22.(1)第三周期ⅣA族
(2)HF>H2O>PH3
(3)HClO4H2SO4H2CO3
(4)
(5) 3
(6) 生成淡黄色沉淀 H2O2+ H2S=S↓+2H2O
23. S2->C1->Na+ ab CH4 D
一、单选题(共13题)
1.溴苯是一种化工原料,实验室合成溴苯的装置如图,关于溴苯的性质及制备,有关说法不正确的是
A.实验开始后,a中上部有白雾生成,下部有褐色油状物生成
B.b为恒压滴液漏斗,便于其中液体顺利滴下
C.c为球形冷凝管,冷凝水应从上口接入
D.粗溴苯的提纯步骤可以是:水洗→NaOH溶液洗→水洗→加CaCl2过滤→蒸馏
2.根据下表中烃的分子式的排列规律,判断空格中烃的同分异构体的数目是( )
1 2 3 4 5 6 7 8
A.3 B.4 C.5 D.6
3.在通常条件下可与乙烯发生反应的物质是
A.食盐溶液 B.稀盐酸
C.氢氧化钠溶液 D.溴的四氯化碳溶液
4.下列各组物质中,能用酸性高锰酸钾溶液鉴别的是
A.乙烯、乙炔 B.己烯、苯 C.己烷、苯 D.己烯、甲苯
5.化学制备萘()的合成过程如图,下列说法正确的是
A.a的分子式是C10H12O B.萘的二氯代物有10种
C.b的所有碳原子可能处于同一平面 D.a→b的反应类型为加成反应
6.室温下,实验室用如图装置探究甲烷与氯气的反应,实验中观察不到的现象是
A.强光照射能较快看到白雾
B.若试管套上黑色纸套,试管内气体颜色逐渐变浅
C.水槽底部可能有少量晶体
D.充分反应后试管中仍有气体
7.下列说法不正确的是
A.乙烯使Br2/CCl4溶液、酸性高锰酸钾溶液褪色的原因是不同的
B.1-丁烯、2-丁烯与H2加成后的产物相同
C.乙烯水化生成乙醇与乙烯氧化生成乙醛的反应条件相同
D.Mg3N2与水反应能生成Mg(OH)2和NH3,则CaC2与水反应能生成Ca(OH)2和CH≡CH
8.下列烷烃中沸点最高的是
A.CH3C(CH3)2CH3 B.CH3CH2CH2CH(CH3)CH3
C.CH3CH(CH3)CH(CH3)CH3 D.CH3(CH2)3CH3
9.下列有关说法不正确的是
A.乙烯的化学性质比乙烷活泼是因为乙烯分子中含有碳碳双键
B.乙烯分子的碳碳双键中有一个键容易断裂,能与溴水发生加成反应
C.1mol乙烯与氯气完全加成后,产物再与氯气彻底取代,两个过程中共消耗氯气5mol
D.四氯乙烯()和聚四氟乙烯()都能使酸性高锰酸钾溶液褪色
10.有机物A的结构简式为,该物质可由炔烃B与H2加成获得。下列有关说法正确的是
A.炔烃B的分子式为C8H16 B.炔烃B的结构可能有3种
C.有机物A的一氯取代物只有5种 D.有机物A与溴水混合后立即发生取代反应
11.实验室中下列做法错误的是
A.将石蜡油蒸气分解得到的气体通入溴水中,溴水褪色,且分层
B.配制Na2SO3溶液时,用新煮沸过并冷却的NaOH溶液溶解Na2SO3固体
C.向含有FeC13的MgC12溶液中,加入氧化镁调pH,搅拌、过滤可除去Fe3+
D.用镊子取绿豆粒大小的钠迅速投入盛有10mL水(含酚酞)的试管中,观察现象
12.异松油烯可以用于制作香精,防腐剂和工业溶剂等,其结构简式如图,下列有关异松油烯的说法正确的是
A.分子式是C10H14 B.能发生加成、氧化、取代反应
C.存在属于芳香烃的同分异构体 D.核磁共振氢谱有7个吸收峰
13.维生素C的结构如图所示。下列说法不正确的是
A.分子式是C6H8O6
B.分子中含有多个羟基,其水溶性较好
C.分子中含有碳碳双键、羟基、醚键3种官能团
D.能使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色
二、非选择题(共10题)
14.I.如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略。将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间。
(1)假设甲烷与氯气充分反应,且只产生一种有机物,请写出化学方程式___。
(2)经过几个小时的反应后,U形管右端的玻璃管中水柱变化是___。
A.升高B.降低C.不变D.无法确定
(3)试解释U形管右端的玻璃管中水柱变化的原因___。
Ⅱ.(4)相对分子质量为72的烷烃的分子式是___,它可能的结构有___种。
15.已知:
完成下列填空:
(1)分子式为C8H8的某烃,在臭氧作用下发生反应为:,则该烃的结构简式为______________________________________。
(2)若分子式为C8H8的某烃其一氯代物只有一种,写出1种其可能的结构简式_________。
分子式为C8H8的烃有很多,其中有一种苯乙烯,性质活泼,易被氧化,是合成橡胶和塑料的单体,用途广泛。苯乙烯可以通过下列途径制备(反应条件下所有物质均呈气态):
(3)上述流程中各物质,属于苯的同系物的是__________(填结构简式);能与溴水发生加成反应的是___________________(均填结构简式)
(4)反应①是强吸热可逆反应。要既快又多地获取苯乙烯,反应①适宜条件是__________;为了进一步提高反应物的转化率,有研究者用加入O2与H2反应的方法获取了更多的苯乙烯,试推测其中的原因___________(写出一条)。
三、实验题
16.下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验。请回答下列问题:
(1)A中碎瓷片的作用是________________。
(2)B装置中反应的化学方程式为:______________________________。
(3)C装置中可观察到的现象是__________________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填字母)中的实验现象可判断该资料是否真实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是__________。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)下列物质中,不是通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
17.硝基苯可用于生产染料、香料、炸药等。实验室可用浓硫酸、浓硝酸、苯为原料制备一定量的硝基苯(硝基苯的密度为,沸点;苯的密度为,沸点为)。
I.粗硝基苯的制备,制备装置如图1所示(夹持及加热装置省略):
实验操作:将浓硫酸缓慢加入浓硝酸(约含)中,然后向混合酸中加入苯于容器中,然后水浴加热约,使其充分反应。
(1)方框甲中的仪器是__________形冷凝管,仪器a的容积以__________(填字母)为宜。
A.150 B.200 C.500 D.1000
(2)水浴加热时,除需要水浴锅、热源外,还必须使用的一种玻璃仪器是____。
Ⅱ.硝基苯精制
实验操作:将a中混合液与适量稀溶液混合,然后进行充分振荡、静置、分液,接着依次进行水洗蒸馏(蒸馏装置如图2所示)。
(3)水洗的目的是__________,操作所用试剂应具有的一种性质是__________。
(4)蒸馏过程中仪器c至少需要使用__________个(次);向乙中通冷却水与加热烧瓶的顺序是__________,若最终得到精制产品,则硝基苯的产率是__________(保留三位有效数字)。
四、计算题
18.以天然气、焦炭、水为初始原料,可以制得CO和H2,进而人工合成汽油。(流程示意图如下,反应③的H2也由反应①得到。)
若反应①、②、③的转化率均为100%,且将反应①中得到的CO2和H2全部用于合成人工汽油。
(1)通过计算说明上述方案能否得到理想的产品_______________。
(2)当CO2的使用量应控制为反应①中CO2产量的______________(填比例范围),可以得到理想的产品。
19.2021年5月8日,美国化学文摘社(CAS)注册了第1.5亿个独特的化学物质-2-氨基嘧啶甲腈衍生物,新的有机化合物仍在源源不断地被发现或合成出来。有机化合物种类繁多,结构和性质都有其特点。请对下列问题按要求填空。
(1)烷烃A在同温、同压下蒸气的密度是H2的43倍,其分子式为_______。
(2)0.1mol炔烃B完全燃烧,消耗8.96L标准状况下的O2,其分子式为_______。
(3)某单烯烃与氢气加成后产物的结构简式如图,则该烯烃可能的结构有_______种(不考虑立体异构体)。
(4)某有机物的结构简式为,其名称是_______。
(5)已知萘分子的结构简式为,则它的六氯代物有_______种。
(6)分子中最多有_______个碳原子共面。
20.在25℃和101KPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔的体积分数是_____。
21.A~I是目前我们已学的常见物质,它们的相互转化关系如图所示(有反应条件、反应物和生成物未给出).已知A、D是组成元素相同的无色气体;G、F组成元素也相同,在常温下都是液体,E是最理想能源物质;C是世界上产量最高的金属。
写出、的化学式:________、________.
反应①的化学方程式可能为________,此反应在生产中的应用是________.
若由两种元素组成,反应⑤的化学方程式为________.
反应②的化学反应基本类型是________.
物质的一种用途是________.
22.随着原子序数递增,短周期主族元素(用字母A、B、C等表示)原子半径的相对大小的变化如图所示,根据判断出的元素回答问题。
(1)L在元素周期表中的位置是___________。
(2)M、G、H的简单气态氢化物的稳定性由强到弱的顺序是___________(用化学式表示)。
(3)E、X、Y三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是___________(用化学式表示)。
(4)G和I能形成一种淡黄色的固体,请写出该物质的电子式:___________。
(5)E与A形成的饱和链烃中,有几种物质每个分子的电子总数均为42,符合该条件的有机物共有___________种,其一氯代物有4种的该饱和链烃结构简式为___________。
(6)A与G、与X均可形成18个电子的分子,这两种分子在水溶液中反应后,生成物之一是含10电子的化合物,该反应可观察到现象是___________,原因是___________。(用化学方程式表示)
23.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是__________________。
(2)用电子式表示E2F的形成过程___________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是________。
(4)下列实验操作对应的实验现象中,不正确的是________(填字母)。
选项 实验操作 实验现象
a 将E单质投入到CuSO4溶液中 生成大量红色固体
b 向AlCl3溶液中通入过量C的气态氢化物 先生成白色沉淀,然后沉淀溶解
c 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 下层溶液变为橙色
d 将B的最高价氧化物通入到Na2SiO3溶液中 生成白色沉淀
(5)写出A与B形成的10电子分子的化学式___________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________ (填字母)。
参考答案:
1.C 2.A 3.D 4.B 5.B 6.B 7.C 8.B 9.D 10.C 11.D 12.B 13.C
14. CH4+4Cl2CCl4+4HCl B 左端密封的混合气体,在反应中总的气体的物质的量逐渐减少和生成的HCl气体极易溶于水,导致左端密封的气体压强小于外界压强 C5H12 3
15. CH3—C≡C—CH=CH—C≡C—CH3 或 、CH2=CH2 适当的温度,低压,催化剂 ①催化剂具有选择性;②氢气和氧气反应导致生成物浓度降低,平衡右移;③氢气和氧气反应放出大量热为合成反应提供了能量,促使平衡右移
16. 催化作用 CH2=CH2+Br2―→BrCH2—CH2Br 紫(红)色褪去 D BC B B
17.(1) 球(蛇) B
(2)温度计
(3) 除去残留的NaOH和生成的可溶性盐 吸水性
(4) 2 通冷却水 79.8%
18. 不能得到理想产品
19. C6H14 C3H4 3 2,3-二甲基-2-戊烯 10 13
20.25%
21. CO H2O2 3CO+Fe2O32Fe+3CO2 炼铁 CH4+2O2CO2+2H2O 置换反应 灭火
22.(1)第三周期ⅣA族
(2)HF>H2O>PH3
(3)HClO4H2SO4H2CO3
(4)
(5) 3
(6) 生成淡黄色沉淀 H2O2+ H2S=S↓+2H2O
23. S2->C1->Na+ ab CH4 D
