第三章铁金属材料单元测试卷高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 第三章铁金属材料单元测试卷高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 390.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:19:54 | ||
图片预览




文档简介
第三章 铁 金属材料 单元测试卷
一、单选题
1.下列反应的离子方程式书写正确的是
A.向氯化亚铁溶液中滴入溶液:
B.向次氯酸钠溶液中通入足量二氧化硫:
C.将氯气通入冷的石灰乳中制漂白粉:
D.向磁性氧化铁粉末中加入稀盐酸:
2.将22.2gAl与Fe的混合物在一定量的稀HNO3溶液中完全溶解,往溶液中滴加KSCN后,溶液不变色,且只收集到标准状况下8.96L无色但遇空气变红棕色的气体,则向反应后的溶液中加入足量的氨水(不考虑沉淀损失),在空气中不断搅拌,充分反应后,最终生成沉淀的质量为
A.47.7g B.42.6g C.32.1g D.27g
3.下列有关物质的性质与用途具有对应关系的是
A.氧化铁粉末呈红色,可用于制取铁盐
B.Na具有强还原性,可用于冶炼稀有金属
C.受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于水的消毒
4.下列关于物质保存的解释,反应方程式不正确的是
A.溶液中放入铁粉:
B.硝酸保存于棕色试剂瓶:
C.氮肥保存于阴凉处:
D.金属钠保存于煤油中:、
5.工业上以黄铜矿(主要含二硫化亚铁铜CuFeS2,还含FeS等)为原料可以制备Cu,其中一步为CuFeS2和FeCl3溶液发生反应:2Fe3++CuFeS2+Cl-=CuCl+2S+4Fe2+。下列有关该反应的说法错误的是
A.CuFeS2既是氧化剂,又是还原剂
B.S既不是电解质,也不是非电解质
C.消耗56gFe3+时,反应中有1mol电子转移
D.向反应后的溶液中滴加少量KSCN溶液,若溶液变红,则说明Fe3+未完全反应
6.铁粉与稀硝酸反应的化学方程式为。下列有关说法正确的是
A.氧化性:
B.作氧化剂的是参与反应的的10%
C.常温下为加快反应速率,可将稀硝酸换为浓硝酸
D.在反应后的混合物中滴加少量氢氧化钠溶液,有气体逸出
7.为除去括号内的杂质,所选用的方法正确的是
A.溶液(),加入粉,过滤
B.,通入饱和溶液中
C.溶液(),加入适量的溶液
D.溶液(),加入过量溶液,过滤
8.将等物质的量的和混合物完全溶于100mL稀盐酸中,向反应后的溶液中缓慢加入NaOH溶液,下列图象中可能正确表示上述反应的是(横坐标表示加入NaOH的体积,纵坐标表示生成沉淀的质量):
A. B. C. D.
9.将某份镁铝合金均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为,则样品中镁、铝物质的量之比为
A. B. C. D.
10.FeCl3是有机反应中常用的催化剂。实验室用如下图所示装置制备少量FeCl3.已知:FeCl3易升华,且易水解:FeCl3+3H2O Fe(OH)3+3HCl。下列说法不正确的是
A.甲中可制得纯净的Cl2
B.实验时若Cl2不足量,则可能生成FeCl2
C.装置丙的作用是收集FeCl3
D.装置丁中CaCl2的作用是防止水蒸气进入装置丙
11.下列实验现象与氧化还原反应无关的是
A.过氧化钠放置于空气中逐渐变白
B.将生石灰投入溶液中,产生白色沉淀
C.通入硝酸酸化的溶液中,产生白色沉淀
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色
12.下列生活应用或生产活动,没有运用相应化学知识的是
选项 生活应用或生产活动 化学知识
A 可用作制冷剂 极易溶于水
B 用漂白纸张 具有漂白性
C 用铝槽车运输浓硝酸 在冷的浓硝酸中发生钝化
D 用制作芯片 是良好的半导体材料
A.A B.B C.C D.D
13.一定浓度的稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知稀硝酸被还原为)。下列说法不正确的是
A.段和段产生的气体物质的量之比为
B.段发生的反应为
C.点之后的溶液中溶质只有
D.原混合溶液中的浓度为
14.根据下列实验操作和现象得到的结论正确的是
选项 实验操作和现象 结论
A 向溶液中滴入硫酸酸化的溶液,溶液变为黄色 氧化性:
B 将灼热的炭加入盛有浓的试管中,试管上方出现红棕色气体 C和浓反应产生
C 将粉末与铝粉混合均匀,在混合物上面加适量,再用镁条引燃混合物,有熔融铁水流出 铝的还原性强于铁,且与铝粉的反应放热
D 将少量晶体放入试管底部,在试管口塞上一团棉花,用酒精灯在试管底部药品处小火微热,试管底部的固体消失,试管口处的内壁上出现“白霜” 晶体依次发生了升华和凝华
A.A B.B C.C D.D
二、非选择题
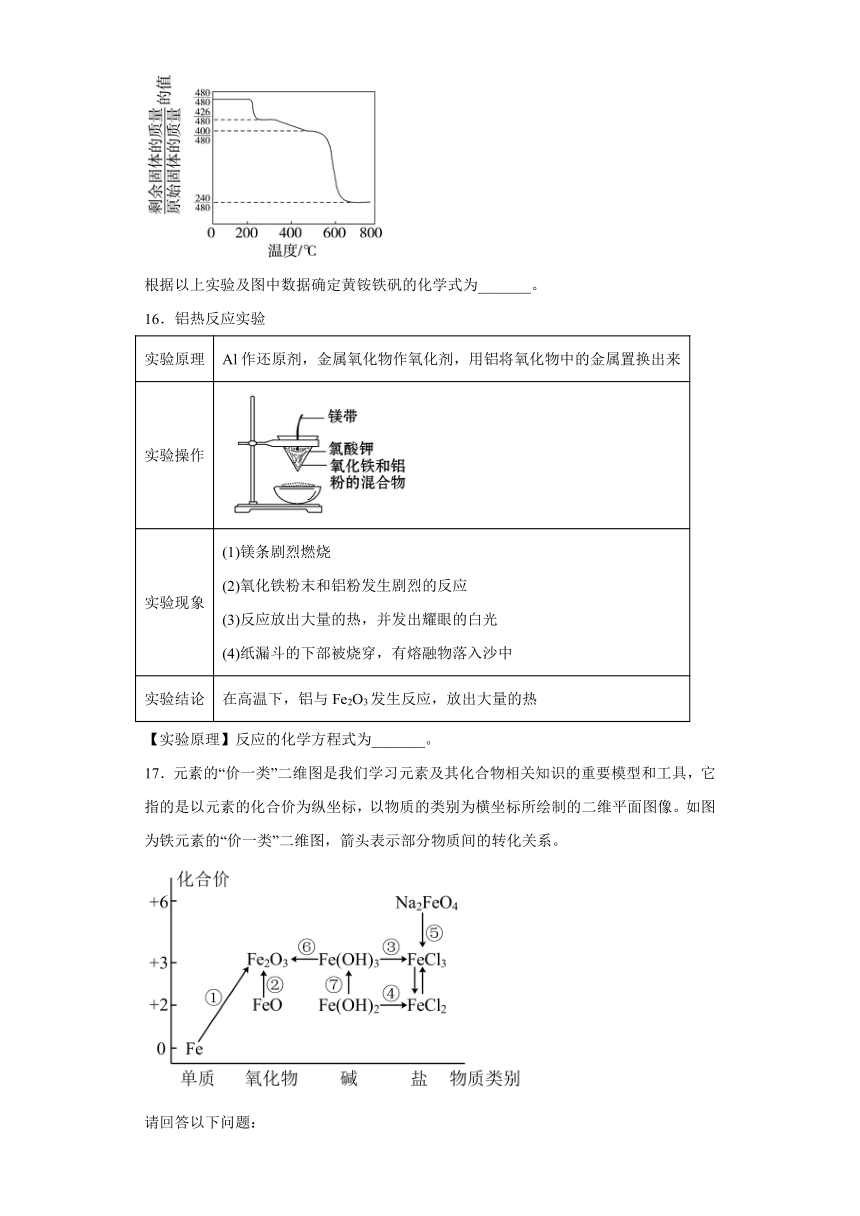
15.黄铵铁矾 [化学式可表示为(NH4)xFey(SO4)z(OH)w,摩尔质量为480 g·mol-1]。Min Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3和H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。
根据以上实验及图中数据确定黄铵铁矾的化学式为_______。
16.铝热反应实验
实验原理 Al作还原剂,金属氧化物作氧化剂,用铝将氧化物中的金属置换出来
实验操作
实验现象 (1)镁条剧烈燃烧 (2)氧化铁粉末和铝粉发生剧烈的反应 (3)反应放出大量的热,并发出耀眼的白光 (4)纸漏斗的下部被烧穿,有熔融物落入沙中
实验结论 在高温下,铝与Fe2O3发生反应,放出大量的热
【实验原理】反应的化学方程式为_______。
17.元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
请回答以下问题:
(1)中Fe的化合价为_______。
(2)是否为碱性氧化物_______(填是或否),理由:_______。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:_______。
(4)已知在强碱溶液中稳定存在,PH越小稳定性越差;则制备时需要在_______(填“酸性”“碱性”或“中性”)环境中进行:也可以作为净水剂,能与水反应生成具有吸附性的胶体,写出其中离子方程式:_______。其中检验溶液中的试剂是_______。
(5)FeO、是合成氨工业生产中所用的催化剂的主要成分。某FeO、混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、的物质的量之比为_______。
18.钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)钠在空气中燃烧生成淡黄色的_______(填“Na2O”或“Na2O2”); Al2O3能溶于酸或强碱溶液生成盐和水,则是一种_______(填“酸性”、“碱性”或“两性”)氧化物;
(2)写出钠与水反应的化学方程式:_______。
(3)写出铝与NaOH溶液反应的化学方程式:_______;
(4)现有下列3种物质:①Na2O2、②NaHCO3、③Na2CO3,请回答:受热易分解的是_______ (填序号,下同),溶于水显碱性的是_______,与CO2反应产生的气体能使带火星木条复燃的是_______。
参考答案:
1.A
【详解】A.Fe2+遇溶液:生成蓝色沉淀,,A正确;
B.次氯酸钠具有强氧化性,二氧化硫具有还原性,两者会发生氧化还原反应:,B错误;
C.石灰乳应写成化学式,将氯气通入冷的中制漂白粉:,C错误;
D.磁性氧化铁为四氧化三铁,和稀盐酸反应生成盐和水,题中所给离子方程式电荷不守恒,应为,D错误;
故答案选A。
2.A
【详解】由题干信息可知,过程中涉及的反应方程式有:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,Fe(NO3)2+2NH3 H2O=Fe(OH)2↓+2NH4NO3,Al(NO3)3+3 NH3 H2O=Al(OH)3↓+3NH4NO3,4Fe(OH)2+O2+2H2O=4Fe(OH)3,设22.4g的混合物中含有Fe为n1mol,Al为n2mol,根据质量守恒有:①56n1+27n2=22.2g,根据电子守恒可知:2n1+3n2=3n(NO)=3=1.2mol,联合方程①②解得:n1=0.3mol,n2=0.2mol,最终得到的沉淀为Fe(OH)3和Al(OH)3,根据质量守恒可知,m沉淀==47.7g,故答案为:A。
3.B
【详解】A.氧化铁粉末呈红色,可用于制备红色涂料,颜色与制取铁盐无关,A错误;
B.Na具有强还原性,可用于冶炼稀有金属,性质和用途相对应,B正确;
C.受热分解,可用于制备发酵粉等,与中和胃酸无关,C错误;
D.明矾溶于水并水解形成胶体,可用于水的净化,形成的氢氧化铝胶体不具有氧化性,不能消毒,D错误;
故选B。
4.B
【详解】A.FeSO4溶液中加入铁粉,Fe2+具有还原性,容易被氧气氧化成Fe3+,加入铁粉能将Fe3+还原为Fe2+,离子方程式为2Fe3++Fe=3Fe2+,A正确;
B.浓硝酸见光易分解生成NO2、O2和水,化学方程式为4HNO34NO2↑+O2↑+2H2O,B错误;
C.碳酸氢铵不稳定,受热易分解,因此保存在阴凉处,化学方程式为,C正确;
D.金属钠化学性质活泼,能与空气中的氧气反应生成氧化钠,同时钠能与水反应生成氢氧化钠和氢气,因此钠保存在煤油中,化学方程式为、,D正确;
故答案选B。
5.C
【分析】二硫化亚铁铜CuFeS2中,铁为+2价,铜为+2价,硫为-2价,在题给反应中,CuFeS2中的铜由+2价降为+1价,硫由-2价升为0价,FeCl3溶液中的铁由+3价降为+2价,其他元素的化合价没有变。
【详解】A.CuFeS2中铜的化合价降低,硫的化合价升高,既是氧化剂,又是还原剂,A正确;
B.S是单质,既不是电解质,也不是非电解质,B正确;
C.消耗3mol Fe3+时,反应中有4mol电子转移,则消耗56g(1mol)Fe3+时,反应中有4/3mol电子转移,C错误;
D.KSCN与Fe3+反应生成红色的络合物,向反应后的溶液中滴加少量KSCN溶液,若溶液变红,则说明Fe3+未完全反应,D正确;
故选:C。
6.B
【详解】A.该反应中HNO3为氧化剂,Fe3+为氧化产物,则氧化性HNO3>Fe3+,A错误;
B.该反应30个HNO3中27个HNO3体现酸性,3个体现氧化性,作氧化剂的HNO3是参与反应的HNO3的10%,B正确;
C.常温下铁遇浓硝酸发生钝化,无法加快反应速率,C错误;
D.反应后的混合物中滴加少量氢氧化钠溶液,NaOH先与铁离子反应生成氢氧化铁沉淀,无气体产生,D错误;
故答案选B。
7.C
【详解】A.铁粉与氯化铁、氯化铜均会发生氧化还原反应,不能达到除杂目的,A错误;
B.饱和溶液与二氧化碳和二氧化硫均会发生反应,不能达到除杂目的,B错误;
C.适量的会与碳酸氢钠发生反应生成碳酸钠,能达到除杂的目的,C正确;
D.过量溶液均会与硫酸钠、碳酸钠发生反应,不能达到除杂目的,D错误;
故选C。
8.C
【详解】Al2O3和 Fe2O3分别与H2SO4反应生成Al2(SO4)3和Fe2(SO4)3,加入氢氧化钠后开始出现沉淀,发生的反应为Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少时,所得沉淀全部为Fe(OH)3,根据NaOH+Al(OH)3=NaAlO2+2H2O可知,若溶解Al(OH)3消耗的NaOH体积为10mL,设NaOH的浓度为cmol/L,说明Al3+的物质的量为0.01cmol,则Fe3+的物质的量为0.01cmol,故沉淀Al3+和Fe3+的NaOH的物质的量为(0.01cmol+0.01cmol)×3=0.06cmol,体积为=0.06L=60mL,因此C选项所对应的图象符合题意;
故选C。
9.C
【详解】根据同温同压下气体的体积之比等于物质的量之比,故设加入氢氧化钠溶液产生的H2为2mol,则加入盐酸产生的H2为3mol,根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知生成2molH2,需要Al的物质的量为mol,由于2Al+6HCl=2AlCl3+3H2↑可知,等质量的Al与盐酸和NaOH反应放出的H2一样多,故说明Mg与盐酸反应产生的H2为1mol,根据反应方程式Mg+2HCl=MgCl2+H2↑可知,生成1molH2需消耗1mol的Mg,故样品中铁、铝物质的量之比为1:=3:4,故答案为:C。
10.B
【分析】高锰酸钾与浓盐酸反应生成氯气,混有杂质HCl和水蒸气杂质,饱和食盐水除去HCl,浓硫酸干燥氯气,氯气和铁粉在加热下反应生成FeCl3,其易升华,加热形成蒸气,在丙装置中冷凝收集氯化铁,由于氯化铁易水解,氯化钙作用是防止空气中水蒸气进入装置丙,NaOH溶液用于吸收有毒的尾气氯气;
【详解】A.高锰酸钾与浓盐酸反应生成氯气,浓盐酸易挥发,氯气中混有杂质HCl和水蒸气杂质,饱和食盐水除去HCl,浓硫酸干燥氯气,甲可制得纯净的Cl2,A正确;
B.无论氯气是否足量,Fe与Cl2都只生成FeCl3,B错误;
C.氯气和铁粉在加热下反应生成FeCl3,其易升华,加热形成蒸气,在丙装置中冷凝收集FeCl3,C正确;
D.由于氯化铁易水解,氯化钙作用是防止空气中水蒸气进入装置丙,D正确;
故选:B。
11.B
【详解】A.过氧化钠和空气中二氧化碳反应生成碳酸钠和氧气,为氧化还原反应,与氧化还原反应有关,A不符合题意;
B.生石灰氧化钙和水生成氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀,没有元素化合价改变,与氧化还原反应无关,B符合题意;
C.氯气和溶液中水生成盐酸和次氯酸为氧化还原反应,盐酸和硝酸银生成氯化银白色沉淀,C不符合题意;
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色,反应中生成的氢氧化亚铁和空气中氧气反应转化为氢氧化铁沉淀,与氧化还原反应有关,D不符合题意;
故选B。
12.A
【详解】A.可用作制冷剂运用的化学知识为:易液化,故A符合题意;
B.用漂白纸张运用的化学知识为:具有漂白性,故B不符合题意;
C.用铝槽车运输浓硝酸运用的化学知识为:在冷的浓硝酸中发生钝化,故C不符合题意;
D.用制作芯片运用的化学知识为:是良好的半导体材料,故D不符合题意;
故选A。
13.D
【分析】由图象可知,刚开始铁少量,OA段发生反应为:Fe++4H+=Fe3++NO+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2,据此解答。
【详解】A.由分析可知,OA段发生反应为:Fe++4H+=Fe3++NO+2H2O,BC段发生反应为:Fe+2H+=Fe2++H2,OA段消耗5.6gFe,BC段消耗14.0g-8.4g=5.6gFe,由方程式可知,段和段产生的气体物质的量之比为1:1,故A正确;
B.由分析可知,AB段发生反应为:Fe+2Fe3+=3Fe2+,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为,故C正确;
D.由图可知:反应消耗14g铁,物质的量是=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,含硫酸,所以硫酸的浓度是,故D错误;
故选D。
14.C
【详解】A.溶液变为黄色说明有三价铁生成,但是酸性环境中含有氢离子,硝酸根在氢离子存在的情况下也可以把二价铁氧化为三家忒,故该现象不能说明氧化性,A错误;
B.将灼热的炭加入到盛有浓的试管中,可能是浓硝酸在加热的情况下分解生成二氧化氮,B错误;
C.氧化铁和铝在加热的情况下生成单质铁,说明铝还原性更强,且用镁条引燃混合物,有熔融铁水流出,说明该反应为放热反应,C正确;
D.在加热的情况下,氯化铵分解生成氨气和氯化氢,在试管口部氨气和氯化氢再次生成氯化铵,这是化学反应,不是升华和凝华,D错误;
故选C。
15.NH4Fe3(SO4)2(OH)6
【详解】设有480 g物质分解,670 ℃以上为红棕色纯净物Fe2O3,则其物质的量为n(Fe2O3)= =1.5 mol,即y=3;在固体质量400 g→240 g时,分析可知,该产物为SO3和Fe2O3,则n(SO3)= =2 mol,即z=2;化合物中各元素化合价代数和为0,则x+3×(+3)+ 2×(-2)+w×(-1)=0,17x+3×56+2×96+17w=480,解得x=1、w=6,所以该物质的化学式为NH4Fe3(SO4)2(OH)6。
16.2Al + Fe2O32Fe + Al2O3
【详解】该反应为铝热反应,以铝作铝热剂,发生反应;
故答案为:。
17.(1)+6
(2) 是 与盐酸反应生成了盐和水
(3)
(4) 碱性 KSCN溶液
(5)2:1
【详解】(1)中钠、氧元素化合价分别为+1、-2,根据化合价代数和为零,可知Fe的化合价为+6;
(2)能和酸反应生成盐和水的氧化物属于碱性氧化物;与盐酸反应生成了盐和水,故其为碱性氧化物;
(3)氢氧化亚铁和空气中氧气、水生成红褐色氢氧化铁,反应为;
(4)已知在强碱溶液中稳定存在,PH越小稳定性越差;则制备时需要在碱性环境中进行;也可以作为净水剂,能与水反应生成具有吸附性的胶体,反应中铁化合价由+6变为+3,则反应中氧元素化合价升高得到氧气,根据电子守恒、质量守恒可知,离子方程式:;铁离子能和KSCN溶液变红色,故其中检验溶液中的试剂是KSCN溶液;
(5)设FeO、的物质的量之比为a:b,则,故a:b=2:1。
18.(1) Na2O2 两性
(2)2Na+2H2O=2NaOH+H2↑
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4) ② ①②③ ①
【详解】(1)钠在空气中燃烧生成淡黄色的Na2O2,Na2O为白色;Al2O3能溶于酸或强碱溶液生成盐和水,即Al2O3+6HCl=2AlCl3+3H2O、Al2O3+2NaOH=2NaAlO2+H2O,Al2O3是一种两性氧化物;故答案为:Na2O2;两性;
(2)钠与水反应生成氢氧化钠和氢气,该反应的化学方程式为:2Na+2H2O=2NaOH+H2↑;故答案为:2Na+2H2O=2NaOH+H2↑;
(3)铝与NaOH溶液反应生成偏铝酸钠和氢气,该反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)受热易分解的是NaHCO3,方程式为:;碳酸钠和碳酸氢钠溶液均显碱性,Na2O2与水反应生成NaOH和O2,故其溶于水也显碱性;2Na2O2+2CO2=2Na2CO3+O2,故与CO2反应产生的气体能使带火星木条复燃的是Na2O2;故答案为:②;①②③;①。
一、单选题
1.下列反应的离子方程式书写正确的是
A.向氯化亚铁溶液中滴入溶液:
B.向次氯酸钠溶液中通入足量二氧化硫:
C.将氯气通入冷的石灰乳中制漂白粉:
D.向磁性氧化铁粉末中加入稀盐酸:
2.将22.2gAl与Fe的混合物在一定量的稀HNO3溶液中完全溶解,往溶液中滴加KSCN后,溶液不变色,且只收集到标准状况下8.96L无色但遇空气变红棕色的气体,则向反应后的溶液中加入足量的氨水(不考虑沉淀损失),在空气中不断搅拌,充分反应后,最终生成沉淀的质量为
A.47.7g B.42.6g C.32.1g D.27g
3.下列有关物质的性质与用途具有对应关系的是
A.氧化铁粉末呈红色,可用于制取铁盐
B.Na具有强还原性,可用于冶炼稀有金属
C.受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于水的消毒
4.下列关于物质保存的解释,反应方程式不正确的是
A.溶液中放入铁粉:
B.硝酸保存于棕色试剂瓶:
C.氮肥保存于阴凉处:
D.金属钠保存于煤油中:、
5.工业上以黄铜矿(主要含二硫化亚铁铜CuFeS2,还含FeS等)为原料可以制备Cu,其中一步为CuFeS2和FeCl3溶液发生反应:2Fe3++CuFeS2+Cl-=CuCl+2S+4Fe2+。下列有关该反应的说法错误的是
A.CuFeS2既是氧化剂,又是还原剂
B.S既不是电解质,也不是非电解质
C.消耗56gFe3+时,反应中有1mol电子转移
D.向反应后的溶液中滴加少量KSCN溶液,若溶液变红,则说明Fe3+未完全反应
6.铁粉与稀硝酸反应的化学方程式为。下列有关说法正确的是
A.氧化性:
B.作氧化剂的是参与反应的的10%
C.常温下为加快反应速率,可将稀硝酸换为浓硝酸
D.在反应后的混合物中滴加少量氢氧化钠溶液,有气体逸出
7.为除去括号内的杂质,所选用的方法正确的是
A.溶液(),加入粉,过滤
B.,通入饱和溶液中
C.溶液(),加入适量的溶液
D.溶液(),加入过量溶液,过滤
8.将等物质的量的和混合物完全溶于100mL稀盐酸中,向反应后的溶液中缓慢加入NaOH溶液,下列图象中可能正确表示上述反应的是(横坐标表示加入NaOH的体积,纵坐标表示生成沉淀的质量):
A. B. C. D.
9.将某份镁铝合金均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为,则样品中镁、铝物质的量之比为
A. B. C. D.
10.FeCl3是有机反应中常用的催化剂。实验室用如下图所示装置制备少量FeCl3.已知:FeCl3易升华,且易水解:FeCl3+3H2O Fe(OH)3+3HCl。下列说法不正确的是
A.甲中可制得纯净的Cl2
B.实验时若Cl2不足量,则可能生成FeCl2
C.装置丙的作用是收集FeCl3
D.装置丁中CaCl2的作用是防止水蒸气进入装置丙
11.下列实验现象与氧化还原反应无关的是
A.过氧化钠放置于空气中逐渐变白
B.将生石灰投入溶液中,产生白色沉淀
C.通入硝酸酸化的溶液中,产生白色沉淀
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色
12.下列生活应用或生产活动,没有运用相应化学知识的是
选项 生活应用或生产活动 化学知识
A 可用作制冷剂 极易溶于水
B 用漂白纸张 具有漂白性
C 用铝槽车运输浓硝酸 在冷的浓硝酸中发生钝化
D 用制作芯片 是良好的半导体材料
A.A B.B C.C D.D
13.一定浓度的稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知稀硝酸被还原为)。下列说法不正确的是
A.段和段产生的气体物质的量之比为
B.段发生的反应为
C.点之后的溶液中溶质只有
D.原混合溶液中的浓度为
14.根据下列实验操作和现象得到的结论正确的是
选项 实验操作和现象 结论
A 向溶液中滴入硫酸酸化的溶液,溶液变为黄色 氧化性:
B 将灼热的炭加入盛有浓的试管中,试管上方出现红棕色气体 C和浓反应产生
C 将粉末与铝粉混合均匀,在混合物上面加适量,再用镁条引燃混合物,有熔融铁水流出 铝的还原性强于铁,且与铝粉的反应放热
D 将少量晶体放入试管底部,在试管口塞上一团棉花,用酒精灯在试管底部药品处小火微热,试管底部的固体消失,试管口处的内壁上出现“白霜” 晶体依次发生了升华和凝华
A.A B.B C.C D.D
二、非选择题
15.黄铵铁矾 [化学式可表示为(NH4)xFey(SO4)z(OH)w,摩尔质量为480 g·mol-1]。Min Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3和H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。
根据以上实验及图中数据确定黄铵铁矾的化学式为_______。
16.铝热反应实验
实验原理 Al作还原剂,金属氧化物作氧化剂,用铝将氧化物中的金属置换出来
实验操作
实验现象 (1)镁条剧烈燃烧 (2)氧化铁粉末和铝粉发生剧烈的反应 (3)反应放出大量的热,并发出耀眼的白光 (4)纸漏斗的下部被烧穿,有熔融物落入沙中
实验结论 在高温下,铝与Fe2O3发生反应,放出大量的热
【实验原理】反应的化学方程式为_______。
17.元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
请回答以下问题:
(1)中Fe的化合价为_______。
(2)是否为碱性氧化物_______(填是或否),理由:_______。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:_______。
(4)已知在强碱溶液中稳定存在,PH越小稳定性越差;则制备时需要在_______(填“酸性”“碱性”或“中性”)环境中进行:也可以作为净水剂,能与水反应生成具有吸附性的胶体,写出其中离子方程式:_______。其中检验溶液中的试剂是_______。
(5)FeO、是合成氨工业生产中所用的催化剂的主要成分。某FeO、混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、的物质的量之比为_______。
18.钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:
(1)钠在空气中燃烧生成淡黄色的_______(填“Na2O”或“Na2O2”); Al2O3能溶于酸或强碱溶液生成盐和水,则是一种_______(填“酸性”、“碱性”或“两性”)氧化物;
(2)写出钠与水反应的化学方程式:_______。
(3)写出铝与NaOH溶液反应的化学方程式:_______;
(4)现有下列3种物质:①Na2O2、②NaHCO3、③Na2CO3,请回答:受热易分解的是_______ (填序号,下同),溶于水显碱性的是_______,与CO2反应产生的气体能使带火星木条复燃的是_______。
参考答案:
1.A
【详解】A.Fe2+遇溶液:生成蓝色沉淀,,A正确;
B.次氯酸钠具有强氧化性,二氧化硫具有还原性,两者会发生氧化还原反应:,B错误;
C.石灰乳应写成化学式,将氯气通入冷的中制漂白粉:,C错误;
D.磁性氧化铁为四氧化三铁,和稀盐酸反应生成盐和水,题中所给离子方程式电荷不守恒,应为,D错误;
故答案选A。
2.A
【详解】由题干信息可知,过程中涉及的反应方程式有:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O,Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,Fe(NO3)2+2NH3 H2O=Fe(OH)2↓+2NH4NO3,Al(NO3)3+3 NH3 H2O=Al(OH)3↓+3NH4NO3,4Fe(OH)2+O2+2H2O=4Fe(OH)3,设22.4g的混合物中含有Fe为n1mol,Al为n2mol,根据质量守恒有:①56n1+27n2=22.2g,根据电子守恒可知:2n1+3n2=3n(NO)=3=1.2mol,联合方程①②解得:n1=0.3mol,n2=0.2mol,最终得到的沉淀为Fe(OH)3和Al(OH)3,根据质量守恒可知,m沉淀==47.7g,故答案为:A。
3.B
【详解】A.氧化铁粉末呈红色,可用于制备红色涂料,颜色与制取铁盐无关,A错误;
B.Na具有强还原性,可用于冶炼稀有金属,性质和用途相对应,B正确;
C.受热分解,可用于制备发酵粉等,与中和胃酸无关,C错误;
D.明矾溶于水并水解形成胶体,可用于水的净化,形成的氢氧化铝胶体不具有氧化性,不能消毒,D错误;
故选B。
4.B
【详解】A.FeSO4溶液中加入铁粉,Fe2+具有还原性,容易被氧气氧化成Fe3+,加入铁粉能将Fe3+还原为Fe2+,离子方程式为2Fe3++Fe=3Fe2+,A正确;
B.浓硝酸见光易分解生成NO2、O2和水,化学方程式为4HNO34NO2↑+O2↑+2H2O,B错误;
C.碳酸氢铵不稳定,受热易分解,因此保存在阴凉处,化学方程式为,C正确;
D.金属钠化学性质活泼,能与空气中的氧气反应生成氧化钠,同时钠能与水反应生成氢氧化钠和氢气,因此钠保存在煤油中,化学方程式为、,D正确;
故答案选B。
5.C
【分析】二硫化亚铁铜CuFeS2中,铁为+2价,铜为+2价,硫为-2价,在题给反应中,CuFeS2中的铜由+2价降为+1价,硫由-2价升为0价,FeCl3溶液中的铁由+3价降为+2价,其他元素的化合价没有变。
【详解】A.CuFeS2中铜的化合价降低,硫的化合价升高,既是氧化剂,又是还原剂,A正确;
B.S是单质,既不是电解质,也不是非电解质,B正确;
C.消耗3mol Fe3+时,反应中有4mol电子转移,则消耗56g(1mol)Fe3+时,反应中有4/3mol电子转移,C错误;
D.KSCN与Fe3+反应生成红色的络合物,向反应后的溶液中滴加少量KSCN溶液,若溶液变红,则说明Fe3+未完全反应,D正确;
故选:C。
6.B
【详解】A.该反应中HNO3为氧化剂,Fe3+为氧化产物,则氧化性HNO3>Fe3+,A错误;
B.该反应30个HNO3中27个HNO3体现酸性,3个体现氧化性,作氧化剂的HNO3是参与反应的HNO3的10%,B正确;
C.常温下铁遇浓硝酸发生钝化,无法加快反应速率,C错误;
D.反应后的混合物中滴加少量氢氧化钠溶液,NaOH先与铁离子反应生成氢氧化铁沉淀,无气体产生,D错误;
故答案选B。
7.C
【详解】A.铁粉与氯化铁、氯化铜均会发生氧化还原反应,不能达到除杂目的,A错误;
B.饱和溶液与二氧化碳和二氧化硫均会发生反应,不能达到除杂目的,B错误;
C.适量的会与碳酸氢钠发生反应生成碳酸钠,能达到除杂的目的,C正确;
D.过量溶液均会与硫酸钠、碳酸钠发生反应,不能达到除杂目的,D错误;
故选C。
8.C
【详解】Al2O3和 Fe2O3分别与H2SO4反应生成Al2(SO4)3和Fe2(SO4)3,加入氢氧化钠后开始出现沉淀,发生的反应为Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少时,所得沉淀全部为Fe(OH)3,根据NaOH+Al(OH)3=NaAlO2+2H2O可知,若溶解Al(OH)3消耗的NaOH体积为10mL,设NaOH的浓度为cmol/L,说明Al3+的物质的量为0.01cmol,则Fe3+的物质的量为0.01cmol,故沉淀Al3+和Fe3+的NaOH的物质的量为(0.01cmol+0.01cmol)×3=0.06cmol,体积为=0.06L=60mL,因此C选项所对应的图象符合题意;
故选C。
9.C
【详解】根据同温同压下气体的体积之比等于物质的量之比,故设加入氢氧化钠溶液产生的H2为2mol,则加入盐酸产生的H2为3mol,根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知生成2molH2,需要Al的物质的量为mol,由于2Al+6HCl=2AlCl3+3H2↑可知,等质量的Al与盐酸和NaOH反应放出的H2一样多,故说明Mg与盐酸反应产生的H2为1mol,根据反应方程式Mg+2HCl=MgCl2+H2↑可知,生成1molH2需消耗1mol的Mg,故样品中铁、铝物质的量之比为1:=3:4,故答案为:C。
10.B
【分析】高锰酸钾与浓盐酸反应生成氯气,混有杂质HCl和水蒸气杂质,饱和食盐水除去HCl,浓硫酸干燥氯气,氯气和铁粉在加热下反应生成FeCl3,其易升华,加热形成蒸气,在丙装置中冷凝收集氯化铁,由于氯化铁易水解,氯化钙作用是防止空气中水蒸气进入装置丙,NaOH溶液用于吸收有毒的尾气氯气;
【详解】A.高锰酸钾与浓盐酸反应生成氯气,浓盐酸易挥发,氯气中混有杂质HCl和水蒸气杂质,饱和食盐水除去HCl,浓硫酸干燥氯气,甲可制得纯净的Cl2,A正确;
B.无论氯气是否足量,Fe与Cl2都只生成FeCl3,B错误;
C.氯气和铁粉在加热下反应生成FeCl3,其易升华,加热形成蒸气,在丙装置中冷凝收集FeCl3,C正确;
D.由于氯化铁易水解,氯化钙作用是防止空气中水蒸气进入装置丙,D正确;
故选:B。
11.B
【详解】A.过氧化钠和空气中二氧化碳反应生成碳酸钠和氧气,为氧化还原反应,与氧化还原反应有关,A不符合题意;
B.生石灰氧化钙和水生成氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀,没有元素化合价改变,与氧化还原反应无关,B符合题意;
C.氯气和溶液中水生成盐酸和次氯酸为氧化还原反应,盐酸和硝酸银生成氯化银白色沉淀,C不符合题意;
D.将溶液滴入溶液中,产生白色沉淀,最终变为红褐色,反应中生成的氢氧化亚铁和空气中氧气反应转化为氢氧化铁沉淀,与氧化还原反应有关,D不符合题意;
故选B。
12.A
【详解】A.可用作制冷剂运用的化学知识为:易液化,故A符合题意;
B.用漂白纸张运用的化学知识为:具有漂白性,故B不符合题意;
C.用铝槽车运输浓硝酸运用的化学知识为:在冷的浓硝酸中发生钝化,故C不符合题意;
D.用制作芯片运用的化学知识为:是良好的半导体材料,故D不符合题意;
故选A。
13.D
【分析】由图象可知,刚开始铁少量,OA段发生反应为:Fe++4H+=Fe3++NO+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2,据此解答。
【详解】A.由分析可知,OA段发生反应为:Fe++4H+=Fe3++NO+2H2O,BC段发生反应为:Fe+2H+=Fe2++H2,OA段消耗5.6gFe,BC段消耗14.0g-8.4g=5.6gFe,由方程式可知,段和段产生的气体物质的量之比为1:1,故A正确;
B.由分析可知,AB段发生反应为:Fe+2Fe3+=3Fe2+,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为,故C正确;
D.由图可知:反应消耗14g铁,物质的量是=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,含硫酸,所以硫酸的浓度是,故D错误;
故选D。
14.C
【详解】A.溶液变为黄色说明有三价铁生成,但是酸性环境中含有氢离子,硝酸根在氢离子存在的情况下也可以把二价铁氧化为三家忒,故该现象不能说明氧化性,A错误;
B.将灼热的炭加入到盛有浓的试管中,可能是浓硝酸在加热的情况下分解生成二氧化氮,B错误;
C.氧化铁和铝在加热的情况下生成单质铁,说明铝还原性更强,且用镁条引燃混合物,有熔融铁水流出,说明该反应为放热反应,C正确;
D.在加热的情况下,氯化铵分解生成氨气和氯化氢,在试管口部氨气和氯化氢再次生成氯化铵,这是化学反应,不是升华和凝华,D错误;
故选C。
15.NH4Fe3(SO4)2(OH)6
【详解】设有480 g物质分解,670 ℃以上为红棕色纯净物Fe2O3,则其物质的量为n(Fe2O3)= =1.5 mol,即y=3;在固体质量400 g→240 g时,分析可知,该产物为SO3和Fe2O3,则n(SO3)= =2 mol,即z=2;化合物中各元素化合价代数和为0,则x+3×(+3)+ 2×(-2)+w×(-1)=0,17x+3×56+2×96+17w=480,解得x=1、w=6,所以该物质的化学式为NH4Fe3(SO4)2(OH)6。
16.2Al + Fe2O32Fe + Al2O3
【详解】该反应为铝热反应,以铝作铝热剂,发生反应;
故答案为:。
17.(1)+6
(2) 是 与盐酸反应生成了盐和水
(3)
(4) 碱性 KSCN溶液
(5)2:1
【详解】(1)中钠、氧元素化合价分别为+1、-2,根据化合价代数和为零,可知Fe的化合价为+6;
(2)能和酸反应生成盐和水的氧化物属于碱性氧化物;与盐酸反应生成了盐和水,故其为碱性氧化物;
(3)氢氧化亚铁和空气中氧气、水生成红褐色氢氧化铁,反应为;
(4)已知在强碱溶液中稳定存在,PH越小稳定性越差;则制备时需要在碱性环境中进行;也可以作为净水剂,能与水反应生成具有吸附性的胶体,反应中铁化合价由+6变为+3,则反应中氧元素化合价升高得到氧气,根据电子守恒、质量守恒可知,离子方程式:;铁离子能和KSCN溶液变红色,故其中检验溶液中的试剂是KSCN溶液;
(5)设FeO、的物质的量之比为a:b,则,故a:b=2:1。
18.(1) Na2O2 两性
(2)2Na+2H2O=2NaOH+H2↑
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4) ② ①②③ ①
【详解】(1)钠在空气中燃烧生成淡黄色的Na2O2,Na2O为白色;Al2O3能溶于酸或强碱溶液生成盐和水,即Al2O3+6HCl=2AlCl3+3H2O、Al2O3+2NaOH=2NaAlO2+H2O,Al2O3是一种两性氧化物;故答案为:Na2O2;两性;
(2)钠与水反应生成氢氧化钠和氢气,该反应的化学方程式为:2Na+2H2O=2NaOH+H2↑;故答案为:2Na+2H2O=2NaOH+H2↑;
(3)铝与NaOH溶液反应生成偏铝酸钠和氢气,该反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)受热易分解的是NaHCO3,方程式为:;碳酸钠和碳酸氢钠溶液均显碱性,Na2O2与水反应生成NaOH和O2,故其溶于水也显碱性;2Na2O2+2CO2=2Na2CO3+O2,故与CO2反应产生的气体能使带火星木条复燃的是Na2O2;故答案为:②;①②③;①。
