第一章物质及其变化检测题高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 第一章物质及其变化检测题高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 715.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:20:06 | ||
图片预览




文档简介
第一章《物质及其变化》检测题
一、单选题
1.关于反应,下列说法正确的是
A.中H元素被氧化 B.在反应充当还原剂
C.还原剂与氧化剂的物质的量之比为3∶4 D.既是氧化产物又是还原产物
2.下列离子方程式书写正确的是
A.铜与浓硫酸在加热条件下反应:
B.水玻璃中通入过量二氧化碳气体:
C.溶液与溶液反应:
D.过量铁粉与稀硝酸反应:
3.下列指定反应的离子方程式正确的是
A.用铝粉和NaOH溶液反应制取少量H2 Al+2OH-=AlO+H2↑
B.电解饱和食盐水制备Cl2 2Cl-+2H2OH2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸 Ba2++OH-+H++ SO=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水 Ca2++HCO+OH-=CaCO3↓+H2O
4.下表所列各组物质中,各物质间能按照下图所示通过一步反应就能完成转化的是
a b c
A Cu CuSO4 Cu(OH)2
B HNO3 NO NO2
C CH2=CH2 CH3CH2OH CH3CH3
D Si SiO2 H2SiO3
A.A B.B C.C D.D
5.请阅读下列材料:
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O=2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。关于反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法正确的是
A.O2发生还原反应 B.Fe(OH)2被还原
C.H2O发生氧化反应 D.H2O是氧化剂
6.下列各组离子在指定的溶液中一定能大量共存的是
A.含有大量Ba2+的溶液中:Cl-、K+、S、C
B.含有大量H+的溶液中:Mg2+、Na+、HC、S
C.含有大量OH-的溶液中:Na+、Fe3+、N、S
D.含有大量Cu2+的溶液中:H+、K+、S、N
7.按物质的组成进行分类,Na2SO4属于
A.碱 B.氧化物 C.盐 D.单质
8.自来水加工处理流程如图,下列有关说法不正确的是( )
A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池
B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3﹣等
C.自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染
D.用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍
9.能正确反映化合物(用M表示)与电解质(用N表示)二者关系的是
选项 A B C D
关系 包含关系 并列关系 交集关系 重叠关系
A.A B.B C.C D.D
10.下列物质中,属于非电解质的是
A.铜 B.蔗糖 C.食盐水 D.氢氧化钾
11.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的顺序组合正确的是( )
纯净物 混合物 强电解质 弱电解质 非电解质
A 盐酸 水煤气 硫酸 醋酸 HD
B 胆矾 石灰水 硫酸钡 HClO NH3
C 火碱 蔗糖溶液 氯化钠 氨水 三氧化硫
D 冰醋酸 福尔马林 苛性钾 碘化氢 乙醇
A.A B.B C.C D.D
12.下列属于氧化物的是
A.Na2O2 B.MgO C.H2SO4 D.NaOH
13.能在水溶液中大量共存的一组离子是( )
A.H+、Cl-、SO42-、CO32-
B.Ag+、Fe3+、Cl-、SO42-
C.K+、SO42-、Cu2+、NO3-
D.NH4+、OH-、Cl-、HCO3-
14.下列离子方程式中,只能表示一个化学反应的是
A.+2H+=CO2↑+H2O
B.Ba2++2OH-+2H++=BaSO4↓+2H2O
C.Cl2+H2OH++Cl-+HClO
D.Fe+Cu2+=Fe2++Cu
15.下列离子方程式的书写中,正确的是
A.浓烧碱溶液中加入铝箔:Al + 2OH一 == AlO2一 + H2↑
B.氯化铁溶液中加入铁粉:Fe + Fe3+ == 2Fe2+
C.氢氧化铜中加入硫化钠溶液:Cu2+ + S2一 == CuS↓
D.碳酸氢镁溶液中加入足量烧碱溶液:Mg2+ + 2HCO3一 + 4OH一 == Mg(OH)2↓ + 2CO32一 + 2H2O
二、填空题
16.特殊氧化物
(1)举例:_______等。
(2)性质:氧元素的价态是_______价。
17.含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:_________________________________。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式______________________________。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面____________,则发生了钝化;若铁棒表面________________,则未发生反应。
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):______________________________。
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式:____________________________。
(6)制取硫酸铜有两种方法:方法一:2Cu+O22CuO,CuO+ H2SO4= CuSO4+H2O,
方法二:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:_____________________________________________(答任一点)。
三、实验题
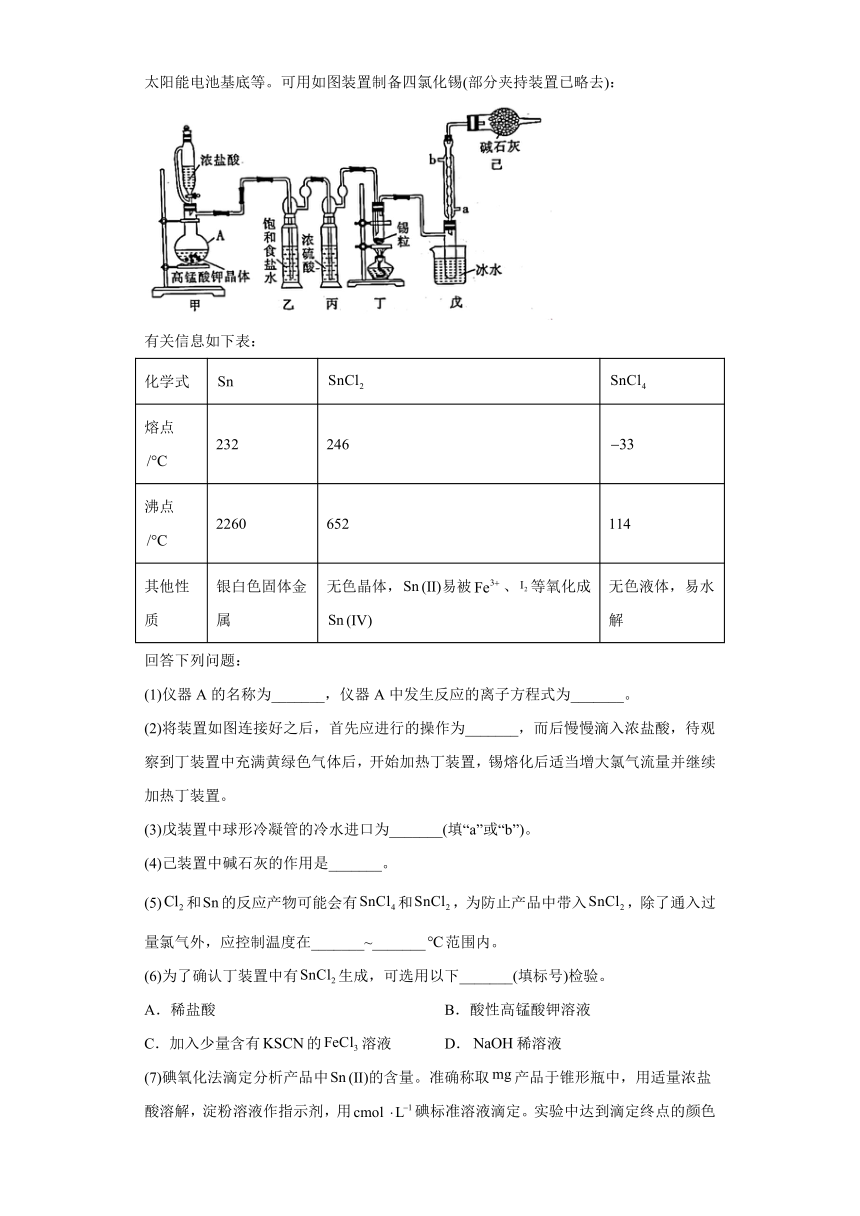
18.无水四氯化锡()可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
有关信息如下表:
化学式
熔点 232 246
沸点 2260 652 114
其他性质 银白色固体金属 无色晶体,(Ⅱ)易被、等氧化成(Ⅳ) 无色液体,易水解
回答下列问题:
(1)仪器A的名称为_______,仪器A中发生反应的离子方程式为_______。
(2)将装置如图连接好之后,首先应进行的操作为_______,而后慢慢滴入浓盐酸,待观察到丁装置中充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量并继续加热丁装置。
(3)戊装置中球形冷凝管的冷水进口为_______(填“a”或“b”)。
(4)己装置中碱石灰的作用是_______。
(5)和的反应产物可能会有和,为防止产品中带入,除了通入过量氯气外,应控制温度在_______~_______范围内。
(6)为了确认丁装置中有生成,可选用以下_______(填标号)检验。
A.稀盐酸 B.酸性高锰酸钾溶液
C.加入少量含有的溶液 D.稀溶液
(7)碘氧化法滴定分析产品中(Ⅱ)的含量。准确称取产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用碘标准溶液滴定。实验中达到滴定终点的颜色变化为_______,若此时消耗碘标准溶液,则产品中(Ⅱ)的质量分数为_______(用字母表示)。
19.某NaCl溶液样品中含有Na2SO4、CaCl2杂质(该溶液用X表示),除去杂质的实验方案如图所示。
请回答:
(1)溶液B中存在的阳离子为____________,阴离子为___________。
(2)固体C中所含物质的化学式为__________。
(3)溶液D中加入适量盐酸后,大量减少的微粒为__________。
(4)①和②不能调换顺序的理由为______________。
四、计算题
20.已知和在常温下可快速反应生成氮气:。当和 比例不同时,产物有差异。请回答:
若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则和的最佳体积比为___________。
体积为的和的混合气体通过浓氨水后,体积变为其中体积分数为,则原混合气体中的体积为_____________气体体积均为标准状况下测定。
有和的混合气体,其中的体积分数为x,将该混合气体与1L氨气混合,讨论当x取不同范围的数值时,所得气体体积y与x的关系式气体体积均在相同状况下测定。
x的取值范围 y与x的关系式
__________
_________
21.A、B、C三种物质的溶解度曲线如图所示,请回答:
(1)对于物质A而言,点P的含义为________。
(2)t3℃时,A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为________。
(3)若A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是________。
(4)烧杯中有t2℃时20%的A溶液50g,要将该溶液变为同温度下的饱和溶液,至少需向烧杯中加入A物质________克。
参考答案:
1.D
【分析】由反应8NH3+6NO2═7N2+12H2O可知,NH3的N元素的化合价由-3价升高到0价,NO2中的N元素的化合价由+4价降低到0价,结合氧化还原反应的规律分析判断。
【详解】A.NH3中H元素的化合价没有发生变化,故其未被氧化,被氧化的是N元素,故A错误;
B.NO2中的N元素的化合价由+4价降低到0价,是氧化剂,故B错误;
C.该反应中,NH3是还原剂,NO2是氧化剂,由化学方程式可知,还原剂与氧化剂的物质的量之比为4∶3,故C错误;
D.NH3的N元素的化合价由-3价升高到0价,NO2中的N元素的化合价由+4价降低到0价,氧化产物和还原产物均为N2,故D正确;
故选D。
2.D
【详解】A.浓硫酸在离子方程式中写成化学式,铜与浓硫酸在加热条件下反应的离子方程式为:,A错误;
B.水玻璃是硅酸钠的水溶液,通入过量二氧化碳气体,反应的离子方程式为:,B错误;
C.溶液与溶液反应,离子方程式为:,C错误;
D.过量铁粉与稀硝酸反应生成硝酸亚铁、一氧化氮和水,反应的离子方程式为:,D正确;
答案选D。
3.B
【详解】A.用铝粉和NaOH溶液反应制取少量H2,正确的离子方程式为2Al+2H2O+2OH-=2AlO +3H2↑,故A错误;
B.电解饱和食盐水制备Cl2,正确的离子方程式为2Cl-+2H2OH2↑+Cl2↑+2OH-,故B正确;
C.向氢氧化钡溶液中加入稀硫酸,正确的离子方程式为Ba2++2OH-+2H++ SO=BaSO4↓+2H2O,故C错误;
D.向碳酸氢铵溶液中加入足量石灰水,正确的离子方程式为Ca2++HCO+NH+2OH-=CaCO3↓+H2O+NH3 H2O,故D错误;
故选B。
4.B
【详解】考查的知识点:元素化合物知识
选项A
a→b:Cu与浓H
SO4共热生成CuSO4、SO2、H2O;b→c:CuSO4+2NaOH=Cu(OH)2+Na2SO4
c→b:Cu(OH)2+H2SO4=CuSO4+2H2O,但c→a无法实现,所以A错误
选项B
a→b:Cu与稀硝酸反应生成Cu(NO3)2、NO、H2O; b→c:2NO+O2=2NO2
c→b:3NO2+H2O=2HNO3+NO, c→a:3NO2+H2O=2HNO3+NO 所以B正确
选项C
a→b:CH2=CH2与H2O加成; b→c、c→b、c→a都无法实现 所以C错误
选项D
a→b: Si与氧气共热生成SiO2; b→c无法实现
c→b:H2SiO3受热分解成SiO2和H2O, c→a无法实现 所以D错误
5.A
【详解】A. 氧气中氧元素化合价降低,得到电子,O2发生还原反应,A正确;
B. 氢氧化亚铁中铁元素化合价升高,失去电子,Fe(OH)2被氧化,B错误;
C. H2O中元素化合价均没有发生变化,不发生氧化反应,也不发生还原反应,C错误;
D. H2O中元素化合价均没有发生变化,不是氧化剂,也不是还原剂,D错误;答案选A。
6.D
【详解】A.Ba2+可与S、C分别反应生成BaSO4、BaCO3沉淀,不能大量共存,故A错误;
B.H+可与HC反应生成CO2和H2O,不能大量共存,故B错误;
C.OH-可与Fe3+反应生成Fe(OH)3沉淀,不能大量共存,故C错误;
D.H+、K+、S、N之间不反应,且都不与Cu2+反应,一定能大量共存,故D正确;
答案选D。
7.C
【详解】A.Na2SO4由金属离子和酸根离子构成,则其不属于碱,A不正确;
B.Na2SO4中含有三种元素,则不属于氧化物,B不正确;
C.Na2SO4由Na+和构成,则其属于盐,C正确;
D.Na2SO4由Na、S、O三种元素组成,不属于单质,D不正确;
故选C。
8.A
【详解】A.亚铁离子具有还原性,含氯物质具有强氧化性,能将亚铁离子氧化为铁离子,所以若用FeSO4作混凝剂,最终铁元素将以Fe(OH)3形式进入反应沉淀池,A项错误;
B. CaO和水反应生成Ca(OH)2,Ca(OH)2和Mg2+产生Mg(OH)2沉淀,氢氧化钙和反应生成CaCO3沉淀,从而除去水中的Mg2+、等,B项正确;
C.含氯物质具有强氧化性,能杀菌消毒,所以自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染,从而使用水更安全,C项正确;
D.消毒杀菌时,ClO2和Cl2中的Cl最终都转变成Cl-;1个ClO2转变为1个Cl-,可以得5个电子,1个Cl2转变为2个Cl-,可以得到2个电子;质量均为ag的ClO2和Cl2能够得到的电子数目的比例为:,所以ClO2消毒效率是Cl2的2.63倍,D项正确;
答案选A。
9.A
【分析】据电解质的概念分析。
【详解】电解质是溶于水或熔化时能导电的化合物。故电解质一定属于化合物,包含在化合物之中。
本题选A。
10.B
【详解】A.铜是金属单质,既不是电解质也不是非电解质,故A错误;
B.蔗糖在水溶液或熔融状态都不能导电,属于非电解质,故B正确;
C.食盐水是混合物,既不是电解质也不是非电解质,故C错误;
D.氢氧化钾在熔融状态或水溶液中都能导电,属于电解质,故D错误;
故选B。
11.B
【详解】A.盐酸是混合物,HD是单质,不是非电解质,故A错误;
B.胆矾是纯净物,石灰水是混合物,硫酸钡是强电解质,HClO是弱电解质,氨气是非电解质,故B正确;
C.氨水是混合物,不是弱电解质,NH3 H2O是弱电解质,故C错误;
D.碘化氢是强电解质,故D错误。
综上所述,答案为B。
12.B
【详解】氧化物是指由两种元素组成,其中一种是氧元素的化合物。硫酸与氢氧化钠中含有3种元素,故C和D错误,过氧化钠属于过氧化物,既不是酸性氧化物也不是碱性氧化物,不属于狭义的氧化物,故A错误;
故选B。
13.C
【详解】A.H+与CO32-反应生成CO2,H+与CO32-不能大量共存,A错误
B.Ag+与Cl-、Ag+与SO42-反应生成AgCl白色沉淀、Ag2SO4白色微溶物,B错误;
C.K+、SO42-、Cu2+、NO3-在溶液中能大量共存,C正确;
D.NH4++OH-NH3.H2O、NH3.H2O,OH-+HCO3- CO32-+H2O,D错误;
答案选D。
14.C
【详解】A.+2H+=CO2+H2O,可以表示可溶性碳酸盐与强酸反应生成二氧化碳、水和可溶性盐,能够表示一类反应,A不符合题意;
B.Ba2+ +2OH- +2H+ +=BaSO4↓+2H2O可表示硫酸与氢氧化钡反应或者氢氧化钡与硫酸氢盐反应,能够表示一类反应,B不符合题意;
C.Cl2+H2OH++Cl-+HClO,只能表示氯气和水的反应,C符合题意;
D.Fe+Cu2+═Fe2++Cu,表示铁与可溶性铜盐反应,能够表示一类反应,D不符合题意;
故选C。
15.D
【详解】A. 浓烧碱溶液中加入铝箔,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al + 2OH一 + 2H2O ==2 AlO2一 + 3H2↑,选项A错误;
B. 氯化铁溶液中加入铁粉,反应生成氯化亚铁,反应的离子方程式为:Fe +2 Fe3+ == 3Fe2+,选项B错误;
C. 氢氧化铜中加入硫化钠溶液,反应生成硫化铜沉淀和氢氧化钠,反应的离子方程式为:Cu(OH)2 + S2一 CuS↓+S2-,选项C错误;
D. 碳酸氢镁溶液中加入足量烧碱溶液,反应生成氢氧化镁、碳酸钠和水,反应的离子方程式为:Mg2+ + 2HCO3一 + 4OH一 == Mg(OH)2↓ + 2CO32一 + 2H2O,选项D正确。
答案选D。
16.(1)Na2O2、H2O2
(2)-1
【解析】(1)
一般的氧化物中氧元素的化合价为-2价,如二氧化碳或二氧化硫等,但如过氧化钠和过氧化氢都属于特殊的氧化物,其中氧元素的化合价为-1价。
(2)
过氧化物中氧元素的化合价为-1价。
17. BaCO3+2H+=Ba2++CO2↑+H2O 无明显现象 有紫红色物质析出 Na2SO3+ SO2+ H2O = 2NaHSO3 SO2+ 2COS + 2CO2 节省原料(硫酸用量少)、无污染
【分析】(1)亚硫酸不稳定,易为氧气氧化生成硫酸;
(2)碳酸钡属于碳酸盐,能和盐酸反应生成可溶性的氯化钡;
(3)铁的活泼性比铜强,铁能和铜离子发生置换反应;
(4)亚硫酸钠能和二氧化硫、水反应生成硫酸氢钠;
(5)在一定条件下,CO还原SO2得到单质硫,同时自身被氧化生成二氧化碳;
(6)二氧化硫有毒,会污染大气,结合反应需要硫酸的量分析。
【详解】(1)亚硫酸不稳定,易被空气中氧气氧化生成硫酸,亚硫酸是弱酸,硫酸是强酸,所以生成硫酸后使酸雨酸性增强,该反应方程式为:H2SO3+O2═H2SO4,反应中电子转移的数目和方向是;
(2)人体胃液中含有盐酸,碳酸钡能和盐酸反应生成可溶性的氯化钡,钡离子有毒,所以会产生中毒现象,反应方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,对应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O;
(3)铁的活泼性大于铜,所以铁能和铜离子发生置换反应生成铜,如果铁棒被氧化,将铁棒洗净后置于CuSO4溶液中,则没有铜析出,铁棒会无明显现象,如果铁棒未被氧化,则铁和铜离子发生置换反应生成铜单质而附着在铁棒上,所以铁棒上有紫红色物质析出;
(4)亚硫酸钠和二氧化硫、水反应生成亚硫酸氢钠,反应方程式为:Na2SO3+SO2+H2O═2NaHSO3;
(5)在一定条件下,一氧化碳能还原二氧化硫生成硫单质,自身被氧化生成二氧化碳,反应方程式为:SO2+2COS+2CO2;
(6)根据方程式知,第一个方程式比第二个方程式节省硫酸,且没有有毒气体二氧化硫生成,所以对环境无污染。
18.(1) 蒸馏烧瓶
(2)检查装置的气密性
(3)a
(4)吸收未反应完的氯气,防止污染空气,防止水蒸气进入戊装置的试管中使产物水解
(5) 232 652
(6)C
(7) 溶液颜色变为蓝色,且半分钟内不变色 或
【解析】(1)
由构造知,仪器A的名称为蒸馏烧瓶,A中发生反应的化学方程式为KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O,离子方程式为:;
(2)
该装置是制取气体的,则将装置如图连接好之后,首先应进行的操作为检查装置的气密性;
(3)
为保证较好的冷凝效果,冷凝水‘下进上出’,冷水进口为a;
(4)
己装置中碱石灰的作用是吸收未反应完的氯气,防止污染空气,防止水蒸气进入戊装置的试管中使产物水解;
(5)
Cl2和Sn的反应产物可能会有SnCl4和SnCl2,为防止产品中带入SnCl2,除了通入过量氯气外,由表中沸点数据可知应控制温度在232~652℃范围内;
(6)
为了确认丁中SnCl2的生成,可选用滴有KSCN溶液的FeCl3溶液,观察红色是否褪去,因高锰酸钾可氧化氯离子,故答案为:C;
(7)
准确称取11.9g产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用0.1mol L-1碘标准溶液滴定,滴入最后一滴,出现溶液变蓝,且30s内颜色不变现象时达到滴定终点,此时消耗碘标准溶液50mL,由Sn2++I2═Sn4++2I-,可知n(SnCl2)=n(I2)=cV×10-3mol,Sn(II)的质量为m=nM= cV×10-3mol×119g/mol=0.119cV g,质量分数为。
19. Na+、Ba2+、Ca2+ Cl- BaCO3、CaCO3 CO32- ①和②调换顺序后可除去Ca2+和SO42-,但加入BaCl2溶液后引入的Ba2+杂质无法除去。
【分析】由题意可知溶液中主要存在Na+、Ca2+、Cl-、SO42-,加BaCl2可以将SO42-沉淀,固体A为BaSO4,溶液B中有Na+、Ca2+、Cl-、Ba2+;再加Na2CO3,可将Ca2+、Ba2+沉淀下来,固体C为BaCO3、CaCO3,溶液D中有Na+、Cl-、CO32-;再加盐酸,与CO32-反应,溶液中只剩Na+和Cl-。
【详解】(1)根据分析,溶液B中存在的阳离子为Na+、Ca2+、Ba2+;阴离子为C1-;
(2)根据分析,沉淀为BaCO3、CaCO3;
(3)根据分析,加入盐酸,H+与CO32-反应,所以大量减少的离子为CO32-;
(4) CO32-除了能够出去原溶液中的Ca2+之外,还能出去加入的Ba2+,如果将①和②调换,不影响Ca2+和SO42-的去除,但加入BaCl2溶液后引入的Ba2+杂质无法除去。
【点睛】本题的一定要注意CO32-与Ba2+的加入顺序,CO32-用于除去溶液中的Ca2+,Ba2+用于除去溶液中的SO42-,过量的CO32-可用HCl除去,但过量的Ba2+却没有用其他试剂除去,只能用CO32-除去,所以CO32-必须在Ba2+之后加入,以便除去过量的Ba2+。
20.
【分析】(1)根据题意,NH3和 Cl2在常温下可快速反应生成氮气:2NH3+3Cl2=N2+6HCl,利用该反应处理含有氨气和氯气的尾气,最佳比例是恰好完全反应;
(2)标准状况下体积为1.12L的Cl2和N2的混合气体物质的量为=0.05mol,通入浓氨水后,体积变为0.672L,其物质的量为=0.03mol,其中Cl2体积分数为50%,则反应后Cl2物质的量为0.015mol,N2的物质的量为0.015mol,设原混合气体中氯气和氮气物质的量分别为xmol、ymol,则参与反应Cl2物质的量为(x-0.015)mol,再由方程式进行计算;
(3)依据反应的极值方法进行分析计算分析判断不同范围的气体体积。
【详解】氨气和氯气在常温下可快速反应生成氮气:,若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则 和 的最佳比例为3:2;
故答案为:3:2;
体积为物质的量为,混合气体通过浓氨水后,体积变为其中体积分数为,为,氯气和分别为,设混合气体中含有氯气物质的量为xmol,氮气物质的量为,反应剩余氯气,则反应消耗氯气,根据化学方程式,反应生成氮气为,所以,计算得到,则原混合气体中的体积为;故答案为:112;
若按上式反应,,氨过量,还会生成氯化铵 ;当时恰好生成氯化铵和氮气,此时生成氮气原来的氮气。;当时氯和氨都用完,求出生成的氮气和氯化氢气体体积之和为,原有氮x,所以共有气体体积为;当时剩余氨气,可以用氯气计算,差量法求得气体减少,所以; 故答案为:; 。
【点睛】本题以NH3和 Cl2反应为载体,考查化学计算,通过分析反应的原理,利用好极端假设法,即可得出答案。
21. 在t1℃时,A的溶解度为35g A>B>C C 14
【分析】根据固体的溶解度曲线结合溶解度的含义分析解答。
【详解】(1)通过分析溶解度曲线可知,对于物质A而言,点P的含义为:在t1℃时,A的溶解度为35g,故答案为:在t1℃时,A的溶解度为35g;
(2)t3℃时,A物质的溶解度最大,B物质的溶解度次之,C物质的溶解度最小,所以A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为A>B>C,故答案为:A>B>C;
(3)气体物质的溶解度随温度的升高而减小,所以A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是C,故答案为:C;
(4)烧杯中有t2℃时20%的A溶液50g,要将该溶液变为同温度下的饱和溶液,t2℃时,A物质的溶解度是60g,50g溶液中含有溶质的质量为:50g×20%=10g,水的质量为40g,40g水中最多可以溶解固体的质量为:40g×=24g,至少需向烧杯中加入A物质的质量为:24g-10g=14g,故答案为:14。
【点睛】认识固体的溶解度曲线所表示的意义是解题的关键。本题的易错点为(4),要注意溶解度计算的基本方法的应用,要首先计算出溶质和溶剂的质量,再根据溶解度计算。
一、单选题
1.关于反应,下列说法正确的是
A.中H元素被氧化 B.在反应充当还原剂
C.还原剂与氧化剂的物质的量之比为3∶4 D.既是氧化产物又是还原产物
2.下列离子方程式书写正确的是
A.铜与浓硫酸在加热条件下反应:
B.水玻璃中通入过量二氧化碳气体:
C.溶液与溶液反应:
D.过量铁粉与稀硝酸反应:
3.下列指定反应的离子方程式正确的是
A.用铝粉和NaOH溶液反应制取少量H2 Al+2OH-=AlO+H2↑
B.电解饱和食盐水制备Cl2 2Cl-+2H2OH2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸 Ba2++OH-+H++ SO=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水 Ca2++HCO+OH-=CaCO3↓+H2O
4.下表所列各组物质中,各物质间能按照下图所示通过一步反应就能完成转化的是
a b c
A Cu CuSO4 Cu(OH)2
B HNO3 NO NO2
C CH2=CH2 CH3CH2OH CH3CH3
D Si SiO2 H2SiO3
A.A B.B C.C D.D
5.请阅读下列材料:
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O=2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。关于反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,下列说法正确的是
A.O2发生还原反应 B.Fe(OH)2被还原
C.H2O发生氧化反应 D.H2O是氧化剂
6.下列各组离子在指定的溶液中一定能大量共存的是
A.含有大量Ba2+的溶液中:Cl-、K+、S、C
B.含有大量H+的溶液中:Mg2+、Na+、HC、S
C.含有大量OH-的溶液中:Na+、Fe3+、N、S
D.含有大量Cu2+的溶液中:H+、K+、S、N
7.按物质的组成进行分类,Na2SO4属于
A.碱 B.氧化物 C.盐 D.单质
8.自来水加工处理流程如图,下列有关说法不正确的是( )
A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池
B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3﹣等
C.自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染
D.用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍
9.能正确反映化合物(用M表示)与电解质(用N表示)二者关系的是
选项 A B C D
关系 包含关系 并列关系 交集关系 重叠关系
A.A B.B C.C D.D
10.下列物质中,属于非电解质的是
A.铜 B.蔗糖 C.食盐水 D.氢氧化钾
11.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的顺序组合正确的是( )
纯净物 混合物 强电解质 弱电解质 非电解质
A 盐酸 水煤气 硫酸 醋酸 HD
B 胆矾 石灰水 硫酸钡 HClO NH3
C 火碱 蔗糖溶液 氯化钠 氨水 三氧化硫
D 冰醋酸 福尔马林 苛性钾 碘化氢 乙醇
A.A B.B C.C D.D
12.下列属于氧化物的是
A.Na2O2 B.MgO C.H2SO4 D.NaOH
13.能在水溶液中大量共存的一组离子是( )
A.H+、Cl-、SO42-、CO32-
B.Ag+、Fe3+、Cl-、SO42-
C.K+、SO42-、Cu2+、NO3-
D.NH4+、OH-、Cl-、HCO3-
14.下列离子方程式中,只能表示一个化学反应的是
A.+2H+=CO2↑+H2O
B.Ba2++2OH-+2H++=BaSO4↓+2H2O
C.Cl2+H2OH++Cl-+HClO
D.Fe+Cu2+=Fe2++Cu
15.下列离子方程式的书写中,正确的是
A.浓烧碱溶液中加入铝箔:Al + 2OH一 == AlO2一 + H2↑
B.氯化铁溶液中加入铁粉:Fe + Fe3+ == 2Fe2+
C.氢氧化铜中加入硫化钠溶液:Cu2+ + S2一 == CuS↓
D.碳酸氢镁溶液中加入足量烧碱溶液:Mg2+ + 2HCO3一 + 4OH一 == Mg(OH)2↓ + 2CO32一 + 2H2O
二、填空题
16.特殊氧化物
(1)举例:_______等。
(2)性质:氧元素的价态是_______价。
17.含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:_________________________________。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式______________________________。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面____________,则发生了钝化;若铁棒表面________________,则未发生反应。
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):______________________________。
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式:____________________________。
(6)制取硫酸铜有两种方法:方法一:2Cu+O22CuO,CuO+ H2SO4= CuSO4+H2O,
方法二:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:_____________________________________________(答任一点)。
三、实验题
18.无水四氯化锡()可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
有关信息如下表:
化学式
熔点 232 246
沸点 2260 652 114
其他性质 银白色固体金属 无色晶体,(Ⅱ)易被、等氧化成(Ⅳ) 无色液体,易水解
回答下列问题:
(1)仪器A的名称为_______,仪器A中发生反应的离子方程式为_______。
(2)将装置如图连接好之后,首先应进行的操作为_______,而后慢慢滴入浓盐酸,待观察到丁装置中充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量并继续加热丁装置。
(3)戊装置中球形冷凝管的冷水进口为_______(填“a”或“b”)。
(4)己装置中碱石灰的作用是_______。
(5)和的反应产物可能会有和,为防止产品中带入,除了通入过量氯气外,应控制温度在_______~_______范围内。
(6)为了确认丁装置中有生成,可选用以下_______(填标号)检验。
A.稀盐酸 B.酸性高锰酸钾溶液
C.加入少量含有的溶液 D.稀溶液
(7)碘氧化法滴定分析产品中(Ⅱ)的含量。准确称取产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用碘标准溶液滴定。实验中达到滴定终点的颜色变化为_______,若此时消耗碘标准溶液,则产品中(Ⅱ)的质量分数为_______(用字母表示)。
19.某NaCl溶液样品中含有Na2SO4、CaCl2杂质(该溶液用X表示),除去杂质的实验方案如图所示。
请回答:
(1)溶液B中存在的阳离子为____________,阴离子为___________。
(2)固体C中所含物质的化学式为__________。
(3)溶液D中加入适量盐酸后,大量减少的微粒为__________。
(4)①和②不能调换顺序的理由为______________。
四、计算题
20.已知和在常温下可快速反应生成氮气:。当和 比例不同时,产物有差异。请回答:
若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则和的最佳体积比为___________。
体积为的和的混合气体通过浓氨水后,体积变为其中体积分数为,则原混合气体中的体积为_____________气体体积均为标准状况下测定。
有和的混合气体,其中的体积分数为x,将该混合气体与1L氨气混合,讨论当x取不同范围的数值时,所得气体体积y与x的关系式气体体积均在相同状况下测定。
x的取值范围 y与x的关系式
__________
_________
21.A、B、C三种物质的溶解度曲线如图所示,请回答:
(1)对于物质A而言,点P的含义为________。
(2)t3℃时,A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为________。
(3)若A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是________。
(4)烧杯中有t2℃时20%的A溶液50g,要将该溶液变为同温度下的饱和溶液,至少需向烧杯中加入A物质________克。
参考答案:
1.D
【分析】由反应8NH3+6NO2═7N2+12H2O可知,NH3的N元素的化合价由-3价升高到0价,NO2中的N元素的化合价由+4价降低到0价,结合氧化还原反应的规律分析判断。
【详解】A.NH3中H元素的化合价没有发生变化,故其未被氧化,被氧化的是N元素,故A错误;
B.NO2中的N元素的化合价由+4价降低到0价,是氧化剂,故B错误;
C.该反应中,NH3是还原剂,NO2是氧化剂,由化学方程式可知,还原剂与氧化剂的物质的量之比为4∶3,故C错误;
D.NH3的N元素的化合价由-3价升高到0价,NO2中的N元素的化合价由+4价降低到0价,氧化产物和还原产物均为N2,故D正确;
故选D。
2.D
【详解】A.浓硫酸在离子方程式中写成化学式,铜与浓硫酸在加热条件下反应的离子方程式为:,A错误;
B.水玻璃是硅酸钠的水溶液,通入过量二氧化碳气体,反应的离子方程式为:,B错误;
C.溶液与溶液反应,离子方程式为:,C错误;
D.过量铁粉与稀硝酸反应生成硝酸亚铁、一氧化氮和水,反应的离子方程式为:,D正确;
答案选D。
3.B
【详解】A.用铝粉和NaOH溶液反应制取少量H2,正确的离子方程式为2Al+2H2O+2OH-=2AlO +3H2↑,故A错误;
B.电解饱和食盐水制备Cl2,正确的离子方程式为2Cl-+2H2OH2↑+Cl2↑+2OH-,故B正确;
C.向氢氧化钡溶液中加入稀硫酸,正确的离子方程式为Ba2++2OH-+2H++ SO=BaSO4↓+2H2O,故C错误;
D.向碳酸氢铵溶液中加入足量石灰水,正确的离子方程式为Ca2++HCO+NH+2OH-=CaCO3↓+H2O+NH3 H2O,故D错误;
故选B。
4.B
【详解】考查的知识点:元素化合物知识
选项A
a→b:Cu与浓H
SO4共热生成CuSO4、SO2、H2O;b→c:CuSO4+2NaOH=Cu(OH)2+Na2SO4
c→b:Cu(OH)2+H2SO4=CuSO4+2H2O,但c→a无法实现,所以A错误
选项B
a→b:Cu与稀硝酸反应生成Cu(NO3)2、NO、H2O; b→c:2NO+O2=2NO2
c→b:3NO2+H2O=2HNO3+NO, c→a:3NO2+H2O=2HNO3+NO 所以B正确
选项C
a→b:CH2=CH2与H2O加成; b→c、c→b、c→a都无法实现 所以C错误
选项D
a→b: Si与氧气共热生成SiO2; b→c无法实现
c→b:H2SiO3受热分解成SiO2和H2O, c→a无法实现 所以D错误
5.A
【详解】A. 氧气中氧元素化合价降低,得到电子,O2发生还原反应,A正确;
B. 氢氧化亚铁中铁元素化合价升高,失去电子,Fe(OH)2被氧化,B错误;
C. H2O中元素化合价均没有发生变化,不发生氧化反应,也不发生还原反应,C错误;
D. H2O中元素化合价均没有发生变化,不是氧化剂,也不是还原剂,D错误;答案选A。
6.D
【详解】A.Ba2+可与S、C分别反应生成BaSO4、BaCO3沉淀,不能大量共存,故A错误;
B.H+可与HC反应生成CO2和H2O,不能大量共存,故B错误;
C.OH-可与Fe3+反应生成Fe(OH)3沉淀,不能大量共存,故C错误;
D.H+、K+、S、N之间不反应,且都不与Cu2+反应,一定能大量共存,故D正确;
答案选D。
7.C
【详解】A.Na2SO4由金属离子和酸根离子构成,则其不属于碱,A不正确;
B.Na2SO4中含有三种元素,则不属于氧化物,B不正确;
C.Na2SO4由Na+和构成,则其属于盐,C正确;
D.Na2SO4由Na、S、O三种元素组成,不属于单质,D不正确;
故选C。
8.A
【详解】A.亚铁离子具有还原性,含氯物质具有强氧化性,能将亚铁离子氧化为铁离子,所以若用FeSO4作混凝剂,最终铁元素将以Fe(OH)3形式进入反应沉淀池,A项错误;
B. CaO和水反应生成Ca(OH)2,Ca(OH)2和Mg2+产生Mg(OH)2沉淀,氢氧化钙和反应生成CaCO3沉淀,从而除去水中的Mg2+、等,B项正确;
C.含氯物质具有强氧化性,能杀菌消毒,所以自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染,从而使用水更安全,C项正确;
D.消毒杀菌时,ClO2和Cl2中的Cl最终都转变成Cl-;1个ClO2转变为1个Cl-,可以得5个电子,1个Cl2转变为2个Cl-,可以得到2个电子;质量均为ag的ClO2和Cl2能够得到的电子数目的比例为:,所以ClO2消毒效率是Cl2的2.63倍,D项正确;
答案选A。
9.A
【分析】据电解质的概念分析。
【详解】电解质是溶于水或熔化时能导电的化合物。故电解质一定属于化合物,包含在化合物之中。
本题选A。
10.B
【详解】A.铜是金属单质,既不是电解质也不是非电解质,故A错误;
B.蔗糖在水溶液或熔融状态都不能导电,属于非电解质,故B正确;
C.食盐水是混合物,既不是电解质也不是非电解质,故C错误;
D.氢氧化钾在熔融状态或水溶液中都能导电,属于电解质,故D错误;
故选B。
11.B
【详解】A.盐酸是混合物,HD是单质,不是非电解质,故A错误;
B.胆矾是纯净物,石灰水是混合物,硫酸钡是强电解质,HClO是弱电解质,氨气是非电解质,故B正确;
C.氨水是混合物,不是弱电解质,NH3 H2O是弱电解质,故C错误;
D.碘化氢是强电解质,故D错误。
综上所述,答案为B。
12.B
【详解】氧化物是指由两种元素组成,其中一种是氧元素的化合物。硫酸与氢氧化钠中含有3种元素,故C和D错误,过氧化钠属于过氧化物,既不是酸性氧化物也不是碱性氧化物,不属于狭义的氧化物,故A错误;
故选B。
13.C
【详解】A.H+与CO32-反应生成CO2,H+与CO32-不能大量共存,A错误
B.Ag+与Cl-、Ag+与SO42-反应生成AgCl白色沉淀、Ag2SO4白色微溶物,B错误;
C.K+、SO42-、Cu2+、NO3-在溶液中能大量共存,C正确;
D.NH4++OH-NH3.H2O、NH3.H2O,OH-+HCO3- CO32-+H2O,D错误;
答案选D。
14.C
【详解】A.+2H+=CO2+H2O,可以表示可溶性碳酸盐与强酸反应生成二氧化碳、水和可溶性盐,能够表示一类反应,A不符合题意;
B.Ba2+ +2OH- +2H+ +=BaSO4↓+2H2O可表示硫酸与氢氧化钡反应或者氢氧化钡与硫酸氢盐反应,能够表示一类反应,B不符合题意;
C.Cl2+H2OH++Cl-+HClO,只能表示氯气和水的反应,C符合题意;
D.Fe+Cu2+═Fe2++Cu,表示铁与可溶性铜盐反应,能够表示一类反应,D不符合题意;
故选C。
15.D
【详解】A. 浓烧碱溶液中加入铝箔,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al + 2OH一 + 2H2O ==2 AlO2一 + 3H2↑,选项A错误;
B. 氯化铁溶液中加入铁粉,反应生成氯化亚铁,反应的离子方程式为:Fe +2 Fe3+ == 3Fe2+,选项B错误;
C. 氢氧化铜中加入硫化钠溶液,反应生成硫化铜沉淀和氢氧化钠,反应的离子方程式为:Cu(OH)2 + S2一 CuS↓+S2-,选项C错误;
D. 碳酸氢镁溶液中加入足量烧碱溶液,反应生成氢氧化镁、碳酸钠和水,反应的离子方程式为:Mg2+ + 2HCO3一 + 4OH一 == Mg(OH)2↓ + 2CO32一 + 2H2O,选项D正确。
答案选D。
16.(1)Na2O2、H2O2
(2)-1
【解析】(1)
一般的氧化物中氧元素的化合价为-2价,如二氧化碳或二氧化硫等,但如过氧化钠和过氧化氢都属于特殊的氧化物,其中氧元素的化合价为-1价。
(2)
过氧化物中氧元素的化合价为-1价。
17. BaCO3+2H+=Ba2++CO2↑+H2O 无明显现象 有紫红色物质析出 Na2SO3+ SO2+ H2O = 2NaHSO3 SO2+ 2COS + 2CO2 节省原料(硫酸用量少)、无污染
【分析】(1)亚硫酸不稳定,易为氧气氧化生成硫酸;
(2)碳酸钡属于碳酸盐,能和盐酸反应生成可溶性的氯化钡;
(3)铁的活泼性比铜强,铁能和铜离子发生置换反应;
(4)亚硫酸钠能和二氧化硫、水反应生成硫酸氢钠;
(5)在一定条件下,CO还原SO2得到单质硫,同时自身被氧化生成二氧化碳;
(6)二氧化硫有毒,会污染大气,结合反应需要硫酸的量分析。
【详解】(1)亚硫酸不稳定,易被空气中氧气氧化生成硫酸,亚硫酸是弱酸,硫酸是强酸,所以生成硫酸后使酸雨酸性增强,该反应方程式为:H2SO3+O2═H2SO4,反应中电子转移的数目和方向是;
(2)人体胃液中含有盐酸,碳酸钡能和盐酸反应生成可溶性的氯化钡,钡离子有毒,所以会产生中毒现象,反应方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,对应的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O;
(3)铁的活泼性大于铜,所以铁能和铜离子发生置换反应生成铜,如果铁棒被氧化,将铁棒洗净后置于CuSO4溶液中,则没有铜析出,铁棒会无明显现象,如果铁棒未被氧化,则铁和铜离子发生置换反应生成铜单质而附着在铁棒上,所以铁棒上有紫红色物质析出;
(4)亚硫酸钠和二氧化硫、水反应生成亚硫酸氢钠,反应方程式为:Na2SO3+SO2+H2O═2NaHSO3;
(5)在一定条件下,一氧化碳能还原二氧化硫生成硫单质,自身被氧化生成二氧化碳,反应方程式为:SO2+2COS+2CO2;
(6)根据方程式知,第一个方程式比第二个方程式节省硫酸,且没有有毒气体二氧化硫生成,所以对环境无污染。
18.(1) 蒸馏烧瓶
(2)检查装置的气密性
(3)a
(4)吸收未反应完的氯气,防止污染空气,防止水蒸气进入戊装置的试管中使产物水解
(5) 232 652
(6)C
(7) 溶液颜色变为蓝色,且半分钟内不变色 或
【解析】(1)
由构造知,仪器A的名称为蒸馏烧瓶,A中发生反应的化学方程式为KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O,离子方程式为:;
(2)
该装置是制取气体的,则将装置如图连接好之后,首先应进行的操作为检查装置的气密性;
(3)
为保证较好的冷凝效果,冷凝水‘下进上出’,冷水进口为a;
(4)
己装置中碱石灰的作用是吸收未反应完的氯气,防止污染空气,防止水蒸气进入戊装置的试管中使产物水解;
(5)
Cl2和Sn的反应产物可能会有SnCl4和SnCl2,为防止产品中带入SnCl2,除了通入过量氯气外,由表中沸点数据可知应控制温度在232~652℃范围内;
(6)
为了确认丁中SnCl2的生成,可选用滴有KSCN溶液的FeCl3溶液,观察红色是否褪去,因高锰酸钾可氧化氯离子,故答案为:C;
(7)
准确称取11.9g产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用0.1mol L-1碘标准溶液滴定,滴入最后一滴,出现溶液变蓝,且30s内颜色不变现象时达到滴定终点,此时消耗碘标准溶液50mL,由Sn2++I2═Sn4++2I-,可知n(SnCl2)=n(I2)=cV×10-3mol,Sn(II)的质量为m=nM= cV×10-3mol×119g/mol=0.119cV g,质量分数为。
19. Na+、Ba2+、Ca2+ Cl- BaCO3、CaCO3 CO32- ①和②调换顺序后可除去Ca2+和SO42-,但加入BaCl2溶液后引入的Ba2+杂质无法除去。
【分析】由题意可知溶液中主要存在Na+、Ca2+、Cl-、SO42-,加BaCl2可以将SO42-沉淀,固体A为BaSO4,溶液B中有Na+、Ca2+、Cl-、Ba2+;再加Na2CO3,可将Ca2+、Ba2+沉淀下来,固体C为BaCO3、CaCO3,溶液D中有Na+、Cl-、CO32-;再加盐酸,与CO32-反应,溶液中只剩Na+和Cl-。
【详解】(1)根据分析,溶液B中存在的阳离子为Na+、Ca2+、Ba2+;阴离子为C1-;
(2)根据分析,沉淀为BaCO3、CaCO3;
(3)根据分析,加入盐酸,H+与CO32-反应,所以大量减少的离子为CO32-;
(4) CO32-除了能够出去原溶液中的Ca2+之外,还能出去加入的Ba2+,如果将①和②调换,不影响Ca2+和SO42-的去除,但加入BaCl2溶液后引入的Ba2+杂质无法除去。
【点睛】本题的一定要注意CO32-与Ba2+的加入顺序,CO32-用于除去溶液中的Ca2+,Ba2+用于除去溶液中的SO42-,过量的CO32-可用HCl除去,但过量的Ba2+却没有用其他试剂除去,只能用CO32-除去,所以CO32-必须在Ba2+之后加入,以便除去过量的Ba2+。
20.
【分析】(1)根据题意,NH3和 Cl2在常温下可快速反应生成氮气:2NH3+3Cl2=N2+6HCl,利用该反应处理含有氨气和氯气的尾气,最佳比例是恰好完全反应;
(2)标准状况下体积为1.12L的Cl2和N2的混合气体物质的量为=0.05mol,通入浓氨水后,体积变为0.672L,其物质的量为=0.03mol,其中Cl2体积分数为50%,则反应后Cl2物质的量为0.015mol,N2的物质的量为0.015mol,设原混合气体中氯气和氮气物质的量分别为xmol、ymol,则参与反应Cl2物质的量为(x-0.015)mol,再由方程式进行计算;
(3)依据反应的极值方法进行分析计算分析判断不同范围的气体体积。
【详解】氨气和氯气在常温下可快速反应生成氮气:,若利用该反应处理含有氨气和氯气的尾气,用于制备盐酸,则 和 的最佳比例为3:2;
故答案为:3:2;
体积为物质的量为,混合气体通过浓氨水后,体积变为其中体积分数为,为,氯气和分别为,设混合气体中含有氯气物质的量为xmol,氮气物质的量为,反应剩余氯气,则反应消耗氯气,根据化学方程式,反应生成氮气为,所以,计算得到,则原混合气体中的体积为;故答案为:112;
若按上式反应,,氨过量,还会生成氯化铵 ;当时恰好生成氯化铵和氮气,此时生成氮气原来的氮气。;当时氯和氨都用完,求出生成的氮气和氯化氢气体体积之和为,原有氮x,所以共有气体体积为;当时剩余氨气,可以用氯气计算,差量法求得气体减少,所以; 故答案为:; 。
【点睛】本题以NH3和 Cl2反应为载体,考查化学计算,通过分析反应的原理,利用好极端假设法,即可得出答案。
21. 在t1℃时,A的溶解度为35g A>B>C C 14
【分析】根据固体的溶解度曲线结合溶解度的含义分析解答。
【详解】(1)通过分析溶解度曲线可知,对于物质A而言,点P的含义为:在t1℃时,A的溶解度为35g,故答案为:在t1℃时,A的溶解度为35g;
(2)t3℃时,A物质的溶解度最大,B物质的溶解度次之,C物质的溶解度最小,所以A、B、C三种饱和溶液中,溶质质量分数由大到小的排列为A>B>C,故答案为:A>B>C;
(3)气体物质的溶解度随温度的升高而减小,所以A、B、C三种物质中有一种是易溶于水的气体,则其溶解度曲线是C,故答案为:C;
(4)烧杯中有t2℃时20%的A溶液50g,要将该溶液变为同温度下的饱和溶液,t2℃时,A物质的溶解度是60g,50g溶液中含有溶质的质量为:50g×20%=10g,水的质量为40g,40g水中最多可以溶解固体的质量为:40g×=24g,至少需向烧杯中加入A物质的质量为:24g-10g=14g,故答案为:14。
【点睛】认识固体的溶解度曲线所表示的意义是解题的关键。本题的易错点为(4),要注意溶解度计算的基本方法的应用,要首先计算出溶质和溶剂的质量,再根据溶解度计算。
