专题9金属的冶炼方法综合练习(含答案)2022——2023学年高一化学下学期苏教版(2019)必修第二册
文档属性
| 名称 | 专题9金属的冶炼方法综合练习(含答案)2022——2023学年高一化学下学期苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 654.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 16:28:10 | ||
图片预览



文档简介
专题9金属的冶炼方法综合练习
一、单选题
1. 下列关于金属冶炼的说法正确的是( )
A. 电解饱和食盐水制取钠 B. 热还原法制取汞、银
C. 利用铝热反应制取钒、铬、锰 D. 利用热分解法制取铜
2. 将、组成的混合物投入一定量稀盐酸中,固体完全溶解,收集到气体为标准状况,向反应后溶液中加入溶液时,金属离子恰好沉淀完全,则形成沉淀的质量为( )
A. (m+1.7)g B. (m+3.4)g C. (m+5.1)g D. (m+6.8)g
3. 文物是传承文化的重要载体,下列主要成分不是硅酸盐的文物是( )
A. 陶彩绘女舞俑 B. 清雍正款霁红釉瓷碗 C. 四羊方尊 D. 萧何月下追韩信图梅瓶
4. 某无色透明的溶液能与铝作用放出氢气,此溶液中可以大量共存的离子组是。( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
5. 将等物质的量的和同时放入足量的水中,充分反应后收集到混合气体标准状况下。下列说法错误的是( )
A. 标准状况下,混合气体中氢气与氧气的体积比为3:1
B. 加入的固体过氧化钠为7.8g
C. 反应后有固体剩余
D. 反应后的溶液中含有的溶质是NaOH和NaAlO2
6. 有关硅材料的说法正确的是。( )
A. 、、是硅元素的不同核素 B. 金刚砂的主要成分是二氧化硅
C. 硅含有个电子 D. 光纤的主要成分是高纯度的单质硅
7. 某一无色溶液,若向其中加入足量的饱和氯水,溶液呈橙黄色;再向橙色溶液中滴加溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出,该溶液中可能大量存在的一组离子是( )
A. B.
C. D.
8. 向含和的混合溶液中加入的溶液,产生沉淀的物质的量与加入溶液体积间的关系图正确的是( )
A. B. C. D.
9. 常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 澄清透明的溶液中:、、、
B. 的溶液中:、、、
C. 含有的水溶液中:、、、
D. 含有的溶液中:、、 、
10. 向一定量的、、、的混合物中加入的稀硝酸恰好使混合物完全溶解,放出标准状况,往所得溶液中加入溶液,无红色出现。若用足量的在加热条件下还原相同质量的混合物,所得到的铁的物质的量为 ( )
A. B. C. D.
11. 构建知识网络是一种有效的学习方法,化学学习中的“价一类”二维图就是其中一种,如图所示是铁及其化合物的“价一类”二维图,下列有关叙述或化学方程式书写不正确的是( )
A. 物质的氧化物不稳定,在空气中受热迅速被氧化
B. 可能是
C. 在空气中容易被氧化成,每被氧化消耗的氧气为
D. 的反应类型是氧化还原反应
12. 如图所示装置,可用于制取和观察在空气中被氧化时颜色的变化。实验提供的试剂:铁屑、稀硫酸、溶液等,下列说法不正确的是( )
A. 烧瓶中发生反应的离子方程式为
B. 实验结束后集气瓶中收集到的是纯净气体
C. 生成的操作:关闭止水夹,使烧瓶中溶液压入装置中进行反应
D. 若取下装置的橡皮塞,可观察沉淀由白色变成灰绿色最后变为红褐色
13. 铝热反应有广泛的用途,实验装置如图所示。下列说法错误的是( )
A. 铝热反应的能量变化可用图表示
B. 和铝粉的混合物被称为铝热剂
C. 铝热反应只能用于冶炼铁、锰、铬、镁等熔点较高的金属
D. 铝热反应可用于焊接铁轨,反应的化学方程式为
14. 铝土矿中主要含有,还有少量,杂质,从铝土矿中冶炼金属铝方法如图所示步骤、、中每步反应结束后经过过滤才进行下一步反应。下列有关说法不正确的是( )
A. 电解熔融氧化铝制取金属铝时加入冰晶石的作用是降低氧化铝熔融所需的温度
B. 步骤的作用是除去母液中的的
C. 步骤生成沉淀的离子反应方程式为
D. 将步骤和步骤顺序颠倒,再通入足量也能得到氢氧化铝沉淀
15. 某同学通过如下流程制备氧化亚铜:
溶液
已知:难溶于水和稀硫酸;。下列说法不正确的是( )
A. 步骤中的可用替换
B. 步骤中为防止被氧化,可用水溶液洗涤
C. 步骤发生反应的离子方程式为
D. 如果试样中混有和杂质,用足量稀硫酸与试样充分反应,根据反应前、后固体质量可计算试样纯度
二、实验题
16. 在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去
烧瓶中常加入碎瓷片,其作用是___________________,小试管的作用是______________________________。
为了安全,在管中的反应发生前,在出口处必须_________________,管中的反应开始后,在出口处应______________________。
反应在一定条件下实际上为可逆反应,本实验中是如何实现向的转变的试用化学平衡移动原理加以解释 _____________________。
停止反应,待管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有的实验操作及现象______________________。
若管中反应按以下两步进行:,,假设实验开始时管中的为,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为。通过计算分析其组成可能为________填序号
和和和 、和
用此固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉________。不考虑空气中的成分参与反应
17. 菠菜是常见食品,可以补充人体所必需的微量元素铁。某兴趣小组设计实验,探究菠菜中铁元素的价态并测定铁元素的含量,实验流程如下:
上述实验中肯定不会用到下列仪器中的_______填字母。
A. . . .
取少许水浸液于试管中,滴入几滴溶液,振荡,溶液颜色无明显变化,再滴加少量和,溶液立即变红。据此探究实验可得到的结论是_______,请写出滴加发生反应的离子方程式_______。
该兴趣小组为了准确测得菠菜中铁的含量,设计如下实验方案:
兴趣小组用“分光光度法”测得滤液中,该菠菜中铁元素的含量为_______保留三位有效数字。
三、简答题
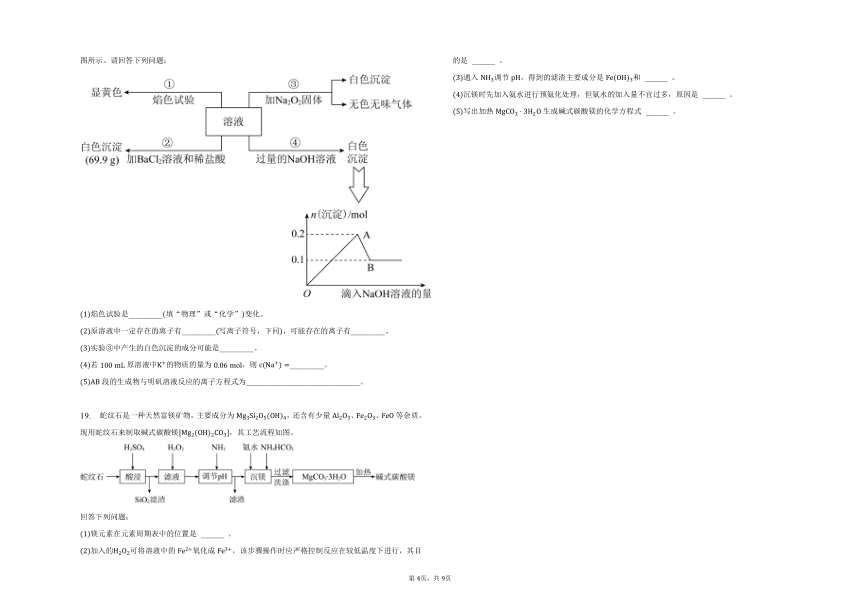
18. 有一无色溶液,其中可能含有、、、、、、、、等离子中的几种忽略水的电离,为分析其成分,各取此溶液分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
焰色试验是_________填“物理”或“化学”变化。
原溶液中一定存在的离子有_________写离子符号,下同,可能存在的离子有_________。
实验中产生的白色沉淀的成分可能是_________。
若原溶液中的物质的量为,则_________。
段的生成物与明矾溶液反应的离子方程式为______________________________。
19. 蛇纹石是一种天然富镁矿物,主要成分为,还含有少量、、等杂质。现用蛇纹石来制取碱式碳酸镁,其工艺流程如图。
回答下列问题:
镁元素在元素周期表中的位置是 ______ 。
加入的可将溶液中的氧化成,该步骤操作时应严格控制反应在较低温度下进行,其目的是 ______ 。
通入调节,得到的滤渣主要成分是和 ______ 。
沉镁时先加入氨水进行预氨化处理,但氨水的加入量不宜过多,原因是 ______ 。
写出加热生成碱式碳酸镁的化学方程式 ______ 。
答案和解析
1.【答案】
【解析】A.电解饱和食盐水得到氢氧化钠、氢气和氯气,得不到金属钠,可利用电解熔融氯化钠制取金属钠,A错误;
B.利用热分解法制取汞、银,即加热氧化汞分解制取汞,加热氧化银分解制取银,B错误;
C.铝是较活泼的金属,具有较强的还原性,可利用铝热反应制取钒、铬、锰,C正确;
D.利用热还原法制取铜,即用一氧化碳或氢气还原氧化铜制取铜,D错误;
答案选C。
2.【答案】
【解析】金属Mg、Al在稀盐酸中完全溶解,生成可溶的氯化物(MgCl2、AICl3),盐酸可能恰好反应,也可能剩余,向溶液中加入NaOH溶液,盐酸被中和,金属离子恰好沉淀,生成Mg(OH)2、Al(OH)3。
梳理本题物质变化思路:Mg→Mg2+→Mg(OH)2, Al→Al3+→Al(OH)3,生成沉淀的质量可由金属元素的质量加上沉淀中OH-的质量求得。而Mg2+、Al3+生成沉淀结合的OH-的物质的量正好是Mg、Al变成离子时失去电子的物质的量,而Mg、Al失去电子的物质的量正好是H+变成H2得到电子的物质的量。由2H+~2e-~H2,可求出得到电子的物质的量为2×=0.1 mol,故 Mg2+、Al3+生成沉淀结合的OH-的物质的量也是0.1 mol,质量为1.7g,故生成沉淀的质量为(m+1.7)g,故选A。
3.【答案】
【解析】A.陶彩绘女舞俑是陶瓷,属于硅酸盐,故不选A;
B.清雍正款霁红釉瓷碗是陶瓷,属于硅酸盐,故不选B;
C.四羊方尊是青铜器,属于金属材料,故选C;
D.萧何月下追韩信图梅瓶是陶瓷,属于硅酸盐,故不选D;
故选C。
4.【答案】
【解析】由于是无色溶液,选项中有,选项中有,则不是正确选项;溶液与铝作用能放出氢气,溶液可以是酸性也可以是碱性,则选项错误选项酸性环境下,不生产,碱性条件下,离子可共存,故选C。
5.【答案】
【解析】Na2O2和Al放入足量的水中,Na2O2先完全反应:2Na2O2+2H2O4NaOH+O2↑,生成的NaOH可与铝继续发生反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑,因Na2O2与Al物质的量相等,故前者产生的NaOH过量,Al无剩余,反应得到的溶液中溶质为NaOH和NaAlO2,O2和H2的物质的量之比为1:3,以此分析回答。
A.由以上分析,根据计算关系式:2Al~3H2、2Na2O2~O2可知,产生的氢气与氧气的物质的量之比为3:1,标准状况下体积比也是3:1,故A正确;
B.由以上分析知,Na2O2产生的氧气为4.48 L×1/4=1.12 L,其物质的量为0.05 mol,则过氧化钠的物质的量为0.1 mol,质量为7.8 g,故B正确;
C.由以上分析知,反应后无固体剩余,故C错误;
D.由以上分析知,反应得到的溶液中溶质为NaOH和NaAlO2,故D正确。
故选:C。
6.【答案】
【解析】略
7.【答案】
【解析】
【分析】
某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙色,则溶液中原来可能含有;向橙色溶液中滴加溶液,产生白色沉淀,沉淀应为硫酸钡沉淀,则含有或者;向原溶液中加入铝粉,有气体放出,则原溶液可能为酸或碱的溶液,据此分析解题。
【解答】
A.各离子均为无色,相互之间不反应,符合题干转化信息,符合题意;
B.,二者不能大量共存,不合题意;
C.的水溶液显黄色,且,二者不能大量共存,不合题意;
D.与反应生成可以生成,但不符合加入足量饱和氯水,溶液呈橙色,向橙色溶液中滴加溶液,产生白色沉淀,故D不合题意;
故答案为:。
8.【答案】
【解析】向含和的混合溶液中加入的溶液,从反应开始到加入时,的物质的量为,发生反应,,恰好中和完全,生成沉淀,再加入时,发生反应,,此时恰好沉淀完全,生成沉淀和沉淀,该阶段共生成沉淀,再加入时,发生反应,生成沉淀,根据图像变化趋势可知,D正确。
9.【答案】
【解析】A.所给离子组均能大量共存,符合题意;
B.与反应生成,不符合题意;
C.会被氧化,不符合题意;
D.与、 反应生成沉淀,不符合题意;
故选A。
10.【答案】
【解析】因一定量的、、、的混合物中加入的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为,所以,由铁元素守恒可知,气还原混合物得到的物质的量:
11.【答案】
【解析】是价铁的氧化物,是;是价铁的氢氧化物,是;是价铁的氢氧化物,是。
A.是,不稳定,在空气中受热迅速被氧化,故A正确;
B.铝的活泼性大于铁,铝能置换出氧化铁中的铁,可能是,故B正确;
C.在空气中容易被氧化成,根据得失电子守恒,每被氧化消耗氧气,没有明确是否为标准状况,体积不一定为,故C错误;
D.的反应中,铁元素化合价发生了变化,该反应是氧化还原反应,故D正确;
故选C。
12.【答案】
【解析】烧瓶中,与稀硫酸发生反应,生成和;打开,生成的逸出,排尽、装置内的空气;然后关闭活塞,此时产生的将烧瓶内的溶液压入装置中,与发生反应,从而生成白色沉淀等。
A.烧瓶中,与稀硫酸发生反应,生成和,离子方程式为,A正确;
B.起初排出的空气也进入集气瓶中,所以实验结束后集气瓶中收集到的气体是和空气的混合气,B错误;
C.关闭活塞,产生的将烧瓶中的溶液压入装置中,与发生反应,从而生成白色沉淀,C正确;
D.若取下装置的橡皮塞,溶解的空气中的与反应生成,可观察沉淀由白色变成灰绿色最后变为红褐色,D正确;
故选B。
13.【答案】
【解析】A.铝热反应是放热反应,能量变化可用图表示,故A正确;
B.和铝粉的混合物被称为铝热剂,故B正确;
C.镁的活泼性大于,不能用铝热反应冶炼金属镁,故C错误;
D.铝热反应可用于焊接铁轨,反应的化学方程式为,故D正确;
故选C。
14.【答案】
【解析】铝土矿的主要成分是,含有杂质、,因、与溶液反应,不与溶液反应;除不与盐酸反应外,、均与盐酸反应;结合流程可知,步骤中,用盐酸浸取铝土矿并过滤得到母液,母液含有、;向母液中加入过量烧碱除去、,并将转化为,过滤得到母液,母液中含有;向母液中通入过量二氧化碳,得到;加热分解得到,再电解氧化铝可得到。
A.氧化铝熔点较高,需要加入冰晶石,降低氧化铝熔融所需的温度,故A正确;
B.步骤中加入过量溶液,作用是除去、,故B正确;
C.通入足量二氧化碳与偏铝酸根反应:,故C正确;
D.将步骤和步骤顺序颠倒,母液中含有、,再通入足量得不到氢氧化铝沉淀,故D错误;
故选D。
15.【答案】
【解析】A.步骤中的主要目的是将还原为,同样具有还原性,可用于代替,故A不符合题意;
B.水溶液具有还原性,可以防止被氧化,故B不符合题意;
C.步骤生成物为,因此与氢氧化钠溶液在加热条件下发生的离子反应为:,故C不符合题意;
D.如果试样中混有和杂质,用足量稀硫酸与试样充分反应得到的固体中有和,无法计算试样纯度,故D符合题意;
故选D。
16.【答案】防止液体暴沸;冷凝水蒸气
检验氢气的纯度;点燃氢气
实验中不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行
取滤液少量,向其中滴加溶液,溶液变为血红色,即证明含有;
【解析】烧瓶用于提供水蒸气,为防止暴沸现象,应加入碎瓷片。在加热条件下,中还原铁粉与水蒸气反应生成和氢气,装置用于冷却水蒸气,然后在中进行干燥,然后用氢气与反应制备铁,以此解答该题。
加热液体时要防止暴沸,则在烧瓶中常加入碎瓷片,其目的是防止液体暴沸;小试管在冰水混合物中,能冷却水蒸气,除去多余的水蒸气;
在装置中与水蒸气反应产生和 ,生成的氢气把装置、中的空气排净,为了防止氢气中混有空气加热爆炸,所以加热前,先检验出口处氢气的纯度,最后氢气要点燃处理,即在出口处应点燃氢气;
高温下与反应的化学方程式为,在一定条件下该反应实际上是可逆反应,如使平衡正向移动,可实验中不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,使平衡正向移动;
管中生成,若检验其中的,应该先加盐酸溶解形成溶液,然后加溶液,若溶液变为血红色,即证明含有。即证明存在的方法是:取滤液少量,向其中滴加溶液,若溶液变为血红色,即证明含有;
质量为,其物质的量为,其中元素的物质的量,则质量;反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为,说明剩余固体中含有元素,因此不可能完全是单质;其中元素的物质的量 ,:::。
固体中含有元素,不可能完全是单质,不符合题意;
当和按:混合时,符合固体中::比例关系,符合题意;
无论和以任何比例混合,都不符合::比例关系,不符合题意;
当和按:混合时,符合固体中::比例关系,符合题意;
假设、和混合物中三种物质的物质的量分别是、、,要符合::比例关系,则::,整理可得,就符合上述关系,符合题意;
综上所述可知符合题意的物质组合为;
用上述固体与粉发生铝热反应,产生单质和,根据上述计算可知元素的物质的量,则由化学式可知,其质量。
17.【答案】
菠菜中含有;
【解析】水浸需要用烧杯,水浸后过滤需要用漏斗,研磨需要用研钵,实验中没有对固体物质的煅烧,肯定不会用到坩埚,故选A。
取少许水浸液于试管中,滴入几滴溶液,振荡,溶液颜色无明显变化,再滴加少量和,溶液立即变红,菠菜中含有,滴加发生反应的离子方程式。
新鲜菠菜中铁元素的质量为,则该菠菜中铁元素的含量为。
18.【答案】物理
、、、
或和
【解析】多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,这在化学上叫作焰色试验,亦称焰色反应。
无色溶液,则不含和;由焰色试验显黄色可知,含有;由加溶液和稀盐酸得到沉淀可知,含有;由加固体得到白色沉淀和无色无味气体,加溶液得到沉淀的图像可知,含有和,则不含、。根据以上分析可知原溶液中一定存在的离子有、、、,可能存在。
实验是过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和铝离子生成氢氧化铝沉淀,和镁离子生成氢氧化镁沉淀,反应中产生的白色沉淀的成分可能是或和。
依据图形变化可知,的物质的量为,的物质的量为,的物质的量等于硫酸钡沉淀的物质的量,为,溶液体积为,若溶液中的物质的量为,依据电荷守恒计算,。
段的生成物是四羟基合铝酸钠,与明矾溶液反应的离子方程式为
。
19.【答案】第三或周期第族
防止受热分解
氨水过量会导致生成氢氧化镁沉淀,影响的产率
【解析】解:镁的原子序数为,原子核外有个电子层,最外层电子数为,则位于周期表第三或周期第族,
故答案为:第三或周期第族;
过氧化氢不稳定,加高温度下易分解,则应在较低温度下进行,以防止受热分解,
故答案为:防止受热分解;
由流程可知通入调节,得到的滤渣主要成分是和,
故答案为:;
如氨水过量,则可生成氢氧化镁沉淀,进而影响的产率,应控制氨水的量不宜过多,
故答案为:氨水过量会导致生成氢氧化镁沉淀,影响的产率;
加热生成碱式碳酸镁,方程式为,
故答案为:。
由流程可知蛇纹石加入硫酸酸浸,可生成硫酸铝、硫酸铁、硫酸亚铁、硫酸镁,过滤得到二氧化硅滤渣,滤液加入过氧化氢,可氧化亚铁离子生成铁离子,加入氨气调节溶液的,得到滤渣含有氢氧化铁、氢氧化铝,滤液加入氨水、碳酸氢铵可生成,加热生成碱式碳酸镁,以此解答该题。
本题考查物质的制备,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度中等。
第1页,共1页
一、单选题
1. 下列关于金属冶炼的说法正确的是( )
A. 电解饱和食盐水制取钠 B. 热还原法制取汞、银
C. 利用铝热反应制取钒、铬、锰 D. 利用热分解法制取铜
2. 将、组成的混合物投入一定量稀盐酸中,固体完全溶解,收集到气体为标准状况,向反应后溶液中加入溶液时,金属离子恰好沉淀完全,则形成沉淀的质量为( )
A. (m+1.7)g B. (m+3.4)g C. (m+5.1)g D. (m+6.8)g
3. 文物是传承文化的重要载体,下列主要成分不是硅酸盐的文物是( )
A. 陶彩绘女舞俑 B. 清雍正款霁红釉瓷碗 C. 四羊方尊 D. 萧何月下追韩信图梅瓶
4. 某无色透明的溶液能与铝作用放出氢气,此溶液中可以大量共存的离子组是。( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
5. 将等物质的量的和同时放入足量的水中,充分反应后收集到混合气体标准状况下。下列说法错误的是( )
A. 标准状况下,混合气体中氢气与氧气的体积比为3:1
B. 加入的固体过氧化钠为7.8g
C. 反应后有固体剩余
D. 反应后的溶液中含有的溶质是NaOH和NaAlO2
6. 有关硅材料的说法正确的是。( )
A. 、、是硅元素的不同核素 B. 金刚砂的主要成分是二氧化硅
C. 硅含有个电子 D. 光纤的主要成分是高纯度的单质硅
7. 某一无色溶液,若向其中加入足量的饱和氯水,溶液呈橙黄色;再向橙色溶液中滴加溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出,该溶液中可能大量存在的一组离子是( )
A. B.
C. D.
8. 向含和的混合溶液中加入的溶液,产生沉淀的物质的量与加入溶液体积间的关系图正确的是( )
A. B. C. D.
9. 常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 澄清透明的溶液中:、、、
B. 的溶液中:、、、
C. 含有的水溶液中:、、、
D. 含有的溶液中:、、 、
10. 向一定量的、、、的混合物中加入的稀硝酸恰好使混合物完全溶解,放出标准状况,往所得溶液中加入溶液,无红色出现。若用足量的在加热条件下还原相同质量的混合物,所得到的铁的物质的量为 ( )
A. B. C. D.
11. 构建知识网络是一种有效的学习方法,化学学习中的“价一类”二维图就是其中一种,如图所示是铁及其化合物的“价一类”二维图,下列有关叙述或化学方程式书写不正确的是( )
A. 物质的氧化物不稳定,在空气中受热迅速被氧化
B. 可能是
C. 在空气中容易被氧化成,每被氧化消耗的氧气为
D. 的反应类型是氧化还原反应
12. 如图所示装置,可用于制取和观察在空气中被氧化时颜色的变化。实验提供的试剂:铁屑、稀硫酸、溶液等,下列说法不正确的是( )
A. 烧瓶中发生反应的离子方程式为
B. 实验结束后集气瓶中收集到的是纯净气体
C. 生成的操作:关闭止水夹,使烧瓶中溶液压入装置中进行反应
D. 若取下装置的橡皮塞,可观察沉淀由白色变成灰绿色最后变为红褐色
13. 铝热反应有广泛的用途,实验装置如图所示。下列说法错误的是( )
A. 铝热反应的能量变化可用图表示
B. 和铝粉的混合物被称为铝热剂
C. 铝热反应只能用于冶炼铁、锰、铬、镁等熔点较高的金属
D. 铝热反应可用于焊接铁轨,反应的化学方程式为
14. 铝土矿中主要含有,还有少量,杂质,从铝土矿中冶炼金属铝方法如图所示步骤、、中每步反应结束后经过过滤才进行下一步反应。下列有关说法不正确的是( )
A. 电解熔融氧化铝制取金属铝时加入冰晶石的作用是降低氧化铝熔融所需的温度
B. 步骤的作用是除去母液中的的
C. 步骤生成沉淀的离子反应方程式为
D. 将步骤和步骤顺序颠倒,再通入足量也能得到氢氧化铝沉淀
15. 某同学通过如下流程制备氧化亚铜:
溶液
已知:难溶于水和稀硫酸;。下列说法不正确的是( )
A. 步骤中的可用替换
B. 步骤中为防止被氧化,可用水溶液洗涤
C. 步骤发生反应的离子方程式为
D. 如果试样中混有和杂质,用足量稀硫酸与试样充分反应,根据反应前、后固体质量可计算试样纯度
二、实验题
16. 在一定条件下,用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经此反应的逆反应,生成颗粒很细的铁粉。某校化学小组利用下图所列装置进行铁与水反应的实验,并利用产物进一步与四氧化三铁反应制取铁粉。装置中的铁架台、铁夹等必要的夹持仪器在图中均已略去
烧瓶中常加入碎瓷片,其作用是___________________,小试管的作用是______________________________。
为了安全,在管中的反应发生前,在出口处必须_________________,管中的反应开始后,在出口处应______________________。
反应在一定条件下实际上为可逆反应,本实验中是如何实现向的转变的试用化学平衡移动原理加以解释 _____________________。
停止反应,待管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有的实验操作及现象______________________。
若管中反应按以下两步进行:,,假设实验开始时管中的为,反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为。通过计算分析其组成可能为________填序号
和和和 、和
用此固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉________。不考虑空气中的成分参与反应
17. 菠菜是常见食品,可以补充人体所必需的微量元素铁。某兴趣小组设计实验,探究菠菜中铁元素的价态并测定铁元素的含量,实验流程如下:
上述实验中肯定不会用到下列仪器中的_______填字母。
A. . . .
取少许水浸液于试管中,滴入几滴溶液,振荡,溶液颜色无明显变化,再滴加少量和,溶液立即变红。据此探究实验可得到的结论是_______,请写出滴加发生反应的离子方程式_______。
该兴趣小组为了准确测得菠菜中铁的含量,设计如下实验方案:
兴趣小组用“分光光度法”测得滤液中,该菠菜中铁元素的含量为_______保留三位有效数字。
三、简答题
18. 有一无色溶液,其中可能含有、、、、、、、、等离子中的几种忽略水的电离,为分析其成分,各取此溶液分别进行了四个实验,其操作和有关现象如图所示。请回答下列问题:
焰色试验是_________填“物理”或“化学”变化。
原溶液中一定存在的离子有_________写离子符号,下同,可能存在的离子有_________。
实验中产生的白色沉淀的成分可能是_________。
若原溶液中的物质的量为,则_________。
段的生成物与明矾溶液反应的离子方程式为______________________________。
19. 蛇纹石是一种天然富镁矿物,主要成分为,还含有少量、、等杂质。现用蛇纹石来制取碱式碳酸镁,其工艺流程如图。
回答下列问题:
镁元素在元素周期表中的位置是 ______ 。
加入的可将溶液中的氧化成,该步骤操作时应严格控制反应在较低温度下进行,其目的是 ______ 。
通入调节,得到的滤渣主要成分是和 ______ 。
沉镁时先加入氨水进行预氨化处理,但氨水的加入量不宜过多,原因是 ______ 。
写出加热生成碱式碳酸镁的化学方程式 ______ 。
答案和解析
1.【答案】
【解析】A.电解饱和食盐水得到氢氧化钠、氢气和氯气,得不到金属钠,可利用电解熔融氯化钠制取金属钠,A错误;
B.利用热分解法制取汞、银,即加热氧化汞分解制取汞,加热氧化银分解制取银,B错误;
C.铝是较活泼的金属,具有较强的还原性,可利用铝热反应制取钒、铬、锰,C正确;
D.利用热还原法制取铜,即用一氧化碳或氢气还原氧化铜制取铜,D错误;
答案选C。
2.【答案】
【解析】金属Mg、Al在稀盐酸中完全溶解,生成可溶的氯化物(MgCl2、AICl3),盐酸可能恰好反应,也可能剩余,向溶液中加入NaOH溶液,盐酸被中和,金属离子恰好沉淀,生成Mg(OH)2、Al(OH)3。
梳理本题物质变化思路:Mg→Mg2+→Mg(OH)2, Al→Al3+→Al(OH)3,生成沉淀的质量可由金属元素的质量加上沉淀中OH-的质量求得。而Mg2+、Al3+生成沉淀结合的OH-的物质的量正好是Mg、Al变成离子时失去电子的物质的量,而Mg、Al失去电子的物质的量正好是H+变成H2得到电子的物质的量。由2H+~2e-~H2,可求出得到电子的物质的量为2×=0.1 mol,故 Mg2+、Al3+生成沉淀结合的OH-的物质的量也是0.1 mol,质量为1.7g,故生成沉淀的质量为(m+1.7)g,故选A。
3.【答案】
【解析】A.陶彩绘女舞俑是陶瓷,属于硅酸盐,故不选A;
B.清雍正款霁红釉瓷碗是陶瓷,属于硅酸盐,故不选B;
C.四羊方尊是青铜器,属于金属材料,故选C;
D.萧何月下追韩信图梅瓶是陶瓷,属于硅酸盐,故不选D;
故选C。
4.【答案】
【解析】由于是无色溶液,选项中有,选项中有,则不是正确选项;溶液与铝作用能放出氢气,溶液可以是酸性也可以是碱性,则选项错误选项酸性环境下,不生产,碱性条件下,离子可共存,故选C。
5.【答案】
【解析】Na2O2和Al放入足量的水中,Na2O2先完全反应:2Na2O2+2H2O4NaOH+O2↑,生成的NaOH可与铝继续发生反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑,因Na2O2与Al物质的量相等,故前者产生的NaOH过量,Al无剩余,反应得到的溶液中溶质为NaOH和NaAlO2,O2和H2的物质的量之比为1:3,以此分析回答。
A.由以上分析,根据计算关系式:2Al~3H2、2Na2O2~O2可知,产生的氢气与氧气的物质的量之比为3:1,标准状况下体积比也是3:1,故A正确;
B.由以上分析知,Na2O2产生的氧气为4.48 L×1/4=1.12 L,其物质的量为0.05 mol,则过氧化钠的物质的量为0.1 mol,质量为7.8 g,故B正确;
C.由以上分析知,反应后无固体剩余,故C错误;
D.由以上分析知,反应得到的溶液中溶质为NaOH和NaAlO2,故D正确。
故选:C。
6.【答案】
【解析】略
7.【答案】
【解析】
【分析】
某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙色,则溶液中原来可能含有;向橙色溶液中滴加溶液,产生白色沉淀,沉淀应为硫酸钡沉淀,则含有或者;向原溶液中加入铝粉,有气体放出,则原溶液可能为酸或碱的溶液,据此分析解题。
【解答】
A.各离子均为无色,相互之间不反应,符合题干转化信息,符合题意;
B.,二者不能大量共存,不合题意;
C.的水溶液显黄色,且,二者不能大量共存,不合题意;
D.与反应生成可以生成,但不符合加入足量饱和氯水,溶液呈橙色,向橙色溶液中滴加溶液,产生白色沉淀,故D不合题意;
故答案为:。
8.【答案】
【解析】向含和的混合溶液中加入的溶液,从反应开始到加入时,的物质的量为,发生反应,,恰好中和完全,生成沉淀,再加入时,发生反应,,此时恰好沉淀完全,生成沉淀和沉淀,该阶段共生成沉淀,再加入时,发生反应,生成沉淀,根据图像变化趋势可知,D正确。
9.【答案】
【解析】A.所给离子组均能大量共存,符合题意;
B.与反应生成,不符合题意;
C.会被氧化,不符合题意;
D.与、 反应生成沉淀,不符合题意;
故选A。
10.【答案】
【解析】因一定量的、、、的混合物中加入的稀硝酸,恰好使混合物完全溶解,无血红色出现,说明溶液中的溶质为,
根据氮元素守恒,硝酸亚铁中的硝酸根离子的物质的量为,所以,由铁元素守恒可知,气还原混合物得到的物质的量:
11.【答案】
【解析】是价铁的氧化物,是;是价铁的氢氧化物,是;是价铁的氢氧化物,是。
A.是,不稳定,在空气中受热迅速被氧化,故A正确;
B.铝的活泼性大于铁,铝能置换出氧化铁中的铁,可能是,故B正确;
C.在空气中容易被氧化成,根据得失电子守恒,每被氧化消耗氧气,没有明确是否为标准状况,体积不一定为,故C错误;
D.的反应中,铁元素化合价发生了变化,该反应是氧化还原反应,故D正确;
故选C。
12.【答案】
【解析】烧瓶中,与稀硫酸发生反应,生成和;打开,生成的逸出,排尽、装置内的空气;然后关闭活塞,此时产生的将烧瓶内的溶液压入装置中,与发生反应,从而生成白色沉淀等。
A.烧瓶中,与稀硫酸发生反应,生成和,离子方程式为,A正确;
B.起初排出的空气也进入集气瓶中,所以实验结束后集气瓶中收集到的气体是和空气的混合气,B错误;
C.关闭活塞,产生的将烧瓶中的溶液压入装置中,与发生反应,从而生成白色沉淀,C正确;
D.若取下装置的橡皮塞,溶解的空气中的与反应生成,可观察沉淀由白色变成灰绿色最后变为红褐色,D正确;
故选B。
13.【答案】
【解析】A.铝热反应是放热反应,能量变化可用图表示,故A正确;
B.和铝粉的混合物被称为铝热剂,故B正确;
C.镁的活泼性大于,不能用铝热反应冶炼金属镁,故C错误;
D.铝热反应可用于焊接铁轨,反应的化学方程式为,故D正确;
故选C。
14.【答案】
【解析】铝土矿的主要成分是,含有杂质、,因、与溶液反应,不与溶液反应;除不与盐酸反应外,、均与盐酸反应;结合流程可知,步骤中,用盐酸浸取铝土矿并过滤得到母液,母液含有、;向母液中加入过量烧碱除去、,并将转化为,过滤得到母液,母液中含有;向母液中通入过量二氧化碳,得到;加热分解得到,再电解氧化铝可得到。
A.氧化铝熔点较高,需要加入冰晶石,降低氧化铝熔融所需的温度,故A正确;
B.步骤中加入过量溶液,作用是除去、,故B正确;
C.通入足量二氧化碳与偏铝酸根反应:,故C正确;
D.将步骤和步骤顺序颠倒,母液中含有、,再通入足量得不到氢氧化铝沉淀,故D错误;
故选D。
15.【答案】
【解析】A.步骤中的主要目的是将还原为,同样具有还原性,可用于代替,故A不符合题意;
B.水溶液具有还原性,可以防止被氧化,故B不符合题意;
C.步骤生成物为,因此与氢氧化钠溶液在加热条件下发生的离子反应为:,故C不符合题意;
D.如果试样中混有和杂质,用足量稀硫酸与试样充分反应得到的固体中有和,无法计算试样纯度,故D符合题意;
故选D。
16.【答案】防止液体暴沸;冷凝水蒸气
检验氢气的纯度;点燃氢气
实验中不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,从而使反应正向进行
取滤液少量,向其中滴加溶液,溶液变为血红色,即证明含有;
【解析】烧瓶用于提供水蒸气,为防止暴沸现象,应加入碎瓷片。在加热条件下,中还原铁粉与水蒸气反应生成和氢气,装置用于冷却水蒸气,然后在中进行干燥,然后用氢气与反应制备铁,以此解答该题。
加热液体时要防止暴沸,则在烧瓶中常加入碎瓷片,其目的是防止液体暴沸;小试管在冰水混合物中,能冷却水蒸气,除去多余的水蒸气;
在装置中与水蒸气反应产生和 ,生成的氢气把装置、中的空气排净,为了防止氢气中混有空气加热爆炸,所以加热前,先检验出口处氢气的纯度,最后氢气要点燃处理,即在出口处应点燃氢气;
高温下与反应的化学方程式为,在一定条件下该反应实际上是可逆反应,如使平衡正向移动,可实验中不断通入水蒸气增大反应物浓度,并移走氢气减小生成物浓度,使平衡正向移动;
管中生成,若检验其中的,应该先加盐酸溶解形成溶液,然后加溶液,若溶液变为血红色,即证明含有。即证明存在的方法是:取滤液少量,向其中滴加溶液,若溶液变为血红色,即证明含有;
质量为,其物质的量为,其中元素的物质的量,则质量;反应一段时间后停止实验,冷却后取出其中固体干燥后称量,其质量变为,说明剩余固体中含有元素,因此不可能完全是单质;其中元素的物质的量 ,:::。
固体中含有元素,不可能完全是单质,不符合题意;
当和按:混合时,符合固体中::比例关系,符合题意;
无论和以任何比例混合,都不符合::比例关系,不符合题意;
当和按:混合时,符合固体中::比例关系,符合题意;
假设、和混合物中三种物质的物质的量分别是、、,要符合::比例关系,则::,整理可得,就符合上述关系,符合题意;
综上所述可知符合题意的物质组合为;
用上述固体与粉发生铝热反应,产生单质和,根据上述计算可知元素的物质的量,则由化学式可知,其质量。
17.【答案】
菠菜中含有;
【解析】水浸需要用烧杯,水浸后过滤需要用漏斗,研磨需要用研钵,实验中没有对固体物质的煅烧,肯定不会用到坩埚,故选A。
取少许水浸液于试管中,滴入几滴溶液,振荡,溶液颜色无明显变化,再滴加少量和,溶液立即变红,菠菜中含有,滴加发生反应的离子方程式。
新鲜菠菜中铁元素的质量为,则该菠菜中铁元素的含量为。
18.【答案】物理
、、、
或和
【解析】多种金属或其化合物在灼烧时能使火焰呈现特殊的颜色,这在化学上叫作焰色试验,亦称焰色反应。
无色溶液,则不含和;由焰色试验显黄色可知,含有;由加溶液和稀盐酸得到沉淀可知,含有;由加固体得到白色沉淀和无色无味气体,加溶液得到沉淀的图像可知,含有和,则不含、。根据以上分析可知原溶液中一定存在的离子有、、、,可能存在。
实验是过氧化钠和水反应生成氢氧化钠和氧气,氢氧化钠和铝离子生成氢氧化铝沉淀,和镁离子生成氢氧化镁沉淀,反应中产生的白色沉淀的成分可能是或和。
依据图形变化可知,的物质的量为,的物质的量为,的物质的量等于硫酸钡沉淀的物质的量,为,溶液体积为,若溶液中的物质的量为,依据电荷守恒计算,。
段的生成物是四羟基合铝酸钠,与明矾溶液反应的离子方程式为
。
19.【答案】第三或周期第族
防止受热分解
氨水过量会导致生成氢氧化镁沉淀,影响的产率
【解析】解:镁的原子序数为,原子核外有个电子层,最外层电子数为,则位于周期表第三或周期第族,
故答案为:第三或周期第族;
过氧化氢不稳定,加高温度下易分解,则应在较低温度下进行,以防止受热分解,
故答案为:防止受热分解;
由流程可知通入调节,得到的滤渣主要成分是和,
故答案为:;
如氨水过量,则可生成氢氧化镁沉淀,进而影响的产率,应控制氨水的量不宜过多,
故答案为:氨水过量会导致生成氢氧化镁沉淀,影响的产率;
加热生成碱式碳酸镁,方程式为,
故答案为:。
由流程可知蛇纹石加入硫酸酸浸,可生成硫酸铝、硫酸铁、硫酸亚铁、硫酸镁,过滤得到二氧化硅滤渣,滤液加入过氧化氢,可氧化亚铁离子生成铁离子,加入氨气调节溶液的,得到滤渣含有氢氧化铁、氢氧化铝,滤液加入氨水、碳酸氢铵可生成,加热生成碱式碳酸镁,以此解答该题。
本题考查物质的制备,把握物质的性质、发生的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度中等。
第1页,共1页
