第1章第三节氧化还原反应-点对点练习上学期高一化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 第1章第三节氧化还原反应-点对点练习上学期高一化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 232.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 17:17:24 | ||
图片预览



文档简介
第1章第三节氧化还原反应-点对点练习2022-2023学年上学期高一化学人教版(2019)必修第一册学校:___________姓名:___________班级:___________考号:___________
一、单选题
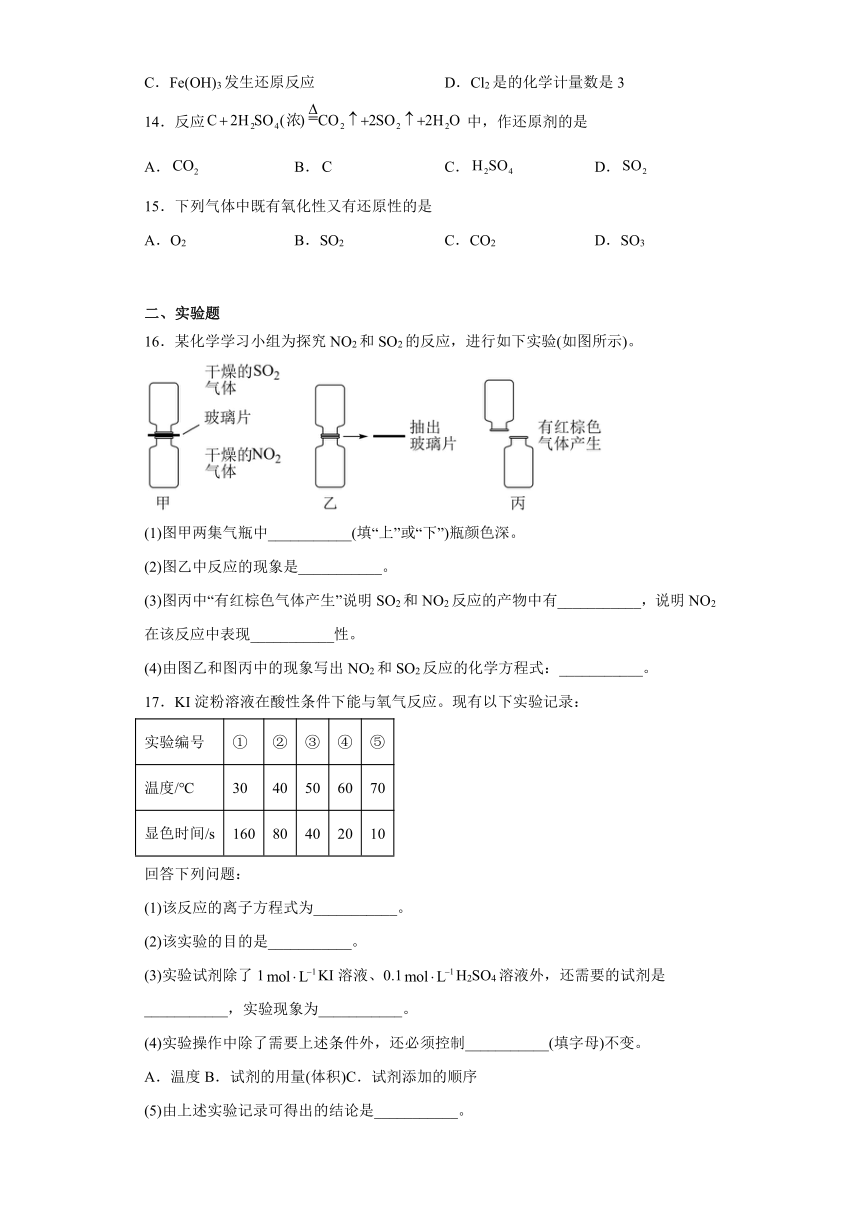
1.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
下列说法正确的是
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.NO2能和NaOH反应,因此是酸性氧化物
C.由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
2.下列反应中,SO2表现了还原性的是
A.SO2+H2OH2SO3 B.SO2+2NaOH=Na2SO3+H2O
C.2SO2+O2 2SO3 D.SO2+CaO=CaSO3
3.工业上制取的化学反应(未配平):,下列说法正确的是
A.在反应中被还原 B.在反应中失去电子
C.在反应中作氧化剂 D.氧化剂在反应中得到电子
4.下列化学反应基本类型中一定是氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
5.下列转化中,需要加入氧化剂才能实现的是
A. B. C. D.
6.氢化钙可用作生氢剂,原理如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
7.氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是
A.该反应属于置换反应 B.该反应属于复分解反应
C.NaH是氧化剂 D.H2O中的氢元素被还原
8.下列物质中的铁元素,既能被氧化又能被还原的是
A.Fe B. C. D.
9.下列反应中,参加反应的化合物作还原剂的是
A.用锌和稀硫酸反应制取氢气
B.在高温下用氢气还原氧化铜得到单质铜
C.用碳和水蒸气在高温下反应制取氢气
D.用氯气和溴化钠反应生成溴和氯化钠
10.海水是一个巨大的化学资源宝库。下列有关海水综合利用的说法正确的是
A.从海水中可以获得,电解溶液可制备金属钠
B.从海水中提取溴的过程中利用了氧化还原反应原理
C.海水中含有镁元素,只需经过物理变化就可以得到镁单质
D.目前工业上可直接从海水中提取
11.双氧水(H2O2)是一种重要的绿色氧化剂,在双氧水中滴加少量酸性KMnO4溶液,紫色KMnO4溶液迅速褪为无色,同时产生气泡,其反应离子方程式为:2MnO+5H2O2+6H+=2Mn2++5O2↑+8H2O,下列说法正确的是
A.O2在该反应中是还原产物
B.H2O2在任何化学反应中都只作氧化剂
C.该反应中氧化剂和还原剂的个数之比为2∶5
D.当有2个KMnO4完全反应生成Mn2+时,转移电子数为5个
12.铝与稀硝酸发生反应的化学方程式为(未配平),若配平方程式后,的化学计量数应该是
A.2 B.4 C.6 D.8
13.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:Fe(OH)3+Cl2+KOHK2FeO4+KCl+H2O。对于该反应,下列说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生还原反应 D.Cl2是的化学计量数是3
14.反应中,作还原剂的是
A. B. C. D.
15.下列气体中既有氧化性又有还原性的是
A.O2 B.SO2 C.CO2 D.SO3
二、实验题
16.某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。
(1)图甲两集气瓶中___________(填“上”或“下”)瓶颜色深。
(2)图乙中反应的现象是___________。
(3)图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有___________,说明NO2在该反应中表现___________性。
(4)由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:___________。
17.KI淀粉溶液在酸性条件下能与氧气反应。现有以下实验记录:
实验编号 ① ② ③ ④ ⑤
温度/℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该反应的离子方程式为___________。
(2)该实验的目的是___________。
(3)实验试剂除了1KI溶液、0.1H2SO4溶液外,还需要的试剂是___________,实验现象为___________。
(4)实验操作中除了需要上述条件外,还必须控制___________(填字母)不变。
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是___________。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是___________。
18.近年来各国都在寻找对环境无害且作用迅速的消毒剂,其中二氧化氯()是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的和草酸()在60℃时反应制得。某兴趣小组的同学设计了如图装置(夹持装置略)来制取、收集并测定其质量。
查阅资料:是一种黄绿色、有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,对热不稳定,温度过高可能引起爆炸,易溶于水,可与碱液反应。
(1)装置A中的反应产物有、和等,请写出该反应的化学方程式:____________。
(2)装置A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、____________,其温度要保持在60~80℃之间,控制温度的目的是________________________。装置B也必须添加温度控制装置,应该选____________(填“冰水浴”“沸水浴”或“60℃的热水浴”)装置。
参考答案:
1.D
【详解】A.稀硝酸与铜反应生成一氧化氮和硝酸铜,稀硝酸被还原为一氧化氮,故A错误;
B.NO2与NaOH反应生成NaNO3、NaNO2和H2O,但生成的盐是两种,且发生元素化合价的变化,所以NO2不是酸性氧化物,故B错误;
C.实验①-③中,由于在滴加稀硫酸前,溶液中含有硝酸根离子,滴加稀硫酸后,使得硝酸根的氧化性增强,从而将剩余的铜氧化,因此只能说明稀硝酸能与铜反应。而在实验2中,最开始在铜片中滴加稀硫酸时,试管中没有明显的反应现象,说明铜不会与稀硫酸反应,故C错误;
D.在实验③中,滴加稀硫酸后增强了硝酸根的氧化性,从而将剩余的铜氧化,因此反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O,故D正确;
故选D。
2.C
【详解】A、B、D项中SO2表现了酸性氧化物的性质,三个反应均为非氧化还原反应,不符合题意,C项SO2中S元素化合价升高,SO2作还原剂,发生了氧化反应,表现了还原性,符合题意,故选C。
3.D
【详解】A.在反应中中S元素化合价由+4升高至+6价,失去电子被氧化,故A错误;
B.中Cl元素化合价由+5价降为中的+4价,得到电子发生还原反应,故B错误;
C.在反应既不作氧化剂也不作还原剂,故C错误;
D.由可知,氧化剂在反应中得到电子,故D正确;
答案选D。
4.D
【详解】A.化合反应不一定为氧化还原反应,如二氧化碳与水反应生成碳酸,故A不选;
B.分解反应不一定为氧化还原反应,如碳酸钙分解生成CaO和二氧化碳,故B不选;
C.复分解反应中一定不含元素的化合价变化,则一定不是氧化还原反应,故C不选;
D.置换反应中一定存在元素的化合价变化,如Zn与盐酸反应生成氯化锌和氢气,则一定为氧化还原反应,故D选;
故选:D。
5.B
【分析】加入适当的氧化剂才能实现,选项中应为还原剂发生的氧化反应,还原剂中某元素的化合价升高,以此来解答。
【详解】A.I元素化合价由0价降低到-1价,发生还原反应,A不符合题意;
B.Fe元素化合价由+2价升高到+3价,发生氧化反应,B符合题意;
C.无化合价变化,不发生氧化还原反应,C不符合题意;
D.Mn元素化合价由+7价降低到+4价,发生还原反应,C不符合题意;
故答案为:B。
6.B
【详解】CaH2中H的化合价为-1价,失去1个电子化合价升为0价,H2O中H的化合价为+1价,得到1个电子化合价降为0价,CaH2为还原剂,H2O为氧化剂,氧化产物、还原产物均为H2;
故选B。
7.D
【分析】NaH中H元素显-1价,H2O中H元素显+1价,H2中H元素的化合价为0,根据氧化还原反应的归中规律分析。
【详解】A.置换反应是单质+化合物→单质+化合物,根据该反应的特点,该反应不属于置换反应,故A错误;
B.该反应不属复分解反应,属于氧化还原反应,故B错误;
C.NaH中H元素显-1价,在反应中转化成0价,化合价升高被氧化,NaH为还原剂,故C错误;
D.H2O中部分H元素由+1价→0价,化合价降低被还原,H2O中部分H被还原,故D正确;
故选D。
8.B
【分析】处于最高价的元素只具有氧化性,处于最低价的元素只具有还原性,处于中间价态的元素具有氧化性和还原性,据此分析;
【详解】A.Fe处于最低价,只具有还原性,只能被氧化,故A不符合题意;
B.氯化亚铁中铁元素显+2价,处于中间价态,既具有氧化性,也具有还原性,既能被氧化,也能被还原,故B符合题意;
C.氯化铁中铁元素显+3价,处于最高价,只具有氧化性,只能被还原,故C不符合题意;
D.氧化铁中铁元素显+3价,处于最高价,只具有氧化性,只能被还原,故D不符合题意;
答案为B。
9.D
【详解】A.锌和稀硫酸反应制取氢气时,Zn作还原剂,硫酸作氧化剂,故A不选;
B.高温下用氢气还原氧化铜得到单质铜的反应中,CuO中的Cu元素化合价降低,作氧化剂,故B不选;
C.碳和水蒸气在高温下反应:,水中的H元素化合价降低,作氧化剂,故C不选;
D.氯气和溴化钠反应生成溴和氯化钠,其中溴元素化合价升高,被氧化,作还原剂,故D选;
故选D。
10.B
【详解】A.海水晒盐得到NaCl,Na为活泼金属,则电解熔融NaCl可制备Na同时产生氯气,A错误;
B.从海水中提取溴的过程中溴离子发生氧化反应生成溴单质,利用了氧化还原反应原理,B正确;
C.海水中镁以离子形成存在,经过化学反应可以获得氯化镁,然后电解熔融氯化镁可冶炼Mg,一定发生化学变化,C错误;
D.虽然海水中碘的总含量很大,但是海水中碘的浓度很低,不能直接由海水提取碘,D错误;
故选B。
11.C
【详解】A.该反应中H2O2中-1价的O被氧化生成氧气,氧气为氧化产物,故A错误;
B.题目所给反应中,H2O2中-1价的O被氧化生成氧气,氧气为氧化产物,H2O2在此反应为还原剂,故B错误;
C.该反应中KMnO4为氧化剂,H2O2为还原剂,根据方程式得氧化剂和还原剂的个数之比为2∶5,故C正确;
D.该反应中Mn2+为唯一还原产物,+7价的MnO被还原成Mn2+,转移5个电子,当有2个KMnO4完全反应生成Mn2+时,转移电子数为10个,故D错误;
故答案为C。
12.B
【详解】根据得失电子守恒和原子守恒,可配平该反应为,则的化学计量数应该是4,B正确,故答案选B。
13.D
【详解】A.置换反应是一种单质和化合物生成另外一种单质和化合物的反应,反应物、生成物的种类、种数不符合置换反应概念,不是置换反应,A错误;
B.钾元素化合价反应前后都为+1价,B错误;
C.铁元素化合价由+3价升高为+6价,Fe(OH)3发生氧化反应,C错误;
D.铁的价态升高3价,氯的价态降低2价,由电子守恒得2Fe(OH)3+3Cl2+10KOH2K2FeO4+6KCl+8H2O,D正确;
故选D。
14.B
【详解】还原剂中元素的化合价升高,从方程式中可以看出,C元素由0价升高为+4价,还原剂为C,故选B。
15.B
【详解】A.O元素化合价通常由0、-1、-2价,因此处于0价的单质O2只有氧化性,没有还原性,A不符合题意;
B.S元素化合价通常为-2、0、+4、+6价,因此在SO2中表现+4价是S既有氧化性又有还原性,B符合题意;
C.C元素化合价通常为0、+2、+4价,因此中CO2中表现+4价是C只有有氧化性没有还原性,C不符合题意;
D.S元素化合价通常为-2、0、+4、+6价,因此在SO3中表现+6价是S只有氧化性,没有还原性,D不符合题意;
故合理选项是B。
16.(1)下
(2)两气体混合后,颜色由红棕色变为无色
(3) NO 氧化
(4)NO2+SO2=NO+SO3
【详解】(1)NO2是红棕色的SO2没有颜色,故是下层有颜色,故下层颜色深;
(2)二氧化硫与密度比二氧化氮密度大,抽开玻璃片,二氧化氮向上,二氧化硫向下混合,生成三氧化硫和一氧化氮,一氧化氮无色气体,所以红棕色逐渐褪去,最终变为无色故答案为:两气体混合后,颜色由红棕色变为无色;
(3)图丙中“有红棕色气体产生”说明反应的产物中有一氧化氮,说明NO2在该反应中显氧化性;
(4)图丙中反应生成的气体遇空气显红棕色,说明图乙中反应生成了NO,即NO2和SO2反应,NO2转化为NO,表现氧化性,而SO2则表现还原性,被氧化,硫元素化合价升高,只能变成+6价,应转化为SO3,为化学方程式为:NO2+SO2=NO+SO3。
17.(1)4H++4I-+O2=2I2+2H2O
(2)探究温度对化学反应速率的影响
(3) 淀粉溶液 溶液由无色变为蓝色
(4)BC
(5)每升高10℃,反应速率增大约2倍
(6)保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
【详解】(1)在酸性条件下KI与氧气发生反应产生水和I2,该反应的离子方程式为:4H++4I-+O2=2I2+2H2O;
(2)根据表格数据可知该实验是为了探究温度对化学反应速率的影响;
(3)该反应产生I2,I2遇淀粉溶液变为蓝色,因此实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要加入的显色试剂是淀粉溶液;实验现象为溶液由无色变为蓝色;
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是试剂的用量(体积)、试剂添加的顺序,因此选项是BC;
(5)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍;
(6)若要进行溶液酸性大小对反应速率的影响的探究实验,则需要保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验。
18. 温度计 使反应发生(或正常进行),并防止温度过高引起爆炸 冰水浴
【分析】由实验装置图可知:A装置是潮湿的和草酸在60℃时反应制得,且对热不稳定,温度过高可能引起爆炸,其温度要保持在60~80℃之间,应使用水浴加热,B装置收集,室温下为气体,沸点为11.0℃,故装置B应添加冰水浴装置,使液化,C装置为尾气处理。
【详解】(1).和草酸发生氧化还原反应生成、、和,反应的化学方程式为,故答案为:;
(2).潮湿的和草酸在60℃时反应制得,且对热不稳定,温度过高可能引起爆炸,其温度要保持在60~80℃之间,控温的目的是使反应正常进行,并防止温度过高引起爆炸。室温下为气体,沸点为11.0℃,故装置B应添加冰水浴装置,使液化,故答案为:温度计;使反应发生(或正常进行),并防止温度过高引起爆炸;冰水浴。
一、单选题
1.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
下列说法正确的是
A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.NO2能和NaOH反应,因此是酸性氧化物
C.由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
2.下列反应中,SO2表现了还原性的是
A.SO2+H2OH2SO3 B.SO2+2NaOH=Na2SO3+H2O
C.2SO2+O2 2SO3 D.SO2+CaO=CaSO3
3.工业上制取的化学反应(未配平):,下列说法正确的是
A.在反应中被还原 B.在反应中失去电子
C.在反应中作氧化剂 D.氧化剂在反应中得到电子
4.下列化学反应基本类型中一定是氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
5.下列转化中,需要加入氧化剂才能实现的是
A. B. C. D.
6.氢化钙可用作生氢剂,原理如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
7.氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:NaH+H2O=NaOH+H2↑。下列有关该反应的说法中,正确的是
A.该反应属于置换反应 B.该反应属于复分解反应
C.NaH是氧化剂 D.H2O中的氢元素被还原
8.下列物质中的铁元素,既能被氧化又能被还原的是
A.Fe B. C. D.
9.下列反应中,参加反应的化合物作还原剂的是
A.用锌和稀硫酸反应制取氢气
B.在高温下用氢气还原氧化铜得到单质铜
C.用碳和水蒸气在高温下反应制取氢气
D.用氯气和溴化钠反应生成溴和氯化钠
10.海水是一个巨大的化学资源宝库。下列有关海水综合利用的说法正确的是
A.从海水中可以获得,电解溶液可制备金属钠
B.从海水中提取溴的过程中利用了氧化还原反应原理
C.海水中含有镁元素,只需经过物理变化就可以得到镁单质
D.目前工业上可直接从海水中提取
11.双氧水(H2O2)是一种重要的绿色氧化剂,在双氧水中滴加少量酸性KMnO4溶液,紫色KMnO4溶液迅速褪为无色,同时产生气泡,其反应离子方程式为:2MnO+5H2O2+6H+=2Mn2++5O2↑+8H2O,下列说法正确的是
A.O2在该反应中是还原产物
B.H2O2在任何化学反应中都只作氧化剂
C.该反应中氧化剂和还原剂的个数之比为2∶5
D.当有2个KMnO4完全反应生成Mn2+时,转移电子数为5个
12.铝与稀硝酸发生反应的化学方程式为(未配平),若配平方程式后,的化学计量数应该是
A.2 B.4 C.6 D.8
13.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:Fe(OH)3+Cl2+KOHK2FeO4+KCl+H2O。对于该反应,下列说法正确的是
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生还原反应 D.Cl2是的化学计量数是3
14.反应中,作还原剂的是
A. B. C. D.
15.下列气体中既有氧化性又有还原性的是
A.O2 B.SO2 C.CO2 D.SO3
二、实验题
16.某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。
(1)图甲两集气瓶中___________(填“上”或“下”)瓶颜色深。
(2)图乙中反应的现象是___________。
(3)图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有___________,说明NO2在该反应中表现___________性。
(4)由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:___________。
17.KI淀粉溶液在酸性条件下能与氧气反应。现有以下实验记录:
实验编号 ① ② ③ ④ ⑤
温度/℃ 30 40 50 60 70
显色时间/s 160 80 40 20 10
回答下列问题:
(1)该反应的离子方程式为___________。
(2)该实验的目的是___________。
(3)实验试剂除了1KI溶液、0.1H2SO4溶液外,还需要的试剂是___________,实验现象为___________。
(4)实验操作中除了需要上述条件外,还必须控制___________(填字母)不变。
A.温度B.试剂的用量(体积)C.试剂添加的顺序
(5)由上述实验记录可得出的结论是___________。
(6)若要进行溶液酸性强弱对反应速率影响的探究实验,你会采取的实验方案是___________。
18.近年来各国都在寻找对环境无害且作用迅速的消毒剂,其中二氧化氯()是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的和草酸()在60℃时反应制得。某兴趣小组的同学设计了如图装置(夹持装置略)来制取、收集并测定其质量。
查阅资料:是一种黄绿色、有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,对热不稳定,温度过高可能引起爆炸,易溶于水,可与碱液反应。
(1)装置A中的反应产物有、和等,请写出该反应的化学方程式:____________。
(2)装置A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、____________,其温度要保持在60~80℃之间,控制温度的目的是________________________。装置B也必须添加温度控制装置,应该选____________(填“冰水浴”“沸水浴”或“60℃的热水浴”)装置。
参考答案:
1.D
【详解】A.稀硝酸与铜反应生成一氧化氮和硝酸铜,稀硝酸被还原为一氧化氮,故A错误;
B.NO2与NaOH反应生成NaNO3、NaNO2和H2O,但生成的盐是两种,且发生元素化合价的变化,所以NO2不是酸性氧化物,故B错误;
C.实验①-③中,由于在滴加稀硫酸前,溶液中含有硝酸根离子,滴加稀硫酸后,使得硝酸根的氧化性增强,从而将剩余的铜氧化,因此只能说明稀硝酸能与铜反应。而在实验2中,最开始在铜片中滴加稀硫酸时,试管中没有明显的反应现象,说明铜不会与稀硫酸反应,故C错误;
D.在实验③中,滴加稀硫酸后增强了硝酸根的氧化性,从而将剩余的铜氧化,因此反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O,故D正确;
故选D。
2.C
【详解】A、B、D项中SO2表现了酸性氧化物的性质,三个反应均为非氧化还原反应,不符合题意,C项SO2中S元素化合价升高,SO2作还原剂,发生了氧化反应,表现了还原性,符合题意,故选C。
3.D
【详解】A.在反应中中S元素化合价由+4升高至+6价,失去电子被氧化,故A错误;
B.中Cl元素化合价由+5价降为中的+4价,得到电子发生还原反应,故B错误;
C.在反应既不作氧化剂也不作还原剂,故C错误;
D.由可知,氧化剂在反应中得到电子,故D正确;
答案选D。
4.D
【详解】A.化合反应不一定为氧化还原反应,如二氧化碳与水反应生成碳酸,故A不选;
B.分解反应不一定为氧化还原反应,如碳酸钙分解生成CaO和二氧化碳,故B不选;
C.复分解反应中一定不含元素的化合价变化,则一定不是氧化还原反应,故C不选;
D.置换反应中一定存在元素的化合价变化,如Zn与盐酸反应生成氯化锌和氢气,则一定为氧化还原反应,故D选;
故选:D。
5.B
【分析】加入适当的氧化剂才能实现,选项中应为还原剂发生的氧化反应,还原剂中某元素的化合价升高,以此来解答。
【详解】A.I元素化合价由0价降低到-1价,发生还原反应,A不符合题意;
B.Fe元素化合价由+2价升高到+3价,发生氧化反应,B符合题意;
C.无化合价变化,不发生氧化还原反应,C不符合题意;
D.Mn元素化合价由+7价降低到+4价,发生还原反应,C不符合题意;
故答案为:B。
6.B
【详解】CaH2中H的化合价为-1价,失去1个电子化合价升为0价,H2O中H的化合价为+1价,得到1个电子化合价降为0价,CaH2为还原剂,H2O为氧化剂,氧化产物、还原产物均为H2;
故选B。
7.D
【分析】NaH中H元素显-1价,H2O中H元素显+1价,H2中H元素的化合价为0,根据氧化还原反应的归中规律分析。
【详解】A.置换反应是单质+化合物→单质+化合物,根据该反应的特点,该反应不属于置换反应,故A错误;
B.该反应不属复分解反应,属于氧化还原反应,故B错误;
C.NaH中H元素显-1价,在反应中转化成0价,化合价升高被氧化,NaH为还原剂,故C错误;
D.H2O中部分H元素由+1价→0价,化合价降低被还原,H2O中部分H被还原,故D正确;
故选D。
8.B
【分析】处于最高价的元素只具有氧化性,处于最低价的元素只具有还原性,处于中间价态的元素具有氧化性和还原性,据此分析;
【详解】A.Fe处于最低价,只具有还原性,只能被氧化,故A不符合题意;
B.氯化亚铁中铁元素显+2价,处于中间价态,既具有氧化性,也具有还原性,既能被氧化,也能被还原,故B符合题意;
C.氯化铁中铁元素显+3价,处于最高价,只具有氧化性,只能被还原,故C不符合题意;
D.氧化铁中铁元素显+3价,处于最高价,只具有氧化性,只能被还原,故D不符合题意;
答案为B。
9.D
【详解】A.锌和稀硫酸反应制取氢气时,Zn作还原剂,硫酸作氧化剂,故A不选;
B.高温下用氢气还原氧化铜得到单质铜的反应中,CuO中的Cu元素化合价降低,作氧化剂,故B不选;
C.碳和水蒸气在高温下反应:,水中的H元素化合价降低,作氧化剂,故C不选;
D.氯气和溴化钠反应生成溴和氯化钠,其中溴元素化合价升高,被氧化,作还原剂,故D选;
故选D。
10.B
【详解】A.海水晒盐得到NaCl,Na为活泼金属,则电解熔融NaCl可制备Na同时产生氯气,A错误;
B.从海水中提取溴的过程中溴离子发生氧化反应生成溴单质,利用了氧化还原反应原理,B正确;
C.海水中镁以离子形成存在,经过化学反应可以获得氯化镁,然后电解熔融氯化镁可冶炼Mg,一定发生化学变化,C错误;
D.虽然海水中碘的总含量很大,但是海水中碘的浓度很低,不能直接由海水提取碘,D错误;
故选B。
11.C
【详解】A.该反应中H2O2中-1价的O被氧化生成氧气,氧气为氧化产物,故A错误;
B.题目所给反应中,H2O2中-1价的O被氧化生成氧气,氧气为氧化产物,H2O2在此反应为还原剂,故B错误;
C.该反应中KMnO4为氧化剂,H2O2为还原剂,根据方程式得氧化剂和还原剂的个数之比为2∶5,故C正确;
D.该反应中Mn2+为唯一还原产物,+7价的MnO被还原成Mn2+,转移5个电子,当有2个KMnO4完全反应生成Mn2+时,转移电子数为10个,故D错误;
故答案为C。
12.B
【详解】根据得失电子守恒和原子守恒,可配平该反应为,则的化学计量数应该是4,B正确,故答案选B。
13.D
【详解】A.置换反应是一种单质和化合物生成另外一种单质和化合物的反应,反应物、生成物的种类、种数不符合置换反应概念,不是置换反应,A错误;
B.钾元素化合价反应前后都为+1价,B错误;
C.铁元素化合价由+3价升高为+6价,Fe(OH)3发生氧化反应,C错误;
D.铁的价态升高3价,氯的价态降低2价,由电子守恒得2Fe(OH)3+3Cl2+10KOH2K2FeO4+6KCl+8H2O,D正确;
故选D。
14.B
【详解】还原剂中元素的化合价升高,从方程式中可以看出,C元素由0价升高为+4价,还原剂为C,故选B。
15.B
【详解】A.O元素化合价通常由0、-1、-2价,因此处于0价的单质O2只有氧化性,没有还原性,A不符合题意;
B.S元素化合价通常为-2、0、+4、+6价,因此在SO2中表现+4价是S既有氧化性又有还原性,B符合题意;
C.C元素化合价通常为0、+2、+4价,因此中CO2中表现+4价是C只有有氧化性没有还原性,C不符合题意;
D.S元素化合价通常为-2、0、+4、+6价,因此在SO3中表现+6价是S只有氧化性,没有还原性,D不符合题意;
故合理选项是B。
16.(1)下
(2)两气体混合后,颜色由红棕色变为无色
(3) NO 氧化
(4)NO2+SO2=NO+SO3
【详解】(1)NO2是红棕色的SO2没有颜色,故是下层有颜色,故下层颜色深;
(2)二氧化硫与密度比二氧化氮密度大,抽开玻璃片,二氧化氮向上,二氧化硫向下混合,生成三氧化硫和一氧化氮,一氧化氮无色气体,所以红棕色逐渐褪去,最终变为无色故答案为:两气体混合后,颜色由红棕色变为无色;
(3)图丙中“有红棕色气体产生”说明反应的产物中有一氧化氮,说明NO2在该反应中显氧化性;
(4)图丙中反应生成的气体遇空气显红棕色,说明图乙中反应生成了NO,即NO2和SO2反应,NO2转化为NO,表现氧化性,而SO2则表现还原性,被氧化,硫元素化合价升高,只能变成+6价,应转化为SO3,为化学方程式为:NO2+SO2=NO+SO3。
17.(1)4H++4I-+O2=2I2+2H2O
(2)探究温度对化学反应速率的影响
(3) 淀粉溶液 溶液由无色变为蓝色
(4)BC
(5)每升高10℃,反应速率增大约2倍
(6)保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验
【详解】(1)在酸性条件下KI与氧气发生反应产生水和I2,该反应的离子方程式为:4H++4I-+O2=2I2+2H2O;
(2)根据表格数据可知该实验是为了探究温度对化学反应速率的影响;
(3)该反应产生I2,I2遇淀粉溶液变为蓝色,因此实验试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要加入的显色试剂是淀粉溶液;实验现象为溶液由无色变为蓝色;
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是试剂的用量(体积)、试剂添加的顺序,因此选项是BC;
(5)由上述实验记录可得出的结论是每升高10℃,反应速率增大约2倍;
(6)若要进行溶液酸性大小对反应速率的影响的探究实验,则需要保持其他实验条件不变,采用不同浓度的硫酸溶液进行对比实验。
18. 温度计 使反应发生(或正常进行),并防止温度过高引起爆炸 冰水浴
【分析】由实验装置图可知:A装置是潮湿的和草酸在60℃时反应制得,且对热不稳定,温度过高可能引起爆炸,其温度要保持在60~80℃之间,应使用水浴加热,B装置收集,室温下为气体,沸点为11.0℃,故装置B应添加冰水浴装置,使液化,C装置为尾气处理。
【详解】(1).和草酸发生氧化还原反应生成、、和,反应的化学方程式为,故答案为:;
(2).潮湿的和草酸在60℃时反应制得,且对热不稳定,温度过高可能引起爆炸,其温度要保持在60~80℃之间,控温的目的是使反应正常进行,并防止温度过高引起爆炸。室温下为气体,沸点为11.0℃,故装置B应添加冰水浴装置,使液化,故答案为:温度计;使反应发生(或正常进行),并防止温度过高引起爆炸;冰水浴。
