2.2化学平衡同步练习题高二上学期化学人教版(2019)选择性必修1(含解析)
文档属性
| 名称 | 2.2化学平衡同步练习题高二上学期化学人教版(2019)选择性必修1(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 17:18:02 | ||
图片预览




文档简介
2.2化学平衡同步练习题
一、选择题
1.在恒温恒容密闭容器中进行反应:,下列能作为反应已达到平衡状态的依据是
A.不再变化 B.反应速率:
C.容器内气体的压强不再变化 D.容器内气体的密度不再变化
2.下列有关实验操作、现象和结论的叙述均正确的是
选项 实验操作 实验现象及结论
A 将某固体加水溶解,滴加少量NaOH溶液,加热 湿润红色石蕊试纸未变蓝,说明固体中不存在
B 往Fe2(SO4)3 溶液中滴加KSCN溶液,再加入少量K2SO4固体 溶液颜色先变红色,后红色变浅,说明生成物浓度增大,平衡逆向移动
C 将苯与液溴反应产生的气体先通过CCl4,再通入AgNO3溶液 AgNO3溶液中产生淡黄色沉淀,说明苯与液溴的反应是取代反应
D 取少量NaHCO3粉末于试管中,插入温度计,加几滴水 NaHCO3溶解,且温度计温度升高,说明NaHCO3溶于水放热
A.A B.B C.C D.D
3.一定条件下:2A(g)+B(s)C(g) △H<0。在测定C(g)的相对分子质量时,下列条件中,测定结果误差最大的是.
A.温度130℃、压强60kPa B.温度0℃、压强60kPa
C.温度130℃、压强150kPa D.温度0℃、压强150kPa
4.下列有关能量的判断和表示方法正确的是
A.已知ΔH=a ΔH=b,则aB.已知:ΔH= 92.4kJ mo 1,则在一定条件下向密闭容器中充入0.5molN2(g)和1.5molH2(g)充分反应放出46.2kJ的热量
C.已知: ΔH= 57.3kJ mol 1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×( 57.3)kJ mol 1
D.已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定
5.一定温度下,反应在密闭容器中达到平衡时,测得容器内、、。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是
A B C D
0.22 0.44 0.11 1.00
0.22 0.44 0.44 1.00
1.56 3.00 1.56 8.00
A.A B.B C.C D.D
6.向容积为1.00L的密闭容器中通入一定量的和的混合气体,发生反应:N2O4(g)2NO2(g) ,(已知:为红棕色气体,为无色气体)。体系中各物质浓度随时间变化如图所示。下列有关说法正确的是
A.64s时,反应达到化学平衡状态。
B.从反应开始至化学平衡前,混合气体的颜色逐渐变浅。
C.若该容器与外界无热量传递,则反应达到平衡前容器内气体的温度逐渐升高。
D.若升高温度,增大了活化分子百分数,则反应速率加快。
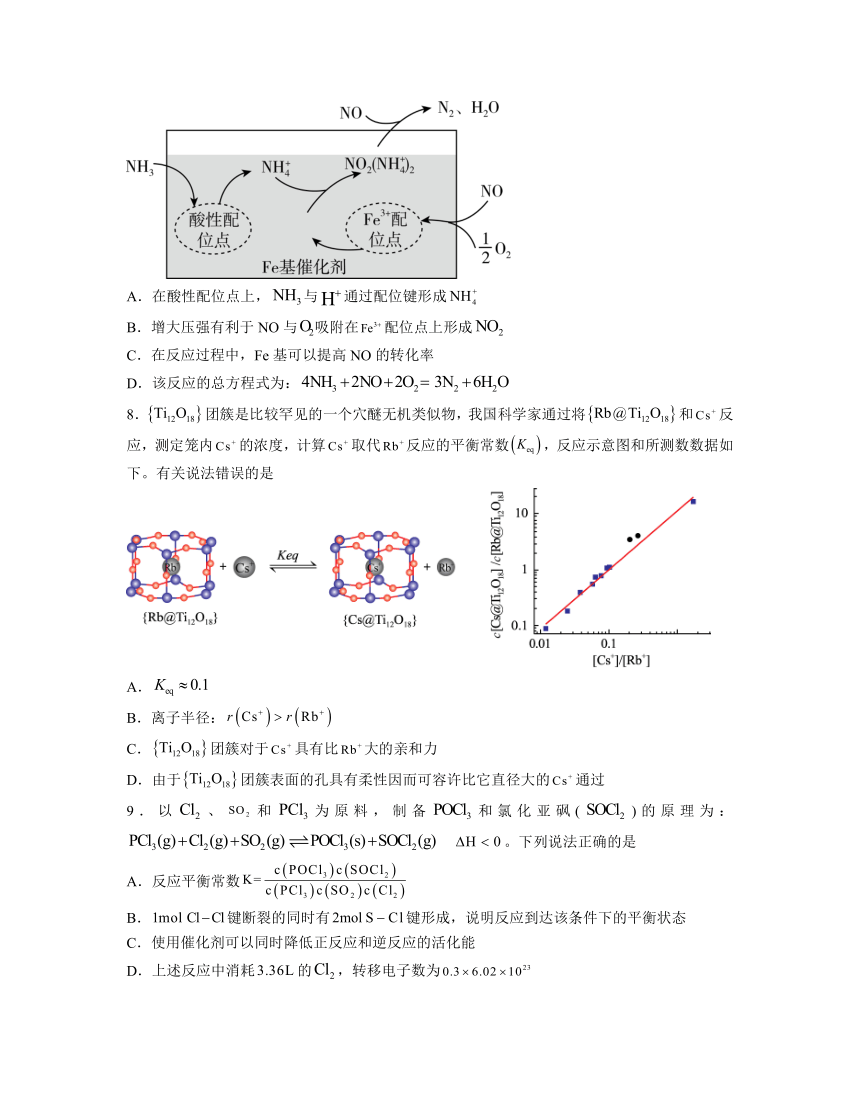
7.有氧条件下,在Fe基催化剂表面,还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法不正确的是
A.在酸性配位点上,与通过配位键形成
B.增大压强有利于NO与吸附在配位点上形成
C.在反应过程中,Fe基可以提高NO的转化率
D.该反应的总方程式为:
8.团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将和反应,测定笼内的浓度,计算取代反应的平衡常数,反应示意图和所测数数据如下。有关说法错误的是
A.
B.离子半径:
C.团簇对于具有比大的亲和力
D.由于团簇表面的孔具有柔性因而可容许比它直径大的通过
9.以、和为原料,制备和氯化亚砜()的原理为: 。下列说法正确的是
A.反应平衡常数
B.键断裂的同时有键形成,说明反应到达该条件下的平衡状态
C.使用催化剂可以同时降低正反应和逆反应的活化能
D.上述反应中消耗的,转移电子数为
10.如图表示合成氨反应过程中的能量变化。关于合成氨反应,下列说法不正确的是
A.升高温度有利于提高的平衡转化率
B.提高与的投料比可增大的转化率
C.增大压强能提高的反应速率和转化率
D.使用催化剂能缩短该反应到达平衡的时间
二、填空题
11.两种物质反应,不管怎样书写化学方程式,平衡常数不变_________
12.在密闭容器中的可逆反应CO(g)+NO2(g)CO2(g)+NO(g) △H<0。达到平衡后:
(1)扩大容器体积,平衡_______移动(填“正向”、“逆向”、“不”),c(NO2)将_______(填“增大”、“减小”、“不变”),反应混合物的颜色将变_______(填“深”、“浅”、“不变”)。
(2)升高温度平衡_______移动(填“正向”、“逆向”、“不”),加入催化剂,NO的物质的量_______(填“增大”、“减小”、“不变”),原因是_______。
13.回答下列问题:
(1)我国提出力争2060年前实现碳中和,将CO2转化为高附加值产品HCOOH是实现该目标的一种方式。向恒容密闭容器中充入1molCO2和1molH2,发生反应CO2(g)+H2(g)HCOOH(g) △H。不同温度下CO2的平衡转化率数据如表所示:
T/K 373 473 573 673
平衡转化率 α 8.4α 24.3α 37.5α
该反应的△H______0(填“>”或“<”)。已知:2H2(g)+O2(g)=2H2O(g) △H1,则反应2CO2(g)+2H2O(g)2HCOOH(g)+O2(g)的△H2=_____(用△H和△H1表示)。
(2)工业上常用反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H消除氮氧化物的污染。在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示。
根据题图判断该反应的△H_____0(填“>”“<”或“=”),理由是_____。
14.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2molB,并测得C的浓度为1.2mol L-1。
(1)A的转化率与B的转化率之比为___;物质A的化学反应速率为___;x=___;
(2)保持温度和容积不变,向平衡体系中再充入2molA和2molB气体,达到新平衡时B的物质的量为___。
(3)此反应在该温度时的化学平衡常数为___。
15.在一定温度下,将2molA和2molB两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g)+2D(g),ΔH<0,2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)x的值等于_______。
(2)该反应的化学平衡常数K=_______,升高温度时K值将_______(选填“增大”、“减小”或“不变”)。
(3)A物质的转化率为_______。
(4)若维持温度不变,在原平衡混合物的容器中再充入4molC和4molD,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为_______mol。达到新平衡时A的物质的量为n(A)=_______mol
16.铼(Re)广泛应用于喷气式发动机和火箭发动机,是重要的战略贵金属,可以通过还原剂在高温条件下还原其氧化物制取。
Ⅰ.实验室以富铼渣(主要成份)为原料制备高纯高铼酸铵(),其部分实验过程如下:
(萃取原理可表示为)
(1)酸浸时转化为两种强酸,该反应的离子方程式为_______。
(2)通过萃取与反萃取可实现铼元素的富集。
①萃取剂应具有的性质_______(填序号)。
A.密度大于水
B.在萃取剂中的溶解度大于水中的
C.不溶于水
②在反萃取时,加入氨水、水的目的是_______。
Ⅱ.以ReS2为原料制备NH4ReO4的装置如图所示:
(3)反应开始前,先向三颈瓶中加入一定量的和水,60℃下,通过分液漏斗依次滴入两种溶液。充分反应后可得和的混合溶液。
①滴入两种溶液时候,向三颈瓶中先滴加的是_______。(填序号)
A.氨水 B.溶液
②不考虑原料损失,实验中加入的与的最佳比为_______。
(4)请设计以三颈瓶中反应后的溶液为原料,制备金属铼粉的实验方案_______。(实验须使用的试剂:Zn粒,稀硫酸,浓硫酸、)
已知①:有关物质溶解度如下表
温度/℃
20 75.4 6.1
30 78.0 32.3
②
17.为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为________________________。
(3)A中发生反应的化学方程式为_______________________________________。
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是_______________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是____________________(填“甲”“乙”“丙”)。
过程ⅣB溶液中含有的离子 过程Ⅵ B溶液中含有的离子
甲 有Fe3+无Fe2+ 有
乙 既有Fe3+又有Fe2+ 有
丙 有Fe3+无Fe2+ 有Fe2+
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。查阅资料:Fe2+(aq) + (aq)FeSO3(s)(墨绿色)。
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
①溶液E为__________________。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因_____________
【参考答案】
一、选择题
1.A
解析:A.反应的平衡常数K=,当不再变化时,说明=K,说明反应达到平衡,故A选;
B.反应速率:,不能说明正逆反应速率相等,不能作为反应已达到平衡状态的依据,故B不选;
C.反应是气体体积不变的反应,反应过程中容器内气体的压强不变,当容器内气体的压强不再变化时,不能说明反应达到平衡,故C不选;
D.反应过程中气体总质量和总体积不变,则反应过程中容器内气体的密度是定值,当容器内气体的密度不再变化时,不能说明反应达到平衡,故D不选;
故选A。
2.C
解析:A.将某固体加水溶解,滴加少量NaOH溶液时,生成的一水合氨浓度减小,检验铵根离子应该向溶液中滴加浓的NaOH溶液,故A错误;
B.在Fe2(SO4)3溶液中滴加无色的KSCN溶液后,有以下可逆反应存在;FeCl3+3KSCN Fe(SCN)3+3KCl,加入少量K2SO4固体,溶液中Fe3+、SCN-浓度不变,K+和SO不参加反应,平衡不移动,所以红色不变,故B错误;
C.液溴具有挥发性,将苯与液溴反应产生的气体先通过CCl4除去挥发的Br2,再通入AgNO3溶液生成淡黄色沉淀AgBr,说明产物中存在HBr,说明苯与液溴的反应是取代反应,故C正确;
D.NaHCO3溶于水吸热,故D错误;
故选C。
3.A
解析:由于存在平衡2A(g)+B(s)C(g),A的存在会影响C的相对分子质量测定,故应采取措施使平衡向右移动,减小A的含量,该反应正反应是体积减小的放热反应,减小压强平衡向逆反应移动,升高温度平衡向逆反应移动,故应采取低温、高压,平衡正向进行,测定结果误差最小,反之最大,故选:A。
4.A
解析:A.所有的燃烧反应均是放热反应,完全燃烧比不完全燃烧放出热量多,而所以aB.此反应是可逆反应,充入0.5molN2(g)和1.5molH2(g)时两者不能完全反应放出热量小于46.2kJ,B错误;
C.中和热是指稀的强酸和稀的强碱反应生成1摩尔液态水时的反应热,硫酸与氢氧化钡反应生成的是硫酸钡沉淀和水,所以利用现有条件不能求出反应热,C错误;
D.白磷转化成红磷是放热的,所以红磷的能力低于白磷,能量越低越稳定,所以红磷比白磷稳定,D错误;
故选A。
5.D
解析:平衡时,、、,则K=;
A组:,反应处于平衡状态;
B组:,反应正向进行;
C组:,反应处于平衡状态;
D组:,反应逆向进行;
故选:D。
6.D
【分析】图示为物质浓度随时间变化的曲线图,当物质浓度不变时,为平衡点,故100s时反应达到平衡,据此分析。
解析:A.达到化学平衡状态,各物质的浓度不变,但不一定相等,由图中信息可知,64s时反应未达到化学平衡状态,A错误;
B.由图中信息可知,反应正向进行,反应体系中c (NO2)增大,所以混合气体的颜色逐渐变深,B错误;
C.由于正反应吸热,由图中信息可知,反应正向进行,绝热条件下容器内温度逐渐降低,C错误;
D.若升高温度,提供了更多的能量,增大了活化分子百分数,则反应速率加快,D正确;
故本题选D。
7.C
解析:A.分子中的N原子还含有一对孤对电子,所以能和通过配位键形成,故A正确;
B.由图可知,NO与吸附在配位点上形成,该过程中气体体积减小,增大压强平衡正向移动,有利于NO与吸附在配位点上形成,故B正确;
C.在反应过程中,Fe基作为催化剂,催化剂不能改变反应的转化率,故C错误;
D.由图可知,在Fe基催化剂表面,还原NO生成N2和H2O,总方程式为:,故D正确;
故选C。
8.A
解析:A.根据图示,时,,,A错误;
B.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;Cs和Rb都是ⅠA族元素,离子半径:,B正确;
C.与反应生成,说明团簇对于具有比大的亲和力,C正确;
D.的直径显著大于团簇表面的孔径,与反应生成,的骨架结构在交换过程中没有被破坏,可推断团簇表面的孔是柔性的,使得能无破坏进入笼内,D正确;
故选A。
9.C
解析:A.反应中为固体,由化学方程式可知,反应平衡常数,A错误;
B.键断裂的同时有键形成,描述的都是正反应,不能说明反应到达该条件下的平衡状态,B错误;
C.催化剂改变反应历程,加快反应速率;使用催化剂可以同时降低正反应和逆反应的活化能,C正确;
D.没有标况,不能计算转移的电子数,D错误;
故选C。
10.A
解析:A.由图可知,反应放热,升高温度,平衡逆向移动,N2的平衡转化率降低,故A错误;
B.提高N2与H2的投料比,平衡正向移动,氢气转化率增大,氮气转化率变小,故B正确;
C.增大压强,化学反应速率加快,反应正向气体分子数减小,加压,平衡正向移动,故C正确;
D.使用催化剂能降低反应所需的活化能,加快化学反应速率,缩短该反应到达平衡的时间,故D正确;
故答案选A。
【点睛】本题考查化学平衡,掌握外界条件改变对平衡的影响是解题的关键。
二、填空题
11.错误
解析:两种物质反应,平衡常数与化学方程式书写有关,故错误;
12.(1) 不 减小 浅
(2) 逆向 不变 催化剂只能缩短反应达平衡的时间
解析:(1)
反应为气体分子数不变的反应,扩大容器体积,平衡不移动;容器体积变大,c(NO2)将减小,物质浓度减小则反应混合物的颜色将变浅;
(2)
反应焓变小于零,为放热反应,升高温度平衡逆向移动;加入催化剂,改变反应速率,不改变平衡移动,故NO的物质的量不变。
13.(1) > 2△H-△H1
(2) < T1时,反应先达到平衡,则T1<T2,T1条件下平衡时CH4的物质的量较大,说明升高温度,化学平衡向逆反应方向移动,则逆反应为吸热反应,正反应为放热反应,△H<0
解析:(1)由题表中数据知,随温度升高,的平衡转化率增大,说明升高温度,平衡正向移动,则该反应为吸热反应,;
已知①,②,运用盖斯定律计算反应热:由得;
(2)时,反应先达到平衡,则,条件下平衡时的物质的量较大,说明升高温度,化学平衡向逆反应方向移动,则逆反应为吸热反应,正反应为放热反应,。
14. 2∶1 0.4mol·L-1·min-1 3 2.4mol 72
解析:(1)根据已知信息可列出三段式:,则A的转化率与B的转化率之比为;物质A的化学反应速率为;由于转化量之比等于化学计量数之比,则,解得x=3;
(2)由于温度和容积不变,且该反应反应前后气体的物质的量不变,再充入2molA和2molB,相当于增大压强,平衡不移动,即达到平衡后与原平衡等效,故B的物质的量为1.2mol×2=2.4mol;
(3)反应达到平衡后,各物质的浓度为:c(C) =1.2mol/L,c(A)= 0.2mol/L,c(B)= 0.6 mol/L,此反应在该温度时的化学平衡常数。
15.减小 60% 4 3.2
解析:(1)C的浓度为0.4mol·L-1,因为容器体积是2L因此C为0.8mol,与D产量相同,故反应中的计量数相同,x是2。
(2)列式求算:
由平衡常数计算公式。因为该反应ΔH<0,是放热反应,故升高温度反应逆向进行,K值减小。
(3) A物质的转化率=。
(4)与原平衡等效,则A与B的物质的量之比为1:1,将4molC和4molD完全转化为A和B,得到6molA和2molB,加上原来的物质的量之后,A为8mol,B为4mol,要使A、B的物质的量相等,还需要加入4molB,达到新平衡后,A的物质的量分数与原来相同,为20%,新平衡时A的物质的量为16mol×20%=3.2mol。
16.(1)2ReS2+19H2O2=2+4+10H++14H2O
(2) BC 将(R3N)2 HReO4转化为NH4ReO4,使Re元素从有机相中转移至水中,生成NH4ReO4溶液
(3) B 19:10
(4)先将反应后的溶液蒸发浓缩,冷却析晶得到NH4ReO4晶体,再将NH4ReO4晶体置于O2气流中加热产生Re2O7;用Zn粒和稀硫酸制备H2,并用浓硫酸干燥;再用H2还原Re2O7制得金属铼粉。
【分析】I.用H2SO4和H2O2将富铼渣(主要成份ReS2)酸浸,H2O2具有强氧化性,可以将ReS2氧化产生H2SO4,并结合“萃取原理”中的可知,反应还声称了HReO4,即“酸浸”过程中,H2O2和ReS2反应生成了HReO4和H2SO4;再用含R3N的有机溶液作萃取剂,将HReO4转化为(R3N)2 HReO4,再用氨水和水对有机相进行“反萃取”得到高铼酸铵溶液;再经过后续分离、提纯,获得高纯NH4ReO4。
II.根据I中的“酸浸”步骤,可以用H2O2溶液、氨水和ReS2制备NH4ReO4和(NH4)2SO4的混合溶液;根据溶解度信息,可以用冷却结晶的方法从混合溶液中获得NH4ReO4晶体。
解析:(1)由分析可知,酸浸时,ReS2转化为HReO4和H2SO4,该反应的离子方程式为2ReS2+19H2O2=2+4+10H++14H2O。
(2)①通过萃取与反萃取可知,在萃取剂中中的溶解度大于水中,萃取剂不能溶于水,故选BC;
②在反萃取时,加入氨水、水的目的是将(R3N)2 HReO4转化为NH4ReO4,使Re元素从有机相中转移至水中,生成NH4ReO4溶液。
(3)①反应开始前,先向三颈瓶中加入一定量的ReS2和水,60℃下,通过分液漏斗先滴入H2O2溶液,将ReS2氧化为HReO4和H2SO4,再滴入氨水反应生成NH4ReO4和(NH4)2SO4,故选B;
②根据离子反应方程式2ReS2+19H2O2=2+4+10H++14H2O可知,2ReS2~19H2O2~2~4,根据物料守恒可知,NH4ReO4~~NH3 H2O,(NH4)2SO4~~2NH3 H2O,综上所述,将2mol ReS2转化为NH4ReO4和(NH4)2SO4,需要19mol H2O2、10mol NH3 H2O,故不考虑原料损失,实验中加入的n(H2O2)与n(NH3 H2O)的最佳比为19:10。
(4)根据题干信息可知,可以通过还原剂在高温条件下还原Re的氧化物制取铼粉;由溶解度数据可知,20~30℃,(NH4)2SO4的溶解度大于NH4ReO4,且NH4ReO4的溶解度变化较大,故可以先将反应后的溶液蒸发浓缩,冷却析晶得到NH4ReO4晶体,再将NH4ReO4晶体置于O2气流中加热产生Re2O7;用Zn粒和稀硫酸制备H2,并用浓硫酸干燥;再用H2还原Re2O7制得金属铼粉。
17. 排出装置中的空气,防止氧气干扰; NaOH溶液 MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑ 2Fe3++SO2+2H2O=2Fe2+++4H+ 乙 丙 Na2SO3溶液 Fe3+消耗,c()减小,使得Fe2+(aq)+ (aq)FeSO3 (s)平衡逆向移动,所以溶液中红棕色变为浅绿色
【分析】打开弹簧夹通入氮气,排尽装置中的空气,先打开活塞a,二氧化锰与浓盐酸加热反应生成氯气,氯气进入氯化亚铁溶液生成氯化铁,关闭K2后打开活塞b,亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫进入氯化铁溶液发生氧化还原反应,据此回答问题。
解析:(1)由于装置中含有空气,空气中的O2会干扰实验,过程Ⅰ中通入一段时间N2,目的是排除装置中的空气,防止干扰。
(2)为了防止多余的Cl2、SO2污染环境,所以棉花中浸润的溶液是NaOH溶液,吸收未反应的Cl2、SO2。
(3)A中二氧化锰与浓盐酸的反应生成MnCl2、氯气、水,该反应的化学方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是2Fe3++SO2+2H2O=2Fe2+++4H+;
(5)甲、过程Ⅳ的B溶液中含有的离子有Fe3+无Fe2+,氯气可能过量,过程Ⅵ的B溶液中含有的,可能是氯气氧化SO2生成的,不能证明Fe3+的氧化性大于SO2;不能证明结论;
乙、过程Ⅳ的B溶液中含有的离子既有Fe3+又有Fe2+,说明氯气不足,氯气氧化性大于铁离子,过程Ⅵ的B溶液中含有的,说明二氧化硫与铁离子发生了反应:2Fe3++SO2+2H2O=2Fe2+++4H+,则Fe3+氧化性大于二氧化硫;能证明结论;
丙、过程Ⅳ的B溶液中有Fe3+、无Fe2+,则氯气的氧化性大于铁离子,过程Ⅵ的B溶液中含有Fe2+,说明SO2将Fe3+还原成Fe2+,则氧化性铁离子大于二氧化硫;能证明结论;
故乙、丙一定能够证明氧化性Cl2>Fe3+>SO2;
(6)①FeCl2溶液加入溶液E后,溶液变为墨绿色,说明生成了FeSO3,说明E为Na2SO3(或可溶性亚硫酸盐);
②溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色,Fe3+消耗,c()减小,使平衡Fe2+(aq)+(aq)FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。
一、选择题
1.在恒温恒容密闭容器中进行反应:,下列能作为反应已达到平衡状态的依据是
A.不再变化 B.反应速率:
C.容器内气体的压强不再变化 D.容器内气体的密度不再变化
2.下列有关实验操作、现象和结论的叙述均正确的是
选项 实验操作 实验现象及结论
A 将某固体加水溶解,滴加少量NaOH溶液,加热 湿润红色石蕊试纸未变蓝,说明固体中不存在
B 往Fe2(SO4)3 溶液中滴加KSCN溶液,再加入少量K2SO4固体 溶液颜色先变红色,后红色变浅,说明生成物浓度增大,平衡逆向移动
C 将苯与液溴反应产生的气体先通过CCl4,再通入AgNO3溶液 AgNO3溶液中产生淡黄色沉淀,说明苯与液溴的反应是取代反应
D 取少量NaHCO3粉末于试管中,插入温度计,加几滴水 NaHCO3溶解,且温度计温度升高,说明NaHCO3溶于水放热
A.A B.B C.C D.D
3.一定条件下:2A(g)+B(s)C(g) △H<0。在测定C(g)的相对分子质量时,下列条件中,测定结果误差最大的是.
A.温度130℃、压强60kPa B.温度0℃、压强60kPa
C.温度130℃、压强150kPa D.温度0℃、压强150kPa
4.下列有关能量的判断和表示方法正确的是
A.已知ΔH=a ΔH=b,则a
C.已知: ΔH= 57.3kJ mol 1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×( 57.3)kJ mol 1
D.已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定
5.一定温度下,反应在密闭容器中达到平衡时,测得容器内、、。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是
A B C D
0.22 0.44 0.11 1.00
0.22 0.44 0.44 1.00
1.56 3.00 1.56 8.00
A.A B.B C.C D.D
6.向容积为1.00L的密闭容器中通入一定量的和的混合气体,发生反应:N2O4(g)2NO2(g) ,(已知:为红棕色气体,为无色气体)。体系中各物质浓度随时间变化如图所示。下列有关说法正确的是
A.64s时,反应达到化学平衡状态。
B.从反应开始至化学平衡前,混合气体的颜色逐渐变浅。
C.若该容器与外界无热量传递,则反应达到平衡前容器内气体的温度逐渐升高。
D.若升高温度,增大了活化分子百分数,则反应速率加快。
7.有氧条件下,在Fe基催化剂表面,还原NO的反应机理如图所示。该反应能够有效脱除烟气中的NO,保护环境。下列说法不正确的是
A.在酸性配位点上,与通过配位键形成
B.增大压强有利于NO与吸附在配位点上形成
C.在反应过程中,Fe基可以提高NO的转化率
D.该反应的总方程式为:
8.团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将和反应,测定笼内的浓度,计算取代反应的平衡常数,反应示意图和所测数数据如下。有关说法错误的是
A.
B.离子半径:
C.团簇对于具有比大的亲和力
D.由于团簇表面的孔具有柔性因而可容许比它直径大的通过
9.以、和为原料,制备和氯化亚砜()的原理为: 。下列说法正确的是
A.反应平衡常数
B.键断裂的同时有键形成,说明反应到达该条件下的平衡状态
C.使用催化剂可以同时降低正反应和逆反应的活化能
D.上述反应中消耗的,转移电子数为
10.如图表示合成氨反应过程中的能量变化。关于合成氨反应,下列说法不正确的是
A.升高温度有利于提高的平衡转化率
B.提高与的投料比可增大的转化率
C.增大压强能提高的反应速率和转化率
D.使用催化剂能缩短该反应到达平衡的时间
二、填空题
11.两种物质反应,不管怎样书写化学方程式,平衡常数不变_________
12.在密闭容器中的可逆反应CO(g)+NO2(g)CO2(g)+NO(g) △H<0。达到平衡后:
(1)扩大容器体积,平衡_______移动(填“正向”、“逆向”、“不”),c(NO2)将_______(填“增大”、“减小”、“不变”),反应混合物的颜色将变_______(填“深”、“浅”、“不变”)。
(2)升高温度平衡_______移动(填“正向”、“逆向”、“不”),加入催化剂,NO的物质的量_______(填“增大”、“减小”、“不变”),原因是_______。
13.回答下列问题:
(1)我国提出力争2060年前实现碳中和,将CO2转化为高附加值产品HCOOH是实现该目标的一种方式。向恒容密闭容器中充入1molCO2和1molH2,发生反应CO2(g)+H2(g)HCOOH(g) △H。不同温度下CO2的平衡转化率数据如表所示:
T/K 373 473 573 673
平衡转化率 α 8.4α 24.3α 37.5α
该反应的△H______0(填“>”或“<”)。已知:2H2(g)+O2(g)=2H2O(g) △H1,则反应2CO2(g)+2H2O(g)2HCOOH(g)+O2(g)的△H2=_____(用△H和△H1表示)。
(2)工业上常用反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H消除氮氧化物的污染。在温度为T1和T2时,分别将0.40molCH4和1.0molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示。
根据题图判断该反应的△H_____0(填“>”“<”或“=”),理由是_____。
14.恒温恒容下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)xC(g)+2D(s),2min时反应达到平衡状态。此时剩余1.2molB,并测得C的浓度为1.2mol L-1。
(1)A的转化率与B的转化率之比为___;物质A的化学反应速率为___;x=___;
(2)保持温度和容积不变,向平衡体系中再充入2molA和2molB气体,达到新平衡时B的物质的量为___。
(3)此反应在该温度时的化学平衡常数为___。
15.在一定温度下,将2molA和2molB两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g)+2D(g),ΔH<0,2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)x的值等于_______。
(2)该反应的化学平衡常数K=_______,升高温度时K值将_______(选填“增大”、“减小”或“不变”)。
(3)A物质的转化率为_______。
(4)若维持温度不变,在原平衡混合物的容器中再充入4molC和4molD,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为_______mol。达到新平衡时A的物质的量为n(A)=_______mol
16.铼(Re)广泛应用于喷气式发动机和火箭发动机,是重要的战略贵金属,可以通过还原剂在高温条件下还原其氧化物制取。
Ⅰ.实验室以富铼渣(主要成份)为原料制备高纯高铼酸铵(),其部分实验过程如下:
(萃取原理可表示为)
(1)酸浸时转化为两种强酸,该反应的离子方程式为_______。
(2)通过萃取与反萃取可实现铼元素的富集。
①萃取剂应具有的性质_______(填序号)。
A.密度大于水
B.在萃取剂中的溶解度大于水中的
C.不溶于水
②在反萃取时,加入氨水、水的目的是_______。
Ⅱ.以ReS2为原料制备NH4ReO4的装置如图所示:
(3)反应开始前,先向三颈瓶中加入一定量的和水,60℃下,通过分液漏斗依次滴入两种溶液。充分反应后可得和的混合溶液。
①滴入两种溶液时候,向三颈瓶中先滴加的是_______。(填序号)
A.氨水 B.溶液
②不考虑原料损失,实验中加入的与的最佳比为_______。
(4)请设计以三颈瓶中反应后的溶液为原料,制备金属铼粉的实验方案_______。(实验须使用的试剂:Zn粒,稀硫酸,浓硫酸、)
已知①:有关物质溶解度如下表
温度/℃
20 75.4 6.1
30 78.0 32.3
②
17.为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________。
(2)棉花中浸润的溶液为________________________。
(3)A中发生反应的化学方程式为_______________________________________。
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是_______________________________。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是____________________(填“甲”“乙”“丙”)。
过程ⅣB溶液中含有的离子 过程Ⅵ B溶液中含有的离子
甲 有Fe3+无Fe2+ 有
乙 既有Fe3+又有Fe2+ 有
丙 有Fe3+无Fe2+ 有Fe2+
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。查阅资料:Fe2+(aq) + (aq)FeSO3(s)(墨绿色)。
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:
①溶液E为__________________。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因_____________
【参考答案】
一、选择题
1.A
解析:A.反应的平衡常数K=,当不再变化时,说明=K,说明反应达到平衡,故A选;
B.反应速率:,不能说明正逆反应速率相等,不能作为反应已达到平衡状态的依据,故B不选;
C.反应是气体体积不变的反应,反应过程中容器内气体的压强不变,当容器内气体的压强不再变化时,不能说明反应达到平衡,故C不选;
D.反应过程中气体总质量和总体积不变,则反应过程中容器内气体的密度是定值,当容器内气体的密度不再变化时,不能说明反应达到平衡,故D不选;
故选A。
2.C
解析:A.将某固体加水溶解,滴加少量NaOH溶液时,生成的一水合氨浓度减小,检验铵根离子应该向溶液中滴加浓的NaOH溶液,故A错误;
B.在Fe2(SO4)3溶液中滴加无色的KSCN溶液后,有以下可逆反应存在;FeCl3+3KSCN Fe(SCN)3+3KCl,加入少量K2SO4固体,溶液中Fe3+、SCN-浓度不变,K+和SO不参加反应,平衡不移动,所以红色不变,故B错误;
C.液溴具有挥发性,将苯与液溴反应产生的气体先通过CCl4除去挥发的Br2,再通入AgNO3溶液生成淡黄色沉淀AgBr,说明产物中存在HBr,说明苯与液溴的反应是取代反应,故C正确;
D.NaHCO3溶于水吸热,故D错误;
故选C。
3.A
解析:由于存在平衡2A(g)+B(s)C(g),A的存在会影响C的相对分子质量测定,故应采取措施使平衡向右移动,减小A的含量,该反应正反应是体积减小的放热反应,减小压强平衡向逆反应移动,升高温度平衡向逆反应移动,故应采取低温、高压,平衡正向进行,测定结果误差最小,反之最大,故选:A。
4.A
解析:A.所有的燃烧反应均是放热反应,完全燃烧比不完全燃烧放出热量多,而所以a
C.中和热是指稀的强酸和稀的强碱反应生成1摩尔液态水时的反应热,硫酸与氢氧化钡反应生成的是硫酸钡沉淀和水,所以利用现有条件不能求出反应热,C错误;
D.白磷转化成红磷是放热的,所以红磷的能力低于白磷,能量越低越稳定,所以红磷比白磷稳定,D错误;
故选A。
5.D
解析:平衡时,、、,则K=;
A组:,反应处于平衡状态;
B组:,反应正向进行;
C组:,反应处于平衡状态;
D组:,反应逆向进行;
故选:D。
6.D
【分析】图示为物质浓度随时间变化的曲线图,当物质浓度不变时,为平衡点,故100s时反应达到平衡,据此分析。
解析:A.达到化学平衡状态,各物质的浓度不变,但不一定相等,由图中信息可知,64s时反应未达到化学平衡状态,A错误;
B.由图中信息可知,反应正向进行,反应体系中c (NO2)增大,所以混合气体的颜色逐渐变深,B错误;
C.由于正反应吸热,由图中信息可知,反应正向进行,绝热条件下容器内温度逐渐降低,C错误;
D.若升高温度,提供了更多的能量,增大了活化分子百分数,则反应速率加快,D正确;
故本题选D。
7.C
解析:A.分子中的N原子还含有一对孤对电子,所以能和通过配位键形成,故A正确;
B.由图可知,NO与吸附在配位点上形成,该过程中气体体积减小,增大压强平衡正向移动,有利于NO与吸附在配位点上形成,故B正确;
C.在反应过程中,Fe基作为催化剂,催化剂不能改变反应的转化率,故C错误;
D.由图可知,在Fe基催化剂表面,还原NO生成N2和H2O,总方程式为:,故D正确;
故选C。
8.A
解析:A.根据图示,时,,,A错误;
B.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;Cs和Rb都是ⅠA族元素,离子半径:,B正确;
C.与反应生成,说明团簇对于具有比大的亲和力,C正确;
D.的直径显著大于团簇表面的孔径,与反应生成,的骨架结构在交换过程中没有被破坏,可推断团簇表面的孔是柔性的,使得能无破坏进入笼内,D正确;
故选A。
9.C
解析:A.反应中为固体,由化学方程式可知,反应平衡常数,A错误;
B.键断裂的同时有键形成,描述的都是正反应,不能说明反应到达该条件下的平衡状态,B错误;
C.催化剂改变反应历程,加快反应速率;使用催化剂可以同时降低正反应和逆反应的活化能,C正确;
D.没有标况,不能计算转移的电子数,D错误;
故选C。
10.A
解析:A.由图可知,反应放热,升高温度,平衡逆向移动,N2的平衡转化率降低,故A错误;
B.提高N2与H2的投料比,平衡正向移动,氢气转化率增大,氮气转化率变小,故B正确;
C.增大压强,化学反应速率加快,反应正向气体分子数减小,加压,平衡正向移动,故C正确;
D.使用催化剂能降低反应所需的活化能,加快化学反应速率,缩短该反应到达平衡的时间,故D正确;
故答案选A。
【点睛】本题考查化学平衡,掌握外界条件改变对平衡的影响是解题的关键。
二、填空题
11.错误
解析:两种物质反应,平衡常数与化学方程式书写有关,故错误;
12.(1) 不 减小 浅
(2) 逆向 不变 催化剂只能缩短反应达平衡的时间
解析:(1)
反应为气体分子数不变的反应,扩大容器体积,平衡不移动;容器体积变大,c(NO2)将减小,物质浓度减小则反应混合物的颜色将变浅;
(2)
反应焓变小于零,为放热反应,升高温度平衡逆向移动;加入催化剂,改变反应速率,不改变平衡移动,故NO的物质的量不变。
13.(1) > 2△H-△H1
(2) < T1时,反应先达到平衡,则T1<T2,T1条件下平衡时CH4的物质的量较大,说明升高温度,化学平衡向逆反应方向移动,则逆反应为吸热反应,正反应为放热反应,△H<0
解析:(1)由题表中数据知,随温度升高,的平衡转化率增大,说明升高温度,平衡正向移动,则该反应为吸热反应,;
已知①,②,运用盖斯定律计算反应热:由得;
(2)时,反应先达到平衡,则,条件下平衡时的物质的量较大,说明升高温度,化学平衡向逆反应方向移动,则逆反应为吸热反应,正反应为放热反应,。
14. 2∶1 0.4mol·L-1·min-1 3 2.4mol 72
解析:(1)根据已知信息可列出三段式:,则A的转化率与B的转化率之比为;物质A的化学反应速率为;由于转化量之比等于化学计量数之比,则,解得x=3;
(2)由于温度和容积不变,且该反应反应前后气体的物质的量不变,再充入2molA和2molB,相当于增大压强,平衡不移动,即达到平衡后与原平衡等效,故B的物质的量为1.2mol×2=2.4mol;
(3)反应达到平衡后,各物质的浓度为:c(C) =1.2mol/L,c(A)= 0.2mol/L,c(B)= 0.6 mol/L,此反应在该温度时的化学平衡常数。
15.减小 60% 4 3.2
解析:(1)C的浓度为0.4mol·L-1,因为容器体积是2L因此C为0.8mol,与D产量相同,故反应中的计量数相同,x是2。
(2)列式求算:
由平衡常数计算公式。因为该反应ΔH<0,是放热反应,故升高温度反应逆向进行,K值减小。
(3) A物质的转化率=。
(4)与原平衡等效,则A与B的物质的量之比为1:1,将4molC和4molD完全转化为A和B,得到6molA和2molB,加上原来的物质的量之后,A为8mol,B为4mol,要使A、B的物质的量相等,还需要加入4molB,达到新平衡后,A的物质的量分数与原来相同,为20%,新平衡时A的物质的量为16mol×20%=3.2mol。
16.(1)2ReS2+19H2O2=2+4+10H++14H2O
(2) BC 将(R3N)2 HReO4转化为NH4ReO4,使Re元素从有机相中转移至水中,生成NH4ReO4溶液
(3) B 19:10
(4)先将反应后的溶液蒸发浓缩,冷却析晶得到NH4ReO4晶体,再将NH4ReO4晶体置于O2气流中加热产生Re2O7;用Zn粒和稀硫酸制备H2,并用浓硫酸干燥;再用H2还原Re2O7制得金属铼粉。
【分析】I.用H2SO4和H2O2将富铼渣(主要成份ReS2)酸浸,H2O2具有强氧化性,可以将ReS2氧化产生H2SO4,并结合“萃取原理”中的可知,反应还声称了HReO4,即“酸浸”过程中,H2O2和ReS2反应生成了HReO4和H2SO4;再用含R3N的有机溶液作萃取剂,将HReO4转化为(R3N)2 HReO4,再用氨水和水对有机相进行“反萃取”得到高铼酸铵溶液;再经过后续分离、提纯,获得高纯NH4ReO4。
II.根据I中的“酸浸”步骤,可以用H2O2溶液、氨水和ReS2制备NH4ReO4和(NH4)2SO4的混合溶液;根据溶解度信息,可以用冷却结晶的方法从混合溶液中获得NH4ReO4晶体。
解析:(1)由分析可知,酸浸时,ReS2转化为HReO4和H2SO4,该反应的离子方程式为2ReS2+19H2O2=2+4+10H++14H2O。
(2)①通过萃取与反萃取可知,在萃取剂中中的溶解度大于水中,萃取剂不能溶于水,故选BC;
②在反萃取时,加入氨水、水的目的是将(R3N)2 HReO4转化为NH4ReO4,使Re元素从有机相中转移至水中,生成NH4ReO4溶液。
(3)①反应开始前,先向三颈瓶中加入一定量的ReS2和水,60℃下,通过分液漏斗先滴入H2O2溶液,将ReS2氧化为HReO4和H2SO4,再滴入氨水反应生成NH4ReO4和(NH4)2SO4,故选B;
②根据离子反应方程式2ReS2+19H2O2=2+4+10H++14H2O可知,2ReS2~19H2O2~2~4,根据物料守恒可知,NH4ReO4~~NH3 H2O,(NH4)2SO4~~2NH3 H2O,综上所述,将2mol ReS2转化为NH4ReO4和(NH4)2SO4,需要19mol H2O2、10mol NH3 H2O,故不考虑原料损失,实验中加入的n(H2O2)与n(NH3 H2O)的最佳比为19:10。
(4)根据题干信息可知,可以通过还原剂在高温条件下还原Re的氧化物制取铼粉;由溶解度数据可知,20~30℃,(NH4)2SO4的溶解度大于NH4ReO4,且NH4ReO4的溶解度变化较大,故可以先将反应后的溶液蒸发浓缩,冷却析晶得到NH4ReO4晶体,再将NH4ReO4晶体置于O2气流中加热产生Re2O7;用Zn粒和稀硫酸制备H2,并用浓硫酸干燥;再用H2还原Re2O7制得金属铼粉。
17. 排出装置中的空气,防止氧气干扰; NaOH溶液 MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑ 2Fe3++SO2+2H2O=2Fe2+++4H+ 乙 丙 Na2SO3溶液 Fe3+消耗,c()减小,使得Fe2+(aq)+ (aq)FeSO3 (s)平衡逆向移动,所以溶液中红棕色变为浅绿色
【分析】打开弹簧夹通入氮气,排尽装置中的空气,先打开活塞a,二氧化锰与浓盐酸加热反应生成氯气,氯气进入氯化亚铁溶液生成氯化铁,关闭K2后打开活塞b,亚硫酸钠和浓硫酸反应生成二氧化硫,二氧化硫进入氯化铁溶液发生氧化还原反应,据此回答问题。
解析:(1)由于装置中含有空气,空气中的O2会干扰实验,过程Ⅰ中通入一段时间N2,目的是排除装置中的空气,防止干扰。
(2)为了防止多余的Cl2、SO2污染环境,所以棉花中浸润的溶液是NaOH溶液,吸收未反应的Cl2、SO2。
(3)A中二氧化锰与浓盐酸的反应生成MnCl2、氯气、水,该反应的化学方程式为MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑;
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是2Fe3++SO2+2H2O=2Fe2+++4H+;
(5)甲、过程Ⅳ的B溶液中含有的离子有Fe3+无Fe2+,氯气可能过量,过程Ⅵ的B溶液中含有的,可能是氯气氧化SO2生成的,不能证明Fe3+的氧化性大于SO2;不能证明结论;
乙、过程Ⅳ的B溶液中含有的离子既有Fe3+又有Fe2+,说明氯气不足,氯气氧化性大于铁离子,过程Ⅵ的B溶液中含有的,说明二氧化硫与铁离子发生了反应:2Fe3++SO2+2H2O=2Fe2+++4H+,则Fe3+氧化性大于二氧化硫;能证明结论;
丙、过程Ⅳ的B溶液中有Fe3+、无Fe2+,则氯气的氧化性大于铁离子,过程Ⅵ的B溶液中含有Fe2+,说明SO2将Fe3+还原成Fe2+,则氧化性铁离子大于二氧化硫;能证明结论;
故乙、丙一定能够证明氧化性Cl2>Fe3+>SO2;
(6)①FeCl2溶液加入溶液E后,溶液变为墨绿色,说明生成了FeSO3,说明E为Na2SO3(或可溶性亚硫酸盐);
②溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色,Fe3+消耗,c()减小,使平衡Fe2+(aq)+(aq)FeSO3(s)逆向移动,溶液颜色由红棕色变为浅绿色。
