化学人教版(2019)必修第一册3.1铁及其化合物——说课 课件(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1铁及其化合物——说课 课件(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 179.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 21:30:46 | ||
图片预览

文档简介
(共25张PPT)
铁及其化合物
内容提要
教法与学法
教学重难点
教学目标
学情分析
教材分析
教学过程
板书设计
教材分析
实验探究
氧化还原反应
离子反应
物质分类
衔接点
学情分析
对化学实验充满好奇
对实验现象的分析能力有待提高
具备一定实验操作和探究能力
知识与技能储备
心理特点与认知水平
宏观辨识与微观探析
变化观念与平衡思想
证据推理与模型认知
实验探究与创新意识
科学精神与社会责任
教材分析
三维目标
学生情况把握
教学目标
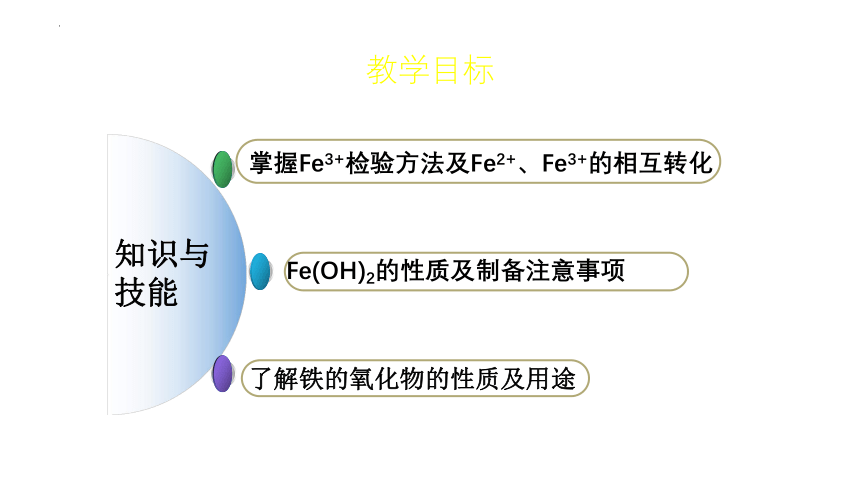
知识与技能
掌握Fe3+检验方法及Fe2+、Fe3+的相互转化
Fe(OH)2的性质及制备注意事项
了解铁的氧化物的性质及用途
教学目标
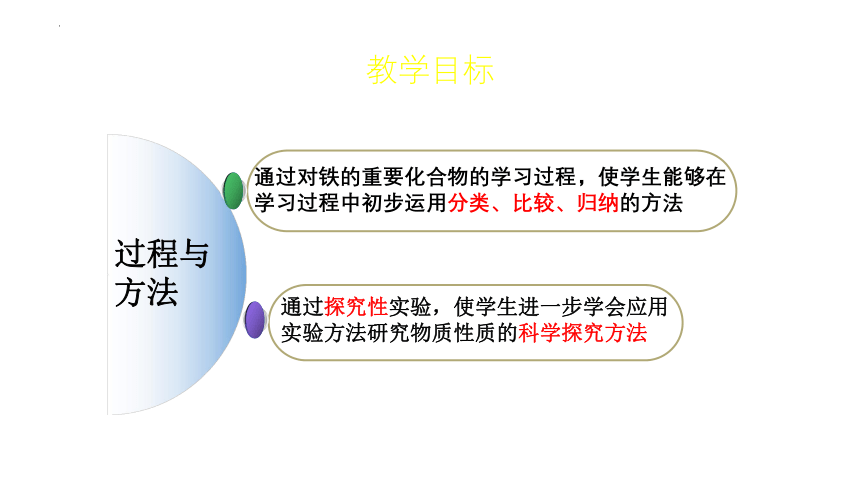
过程与方法
通过对铁的重要化合物的学习过程,使学生能够在
学习过程中初步运用分类、比较、归纳的方法
通过探究性实验,使学生进一步学会应用
实验方法研究物质性质的科学探究方法
教学重难点
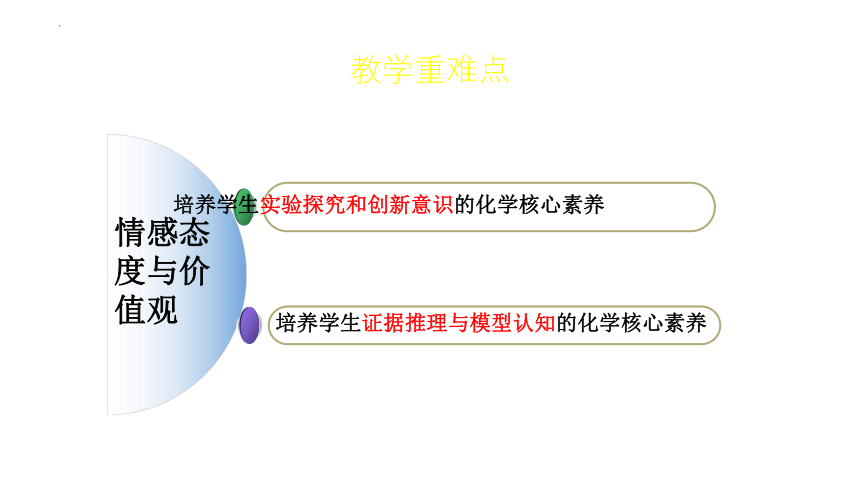
情感态度与价值观
培养学生实验探究和创新意识的化学核心素养
培养学生证据推理与模型认知的化学核心素养
教学重难点
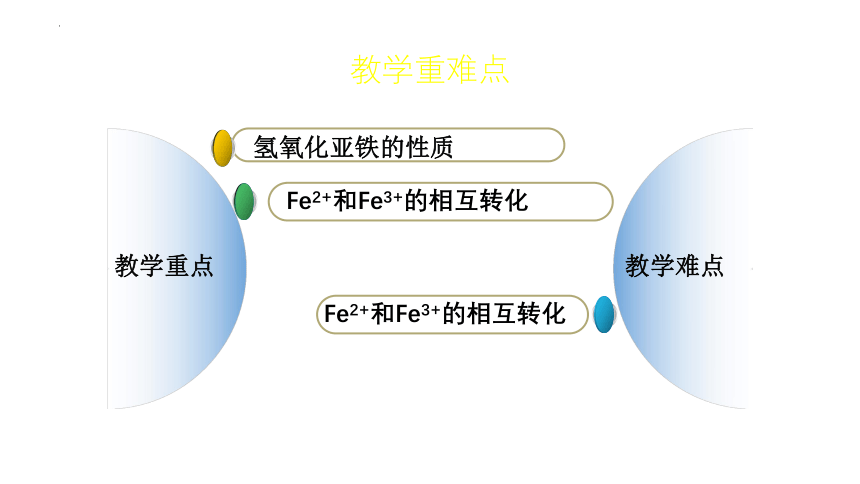
教学重点
教学难点
氢氧化亚铁的性质
Fe2+和Fe3+的相互转化
Fe2+和Fe3+的相互转化
教法选取与学法指导
实验探究
教法
选取
学法
指导
分析对比
理论联系实际
实验操作
现象观察
教学过程
第一类 铁盐和亚铁盐
环节1 生活实例引入:
问题:维生素C与补铁剂一起服用能将Fe3+转化为Fe2+,促进铁的吸收,同学们认为是真的还是假的?
实验操作 现象 结论和解释
1.向试管中加1mlFeCl3溶液,再滴入1滴KSCN溶液,观察现象
2.在上述溶液中加入少量维生素C.振荡,观察现象
结论: Fe3+具有氧化性,维生素C具有还原性,其可使Fe3+转化为Fe2+,并防止Fe2+被氧化
教学过程
环节1的设计意图
与生活中的实例相联系,以实验探究的形式展现知识,指导学生利用知识解决社会生活中的问题,培养学生科学精神与社会责任的化学核心素养
教学过程
环节2:依据氧化还原反应相关知识探究Fe3+与Fe2+的相互转化
问题2:依据氧化还原反应的相关知识,除维生素C外,还有那些物质可将Fe3+还原为Fe2+
实验操作 现象 结论和解释
1.向试管中1mlFeCl3溶液,加入_____,充分振荡,观察现象
2.再滴入KSCN溶液
归纳总结:Fe,Cu,Zn,S2-,I-,SO32-等还原剂,均能将Fe3+转化为Fe2+
教学过程
问题3: Fe2+也可被氧化剂氧化为Fe3+,请思考那些试剂可将Fe2+氧化为Fe3+呢?
归纳总结: H2O2, 氯水, 硝酸,KMnO4等较强的氧化剂均可将Fe2+氧化为Fe3+
实验操作 现象 结论和解释
1.向试管中1mlFeSO4溶液,再滴入1滴KSCN溶液,观察现象
2.再向上述混合溶液中滴入少量______,观察现象
教学过程
环节2的设计意图
本环节与氧化还原反应知识密切相关,引导学生利用氧化还原的相关知识对Fe3+和Fe2+间的转化进行分析,培养学生证据推理与模型认知的化学核心素养
本环节注重学生的实验设计与探究能力,旨在培养学生的实验探究与创新意识的化学核心素养
教学过程
小结
Fe2+
Fe3+
H2O2, 氯水等氧化剂
Fe,Cu等还原剂
总结Fe2+与Fe3+ 的相互转化,让学生感受化学中的物质转化观念,体现化学核心素养中的变化观念
教学过程
第二类 铁的氢氧化物
环节1 生活实例引入:
问题1:中国人习惯饭后一杯茶,但网上有传言说饭后喝茶会阻碍机体对铁的吸收。你认为这种传言是真的吗?
结论与解释:传言是真的,饭后饮茶的确会是人体内铁元素沉淀,因为人体内铁元素会与茶水中的茶碱,鞣酸等物质反应形成沉淀
实验操作 现象 结论与解释
往茶水中滴加饱和FeSO4溶液
教学过程
环节2:Fe(OH)2和Fe(OH)3沉淀的形成与性质
问题2:Fe3+与Fe2+与那些物质反应可形成沉淀?
实验操作 现象 结论与解释
1.向试管中加入2mlFeCl3溶液,再滴入几滴NaOH溶液,观察现象
2.向试管中加2mlFeSO4溶液,再滴入几滴NaOH溶液,观察现象
教学过程
现象1:产生红褐色沉淀 Fe3+ + 3OH- = Fe(OH)3↓
现象2:产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色
问题3 :为什么白色沉淀会变为红褐色?
问题4 :在制备Fe(OH)2时应注意什么?
教学过程
问题5 : Fe(OH)2和 Fe(OH)3均属于不溶性碱,其可与那些物质反应呢?并写出离子方程式
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
教学过程
设计意图
通过实验探究,观察现象,得出结论的方式学习Fe(OH)2的化学性质,培养学生证据推理的化学核心素养
教学过程
第三类 铁的氧化物
本环节的内容主要采用指导学生阅读课本P59 倒数第1-3段,
采用分类法归纳FeO,Fe2O3和Fe3O4的性质,完成表格
FeO Fe2O3 Fe3O4
俗称
化合价
色,态
用途
与酸反应 (碱性氧化物)
提高学生的阅读及提取信息的能力,在填表的过程中
感受和应用分类归纳的方法
小结
物质转化观
酸碱反应规律
氧化还原规律
铁、铁的氧化物、铁的氢氧化物、铁盐之间的相互转化,体现了化学核心素养中的变化观念与模型认知
板书设计
Fe2+
Fe3+
H2O2, 氯水等氧化剂
Fe,Cu等还原剂
OH-
H+
Fe(OH)3
Fe(OH)2
O2 + H2O
Fe2O3
(KSCN溶液检验)
溶液呈红色
OH-
H+
FeO
Fe3O4
感谢聆听!
铁及其化合物
内容提要
教法与学法
教学重难点
教学目标
学情分析
教材分析
教学过程
板书设计
教材分析
实验探究
氧化还原反应
离子反应
物质分类
衔接点
学情分析
对化学实验充满好奇
对实验现象的分析能力有待提高
具备一定实验操作和探究能力
知识与技能储备
心理特点与认知水平
宏观辨识与微观探析
变化观念与平衡思想
证据推理与模型认知
实验探究与创新意识
科学精神与社会责任
教材分析
三维目标
学生情况把握
教学目标
知识与技能
掌握Fe3+检验方法及Fe2+、Fe3+的相互转化
Fe(OH)2的性质及制备注意事项
了解铁的氧化物的性质及用途
教学目标
过程与方法
通过对铁的重要化合物的学习过程,使学生能够在
学习过程中初步运用分类、比较、归纳的方法
通过探究性实验,使学生进一步学会应用
实验方法研究物质性质的科学探究方法
教学重难点
情感态度与价值观
培养学生实验探究和创新意识的化学核心素养
培养学生证据推理与模型认知的化学核心素养
教学重难点
教学重点
教学难点
氢氧化亚铁的性质
Fe2+和Fe3+的相互转化
Fe2+和Fe3+的相互转化
教法选取与学法指导
实验探究
教法
选取
学法
指导
分析对比
理论联系实际
实验操作
现象观察
教学过程
第一类 铁盐和亚铁盐
环节1 生活实例引入:
问题:维生素C与补铁剂一起服用能将Fe3+转化为Fe2+,促进铁的吸收,同学们认为是真的还是假的?
实验操作 现象 结论和解释
1.向试管中加1mlFeCl3溶液,再滴入1滴KSCN溶液,观察现象
2.在上述溶液中加入少量维生素C.振荡,观察现象
结论: Fe3+具有氧化性,维生素C具有还原性,其可使Fe3+转化为Fe2+,并防止Fe2+被氧化
教学过程
环节1的设计意图
与生活中的实例相联系,以实验探究的形式展现知识,指导学生利用知识解决社会生活中的问题,培养学生科学精神与社会责任的化学核心素养
教学过程
环节2:依据氧化还原反应相关知识探究Fe3+与Fe2+的相互转化
问题2:依据氧化还原反应的相关知识,除维生素C外,还有那些物质可将Fe3+还原为Fe2+
实验操作 现象 结论和解释
1.向试管中1mlFeCl3溶液,加入_____,充分振荡,观察现象
2.再滴入KSCN溶液
归纳总结:Fe,Cu,Zn,S2-,I-,SO32-等还原剂,均能将Fe3+转化为Fe2+
教学过程
问题3: Fe2+也可被氧化剂氧化为Fe3+,请思考那些试剂可将Fe2+氧化为Fe3+呢?
归纳总结: H2O2, 氯水, 硝酸,KMnO4等较强的氧化剂均可将Fe2+氧化为Fe3+
实验操作 现象 结论和解释
1.向试管中1mlFeSO4溶液,再滴入1滴KSCN溶液,观察现象
2.再向上述混合溶液中滴入少量______,观察现象
教学过程
环节2的设计意图
本环节与氧化还原反应知识密切相关,引导学生利用氧化还原的相关知识对Fe3+和Fe2+间的转化进行分析,培养学生证据推理与模型认知的化学核心素养
本环节注重学生的实验设计与探究能力,旨在培养学生的实验探究与创新意识的化学核心素养
教学过程
小结
Fe2+
Fe3+
H2O2, 氯水等氧化剂
Fe,Cu等还原剂
总结Fe2+与Fe3+ 的相互转化,让学生感受化学中的物质转化观念,体现化学核心素养中的变化观念
教学过程
第二类 铁的氢氧化物
环节1 生活实例引入:
问题1:中国人习惯饭后一杯茶,但网上有传言说饭后喝茶会阻碍机体对铁的吸收。你认为这种传言是真的吗?
结论与解释:传言是真的,饭后饮茶的确会是人体内铁元素沉淀,因为人体内铁元素会与茶水中的茶碱,鞣酸等物质反应形成沉淀
实验操作 现象 结论与解释
往茶水中滴加饱和FeSO4溶液
教学过程
环节2:Fe(OH)2和Fe(OH)3沉淀的形成与性质
问题2:Fe3+与Fe2+与那些物质反应可形成沉淀?
实验操作 现象 结论与解释
1.向试管中加入2mlFeCl3溶液,再滴入几滴NaOH溶液,观察现象
2.向试管中加2mlFeSO4溶液,再滴入几滴NaOH溶液,观察现象
教学过程
现象1:产生红褐色沉淀 Fe3+ + 3OH- = Fe(OH)3↓
现象2:产生白色絮状沉淀,迅速变为灰绿色,最后变为红褐色
问题3 :为什么白色沉淀会变为红褐色?
问题4 :在制备Fe(OH)2时应注意什么?
教学过程
问题5 : Fe(OH)2和 Fe(OH)3均属于不溶性碱,其可与那些物质反应呢?并写出离子方程式
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
教学过程
设计意图
通过实验探究,观察现象,得出结论的方式学习Fe(OH)2的化学性质,培养学生证据推理的化学核心素养
教学过程
第三类 铁的氧化物
本环节的内容主要采用指导学生阅读课本P59 倒数第1-3段,
采用分类法归纳FeO,Fe2O3和Fe3O4的性质,完成表格
FeO Fe2O3 Fe3O4
俗称
化合价
色,态
用途
与酸反应 (碱性氧化物)
提高学生的阅读及提取信息的能力,在填表的过程中
感受和应用分类归纳的方法
小结
物质转化观
酸碱反应规律
氧化还原规律
铁、铁的氧化物、铁的氢氧化物、铁盐之间的相互转化,体现了化学核心素养中的变化观念与模型认知
板书设计
Fe2+
Fe3+
H2O2, 氯水等氧化剂
Fe,Cu等还原剂
OH-
H+
Fe(OH)3
Fe(OH)2
O2 + H2O
Fe2O3
(KSCN溶液检验)
溶液呈红色
OH-
H+
FeO
Fe3O4
感谢聆听!
