专题3第三单元共价键、共价晶体同步练习(含答案)2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3第三单元共价键、共价晶体同步练习(含答案)2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 599.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
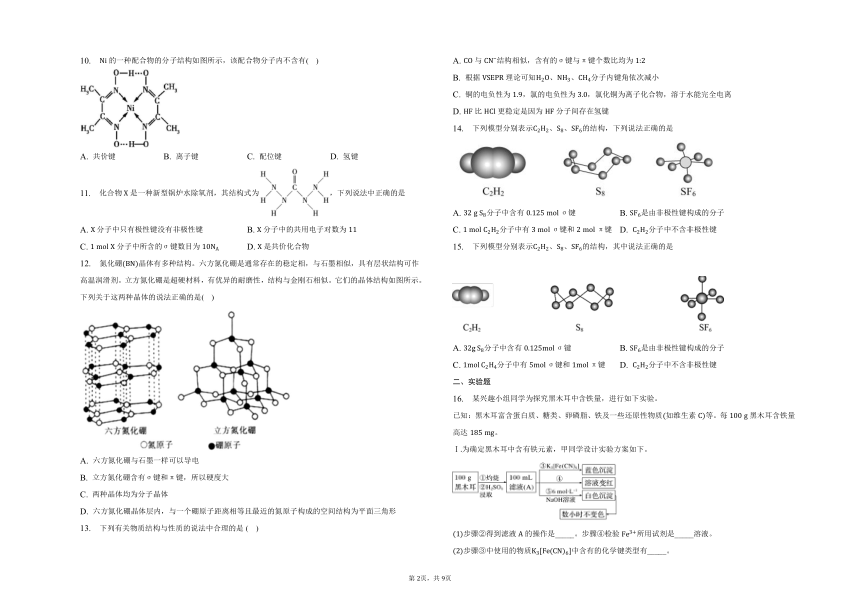
| 更新时间 | 2023-06-18 21:25:28 | ||
图片预览



文档简介
专题3第三单元共价键、共价晶体同步练习
一、单选题
1. 下列说法不正确的是 ( )
A. 键比键重叠程度大,形成的共价键强 B. 两个原子之间形成共价键时,最多有一个键
C. 气体单质中,一定有键,可能有键 D. 分子中有一个键,个键
2. 下列有关物质结构与性质的说法中合理的是( )
A. 与结构相似,含有的键与键个数比均为
B. 根据理论可知、、分子内键角依次减小
C. 铜的电负性为,氯的电负性为,氯化铜为离子化合物,溶于水能完全电离
D. 比更稳定是因为分子间存在氢键
3. 下列说法不正确的是为阿伏加德罗常数( )
A. 如图中含有键的个数为
B. 冰中含有氢键数目最多为
C. 离子中含有的 键为
D. 结构如图,中含有的键个数为
4. 离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。乙基甲基咪唑四氟硼酸盐离子液体结构如图所示,其环状结构中存在大键。下列相关叙述错误的是( )
A. 阳离子中至少原子共平面 B. 阴离子呈正四面体形
C. 该离子液体存在共价键、配位键、离子键 D. 阳离子中键数目是键数目的倍
5. 下列关于晶体说法正确的是( )
A. 是由极性键构成的非极性分子
B. 若表示阿伏伽德罗常数,常温常压下中含有的共价键数目为
C. 碳和硅同主族,因此和化学性质相似,物理性质也相似
D. 晶体结构中的最小环为个和个组成的元环
6. 法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法错误的是 ( )
A. 该分子中、、的第一电离能由大到小的顺序为
B. 该分子中键的键能大于键的键能
C. 该分子中所有原子都为杂化
D. 该分子中键与键数目之比为
7. 下列有关共价键和键参数的说法不正确的是( )
A. 一个丙烯分子中含有个键和个键
B. 碳碳双键的键能是碳碳单键键能的倍
C. 键比键键长更短,故CH比更稳定
D. 由于孤电子对的存在,分子的键角小于
8. 下列说法中正确的是( )
A. 、中所含化学键类型完全相同
B. 和分子中所有原子的最外层都达到了电子稳定结构
C. 等物质的量的 和 含有的共用电子对数相等
D. 氯气与 溶液反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
9. 将与过量的液氨反应可生成化合物。将该化合物在无氧条件下高温灼烧,可得到氮化硅固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是( )
A. 、的晶体类型相同 B. 晶体是立体网状结构
C. 共价晶体的熔点比的低 D. 晶体在熔化过程中化学键断裂
10. 的一种配合物的分子结构如图所示,该配合物分子内不含有( )
A. 共价键 B. 离子键 C. 配位键 D. 氢键
11. 化合物是一种新型锅炉水除氧剂,其结构式为,下列说法中正确的是
A. 分子中只有极性键没有非极性键 B. 分子中的共用电子对数为
C. 分子中所含的键数目为 D. 是共价化合物
12. 氮化硼晶体有多种结构。六方氮化硼是通常存在的稳定相,与石墨相似,具有层状结构可作高温润滑剂。立方氮化硼是超硬材料,有优异的耐磨性,结构与金刚石相似。它们的晶体结构如图所示。下列关于这两种晶体的说法正确的是( )
A. 六方氮化硼与石墨一样可以导电
B. 立方氮化硼含有键和键,所以硬度大
C. 两种晶体均为分子晶体
D. 六方氮化硼晶体层内,与一个硼原子距离相等且最近的氮原子构成的空间结构为平面三角形
13. 下列有关物质结构与性质的说法中合理的是( )
A. 与结构相似,含有的键与键个数比均为
B. 根据理论可知、、分子内键角依次减小
C. 铜的电负性为,氯的电负性为,氯化铜为离子化合物,溶于水能完全电离
D. 比更稳定是因为分子间存在氢键
14. 下列模型分别表示、、的结构,下列说法正确的是
A. 分子中含有键 B. 是由非极性键构成的分子
C. 分子中有键和键 D. 分子中不含非极性键
15. 下列模型分别表示、、的结构,其中说法正确的是
A. 分子中含有键 B. 是由非极性键构成的分子
C. 分子中有键和键 D. 分子中不含非极性键
二、实验题
16. 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质如维生素等。每黑木耳含铁量高达。
Ⅰ为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
步骤得到滤液的操作是_____。步骤检验所用试剂是_____溶液。
步骤中使用的物质中含有的化学键类型有_____。
下列有关上述实验得出的结论是_____填字母。
黑木耳中一定含和
滤液中一定含和
白色沉淀中一定含
Ⅱ为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
可选做试剂的物质是_____填字母。
步骤用酸性溶液滴定滤液的终点现象是_____,其中发生反应的离子方程式为_____。
若乙同学试剂选择正确、实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是_____。
17. 钴的化合物种类较多,其中三氯化六氨合钴,在工业上用途广泛。实验室以活性炭作为催化剂,以作氧化剂氧化的方法制备三氯化六氨合钴。
已知:钴单质在以上易被氧气氧化,易潮解。不易被氧化,具有强氧化性;具有较强的还原性,性质稳定。
回答下列问题:
I.的制备。
装置中盛放浓盐酸的仪器名称是________。
按照气体流向从左到右连接仪器的顺序为________________________。
装置的烧瓶中发生反应的离子方程式为________。
实验时,要先加入浓盐酸,使装置中开始生成氯气,待________填现象时,再加热装置,目的是________。
三氯化六氨合钴的制备。
先向三颈烧瓶中加入活性炭、和溶液,然后滴加稍过量的浓氨水;
冷水浴冷却至以下,缓慢滴加溶液并不断搅拌;
转移至水浴中,恒温加热同时缓慢搅拌;
冷却结晶,过滤洗涤可得三氯化六氨合钴粗产品。
三氯化六氨合钴中的中心原子和配位原子分别为________;装置中制备三氯化六氨合钴的总反应化学方程式为________。
纯度测定。
称取粗产品与氢氧化钠在空气中混合煅烧得氧化钴将氧化钴用稀硫酸溶解配成溶液________按顺序填序号,纯度为________写出表达式。
向锥形瓶中加入稍过量的溶液被还原后的产物为,充分反应
平行滴定三次,消耗标准溶液的体积平均值为
取待测液于锥形瓶中
用淀粉溶液作指示剂,用标准溶液滴定产物为
三、简答题
18. 材料是人类文明进步的阶梯,第Ⅲ族、Ⅳ族、族及Ⅷ族元素是组成特殊材料的重要元素。回答下列问题:
基态核外电子排布图为________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
经测定发现,固体由和两种离子组成,该固体中原子杂化类型有_________。
铁氰化钾溶液可以检验铁陨石中铁元素价态。含键数目为____。铁氰化钾中存在的作用力有___填字母。
离子键 极性键 非极性键 配位键 氢键
分子在独立存在时键角为。如图是离子的部分结构以及键角的测量值。解释形成如图配合物后键角变大的原因:_________。
某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为,每个阴离子是由个硼原子和个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,占据阴离子组成的所有正四面体中心,该化合物的化学式为_____用最简整数比表示。假设晶胞边长为,代表阿伏伽德罗常数的值,则该晶胞的密度为_____。
19. 将资源化一直是科技界研究的热点内容之一,一种利用新型催化剂络合物与复合光催化剂将还原为的原理如图所示。
回答下列问题:
已知:基态的价层电子排布式为,则基态原子能层上电子运动状态有_________种;络合物中第一电离能最大的元素是_________,基态磷原子的价层电子排布图为___________________,、之间的化学键类型是_________填字母。
A.键 离子键 配位键 非极性键
分子中键与键数目之比为_________,过程中,碳原子的杂化类型变化是_________。
、、的相关信息如表所示:
相对分子质量
沸点
导致、沸点相差较大的原因是__________________________________________,导致和沸点差异的原因是______________________________________。
氮化碳晶体的硬度超过金刚石,是首屈一指的超硬新材料,其晶体类型是______。碳元素能形成多种单质,其中金刚石的晶胞结构如图所示,则该晶体的空间利用率为_______用含的代数式表示。
答案和解析
1.【答案】
【解析】
【分析】
本题考查了键、键,明确键和键的形成是解本题关键,注意并不是所有的物质中都含有化学键,单原子分子不含化学键,为易错点.
【解答】
A.键是电子“头对头”重叠形成的,键是电子“肩并肩”重叠形成的,所以键比键重叠程度大,故A正确;
B.键是头碰头形成的,两个原子之间能形成一个,原子轨道杂化的对称性很高,一个方向上只可能有一个杂化轨道,所以最多有一个键,故B正确;
C.气体单质分子中,可能只有键,如;也可能既有键又有键,如;但也可能没有化学键,如稀有气体,故C错误;
D.氮气分子的结构式为,所以一个氮气分子中含有一个键,个键,故D正确;
故选C。
2.【答案】
【解析】
【分析】
本题考查化学键、键角比较、电负性应用、氢键等,掌握基础是关键,试题难度不大。
【解答】
A.与结构相似,含有的键与 键个数比均为,故A正确;
B.由于孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,所以根据理论可知、、分子内键角依次增大,故B错误;
C.铜的电负性为,氯的电负性为,二者电负性差值小于,所以氯化铜为共价化合物,但溶于水能完全电离,故C错误;
D.比更稳定是因为键键能大,故D错误。
故选A。
3.【答案】
【解析】
【分析】
本题考查了阿伏加德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度一般。
【解答】
A.单质的物质的量为,而单质中含键,单质中含键即个,故A正确
B.依据计算物质的量,氢键是分子间作用力,每个水分子形成两个氢键,冰中含有的氢键数目为,故B正确;
C.中配位键属于键,中也有个键,离子中含有的键为,即,故C错误;
D.依据计算物质的量,形成的键为,则形成 键个数为,故D正确,
故选C。
4.【答案】
【解析】略
5.【答案】
【解析】
【分析】
本题考查了二氧化硅的结构单元,难度不大,注意教材中常见晶体的结构的掌握。
【解答】
A.是由极性键构成的共价晶体,不存在分子,故A错误;
B.晶体中每个原子与个原子成键,所以常温常压下中含有的共价键数目为,故B错误;
C.与化学性质相似,但是分子晶体,是原子晶体,故两者的物理性质不同,故C错误;
D.最小的环上,有个原子和个原子组成的元环,故D正确。
故选D。
6.【答案】
【解析】
【分析】
本题考查有机物的结构和化学键、杂化类型的判断,为高频考点,侧重考查学生的分析能力,注意把握原子的成键特点,题目难度不大。
【解答】
A.同周期主族元素从左到右,第一电离能呈增大趋势,原子最外层为半充满结构,第一电离能大于同周期相邻元素,则、、的第一电离能由大到小的顺序为,故A正确;
B.碳碳双键的键能大于碳碳单键,故B正确;
C.含有键的原子形成个键且还含有一对孤对电子,原子为杂化,故C错误;
D.有机物分子含有个、个、个、个、个、个、个、个键,其中双键含有个键、个键,则该分子中键与键数目之比为:,故D正确。
故选:。
7.【答案】
【解析】
【分析】
本题考查了共价键中的键和键以及键能、键长等知识,难度一般。
【解答】
A.丙烯的结构简式为,有个键、个键,个键,单键都是键,双键中有个键和个键,共个键和个键 ,故A正确;
B.碳碳双键的键能不是碳碳单键键能的倍,故B错误;
C.键比键键长更短,键能更大,故CH比更稳定,故C正确;
D.分子中的原子有对孤电子对,对成键电子对有排斥作用,因此分子的键角小于 ,故D正确。
8.【答案】
【解析】
【分析】
本题考查了化学键类型有关知识,注意离子键、极性键的概念,注意不能根据是否含有金属元素判断离子化合物,为易错点,题目难度不大。
【解答】
A.含离子键和非极性键,中含离子键和极性键,则化学键类型不完全相同,故A错误;
B.分子中的原子和分子中的原子最外层都不能达到电子稳定结构,故B错误;
C.中含有碳氮三键,带有个单位负电荷,其电子式为:,含有的共用电子对为,氮气分子中存在氮氮三键,的电子式为:,含有的共用电子对为,等物质的量的和含有的共用电子对数相等,故C正确;
D.氯气与反应生成、、,产物中不存在非极性键,则有离子键、极性键和非极性键的断裂,但没有非极性键的形成,故D错误;
故选:。
9.【答案】
【解析】
【分析】
本题考查有关物质的结构及性质,难度不大,掌握相关物质的结构是解答的关键。
【解答】
A.四氯化硅为分子晶体,氮化硅为共价晶体,故A错误;
B.氮化硅固体,氮化硅是一种新型耐高温、耐磨材料,故结构为立体网状结构,故B正确;
C.因这两种晶体均为共价晶体,决定熔点的是共价键强弱,因碳原子半径小于硅原子,故前者共价键短,则熔点高,故C错误;
D.四氯化硅晶体是分子晶体,熔化时破坏分子间作用力,故D错误。
10.【答案】
【解析】
【分析】
本题考查化学键知识,注意化学键类型和组成元素的判断,把握分子的构型的判断,注意氢键和配位键的判断,难度不大。
【解答】
分子中、、、等都为共价键,为氢键,为配位键,为共价化合物,不含离子键。
故选:。
11.【答案】
【解析】【试题解析】
略
12.【答案】
【解析】六方氮化硼晶体层内一个硼原子与相邻氮原子形成个共价单键,且原子中不存在孤对电子,该物质的层状结构中不存在自由移动的电子,所以不导电,故A项错误;
立方氮化硼中含有键,不存在键,故B项错误;
立方氮化硼为共价晶体,故C项错误;
由六方氮化硼的晶体结构可知,在一层内,与一个硼原子距离相等且最近的氮原子构成的空间结构为平面三角形,故D项正确。
13.【答案】
【解析】
【分析】
本题考查化学键、键角比较、电负性应用、氢键等,掌握基础是关键,试题难度不大。
【解答】
A.与结构相似,含有的键与键个数比均为,故A正确;
B.由于孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,所以根据理论可知、、分子内键角依次增大,故B错误;
C.铜的电负性为,氯的电负性为,二者电负性差值小于,所以氯化铜为共价化合物,但溶于水能完全电离,故C错误;
D.比更稳定是因为键键能大,故D错误。
故选A。
14.【答案】
【解析】
【分析】
本题考查物质中的化学键,难度不大。
【解答】
A.中含有键,因此分子中所含键为,项错误;
B.是由极性键构成的分子,项错误;
C.的结构式为,单键为键,三键中含有个键和个键,所以分子中含有键和键,项正确;
D.分子中所含的碳碳三键是非极性键,项错误。
15.【答案】
【解析】
【分析】
本题考查共价键的分类及判断,意在考查学生的辨析能力,解题的关键是掌握共价键的类型判断。
【解答】
A.中含有键,因此分子中所含键为,项错误;
B.根据的结构可知,中所含化学键为键,为极性键,项错误;
C.的结构式为,单键为键,双键键中含有个键和个键,所以分子中含有键和键,项正确;
D.分子中所含的碳碳三键是非极性键,项错误。
16.【答案】过滤;
离子键、共价键、配位键
溶液变成浅红色,且半分钟不变色
黑木耳中还含有其他还原性物质或黑木耳中还含有维生素
【解析】
【分析】
本题考查物质含量测定实验,难度中等,熟练知识元素化合物知识,明确发生的反应,理解测定原理,侧重分析与实验能力的考查。
【解答】
不溶性固体和液体的分离可采用过滤的方法,因此步骤得到滤液的操作是过滤。步骤检验所用试剂是溶液。
中含有的化学键类型有离子键钾离子与铁氰酸根离子之间、共价键碳与氮之间、配位键铁离子与氰酸根之间;
根据步骤中产生蓝色沉淀可知滤液中含有亚铁离子,则白色沉淀中含有;根据步骤可知滤液中含有铁离子,由于在灼烧过程中亚铁离子可能被氧化为铁离子,所以黑木耳中不一定含有铁离子,所以错误,、正确。
滤液中含有铁离子,需要利用还原剂将其转化为亚铁离子,且不能再引入铁元素,也不能干扰亚铁离子与高锰酸钾的反应。金属钠在溶液中反应生成,与铁离子反应生成沉淀,得不到亚铁离子,错误;金属锌与铁离子、亚铁离子和高锰酸钾均反应,错误;金属铁和铁离子反应生成亚铁离子,但引入了铁元素,错误;金属铜与铁离子反应生成亚铁离子和铜离子,且不会影响亚铁离子与高锰酸钾的反应,正确。
酸性高锰酸钾溶液与亚铁离子反应生成铁离子、锰离子和水,则步骤中观察到的实验现象是溶液变成浅红色,且半分钟不变色,反应的离子方程式是。
由于黑木耳中含有其他还原性物质,如维生素,导致消耗高锰酸钾溶液的体积增加,所以测得含铁量远大于实际的含量。
17.【答案】恒压滴液漏斗;
装置内充满黄绿色气体;排尽装置内空气,防止加热时钴被氧气氧化
、;
、、、
【解析】
【分析】
本题考查实验室制备三氯化六氨合钴,涉及仪器识别、对操作的分析评价、纯度计算等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等。
【解答】
观察 装置,可知盛放浓盐酸的仪器为恒压滴液漏斗;
装置制取氯气,经装置除去并干燥后通入中,连接顺序为 。
中与浓盐酸反应制备氯气,反应的离子方程式为。
实验时,要先加入浓盐酸,使装置中开始生成氯气,待装置内充满黄绿色气体时,再加热装置,由于钴加热时易被氧气氧化,故要先通氯气至装置内充满黄绿色气体,以排尽装置内的空气。
三氯化六氨合钴中的中心原子和配位原子分别为、,用溶液在浓氨水稍过量的条件下将氧化生成三氯化六氨合钴Ⅲ,总反应的化学方程式为。
测定产品纯度的步骤为取 配制好的溶液于锥形瓶中,加入过量的溶液,使 均被还原成,加入淀粉溶液作指示剂,用 标准溶液滴定,发生反应,平行滴定三次,消耗 标准溶液的体积平均值为 。根据关系式∽∽,可得 粗产品中,三氯化六氨合钴Ⅲ的物质的量为,则纯度为。
18.【答案】 ; ;
;
杂化、杂化;
;;
分子中原子的孤电子对进入的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱;
面心立方最密堆积 ; ; 。
【解析】
【分析】
本题是对物质结构与性质的考查,涉及核外电子排布与运动、电离能、杂化方式、晶体类型与性质、价层电子对互斥理论、晶胞结构与计算等,题目侧重考查学生分析计算能力,需要学生晶胞扎实的基础与灵活运用的能力,掌握均摊法进行晶胞有关计算。
【解答】
基态原子的核外电子排布图为 ;与硼处于同周期且相邻的两种元素为、,同周期随原子序数的增大第一电离能呈增大趋势,原子的轨道为全充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:,
故答案为:;;
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则该元素原子能级容纳个电子,原子先填充能级,再填充能级,故该元素原子价电子排布式为:,
故答案为:;
中原子杂化轨道数目,原子采取杂化,而中原子杂化轨道数目,原子采取杂化,
故答案为:杂化、杂化;
每个含有一个键和两个键,个与之间形成个配位键键,则含键数目为;铁氰化钾中,钾离子与之间是离子键,中与之间是极性共价键,与之间是配位键,
故答案为:;;
分子中原子的孤电子对进入的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱,故形成如图配合物后键角变大,
故答案为:分子中原子的孤电子对进入的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱;
由图可知,阴离子处于晶胞的顶点与面心,属于面心立方最密堆积;顶点阴离子与面心阴离子形成正四面体结构,晶胞中有个正四面体,故晶胞中有个,晶胞中离子团数目,故L、、原子数目之比为::::,故化学式为晶胞相当于含有个““,晶胞质量,故晶体密度,
故答案为:面心立方最密堆积;;。
19.【答案】;;;;
;;
分子间能形成氢键;相对分子质量较大,分子间作用力较大;
原子晶体;
【解析】
【分析】
本题考查物质结构与性质的知识,核外电子的运动,第一电离能,价层电子排布图,化学键,杂化轨道,分子间作用力,晶胞相关计算,属于物质结构常规考查,强调学生的基础,题目难度一般。
【解答】
原子能层上有个电子,每一个电子的运动状态都不同,所以其能层上电子运动状态有种;络合物中第一电离能最大的元素是元素,因为氮元素的能级处于半充满结构,难失去电子,磷是号元素,价层为第三层,有个电子,其电子排布图为,、之间的化学键类型是配位键,故答案为:;;;;
分子中只有双键中有一个键,其余的都是键,所以键与键数目之比为,中的原子采用的是杂化,中的原子采用的是杂化,过程中,碳原子的杂化类型变化是;
故答案为:;;
、、的相关信息如表所示:
相对分子质量
沸点
、的分子量相差不大,导致、沸点相差较大的原因是中能够形成氢键,导致和沸点差异的原因是的相对分子质量较大,相对分子量越大分子间作用力越大,熔沸点越高,
故答案为:分子间能形成氢键;相对分子质量较大,分子间作用力较大;
氮化碳晶体的硬度超过金刚石,符合原子晶体的特征,所以其晶体类型是原子晶体。假设碳原子半径为,晶胞边长为,依据晶胞图示可知,晶胞中含有的碳原子数为:,其体积为:,晶胞边长,晶胞的体积为:,则该晶体的空间利用率为。
故答案为:原子晶体;.
第1页,共1页
一、单选题
1. 下列说法不正确的是 ( )
A. 键比键重叠程度大,形成的共价键强 B. 两个原子之间形成共价键时,最多有一个键
C. 气体单质中,一定有键,可能有键 D. 分子中有一个键,个键
2. 下列有关物质结构与性质的说法中合理的是( )
A. 与结构相似,含有的键与键个数比均为
B. 根据理论可知、、分子内键角依次减小
C. 铜的电负性为,氯的电负性为,氯化铜为离子化合物,溶于水能完全电离
D. 比更稳定是因为分子间存在氢键
3. 下列说法不正确的是为阿伏加德罗常数( )
A. 如图中含有键的个数为
B. 冰中含有氢键数目最多为
C. 离子中含有的 键为
D. 结构如图,中含有的键个数为
4. 离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。乙基甲基咪唑四氟硼酸盐离子液体结构如图所示,其环状结构中存在大键。下列相关叙述错误的是( )
A. 阳离子中至少原子共平面 B. 阴离子呈正四面体形
C. 该离子液体存在共价键、配位键、离子键 D. 阳离子中键数目是键数目的倍
5. 下列关于晶体说法正确的是( )
A. 是由极性键构成的非极性分子
B. 若表示阿伏伽德罗常数,常温常压下中含有的共价键数目为
C. 碳和硅同主族,因此和化学性质相似,物理性质也相似
D. 晶体结构中的最小环为个和个组成的元环
6. 法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法错误的是 ( )
A. 该分子中、、的第一电离能由大到小的顺序为
B. 该分子中键的键能大于键的键能
C. 该分子中所有原子都为杂化
D. 该分子中键与键数目之比为
7. 下列有关共价键和键参数的说法不正确的是( )
A. 一个丙烯分子中含有个键和个键
B. 碳碳双键的键能是碳碳单键键能的倍
C. 键比键键长更短,故CH比更稳定
D. 由于孤电子对的存在,分子的键角小于
8. 下列说法中正确的是( )
A. 、中所含化学键类型完全相同
B. 和分子中所有原子的最外层都达到了电子稳定结构
C. 等物质的量的 和 含有的共用电子对数相等
D. 氯气与 溶液反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
9. 将与过量的液氨反应可生成化合物。将该化合物在无氧条件下高温灼烧,可得到氮化硅固体,氮化硅是一种新型耐高温、耐磨材料,在工业上有广泛的应用。下列推断可能正确的是( )
A. 、的晶体类型相同 B. 晶体是立体网状结构
C. 共价晶体的熔点比的低 D. 晶体在熔化过程中化学键断裂
10. 的一种配合物的分子结构如图所示,该配合物分子内不含有( )
A. 共价键 B. 离子键 C. 配位键 D. 氢键
11. 化合物是一种新型锅炉水除氧剂,其结构式为,下列说法中正确的是
A. 分子中只有极性键没有非极性键 B. 分子中的共用电子对数为
C. 分子中所含的键数目为 D. 是共价化合物
12. 氮化硼晶体有多种结构。六方氮化硼是通常存在的稳定相,与石墨相似,具有层状结构可作高温润滑剂。立方氮化硼是超硬材料,有优异的耐磨性,结构与金刚石相似。它们的晶体结构如图所示。下列关于这两种晶体的说法正确的是( )
A. 六方氮化硼与石墨一样可以导电
B. 立方氮化硼含有键和键,所以硬度大
C. 两种晶体均为分子晶体
D. 六方氮化硼晶体层内,与一个硼原子距离相等且最近的氮原子构成的空间结构为平面三角形
13. 下列有关物质结构与性质的说法中合理的是( )
A. 与结构相似,含有的键与键个数比均为
B. 根据理论可知、、分子内键角依次减小
C. 铜的电负性为,氯的电负性为,氯化铜为离子化合物,溶于水能完全电离
D. 比更稳定是因为分子间存在氢键
14. 下列模型分别表示、、的结构,下列说法正确的是
A. 分子中含有键 B. 是由非极性键构成的分子
C. 分子中有键和键 D. 分子中不含非极性键
15. 下列模型分别表示、、的结构,其中说法正确的是
A. 分子中含有键 B. 是由非极性键构成的分子
C. 分子中有键和键 D. 分子中不含非极性键
二、实验题
16. 某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质如维生素等。每黑木耳含铁量高达。
Ⅰ为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
步骤得到滤液的操作是_____。步骤检验所用试剂是_____溶液。
步骤中使用的物质中含有的化学键类型有_____。
下列有关上述实验得出的结论是_____填字母。
黑木耳中一定含和
滤液中一定含和
白色沉淀中一定含
Ⅱ为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
可选做试剂的物质是_____填字母。
步骤用酸性溶液滴定滤液的终点现象是_____,其中发生反应的离子方程式为_____。
若乙同学试剂选择正确、实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是_____。
17. 钴的化合物种类较多,其中三氯化六氨合钴,在工业上用途广泛。实验室以活性炭作为催化剂,以作氧化剂氧化的方法制备三氯化六氨合钴。
已知:钴单质在以上易被氧气氧化,易潮解。不易被氧化,具有强氧化性;具有较强的还原性,性质稳定。
回答下列问题:
I.的制备。
装置中盛放浓盐酸的仪器名称是________。
按照气体流向从左到右连接仪器的顺序为________________________。
装置的烧瓶中发生反应的离子方程式为________。
实验时,要先加入浓盐酸,使装置中开始生成氯气,待________填现象时,再加热装置,目的是________。
三氯化六氨合钴的制备。
先向三颈烧瓶中加入活性炭、和溶液,然后滴加稍过量的浓氨水;
冷水浴冷却至以下,缓慢滴加溶液并不断搅拌;
转移至水浴中,恒温加热同时缓慢搅拌;
冷却结晶,过滤洗涤可得三氯化六氨合钴粗产品。
三氯化六氨合钴中的中心原子和配位原子分别为________;装置中制备三氯化六氨合钴的总反应化学方程式为________。
纯度测定。
称取粗产品与氢氧化钠在空气中混合煅烧得氧化钴将氧化钴用稀硫酸溶解配成溶液________按顺序填序号,纯度为________写出表达式。
向锥形瓶中加入稍过量的溶液被还原后的产物为,充分反应
平行滴定三次,消耗标准溶液的体积平均值为
取待测液于锥形瓶中
用淀粉溶液作指示剂,用标准溶液滴定产物为
三、简答题
18. 材料是人类文明进步的阶梯,第Ⅲ族、Ⅳ族、族及Ⅷ族元素是组成特殊材料的重要元素。回答下列问题:
基态核外电子排布图为________。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则其基态原子的价层电子排布式为_____。
经测定发现,固体由和两种离子组成,该固体中原子杂化类型有_________。
铁氰化钾溶液可以检验铁陨石中铁元素价态。含键数目为____。铁氰化钾中存在的作用力有___填字母。
离子键 极性键 非极性键 配位键 氢键
分子在独立存在时键角为。如图是离子的部分结构以及键角的测量值。解释形成如图配合物后键角变大的原因:_________。
某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为,每个阴离子是由个硼原子和个氢原子所构成的原子团。阴离子在晶胞中位置如图所示,其堆积方式为_____,占据阴离子组成的所有正四面体中心,该化合物的化学式为_____用最简整数比表示。假设晶胞边长为,代表阿伏伽德罗常数的值,则该晶胞的密度为_____。
19. 将资源化一直是科技界研究的热点内容之一,一种利用新型催化剂络合物与复合光催化剂将还原为的原理如图所示。
回答下列问题:
已知:基态的价层电子排布式为,则基态原子能层上电子运动状态有_________种;络合物中第一电离能最大的元素是_________,基态磷原子的价层电子排布图为___________________,、之间的化学键类型是_________填字母。
A.键 离子键 配位键 非极性键
分子中键与键数目之比为_________,过程中,碳原子的杂化类型变化是_________。
、、的相关信息如表所示:
相对分子质量
沸点
导致、沸点相差较大的原因是__________________________________________,导致和沸点差异的原因是______________________________________。
氮化碳晶体的硬度超过金刚石,是首屈一指的超硬新材料,其晶体类型是______。碳元素能形成多种单质,其中金刚石的晶胞结构如图所示,则该晶体的空间利用率为_______用含的代数式表示。
答案和解析
1.【答案】
【解析】
【分析】
本题考查了键、键,明确键和键的形成是解本题关键,注意并不是所有的物质中都含有化学键,单原子分子不含化学键,为易错点.
【解答】
A.键是电子“头对头”重叠形成的,键是电子“肩并肩”重叠形成的,所以键比键重叠程度大,故A正确;
B.键是头碰头形成的,两个原子之间能形成一个,原子轨道杂化的对称性很高,一个方向上只可能有一个杂化轨道,所以最多有一个键,故B正确;
C.气体单质分子中,可能只有键,如;也可能既有键又有键,如;但也可能没有化学键,如稀有气体,故C错误;
D.氮气分子的结构式为,所以一个氮气分子中含有一个键,个键,故D正确;
故选C。
2.【答案】
【解析】
【分析】
本题考查化学键、键角比较、电负性应用、氢键等,掌握基础是关键,试题难度不大。
【解答】
A.与结构相似,含有的键与 键个数比均为,故A正确;
B.由于孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,所以根据理论可知、、分子内键角依次增大,故B错误;
C.铜的电负性为,氯的电负性为,二者电负性差值小于,所以氯化铜为共价化合物,但溶于水能完全电离,故C错误;
D.比更稳定是因为键键能大,故D错误。
故选A。
3.【答案】
【解析】
【分析】
本题考查了阿伏加德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度一般。
【解答】
A.单质的物质的量为,而单质中含键,单质中含键即个,故A正确
B.依据计算物质的量,氢键是分子间作用力,每个水分子形成两个氢键,冰中含有的氢键数目为,故B正确;
C.中配位键属于键,中也有个键,离子中含有的键为,即,故C错误;
D.依据计算物质的量,形成的键为,则形成 键个数为,故D正确,
故选C。
4.【答案】
【解析】略
5.【答案】
【解析】
【分析】
本题考查了二氧化硅的结构单元,难度不大,注意教材中常见晶体的结构的掌握。
【解答】
A.是由极性键构成的共价晶体,不存在分子,故A错误;
B.晶体中每个原子与个原子成键,所以常温常压下中含有的共价键数目为,故B错误;
C.与化学性质相似,但是分子晶体,是原子晶体,故两者的物理性质不同,故C错误;
D.最小的环上,有个原子和个原子组成的元环,故D正确。
故选D。
6.【答案】
【解析】
【分析】
本题考查有机物的结构和化学键、杂化类型的判断,为高频考点,侧重考查学生的分析能力,注意把握原子的成键特点,题目难度不大。
【解答】
A.同周期主族元素从左到右,第一电离能呈增大趋势,原子最外层为半充满结构,第一电离能大于同周期相邻元素,则、、的第一电离能由大到小的顺序为,故A正确;
B.碳碳双键的键能大于碳碳单键,故B正确;
C.含有键的原子形成个键且还含有一对孤对电子,原子为杂化,故C错误;
D.有机物分子含有个、个、个、个、个、个、个、个键,其中双键含有个键、个键,则该分子中键与键数目之比为:,故D正确。
故选:。
7.【答案】
【解析】
【分析】
本题考查了共价键中的键和键以及键能、键长等知识,难度一般。
【解答】
A.丙烯的结构简式为,有个键、个键,个键,单键都是键,双键中有个键和个键,共个键和个键 ,故A正确;
B.碳碳双键的键能不是碳碳单键键能的倍,故B错误;
C.键比键键长更短,键能更大,故CH比更稳定,故C正确;
D.分子中的原子有对孤电子对,对成键电子对有排斥作用,因此分子的键角小于 ,故D正确。
8.【答案】
【解析】
【分析】
本题考查了化学键类型有关知识,注意离子键、极性键的概念,注意不能根据是否含有金属元素判断离子化合物,为易错点,题目难度不大。
【解答】
A.含离子键和非极性键,中含离子键和极性键,则化学键类型不完全相同,故A错误;
B.分子中的原子和分子中的原子最外层都不能达到电子稳定结构,故B错误;
C.中含有碳氮三键,带有个单位负电荷,其电子式为:,含有的共用电子对为,氮气分子中存在氮氮三键,的电子式为:,含有的共用电子对为,等物质的量的和含有的共用电子对数相等,故C正确;
D.氯气与反应生成、、,产物中不存在非极性键,则有离子键、极性键和非极性键的断裂,但没有非极性键的形成,故D错误;
故选:。
9.【答案】
【解析】
【分析】
本题考查有关物质的结构及性质,难度不大,掌握相关物质的结构是解答的关键。
【解答】
A.四氯化硅为分子晶体,氮化硅为共价晶体,故A错误;
B.氮化硅固体,氮化硅是一种新型耐高温、耐磨材料,故结构为立体网状结构,故B正确;
C.因这两种晶体均为共价晶体,决定熔点的是共价键强弱,因碳原子半径小于硅原子,故前者共价键短,则熔点高,故C错误;
D.四氯化硅晶体是分子晶体,熔化时破坏分子间作用力,故D错误。
10.【答案】
【解析】
【分析】
本题考查化学键知识,注意化学键类型和组成元素的判断,把握分子的构型的判断,注意氢键和配位键的判断,难度不大。
【解答】
分子中、、、等都为共价键,为氢键,为配位键,为共价化合物,不含离子键。
故选:。
11.【答案】
【解析】【试题解析】
略
12.【答案】
【解析】六方氮化硼晶体层内一个硼原子与相邻氮原子形成个共价单键,且原子中不存在孤对电子,该物质的层状结构中不存在自由移动的电子,所以不导电,故A项错误;
立方氮化硼中含有键,不存在键,故B项错误;
立方氮化硼为共价晶体,故C项错误;
由六方氮化硼的晶体结构可知,在一层内,与一个硼原子距离相等且最近的氮原子构成的空间结构为平面三角形,故D项正确。
13.【答案】
【解析】
【分析】
本题考查化学键、键角比较、电负性应用、氢键等,掌握基础是关键,试题难度不大。
【解答】
A.与结构相似,含有的键与键个数比均为,故A正确;
B.由于孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,所以根据理论可知、、分子内键角依次增大,故B错误;
C.铜的电负性为,氯的电负性为,二者电负性差值小于,所以氯化铜为共价化合物,但溶于水能完全电离,故C错误;
D.比更稳定是因为键键能大,故D错误。
故选A。
14.【答案】
【解析】
【分析】
本题考查物质中的化学键,难度不大。
【解答】
A.中含有键,因此分子中所含键为,项错误;
B.是由极性键构成的分子,项错误;
C.的结构式为,单键为键,三键中含有个键和个键,所以分子中含有键和键,项正确;
D.分子中所含的碳碳三键是非极性键,项错误。
15.【答案】
【解析】
【分析】
本题考查共价键的分类及判断,意在考查学生的辨析能力,解题的关键是掌握共价键的类型判断。
【解答】
A.中含有键,因此分子中所含键为,项错误;
B.根据的结构可知,中所含化学键为键,为极性键,项错误;
C.的结构式为,单键为键,双键键中含有个键和个键,所以分子中含有键和键,项正确;
D.分子中所含的碳碳三键是非极性键,项错误。
16.【答案】过滤;
离子键、共价键、配位键
溶液变成浅红色,且半分钟不变色
黑木耳中还含有其他还原性物质或黑木耳中还含有维生素
【解析】
【分析】
本题考查物质含量测定实验,难度中等,熟练知识元素化合物知识,明确发生的反应,理解测定原理,侧重分析与实验能力的考查。
【解答】
不溶性固体和液体的分离可采用过滤的方法,因此步骤得到滤液的操作是过滤。步骤检验所用试剂是溶液。
中含有的化学键类型有离子键钾离子与铁氰酸根离子之间、共价键碳与氮之间、配位键铁离子与氰酸根之间;
根据步骤中产生蓝色沉淀可知滤液中含有亚铁离子,则白色沉淀中含有;根据步骤可知滤液中含有铁离子,由于在灼烧过程中亚铁离子可能被氧化为铁离子,所以黑木耳中不一定含有铁离子,所以错误,、正确。
滤液中含有铁离子,需要利用还原剂将其转化为亚铁离子,且不能再引入铁元素,也不能干扰亚铁离子与高锰酸钾的反应。金属钠在溶液中反应生成,与铁离子反应生成沉淀,得不到亚铁离子,错误;金属锌与铁离子、亚铁离子和高锰酸钾均反应,错误;金属铁和铁离子反应生成亚铁离子,但引入了铁元素,错误;金属铜与铁离子反应生成亚铁离子和铜离子,且不会影响亚铁离子与高锰酸钾的反应,正确。
酸性高锰酸钾溶液与亚铁离子反应生成铁离子、锰离子和水,则步骤中观察到的实验现象是溶液变成浅红色,且半分钟不变色,反应的离子方程式是。
由于黑木耳中含有其他还原性物质,如维生素,导致消耗高锰酸钾溶液的体积增加,所以测得含铁量远大于实际的含量。
17.【答案】恒压滴液漏斗;
装置内充满黄绿色气体;排尽装置内空气,防止加热时钴被氧气氧化
、;
、、、
【解析】
【分析】
本题考查实验室制备三氯化六氨合钴,涉及仪器识别、对操作的分析评价、纯度计算等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等。
【解答】
观察 装置,可知盛放浓盐酸的仪器为恒压滴液漏斗;
装置制取氯气,经装置除去并干燥后通入中,连接顺序为 。
中与浓盐酸反应制备氯气,反应的离子方程式为。
实验时,要先加入浓盐酸,使装置中开始生成氯气,待装置内充满黄绿色气体时,再加热装置,由于钴加热时易被氧气氧化,故要先通氯气至装置内充满黄绿色气体,以排尽装置内的空气。
三氯化六氨合钴中的中心原子和配位原子分别为、,用溶液在浓氨水稍过量的条件下将氧化生成三氯化六氨合钴Ⅲ,总反应的化学方程式为。
测定产品纯度的步骤为取 配制好的溶液于锥形瓶中,加入过量的溶液,使 均被还原成,加入淀粉溶液作指示剂,用 标准溶液滴定,发生反应,平行滴定三次,消耗 标准溶液的体积平均值为 。根据关系式∽∽,可得 粗产品中,三氯化六氨合钴Ⅲ的物质的量为,则纯度为。
18.【答案】 ; ;
;
杂化、杂化;
;;
分子中原子的孤电子对进入的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱;
面心立方最密堆积 ; ; 。
【解析】
【分析】
本题是对物质结构与性质的考查,涉及核外电子排布与运动、电离能、杂化方式、晶体类型与性质、价层电子对互斥理论、晶胞结构与计算等,题目侧重考查学生分析计算能力,需要学生晶胞扎实的基础与灵活运用的能力,掌握均摊法进行晶胞有关计算。
【解答】
基态原子的核外电子排布图为 ;与硼处于同周期且相邻的两种元素为、,同周期随原子序数的增大第一电离能呈增大趋势,原子的轨道为全充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:,
故答案为:;;
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态氮原子的未成对电子数相同,则该元素原子能级容纳个电子,原子先填充能级,再填充能级,故该元素原子价电子排布式为:,
故答案为:;
中原子杂化轨道数目,原子采取杂化,而中原子杂化轨道数目,原子采取杂化,
故答案为:杂化、杂化;
每个含有一个键和两个键,个与之间形成个配位键键,则含键数目为;铁氰化钾中,钾离子与之间是离子键,中与之间是极性共价键,与之间是配位键,
故答案为:;;
分子中原子的孤电子对进入的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱,故形成如图配合物后键角变大,
故答案为:分子中原子的孤电子对进入的空轨道形成配位键后,原孤电子对与成键电子对间的排斥作用变为成键电子对间的排斥,排斥作用减弱;
由图可知,阴离子处于晶胞的顶点与面心,属于面心立方最密堆积;顶点阴离子与面心阴离子形成正四面体结构,晶胞中有个正四面体,故晶胞中有个,晶胞中离子团数目,故L、、原子数目之比为::::,故化学式为晶胞相当于含有个““,晶胞质量,故晶体密度,
故答案为:面心立方最密堆积;;。
19.【答案】;;;;
;;
分子间能形成氢键;相对分子质量较大,分子间作用力较大;
原子晶体;
【解析】
【分析】
本题考查物质结构与性质的知识,核外电子的运动,第一电离能,价层电子排布图,化学键,杂化轨道,分子间作用力,晶胞相关计算,属于物质结构常规考查,强调学生的基础,题目难度一般。
【解答】
原子能层上有个电子,每一个电子的运动状态都不同,所以其能层上电子运动状态有种;络合物中第一电离能最大的元素是元素,因为氮元素的能级处于半充满结构,难失去电子,磷是号元素,价层为第三层,有个电子,其电子排布图为,、之间的化学键类型是配位键,故答案为:;;;;
分子中只有双键中有一个键,其余的都是键,所以键与键数目之比为,中的原子采用的是杂化,中的原子采用的是杂化,过程中,碳原子的杂化类型变化是;
故答案为:;;
、、的相关信息如表所示:
相对分子质量
沸点
、的分子量相差不大,导致、沸点相差较大的原因是中能够形成氢键,导致和沸点差异的原因是的相对分子质量较大,相对分子量越大分子间作用力越大,熔沸点越高,
故答案为:分子间能形成氢键;相对分子质量较大,分子间作用力较大;
氮化碳晶体的硬度超过金刚石,符合原子晶体的特征,所以其晶体类型是原子晶体。假设碳原子半径为,晶胞边长为,依据晶胞图示可知,晶胞中含有的碳原子数为:,其体积为:,晶胞边长,晶胞的体积为:,则该晶体的空间利用率为。
故答案为:原子晶体;.
第1页,共1页
