专题4第二单元配合物的形成和应用同步练习 (含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4第二单元配合物的形成和应用同步练习 (含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 652.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 21:42:15 | ||
图片预览



文档简介
专题4第二单元配合物的形成和应用同步练习
一、单选题
1. 配位化合物的数量巨大,组成和结构形形色色。配合物的中心离子、配位体、中心离子的化合价和配位数分别为 ( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
2. 配合物中,中心离子的化合价是( )
A. B. C. D. 无法确定
3. 在水溶液中可与发生反应生成和,下列说法错误的是。( )
A. 基态核外电子排布式为
B. 分子中含有键的数目约为
C. 分子中碳原子轨道的杂化类型是
D. 中与的原子形成配位键,结构可表示为
4. 下列物质中,不属于配合物的是( )
A. B.
C. D.
5. Ⅲ的八面体配合物与溶液反应生成沉淀,则、的值是 ( )
A. , B. , C. , D. ,
6. 有三种组成均为的配合物,甲为亮绿色,乙为暗绿色,丙为紫色,向含相同物质的量的甲、乙、丙的水溶液中分别加入足量的溶液,析出的物质的量之比为。已知铬的配位数均为,下列说法错误的是 ( )
A. 丙的化学式为 B. 配位体均为
C. 铬元素均显价 D. 有两种异构体
7. 的化学名称为二氯二氨合铂,它有两种几何异构体,一种是顺式,一种是反式,简称顺铂和反铂。下列说法正确的是 ( )
A. 该物质是一种复盐 B. 该物质中的化合价为
C. 该配合物的结构为四面体结构 D. 该物质中含有个配位键
8. 年某科研团队经多次实验发现一种新型漂白剂结构见下图,可用于漂白蚕丝等织品,其组成元素均为短周期元素,、对应的简单离子核外电子排布相同,且、、的原子最外层电子数之和等于的原子最外层电子数,下列说法错误的是( )
A. 四种元素中的电负性最大 B. 该物质中含有配位键
C. 的最高价氧化物对应的水化物是一元弱酸 D. 离子半径:
9. 钙钛矿光催化剂具有高活性和选择性。带有负电荷的将带正电的固定在其表面,用于可见光驱动还原。下列说法错误的是( )
A. 电负性: B. 中的配位数为
C. 三联呲啶中原子的杂化方式为 D. 还原过程中有极性键、非极性键断裂和形成
10. 结构中含有两个或两个以上中心原子离子的配合物称为多核配合物。一种Ⅱ双核配合物的内界结构如图所示,内界中存在、配位,外界为。下列说法正确的是( )
A. 中心离子的配位数为
B. 该内界结构中含有极性键、非极性键和离子键
C. 的一氯代物有种
D. 常温下,向含有该配合物的溶液中加入足量溶液,最终生成沉淀
11. 硼砂是含结晶水的四硼酸钠,其阴离子含、、三种元素的球棍模型如图所示图中球的相对大小可代表原子半径的相对大小。下列有关叙述正确的是 ( )
A. 可表示为 B. 硼原子的轨道杂化类型有、
C. 配位键存在于、原子之间 D. 硼砂晶体中有离子键、配位键两种化学键
12. 实验室中可用溶液检验酚羟基的存在,原理是生成有颜色的配合物。下列有关判断正确的是( )
A. 提供孤电子对,酚羟基中的原子提供空轨道形成配位键
B. 提供空轨道,酚羟基中的原子提供孤电子对形成配位键
C. 提供空轨道,酚中的原子提供孤电子对形成配位键
D. 所有的酚类物质遇溶液均显紫色
13. 在金属离子的含量测定实验中有着重要的应用。下列关于的说法正确的是 ( )
A. 溶液中含有
B. 是二元有机羧酸
C. 电离出的离子中,所有的、原子均能与金属离子形成配位键
D. 个可与金属离子形成个配位键
14. 向溶液中滴加几滴浓度为的氨水,首先形成蓝色沉淀,继续滴加氨水并振荡,沉淀溶解,得到深蓝色溶液,继续滴加的乙醇,析出深蓝色的晶体。下列分析错误的是 ( )
A. 深蓝色晶体的化学式为
B. 属于配离子,为配体
C. 可表示为,离子空间结构一定为正四面体形
D. 五水硫酸铜可表示为
15. 含的配合物呈现不同的颜色,如呈淡紫色稀溶液时为无色,、呈黄色。在黄色溶液中,加入稀至溶液接近无色,用该无色溶液做实验,现象如下:
下列说法错误的是
A. 中提供空轨道,提供孤电子对
B. 黄色溶液中存在
C. 实验反应的离子方程式为:
D. 实验现象说明比更易结合
二、实验题
16. 实验小组研究硫酸四氨合铜晶体的制备。
实验一制备溶液
甲:向溶液中滴加溶液,产生蓝色沉淀,再向所得浊液标记为浊液中加入过量氨水,沉淀不溶解。
乙:向溶液中滴加氨水,产生蓝色沉淀,再向浊液中继续滴加过量氨水,沉淀溶解,得到深蓝色溶液。
画出四氨合铜配离子中的配位键:_______。
甲中,生成蓝色沉淀的离子方程式是_______。
研究甲、乙中现象不同的原因。
提出猜测
可能影响的生成。
.促进了的生成。
进行实验
将浊液过滤,洗涤沉淀,把所得固体分成两份。
向其中一份加入过量氨水,观察到_______ ,说明猜测不成立。
向另一份加入过量氨水,再滴入几滴_______填试剂,沉淀溶解,得到深蓝色溶液,说明猜测成立。
实验反思
从平衡移动的角度,结合化学用语解释为什么能促进的生成:_______。
实验二制备硫酸四氨合铜晶体
资料:
受热易分解;
在乙醇水的混合溶剂中溶解度随乙醇体积分数的变化如下图所示。
用蒸发、结晶的方法从乙所得深蓝色溶液中获得的晶体中往往含有、等杂质。
结合,上述信息分析,从乙所得深蓝色溶液中获得较多晶体的措施是_______写出两条即可。
17. 甲醛与新制氢氧化铜悬浊液反应的产物受多种条件的影响。某同学设计了如图装置夹持装置略探究其反应产物,反应一段时间后,有大量气体生成,新制氢氧化铜悬浊液的蓝色褪去,三颈烧瓶的底部有红色沉淀生成。
已知:
与银氨溶液能发生反应生成银;
能与氨水反应生成无色,易被氧化生成。
回答下列问题:
仪器的名称是_______,反应控制温度为,适宜采用的加热方式为_______。
该同学对反应产物提出如下猜想:
气体产物 、、
溶液中的产物 、
固体产物 、
利用下列装置确定气体成分,装置的连接顺序是_______填序号,仪器可重复使用。
实验发现,中固体颜色变蓝,、中均无明显现象,中固体变为红色,证明生成的气体是_______。
为确定溶液中产物与固体产物,该同学又做了以下实验:
由实验现象可知,溶液中的产物为猜想中的_______填离子符号;向滤渣中加入足量浓氨水,发生反应的离子方程式为_______;固体产物为_______填化学式。
三、简答题
18. 是一种高迁移率的新型热电材料,回答下列问题:
为Ⅳ族元素,单质与干燥反应生成。常温常压下为无色液体,空间构型为________,其固体的晶体类型为________。
、、的沸点由高到低的顺序为________填化学式,下同,还原性由强到弱的顺序为________,键角由大到小的顺序为________。
含有多个配位原子的配体与同一中心离子或原子通过螯合配位成环而形成的配合物为螯合物。一种配合物的结构如图所示,该配合物中通过螯合作用形成的配位键有________,该螯合物中的杂化方式有________种。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为,晶胞中部分原子的分数坐标如表所示。
一个晶胞中有________个,找出距离最近的________用分数坐标表示。晶体中与单个键合的有________个。
19. 工业上合成氨,易与铁触媒作用导致铁触媒失去催化活性:。为了防止催化剂铁触媒中毒,要除去,发生的反应为。设阿伏加德罗常数的值为,回答下列问题:
写出的一种常见等电子体分子的结构式: 。
与同族的元素还有、、,它们氢化物的沸点大小顺序为,其原因是 。
配合物中,铜显价,则其含有化学键的类型有 ;该配合物中含有的键数目为 ,分子的价电子对互斥理论模型是 。
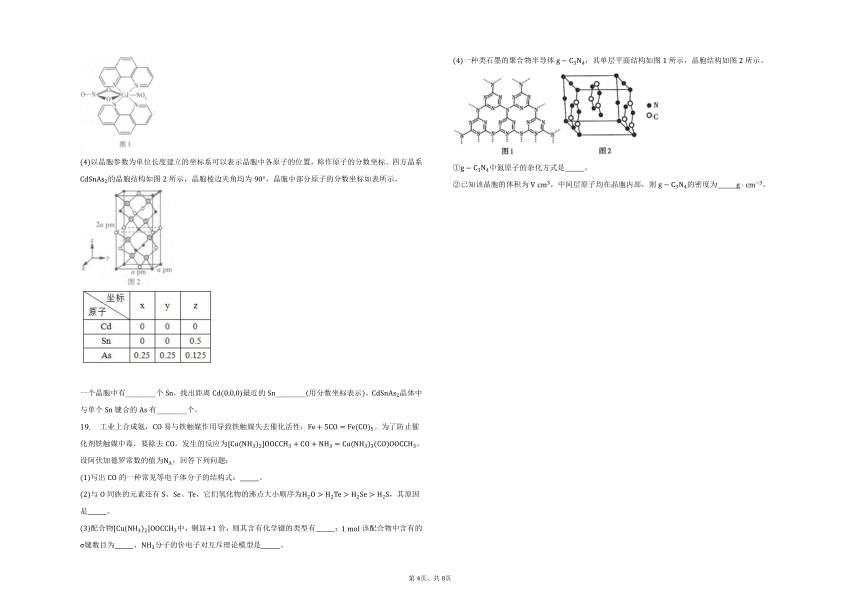
一种类石墨的聚合物半导体,其单层平面结构如图所示,晶胞结构如图所示。
中氮原子的杂化方式是 。
已知该晶胞的体积为 ,中间层原子均在晶胞内部,则的密度为 。
答案和解析
1.【答案】
【解析】 配合物中,为中心离子,化合价为,配位体为,配位数为。
2.【答案】
【解析】
【分析】
本题考查配合物的组成,明确配合物中外界、内界等概念即可解答,题目难度不大。
【解答】
配合物中外界硝酸根带一个单位负电荷,内界带一个单位负电荷,不带电荷,所以中心离子是,化合价是。
3.【答案】
【解析】的原子序数为,位于第Ⅱ族,所以基态核外电子排布式为,项正确;
分子含个键和个键,共有个键,所以分子中含有键的物质的量为,数目约为,项正确;
分子中与羟基相连的为杂化,中的为杂化,项错误;
中与的原子形成配位键,为杂化,配位原子形成正四面体,所以的结构可表示为,项正确。
4.【答案】
【解析】
【分析】
本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,明确“只有有提供空轨道原子和提供孤电子对的原子”才能形成配位键,题目难度中等。
【解答】
A.该物质中,铜离子提供空轨道、水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故A不选;
B.该物质中,银离子提供空轨道、中氮原子提供孤电子对而形成配位键,所以该物质属于配合物,故B不选;
C.属于一般化合物,不含配体,所以不属于配合物,故C选;
D.中铝原子提供空轨道,原子提供孤电子对,所以该物质属于配合物,故D不选。
5.【答案】
【解析】Ⅲ的八面体配合物呈电中性,因为为分子,钴离子的化合价为,所以的值为,而该配合物与溶液反应生成沉淀,则该配合物中外界含有个,又因为该配合物为八面体,所以中心离子的配位数为,则的值为,即该配合物的化学式是,项正确。
6.【答案】
【解析】项,只有外界中的可以电离出来,故由向含相同物质的量的甲、乙、丙的水溶液中分别加入足量的溶液,析出的物质的量之比为,可知丙的化学式为,正确;
项,配合物中铬的配位数均是,由配合物组成式可知配位体还有水,错误;
项,该化合物中铬元素化合价相同,均为,正确;
项,有顺式和反式两种异构体,分别为 ,正确。
7.【答案】
【解析】项,该物质是配合物,不是复盐,错误;项,该物质中的化合价为,错误;项,该配合物的结构是平面四边形,错误;项,该物质中含有个配位键,配位体是个分子和个,正确。
8.【答案】
【解析】由该物质的结构可知,形成两条共价键,形成价阳离子,、对应的简单离子核外电子排布相同,则为,为,形成一条共价键,、、的原子最外层电子数之和等于的原子最外层电子数,则为,为,据此分析答题。
9.【答案】
【解析】
【分析】
略
【解答】
A.同周期元素电负性从左往右增大,同主族元素电负性长上往下减小,电负性:,则电负性:,选项A正确;
B.根据中与三联吡啶螯合配位成环,配位键数目为,选项B正确;
C.三联吡啶中原子形成键及双键,原子形成三个键,没有孤电子对,其杂化方式为,选项C正确:
D.与还原为和的过程中只有极性键和形成,选项D错误;
答案选D。
10.【答案】
【解析】中心离子与个原子、个或个原子、个形成配位键,则配位数为,故A错误;
该物质中含有、极性键、非极性键,不含有离子键,故B错误;
的一氯代物有种,故C错误;
中心离子为,则该配合物外界有,加入足量溶液,最终生成沉淀,故D正确。
11.【答案】
【解析】观察模型及原子半径可知,模型中、、、号球代表原子,、号球代表原子,可表示为,为价,为价,为价,根据化合价规则可得,则可表示为,项错误;
号原子形成个化学键,价电子对数键个数,则号原子为杂化,号原子形成个化学键,其中个键是配位键,价电子对数为,则号原子为杂化,项正确;
原子含有空轨道,原子含有孤对电子,号原子连接的是原子,孤电子对更易提供出来,则、号原子之间形成配位键,项错误;
硼砂晶体中有离子键、共价键、配位键,项错误。
12.【答案】
【解析】【解答】
用溶液检验酚羟基的原理是:提供空轨道,酚羟基中的原子提供孤电子对形成配位键,项正确,、项错误;酚类物质遇溶液会显色,但不一定是紫色,项错误。
故选:。
13.【答案】
【解析】溶液中,个可以电离出两个,生成,项正确;
是盐,不是羧酸,项错误;
中的个原子、与原子形成单键的个原子均能与金属离子形成配位键,而与原子形成双键的原子不能与金属离子形成配位键,、项错误。
14.【答案】
【解析】铜离子和形成配位键,形成的配合物在乙醇中的溶解度降低,所以深蓝色晶体的化学式为,A正确;
铜离子含有空轨道,中氮原子含有孤电子对,因此属于配离子,其中为配体,B正确;
可表示为,离子空间结构为平面正方形,C错误;
铜离子和水也可以形成配位键,所以五水硫酸铜可表示为,D正确。
15.【答案】
【解析】略
16.【答案】
蓝色沉淀不溶解 硫酸铵溶液 由于 ,加入 能结合使平衡正移,促进的生成
降低温度加入乙醇
【解析】
【分析】向溶液中滴加氨水,产生蓝色沉淀,再向浊液中继续滴加过量氨水,沉淀溶解,得到深蓝色溶液,制得了溶液。将溶液降温,并加入乙醇可析出硫酸四氨合铜晶体。
四氨合铜配离子中的配位键是氨分子中的氮原子提供孤电子对,提供空轨道形成的,表示为 。
甲中硫酸铜溶液和氢氧化钠溶液生成蓝色沉淀氢氧化铜,离子方程式是:。
由于向含有的浊液中滴加过量的氨水,若观察到蓝色沉淀不溶解,则说明不影响的生成。若加入含 的物质,蓝色沉淀溶解,则可证明猜想成立,所以向另一份加入过量氨水,再滴入几滴硫酸铵溶液,沉淀溶解,得到深蓝色溶液,说明猜测成立。由于 ,加入 能结合使平衡正移,促进的生成。
受热易分解;在乙醇水的混合溶剂中溶解度随乙醇体积分数的增多而降低,所以从乙所得深蓝色溶液中获得较多晶体的措施可以是降温和加入乙醇。
17.【答案】 球形冷凝管 水浴加热
【解析】【解析】
【小问详解】
仪器为球形冷凝管,若要控制反应温度,适宜采用水浴加热的方式。
【小问详解】
猜想气体产物有氢气、一氧化碳、二氧化碳,根据装置分析,先用澄清石灰水检验二氧化碳,再用银氨溶液检验一氧化碳,然后用无水氯化钙对气体进行干燥,防止干扰,再用气体和氧化铜反应,用硫酸铜检验是否水生成检验是否有氢气,故装置的连接顺序为。、中均无明显现象,说明不含一氧化碳和二氧化碳,中固体变为红色,中固体颜色变蓝,证明生成的气体是氢气。
猜想溶液中产物为甲酸根离子和碳酸根离子,滤液加入稀硫酸无明显现象,则说明不含有碳酸根离子,液体产物中存在离子是,已知能与氨水反应生成 无色, 易被氧化生成 ,根据实验现象可知,该固体产物中含有,则滤渣中加入足量浓氨水时,主要反应的离子方程式为 .
18.【答案】正四面体形 分子晶体
、、 、、 、、
、
【解析】为元素周期表中Ⅳ族元素,最外层有个电子,故的中心原子的价层电子对数为,且均为成键电子对,故的空间构型为正四面体形。由常温常压下为液体的物理性质可知符合分子晶体的特点,故其为分子晶体。
中存在分子间氢键,导致其沸点比与同主族的、的氢化物、的沸点要高,而、中均不存在分子间氢键,故影响、沸点的因素为范德华力,相对分子质量越大,沸点越高,则沸点由高到低的顺序为、、。通常同主族元素随着原子序数的递增,气态氢化物的还原性逐渐增强,则还原性由强到弱的顺序是、、。同主族元素,随着原子序数的递增,电负性逐渐减弱,则其气态氢化物中的成键电子对逐渐远离中心原子,致使成键电子对的排斥力降低,键角逐渐减小,故键角由大到小的顺序是、、。
根据螯合物的定义可知,该螯合物中与个原子、个原子形成化学键,其中与硝基中的原子形成共价键,其余的均为配位键,故该配合物中通过螯合作用形成配位键。该螯合物中无论是硝基中的原子,还是中的原子,还是六元环中的原子,均为杂化,即只有种杂化方式。
由四方晶系晶胞及原子的分数坐标可知,有个位于棱上,个位于面上,则属于一个晶胞的的个数为。与最近的为如图所示的、两个位置,位置的的分数坐标为,位置的的分数坐标为。晶体中除与该晶胞中的个键合外,还与相邻晶胞中的个键合,故晶体中单个与个键合。
19.【答案】
、、、均是分子晶体,、、的相对分子质量逐渐减小,范德华力逐渐减小,所以沸点逐渐减小,而水分子间存在氢键,所以沸点最高
离子键、共价键、配位键;;四面体形
;
【解析】与互为等电子体的分子为,结构式为。
、、、的氢化物均为分子晶体,、、的相对分子质量逐渐减小,范德华力逐渐减小,所以沸点逐渐减小,而由于存在分子间氢键,氢键的作用力比范德华力强,所以的沸点最高,故沸点大小顺序为。
配合物中,和之间为离子键,中和之间为配位键,、中原子之间为共价键。中个与个形成个配位键键,个含个键,个含有个键,所以 中含有的键数目为;中原子形成个键,含有对孤电子对,价层电子对数,故其价电子对互斥理论模型是四面体形。
中原子的价电子对数为,为杂化。
由中间层原子均在晶胞内部知,该晶胞中位于面上和体内,个数为,位于顶点、面上、棱上和体内,个数为,晶胞质量为,晶胞体积为,则的密度为。
第1页,共1页
一、单选题
1. 配位化合物的数量巨大,组成和结构形形色色。配合物的中心离子、配位体、中心离子的化合价和配位数分别为 ( )
A. 、、、 B. 、、、
C. 、、、 D. 、、、
2. 配合物中,中心离子的化合价是( )
A. B. C. D. 无法确定
3. 在水溶液中可与发生反应生成和,下列说法错误的是。( )
A. 基态核外电子排布式为
B. 分子中含有键的数目约为
C. 分子中碳原子轨道的杂化类型是
D. 中与的原子形成配位键,结构可表示为
4. 下列物质中,不属于配合物的是( )
A. B.
C. D.
5. Ⅲ的八面体配合物与溶液反应生成沉淀,则、的值是 ( )
A. , B. , C. , D. ,
6. 有三种组成均为的配合物,甲为亮绿色,乙为暗绿色,丙为紫色,向含相同物质的量的甲、乙、丙的水溶液中分别加入足量的溶液,析出的物质的量之比为。已知铬的配位数均为,下列说法错误的是 ( )
A. 丙的化学式为 B. 配位体均为
C. 铬元素均显价 D. 有两种异构体
7. 的化学名称为二氯二氨合铂,它有两种几何异构体,一种是顺式,一种是反式,简称顺铂和反铂。下列说法正确的是 ( )
A. 该物质是一种复盐 B. 该物质中的化合价为
C. 该配合物的结构为四面体结构 D. 该物质中含有个配位键
8. 年某科研团队经多次实验发现一种新型漂白剂结构见下图,可用于漂白蚕丝等织品,其组成元素均为短周期元素,、对应的简单离子核外电子排布相同,且、、的原子最外层电子数之和等于的原子最外层电子数,下列说法错误的是( )
A. 四种元素中的电负性最大 B. 该物质中含有配位键
C. 的最高价氧化物对应的水化物是一元弱酸 D. 离子半径:
9. 钙钛矿光催化剂具有高活性和选择性。带有负电荷的将带正电的固定在其表面,用于可见光驱动还原。下列说法错误的是( )
A. 电负性: B. 中的配位数为
C. 三联呲啶中原子的杂化方式为 D. 还原过程中有极性键、非极性键断裂和形成
10. 结构中含有两个或两个以上中心原子离子的配合物称为多核配合物。一种Ⅱ双核配合物的内界结构如图所示,内界中存在、配位,外界为。下列说法正确的是( )
A. 中心离子的配位数为
B. 该内界结构中含有极性键、非极性键和离子键
C. 的一氯代物有种
D. 常温下,向含有该配合物的溶液中加入足量溶液,最终生成沉淀
11. 硼砂是含结晶水的四硼酸钠,其阴离子含、、三种元素的球棍模型如图所示图中球的相对大小可代表原子半径的相对大小。下列有关叙述正确的是 ( )
A. 可表示为 B. 硼原子的轨道杂化类型有、
C. 配位键存在于、原子之间 D. 硼砂晶体中有离子键、配位键两种化学键
12. 实验室中可用溶液检验酚羟基的存在,原理是生成有颜色的配合物。下列有关判断正确的是( )
A. 提供孤电子对,酚羟基中的原子提供空轨道形成配位键
B. 提供空轨道,酚羟基中的原子提供孤电子对形成配位键
C. 提供空轨道,酚中的原子提供孤电子对形成配位键
D. 所有的酚类物质遇溶液均显紫色
13. 在金属离子的含量测定实验中有着重要的应用。下列关于的说法正确的是 ( )
A. 溶液中含有
B. 是二元有机羧酸
C. 电离出的离子中,所有的、原子均能与金属离子形成配位键
D. 个可与金属离子形成个配位键
14. 向溶液中滴加几滴浓度为的氨水,首先形成蓝色沉淀,继续滴加氨水并振荡,沉淀溶解,得到深蓝色溶液,继续滴加的乙醇,析出深蓝色的晶体。下列分析错误的是 ( )
A. 深蓝色晶体的化学式为
B. 属于配离子,为配体
C. 可表示为,离子空间结构一定为正四面体形
D. 五水硫酸铜可表示为
15. 含的配合物呈现不同的颜色,如呈淡紫色稀溶液时为无色,、呈黄色。在黄色溶液中,加入稀至溶液接近无色,用该无色溶液做实验,现象如下:
下列说法错误的是
A. 中提供空轨道,提供孤电子对
B. 黄色溶液中存在
C. 实验反应的离子方程式为:
D. 实验现象说明比更易结合
二、实验题
16. 实验小组研究硫酸四氨合铜晶体的制备。
实验一制备溶液
甲:向溶液中滴加溶液,产生蓝色沉淀,再向所得浊液标记为浊液中加入过量氨水,沉淀不溶解。
乙:向溶液中滴加氨水,产生蓝色沉淀,再向浊液中继续滴加过量氨水,沉淀溶解,得到深蓝色溶液。
画出四氨合铜配离子中的配位键:_______。
甲中,生成蓝色沉淀的离子方程式是_______。
研究甲、乙中现象不同的原因。
提出猜测
可能影响的生成。
.促进了的生成。
进行实验
将浊液过滤,洗涤沉淀,把所得固体分成两份。
向其中一份加入过量氨水,观察到_______ ,说明猜测不成立。
向另一份加入过量氨水,再滴入几滴_______填试剂,沉淀溶解,得到深蓝色溶液,说明猜测成立。
实验反思
从平衡移动的角度,结合化学用语解释为什么能促进的生成:_______。
实验二制备硫酸四氨合铜晶体
资料:
受热易分解;
在乙醇水的混合溶剂中溶解度随乙醇体积分数的变化如下图所示。
用蒸发、结晶的方法从乙所得深蓝色溶液中获得的晶体中往往含有、等杂质。
结合,上述信息分析,从乙所得深蓝色溶液中获得较多晶体的措施是_______写出两条即可。
17. 甲醛与新制氢氧化铜悬浊液反应的产物受多种条件的影响。某同学设计了如图装置夹持装置略探究其反应产物,反应一段时间后,有大量气体生成,新制氢氧化铜悬浊液的蓝色褪去,三颈烧瓶的底部有红色沉淀生成。
已知:
与银氨溶液能发生反应生成银;
能与氨水反应生成无色,易被氧化生成。
回答下列问题:
仪器的名称是_______,反应控制温度为,适宜采用的加热方式为_______。
该同学对反应产物提出如下猜想:
气体产物 、、
溶液中的产物 、
固体产物 、
利用下列装置确定气体成分,装置的连接顺序是_______填序号,仪器可重复使用。
实验发现,中固体颜色变蓝,、中均无明显现象,中固体变为红色,证明生成的气体是_______。
为确定溶液中产物与固体产物,该同学又做了以下实验:
由实验现象可知,溶液中的产物为猜想中的_______填离子符号;向滤渣中加入足量浓氨水,发生反应的离子方程式为_______;固体产物为_______填化学式。
三、简答题
18. 是一种高迁移率的新型热电材料,回答下列问题:
为Ⅳ族元素,单质与干燥反应生成。常温常压下为无色液体,空间构型为________,其固体的晶体类型为________。
、、的沸点由高到低的顺序为________填化学式,下同,还原性由强到弱的顺序为________,键角由大到小的顺序为________。
含有多个配位原子的配体与同一中心离子或原子通过螯合配位成环而形成的配合物为螯合物。一种配合物的结构如图所示,该配合物中通过螯合作用形成的配位键有________,该螯合物中的杂化方式有________种。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为,晶胞中部分原子的分数坐标如表所示。
一个晶胞中有________个,找出距离最近的________用分数坐标表示。晶体中与单个键合的有________个。
19. 工业上合成氨,易与铁触媒作用导致铁触媒失去催化活性:。为了防止催化剂铁触媒中毒,要除去,发生的反应为。设阿伏加德罗常数的值为,回答下列问题:
写出的一种常见等电子体分子的结构式: 。
与同族的元素还有、、,它们氢化物的沸点大小顺序为,其原因是 。
配合物中,铜显价,则其含有化学键的类型有 ;该配合物中含有的键数目为 ,分子的价电子对互斥理论模型是 。
一种类石墨的聚合物半导体,其单层平面结构如图所示,晶胞结构如图所示。
中氮原子的杂化方式是 。
已知该晶胞的体积为 ,中间层原子均在晶胞内部,则的密度为 。
答案和解析
1.【答案】
【解析】 配合物中,为中心离子,化合价为,配位体为,配位数为。
2.【答案】
【解析】
【分析】
本题考查配合物的组成,明确配合物中外界、内界等概念即可解答,题目难度不大。
【解答】
配合物中外界硝酸根带一个单位负电荷,内界带一个单位负电荷,不带电荷,所以中心离子是,化合价是。
3.【答案】
【解析】的原子序数为,位于第Ⅱ族,所以基态核外电子排布式为,项正确;
分子含个键和个键,共有个键,所以分子中含有键的物质的量为,数目约为,项正确;
分子中与羟基相连的为杂化,中的为杂化,项错误;
中与的原子形成配位键,为杂化,配位原子形成正四面体,所以的结构可表示为,项正确。
4.【答案】
【解析】
【分析】
本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,明确“只有有提供空轨道原子和提供孤电子对的原子”才能形成配位键,题目难度中等。
【解答】
A.该物质中,铜离子提供空轨道、水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故A不选;
B.该物质中,银离子提供空轨道、中氮原子提供孤电子对而形成配位键,所以该物质属于配合物,故B不选;
C.属于一般化合物,不含配体,所以不属于配合物,故C选;
D.中铝原子提供空轨道,原子提供孤电子对,所以该物质属于配合物,故D不选。
5.【答案】
【解析】Ⅲ的八面体配合物呈电中性,因为为分子,钴离子的化合价为,所以的值为,而该配合物与溶液反应生成沉淀,则该配合物中外界含有个,又因为该配合物为八面体,所以中心离子的配位数为,则的值为,即该配合物的化学式是,项正确。
6.【答案】
【解析】项,只有外界中的可以电离出来,故由向含相同物质的量的甲、乙、丙的水溶液中分别加入足量的溶液,析出的物质的量之比为,可知丙的化学式为,正确;
项,配合物中铬的配位数均是,由配合物组成式可知配位体还有水,错误;
项,该化合物中铬元素化合价相同,均为,正确;
项,有顺式和反式两种异构体,分别为 ,正确。
7.【答案】
【解析】项,该物质是配合物,不是复盐,错误;项,该物质中的化合价为,错误;项,该配合物的结构是平面四边形,错误;项,该物质中含有个配位键,配位体是个分子和个,正确。
8.【答案】
【解析】由该物质的结构可知,形成两条共价键,形成价阳离子,、对应的简单离子核外电子排布相同,则为,为,形成一条共价键,、、的原子最外层电子数之和等于的原子最外层电子数,则为,为,据此分析答题。
9.【答案】
【解析】
【分析】
略
【解答】
A.同周期元素电负性从左往右增大,同主族元素电负性长上往下减小,电负性:,则电负性:,选项A正确;
B.根据中与三联吡啶螯合配位成环,配位键数目为,选项B正确;
C.三联吡啶中原子形成键及双键,原子形成三个键,没有孤电子对,其杂化方式为,选项C正确:
D.与还原为和的过程中只有极性键和形成,选项D错误;
答案选D。
10.【答案】
【解析】中心离子与个原子、个或个原子、个形成配位键,则配位数为,故A错误;
该物质中含有、极性键、非极性键,不含有离子键,故B错误;
的一氯代物有种,故C错误;
中心离子为,则该配合物外界有,加入足量溶液,最终生成沉淀,故D正确。
11.【答案】
【解析】观察模型及原子半径可知,模型中、、、号球代表原子,、号球代表原子,可表示为,为价,为价,为价,根据化合价规则可得,则可表示为,项错误;
号原子形成个化学键,价电子对数键个数,则号原子为杂化,号原子形成个化学键,其中个键是配位键,价电子对数为,则号原子为杂化,项正确;
原子含有空轨道,原子含有孤对电子,号原子连接的是原子,孤电子对更易提供出来,则、号原子之间形成配位键,项错误;
硼砂晶体中有离子键、共价键、配位键,项错误。
12.【答案】
【解析】【解答】
用溶液检验酚羟基的原理是:提供空轨道,酚羟基中的原子提供孤电子对形成配位键,项正确,、项错误;酚类物质遇溶液会显色,但不一定是紫色,项错误。
故选:。
13.【答案】
【解析】溶液中,个可以电离出两个,生成,项正确;
是盐,不是羧酸,项错误;
中的个原子、与原子形成单键的个原子均能与金属离子形成配位键,而与原子形成双键的原子不能与金属离子形成配位键,、项错误。
14.【答案】
【解析】铜离子和形成配位键,形成的配合物在乙醇中的溶解度降低,所以深蓝色晶体的化学式为,A正确;
铜离子含有空轨道,中氮原子含有孤电子对,因此属于配离子,其中为配体,B正确;
可表示为,离子空间结构为平面正方形,C错误;
铜离子和水也可以形成配位键,所以五水硫酸铜可表示为,D正确。
15.【答案】
【解析】略
16.【答案】
蓝色沉淀不溶解 硫酸铵溶液 由于 ,加入 能结合使平衡正移,促进的生成
降低温度加入乙醇
【解析】
【分析】向溶液中滴加氨水,产生蓝色沉淀,再向浊液中继续滴加过量氨水,沉淀溶解,得到深蓝色溶液,制得了溶液。将溶液降温,并加入乙醇可析出硫酸四氨合铜晶体。
四氨合铜配离子中的配位键是氨分子中的氮原子提供孤电子对,提供空轨道形成的,表示为 。
甲中硫酸铜溶液和氢氧化钠溶液生成蓝色沉淀氢氧化铜,离子方程式是:。
由于向含有的浊液中滴加过量的氨水,若观察到蓝色沉淀不溶解,则说明不影响的生成。若加入含 的物质,蓝色沉淀溶解,则可证明猜想成立,所以向另一份加入过量氨水,再滴入几滴硫酸铵溶液,沉淀溶解,得到深蓝色溶液,说明猜测成立。由于 ,加入 能结合使平衡正移,促进的生成。
受热易分解;在乙醇水的混合溶剂中溶解度随乙醇体积分数的增多而降低,所以从乙所得深蓝色溶液中获得较多晶体的措施可以是降温和加入乙醇。
17.【答案】 球形冷凝管 水浴加热
【解析】【解析】
【小问详解】
仪器为球形冷凝管,若要控制反应温度,适宜采用水浴加热的方式。
【小问详解】
猜想气体产物有氢气、一氧化碳、二氧化碳,根据装置分析,先用澄清石灰水检验二氧化碳,再用银氨溶液检验一氧化碳,然后用无水氯化钙对气体进行干燥,防止干扰,再用气体和氧化铜反应,用硫酸铜检验是否水生成检验是否有氢气,故装置的连接顺序为。、中均无明显现象,说明不含一氧化碳和二氧化碳,中固体变为红色,中固体颜色变蓝,证明生成的气体是氢气。
猜想溶液中产物为甲酸根离子和碳酸根离子,滤液加入稀硫酸无明显现象,则说明不含有碳酸根离子,液体产物中存在离子是,已知能与氨水反应生成 无色, 易被氧化生成 ,根据实验现象可知,该固体产物中含有,则滤渣中加入足量浓氨水时,主要反应的离子方程式为 .
18.【答案】正四面体形 分子晶体
、、 、、 、、
、
【解析】为元素周期表中Ⅳ族元素,最外层有个电子,故的中心原子的价层电子对数为,且均为成键电子对,故的空间构型为正四面体形。由常温常压下为液体的物理性质可知符合分子晶体的特点,故其为分子晶体。
中存在分子间氢键,导致其沸点比与同主族的、的氢化物、的沸点要高,而、中均不存在分子间氢键,故影响、沸点的因素为范德华力,相对分子质量越大,沸点越高,则沸点由高到低的顺序为、、。通常同主族元素随着原子序数的递增,气态氢化物的还原性逐渐增强,则还原性由强到弱的顺序是、、。同主族元素,随着原子序数的递增,电负性逐渐减弱,则其气态氢化物中的成键电子对逐渐远离中心原子,致使成键电子对的排斥力降低,键角逐渐减小,故键角由大到小的顺序是、、。
根据螯合物的定义可知,该螯合物中与个原子、个原子形成化学键,其中与硝基中的原子形成共价键,其余的均为配位键,故该配合物中通过螯合作用形成配位键。该螯合物中无论是硝基中的原子,还是中的原子,还是六元环中的原子,均为杂化,即只有种杂化方式。
由四方晶系晶胞及原子的分数坐标可知,有个位于棱上,个位于面上,则属于一个晶胞的的个数为。与最近的为如图所示的、两个位置,位置的的分数坐标为,位置的的分数坐标为。晶体中除与该晶胞中的个键合外,还与相邻晶胞中的个键合,故晶体中单个与个键合。
19.【答案】
、、、均是分子晶体,、、的相对分子质量逐渐减小,范德华力逐渐减小,所以沸点逐渐减小,而水分子间存在氢键,所以沸点最高
离子键、共价键、配位键;;四面体形
;
【解析】与互为等电子体的分子为,结构式为。
、、、的氢化物均为分子晶体,、、的相对分子质量逐渐减小,范德华力逐渐减小,所以沸点逐渐减小,而由于存在分子间氢键,氢键的作用力比范德华力强,所以的沸点最高,故沸点大小顺序为。
配合物中,和之间为离子键,中和之间为配位键,、中原子之间为共价键。中个与个形成个配位键键,个含个键,个含有个键,所以 中含有的键数目为;中原子形成个键,含有对孤电子对,价层电子对数,故其价电子对互斥理论模型是四面体形。
中原子的价电子对数为,为杂化。
由中间层原子均在晶胞内部知,该晶胞中位于面上和体内,个数为,位于顶点、面上、棱上和体内,个数为,晶胞质量为,晶胞体积为,则的密度为。
第1页,共1页
