专题3第一单元金属键、金属晶体同步练习(含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3第一单元金属键、金属晶体同步练习(含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 498.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 21:43:33 | ||
图片预览

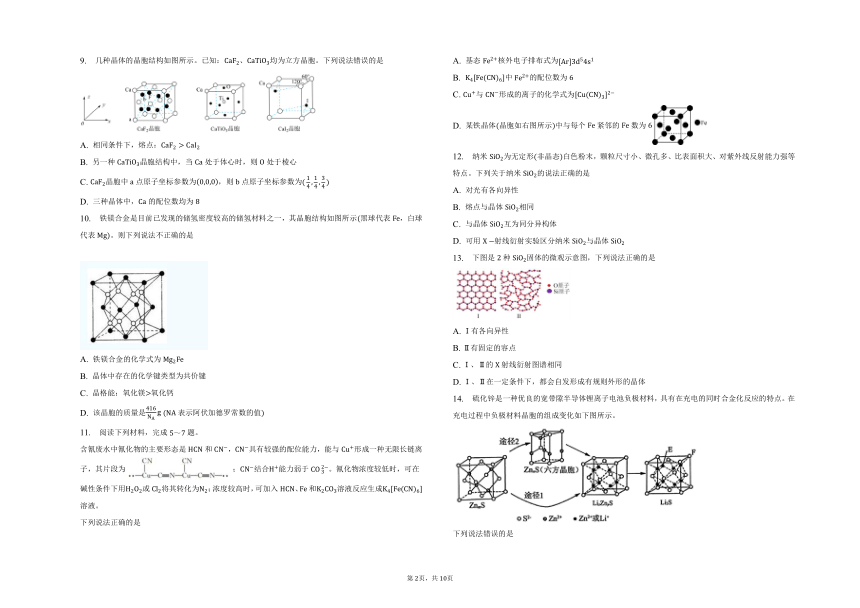



文档简介
专题3第一单元金属键、金属晶体同步练习
一、单选题
1. 下列有关金属键的叙述错误的是 ( )
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间强烈的静电吸引作用
C. 金属键中的自由电子属于整块金属
D. 金属的性质和金属固体的形成都与金属键有关
2. 下列有关晶体的认识不正确的是( )
A. 可以用射线衍射鉴别晶体与非晶体
B. 晶体具有各向异性和自范性
C. 晶体中只要有阳离子就一定有阴离子
D. 金刚石中含有键的数目为为阿伏加德罗常数
3. 晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为毫米的大直径硅单晶,晶体硅大量用于电子产业。下列对晶体硅的叙述中正确的是
A. 形成晶体硅的速率越大越好
B. 晶体硅没有固定的熔、沸点
C. 可用射线衍射实验来鉴别晶体硅和玻璃
D. 晶体硅的形成与晶体的自范性有关,而与各向异性无关
4. 下列有关晶体常识的叙述错误的是
A. 水晶属于晶体,有固定的熔点,而玻璃无固定的熔点,属于非晶体
B. 当单一波长的射线通过晶体时可以看到明显的分立的斑点或者谱线
C. 晶体都具有自范性。自范性是晶体的本质属性
D. 晶体都具有规则的几何外形,而非晶体都不具有规则的几何外形
5. 有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
A. 为简单立方堆积 为六方最密堆积 为体心立方堆积 为面心立方最密堆积
B. 晶胞中原子的配位数分别为:
C. 晶胞中含有的原子个数分别为:个 个 个 个
D. 空间利用率的大小关系为:
6. 银晶体的晶胞如图所示。设银原子的半径为,用表示阿伏加德罗常数,表示银的摩尔质量。则下列说法错误的是 ( )
A. 银晶体每个晶胞中含有个银原子 B. 配位数是
C. 一个晶胞的体积是 D. 晶体的密度是
7. 如图所示,铁有、、三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是 ( )
A. 晶胞中含有个铁原子,与每个铁原子等距离且最近的铁原子有个
B. 晶体的空间利用率:
C. 设晶胞中铁原子的半径为,则晶胞的体积是
D. 已知铁的相对原子质量为,设阿伏加德罗常数的值为,晶体的密度为 ,则铁原子的半径
8. 下列说法正确的是( )
A. 熔融状态的不能导电,的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类是一种共价化合物、非电解质、盐、分子晶体
B. 某单质熔点,是热和电的良导体,该晶体最可能是分子晶体
C. 含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子
D. 固态金属单质都是金属晶体,金属晶体含有金属键;非金属单质晶体都是分子晶体,分子晶体主要含有共价键、范德华力,有些分子晶体还含有氢键
9. 几种晶体的晶胞结构如图所示。已知:、均为立方晶胞。下列说法错误的是
A. 相同条件下,熔点:
B. 另一种晶胞结构中,当处于体心时,则处于棱心
C. 晶胞中点原子坐标参数为,则点原子坐标参数为
D. 三种晶体中,的配位数均为
10. 铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示黑球代表,白球代表。则下列说法不正确的是
A. 铁镁合金的化学式为
B. 晶体中存在的化学键类型为共价键
C. 晶格能:氧化镁氧化钙
D. 该晶胞的质量是 表示阿伏加德罗常数的值
11. 阅读下列材料,完成题。
含氰废水中氰化物的主要形态是和,具有较强的配位能力,能与形成一种无限长链离子,其片段为 ;结合能力弱于。氰化物浓度较低时,可在碱性条件下用或将其转化为;浓度较高时,可加入、和溶液反应生成溶液。
下列说法正确的是
A. 基态核外电子排布式为
B. 中的配位数为
C. 与形成的离子的化学式为
D. 某铁晶体晶胞如右图所示中与每个紧邻的数为
12. 纳米为无定形非晶态白色粉末,颗粒尺寸小、微孔多、比表面积大、对紫外线反射能力强等特点。下列关于纳米的说法正确的是
A. 对光有各向异性
B. 熔点与晶体相同
C. 与晶体互为同分异构体
D. 可用射线衍射实验区分纳米与晶体
13. 下图是种固体的微观示意图,下列说法正确的是
A. Ⅰ有各向异性
B. Ⅱ有固定的容点
C. Ⅰ、Ⅱ的射线衍射图谱相同
D. Ⅰ、Ⅱ在一定条件下,都会自发形成有规则外形的晶体
14. 硫化锌是一种优良的宽带隙半导体锂离子电池负极材料,具有在充电的同时合金化反应的特点。在充电过程中负极材料晶胞的组成变化如下图所示。
下列说法错误的是
A. 转化为是非氧化还原反应
B. 每个晶胞中的个数为
C. 若的晶胞参数为,则间的距离为
D. 在晶胞体对角线的一维空间上会出现“”的排布规律
15. 锂的某些化合物是性能优异的材料。如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为
A. B. C. D.
二、实验题
16. 可用于制防污涂料,其可由热的铜在硫蒸气或 中反应制得.
铜元素在元素周期表中的位置为 ______ ,的核外电子排布式为 ______ ,基态铜原子核外电子共有 ______ 种运动状态.
在一定条件下可被氧化为.
在中原子的杂化轨道类型为 ______ ;、与 互为 ______ ;其中、、第一电离能由大到小顺序为 ______ ;
硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图 表示,图中、 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为,写出环状结构中硅酸根离子的通式 ______ .
甲醇中的羟基被硫羟基取代生成甲硫醇,二者部分物理性质如表:
物质 熔点 沸点 水溶液
甲醇 互溶
甲硫醇 不溶
甲醇和甲硫醇在熔沸点和水溶性方面性质差异的原因是 ______ .
某化合物由、、 三种元素组成,其晶胞结构如图所示,该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度 ______ 保留三位有效数字.
17. 砷是生命的第七元素,可形成多种重要的化合物。回答下列问题:
基态砷原子电子层中的成对电子与单电子的数量比为 ______ 。的第一电离能比大的原因是 ______ 。
雄黄和雌黄在自然界中共生,是提取砷的主要矿物原料,其结构如图所示,雄黄与反应生成,转移电子,则另一种产物为 ______ 。雌黄中的杂化方式为 ______ 。
亚砷酸可以用来治疗白血病,为三元弱酸,试推测的空间构型为 ______ 。其酸性弱于砷酸的原因是 ______ 。
砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。其晶胞结构如图所示,若沿体对角线方向进行投影则得到如图,请在图中将原子的位置涂黑 ______ 。晶体中原子周围与其距离最近的原子的个数为 ______ ,若原子的半径为,原子的半径为,则最近的两个原子的距离为 ______ 。
简答题
18. 不锈钢是生活中常见的一种不锈钢,业内也叫做不锈钢,指必须含有以上的铬,以上的镍的不锈钢。
回答下列问题:
基态铬原子的价电子排布式为_______________________________________,排布时能量最高的电子所占能级的原子轨道有_________________个伸展方向。
铬和镍能形成多种配合物。如为正四面体构型,为正方形构型,、为正八面体构型等。下列说法正确的是_____________________填选项字母。
A.在形成配合物时其配位数只能为,在形成配合物时其配位数只能为
B.的空间构型为正四面体形
C.与互为等电子体,其中分子内键和键的个数比为
D.和中,镍原子均为杂化
年月,云南一化工厂发生铬污染致数万立方米水质变差、牲畜接连死亡的消息引发社会各界的极大关注。与、互为等电子体,六价铬属于强致突变物质,可诱发肺癌和鼻咽癌,的空间构型为_______________________________________。
的晶体结构类型与氯化钠相同,相关离子半径如下表所示:
晶胞中的配位数为______________________________,的熔点比高的原因是_______________________________________。
与处于同一周期,且核外最外层电子构型相同,但金属的熔点和沸点都比金属高,原因为________________________。区分晶体和非晶体的最可靠的科学方法为_______________________________________。
某铬镍合金的晶胞如图所示,设阿伏加德罗常数的值为,该晶体的密度___________用含、、的代数式表示。
19. 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题。
和属于同一周期,且基态原子核外最外层电子构型相同,但金属的熔点比金属低,试解释原因。
晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为,晶胞中、、分别处于顶点、体心、面心位置,如图所示。与原子紧邻的原子有几个?试说明分析思路。
计算晶体中原子与原子间的最短距离。
答案和解析
1.【答案】
【解析】金属键是金属阳离子和自由电子之间的强烈的相互作用,自由电子不专属于某个特定的金属阳离子,而是在整块固态金属中自由移动,所以金属键没有方向性和饱和性,、C正确;
金属键是金属阳离子和自由电子之间强烈的静电作用,既包括吸引作用也包括排斥作用,B错误;
金属晶体中的金属键决定了金属的性质和金属固体的形成,D正确。
2.【答案】
【解析】
【分析】
本题考查晶体的有关知识,题目难度不大,掌握晶体的特点及各类晶体的构成粒子是解题关键。
【解答】
A.可以用射线衍射鉴别晶体与非晶体,故 A正确;
B.晶体具有各向异性和自范性,故 B正确;
C.金属晶体中有阳离子和自由电子,故C错误;
D.利用均摊法,金刚石中含有键的数目为故D正确
故选C。
3.【答案】
【解析】
【分析】
本题主要考查了晶体硅的性质,较为基础,注意晶体的结构特点和物理性质,难度不大。
【解答】
A.晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,故A错误;
B.晶体有固定熔沸点,故B错误;
C.射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列就能区分出晶体与非晶体,故C正确;
D.晶体的形成与晶体的自范性和各向异性都有密切关系,故D错误。
故选C。
4.【答案】
【解析】
【分析】
本题考查晶体的有关性质,难度不大,解答该题要熟练的掌握晶体和非晶体的特性。
【解答】
A.水晶属于晶体,有固定的熔点,普通玻璃属于非晶体,没有固定熔点,故A正确;
B.当单一波长的射线通过晶体时,会在记录仪上看到分立的斑点或谱线,而同一条件下摄取的非晶体图谱中看不到分立的斑点或明锐的谱线,故B正确;
C.晶体都具有自范性,自范性是晶体的本质属性,故C正确;
D.某些非晶体经人工加工也可能呈现规则的几何外形,如玻璃,故D错误;
故选D。
5.【答案】
【解析】
【分析】
本题考查金属晶胞的识别,侧重考查学生空间想象能力、计算能力,知道每种堆积模型中典型金属,难点是计算配位数,题目难度中等。
【解答】
A.由晶胞结构可知为简单立方堆积,为体心立方堆积,为六方最密堆积,为面心立方最密堆积,故A错误;
B.晶胞中原子的配位数应为,故B错误;
C.每个晶胞含有的原子数分别为,,,,故C正确;
D.四种晶体的空间利用率分别为、、、,则空间利用率的大小关系为:,故D错误。
故选C。
6.【答案】
【解析】根据晶胞图可知,银原子处于顶点与面心上,晶胞中含有的银原子数目为,A正确;
银晶体中,根据晶胞图可知,采用沿、、三轴切割的方法知,每个平面上银原子的配位数是,三个面共有个银原子,银原子配位数是,B正确;
在立方体的各个面的对角线上个银原子彼此两两相切,银原子的半径为,故面对角线长为,则棱长为,故晶胞的体积为,C正确;
每个晶胞中含有个原子,故晶胞质量为,晶胞的体积为,故晶体密度为,D错误。
7.【答案】
【解析】
【分析】本题考查晶胞结构与计算,关键是明确原子在晶胞中的位置,理解原子半径与晶胞棱长的关系,需要学生具有一定的数学计算能力,掌握均摊法进行晶胞有关计算。
【解答】
A.根据切割法,晶胞中含有原子的个数为;由图可知,与每个铁原子等距离且最近的铁原子有个,A正确。
B.设原子的半径为,晶胞的棱长为,晶胞含有原子的个数为,由其晶胞结构示意图可得,则,其空间利用率为;晶胞中含有原子的个数为,因其有原子位于面心,则有,解得,其空间利用率为;晶胞中含有原子的个数为,则有,其空间利用率为;故晶体的空间利用率:,B错误。
C.若晶胞中铁原子的半径为,则晶胞的面对角线长为,所以晶胞的棱长为,则该晶胞的体积为,C正确。
D.晶胞中含有原子的个数为,则该晶胞的体积为,其棱长为,该晶胞的体对角线长为棱长的倍,也是原子半径的倍,即,解得,D正确。
8.【答案】
【解析】
【分析】
本题考查了晶体的类型和晶体的性质,题目难度不大,注意在熔融状态下能导电的化合物一定是离子晶体。
【解答】
A、的稀溶液有弱的导电能力,说明是弱电解质,故A错误;
B、分子晶体不导电,而该单质是热和电的良导体,所以不是分子晶体,故B错误;
C、晶体呈电中性,有阴离子的晶体中一定有阳离子,但是有阳离子的晶体中不一定含有阴离子,比如金属晶体没有阴离子而含有电子,故C正确;
D、金刚石、晶体硅是非金属单质晶体,但不是分子晶体,故D错误;
故选:。
9.【答案】
【解析】A. 半径小于 , 的离子键强于 的, 熔点更高,项正确;
B.另一种 晶胞结构中,当 处于体心时, 处于顶角、处于棱心,项正确;
C.由 晶胞结构及点原子坐标参数为 ,可知 点原子坐标参数为, ,项正确;
D. 中 的配位数为,项错误;
故答案为:。
10.【答案】
【解析】
【分析】
本题考查金属晶体堆积模型,为高频考点,侧重考查学生分析及空间想象能力,难点是配位数的判断及空间利用率计算,注意晶胞中哪些原子紧挨着,为易错点。
【解答】
A.位于面心和顶点,数目为:;原子位于晶胞内,数目为,化学式为:,故A正确;
B.晶体中存在的化学键类型为金属键,故B错误;
C.钙离子半径大于镁离子半径,则晶格能:氧化镁氧化钙,故C正确;
D.该晶胞中有个铁原子和个镁原子,则该晶胞的质量为:,故D正确。
故选B。
11.【答案】
【解析】略
12.【答案】
【解析】
【分析】
本题考查的内容为纳米材料的特性,题目不难,掌握纳米材料和一般晶体的区别即可解答。
【解答】
A.纳米对光没有各向异性,故错误;
B.熔点与晶体不相同,故错误;
C.纳米二氧化硅与晶体均没有分子式,故错误;
D.可用射线衍射实验区分纳米与晶体,故正确。
13.【答案】
【解析】
【分析】
本题考查晶体和非晶体,难度不大,理解晶体特征是解题关键。
【解答】由图可知,Ⅰ中微粒呈周期性有序排布,Ⅱ中微粒排列不规则,则Ⅰ为晶体,Ⅱ为非晶体即无定型二氧化硅;
A.Ⅰ形成的固体为晶体,具有各向异性,故A正确;
B.晶体具有固定熔点,非晶体没有固定熔点,Ⅱ为非晶体,没有固定熔点,故B错误;
C.射线衍射可用于区分晶体和非晶体,则Ⅰ、Ⅱ的射线衍射图谱不相同,故C错误;
D.晶体有规则的几何外形,非晶体没有规则的几何外形,Ⅰ会形成有规则外形的晶体,Ⅱ不会,故D错误;
故选A。
14.【答案】
【解析】
【分析】
本题考查晶体结构,侧重考查学生对信息的分析以及晶胞结构、计算的掌握情况,试题难度一般。
【解答】
A.均摊法分析, 晶胞中:个,个,化学式,完全转化为时,可当作立方晶胞计算原子数晶胞中:个,:个,化学式,化合价未改变是非氧化还原反应,故A正确;
B.每个晶胞中个,个离子、在四面体间隙,根据化合价代数和为,可知每个晶胞中的个数为,故B正确;
C.若的晶胞参数为,则间的距离为,故C错误;
D.根据结构,体对角线的一维空间上会出现“”的排布规律,故D正确;
故选C。
15.【答案】
【解析】略
16.【答案】第四周期Ⅰ族;或;;
;等电子体;;
;
与分子、与水分子间易形成氢键,导致其熔沸点较高,且易溶于水;而中的电负性小,不能形成氢键;
。
【解析】
【分析】本题是对物质结构与性质的考查,涉及核外电子排布、等电子体、杂化方式、氢键、晶胞计算等,是对物质结构主干知识的考查,中计算为易错点,题目计算量大,关键是计算晶胞中原子数目。
原子核外电子数为,第四周期Ⅰ 族,根据能量最低原理书写核外电子排布式;基态铜原子核外电子共有种运动状态;
离子中含有个键,没有孤电子对,所以其立体构型是正四面体,硫原子采取杂化;、与 三者原子数是,电子总数是,所以三者互为等电子体;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第族、第族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;根据、的化学式找出规律,然后推断硅原子数目为时含有的氧原子、硅原子数目及所带电荷数,从而确定其化学式;
从分子间形成氢键角度分析解答;
根据均摊法计算晶胞中各原子数目,进而计算晶胞质量,再根据计算晶胞密度。
【解答】原子核外电子数为,第四周期Ⅰ 族,的核外电子排布式为;有个电子就有种运动状态,故答案为:第四周期Ⅰ 族;或;;
离子中含有个键,没有孤电子对,所以其立体构型是正四面体,硫原子采取杂化;、与 三者原子数是,电子总数是,所以三者互为等电子体;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第族、第族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序,所以、、第一电离能由大到小顺序为,故答案为:;等电子体; ;
中含有个四面体结构,所以含有个原子,含有的氧原子数为,含有氧原子数比个硅酸根离子少个,带有的电荷为:;根据图示可知:若一个单环状离子中原子数为,则含有个四面体结构,含有的氧原子比个硅酸根离子恰好少个原子,即:含有个,则含有个,带有的负电荷为:,其化学式为:,故答案为:;
氧的非金属性强于硫,所以甲醇与甲醇分子与分间,甲醇与水分子间易形成氢键,导致熔沸点异常的高,故答案为: 与 分子、 与水分子间易形成氢键,导致其熔沸点较高,且易溶于水;而 中的电负性小,不能形成氢键;
晶胞中原子数目为,原子数目为,原子数目为,故晶胞的质量为,该晶体的密度,
故答案为:。
17.【答案】: 的轨道为半充满,稳定,较大 三角锥形 结构中有个非羟基氧原子而没有,非羟基氧原子越多,酸性越强 或
【解析】解:是号元素,其基态原子的核外电子排布式为:,故基态砷原子电子层中的成对电子与单电子的数量比为:,的轨道为半充满,故A更稳定,较大,
故答案为::;的轨道为半充满,稳定,较大;
依据提示雄黄与反应生成,转移电子,即与反应,依据提示可知反应方程式为:,由图中可知,雌黄中与在周围的个原子形成了个键,孤电子对数为,故其价层电子对数为,故雌黄中的杂化方式为,
故答案为:;;
中与在周围的个原子形成了个键,孤电子对数为,故其价层电子对数为,故A的空间构型为三角锥形,由于结构中有个非羟基氧原子而没有,非羟基氧原子越多,酸性越强,故其酸性弱于砷酸,
故答案为:三角锥形;结构中有个非羟基氧原子而没有,非羟基氧原子越多,酸性越强;
分析晶胞结构可知,若沿体对角线方向进行投影则得到如图,则在图中将原子的位置涂黑为:或,由砷化镓的晶胞结构示意图可知,晶体中原子周围与其距离最近的原子的个数为,而中和原子个数比为:,故两原子的配位数相等,故A原子周围与其距离最近的原子的个数为,若原子的半径为,原子的半径为,则晶胞的边长为:,而最近的两个原子的距离为面对角线的一半,故为,
故答案为:或;;。
是号元素,其基态原子的核外电子排布式为:,据此分析成对单子与成单电子数目及比例,的轨道为半充满,为稳定结构;
雄黄与反应生成,转移电子,即与反应,据此书写方程式,由图中可知,雌黄中与在周围的个原子形成了个键,计算价层电子对数和孤电子对数,进而判断构型;
中与在周围的个原子形成了个键,计算价层电子对数和孤电子对数,进而判断构型,分析两者非羟基氧原子数目,非羟基氧原子越多,酸性越强;
根据砷化镓的晶胞结构示意图可知,若沿体对角线方向进行投影则得到如图,则在图中将原子的位置涂黑为:或,由砷化镓的晶胞结构示意图可知,晶体中原子周围与其距离最近的原子的个数为,而中和原子个数比为:,进而判断配位数,依据均摊法计算原子数目,结合密度公式求算晶胞边长,进而分析最近的两个原子的距离。
本题考查物质结构和性质,涉及晶胞计算、微粒空间构型等知识点,明确原子结构、物质结构是解本题关键,难点是空间利用率计算,会根据密度计算晶胞体积,题目难度中等。
18.【答案】
正四面体形
;离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高
的原子半径较小,价电子数较多,金属键较强;射线衍射法
【解析】
【分析】
本题综合考查物质结构与性质,难度中等,解题关键是理解物质结构与性质的概念、原理与规律。
【解答】
为号元素,基态原子的价电子排布式为,排布时能量最高的电子所占能级为,轨道有个伸展方向。
由可知,在形成配合物时其配位数可以为,故A错误;
B.的空间构型为三角锥形,故B错误;
C.与、互为等电子体,分子内和成三键,故键和键的个数比为,故C正确;
D.为正四面体构型,镍原子为杂化,但为正方形构型,镍离子不为杂化,故D错误,故选C。
与、互为等电子体,、均为正四面体形结构,故的空间构型为正四面体形。
的晶体结构类型与氯化钠相同,根据氯化钠晶体中阴阳离子的配位数均为,则晶胞中的配位数为;、均为离子晶体,影响离子晶体熔点的因素有离子半径和离子所带电荷数,离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高,故的熔点比高。
与均为金属晶体,的原子半径较小,价电子数较多,金属键较强,故金属的熔点和沸点都比金属高;根据晶体和非晶体的差异,区分晶体和非晶体的最可靠的科学方法为射线衍射法。
该晶胞中的个数为,的个数为,晶胞的质量为,晶胞体积为,故晶体密度为。
19.【答案】的原子半径比大且的价电子数比少,则的金属键比弱;
原子处于顶上,原子处于面心,在每个晶胞中,与每个原子紧邻的原子个数为个,而每个原子被个晶胞共有,则与原子紧邻的原子有。
。
【解析】
【分析】
本题主要考查的是物质的结构和性质,涉及金属键、晶胞结构分析和相关计算,意在考查学生的分析能力和知识应用能力。
【解答】
和都属于金属晶体,其熔点、沸点与金属键的强弱有关,和处于同一周期,且核外最外层电子构型相同,但的原子半径比大,且的价电子数比少,则的金属键比弱,因此的熔沸点比低。
根据的化学式及晶胞结构推知,原子处于顶上,原子处于面心,在每个晶胞中,与每个原子紧邻的原子个数为个,而每个原子被个晶胞共有,则与原子紧邻的原子有。
分析晶胞结构可知,与原子之间的最短距离为。
第1页,共1页
一、单选题
1. 下列有关金属键的叙述错误的是 ( )
A. 金属键没有饱和性和方向性
B. 金属键是金属阳离子和自由电子之间强烈的静电吸引作用
C. 金属键中的自由电子属于整块金属
D. 金属的性质和金属固体的形成都与金属键有关
2. 下列有关晶体的认识不正确的是( )
A. 可以用射线衍射鉴别晶体与非晶体
B. 晶体具有各向异性和自范性
C. 晶体中只要有阳离子就一定有阴离子
D. 金刚石中含有键的数目为为阿伏加德罗常数
3. 晶体是一类非常重要的材料,在很多领域都有广泛的应用。我国现已能够拉制出直径为毫米的大直径硅单晶,晶体硅大量用于电子产业。下列对晶体硅的叙述中正确的是
A. 形成晶体硅的速率越大越好
B. 晶体硅没有固定的熔、沸点
C. 可用射线衍射实验来鉴别晶体硅和玻璃
D. 晶体硅的形成与晶体的自范性有关,而与各向异性无关
4. 下列有关晶体常识的叙述错误的是
A. 水晶属于晶体,有固定的熔点,而玻璃无固定的熔点,属于非晶体
B. 当单一波长的射线通过晶体时可以看到明显的分立的斑点或者谱线
C. 晶体都具有自范性。自范性是晶体的本质属性
D. 晶体都具有规则的几何外形,而非晶体都不具有规则的几何外形
5. 有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
A. 为简单立方堆积 为六方最密堆积 为体心立方堆积 为面心立方最密堆积
B. 晶胞中原子的配位数分别为:
C. 晶胞中含有的原子个数分别为:个 个 个 个
D. 空间利用率的大小关系为:
6. 银晶体的晶胞如图所示。设银原子的半径为,用表示阿伏加德罗常数,表示银的摩尔质量。则下列说法错误的是 ( )
A. 银晶体每个晶胞中含有个银原子 B. 配位数是
C. 一个晶胞的体积是 D. 晶体的密度是
7. 如图所示,铁有、、三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是 ( )
A. 晶胞中含有个铁原子,与每个铁原子等距离且最近的铁原子有个
B. 晶体的空间利用率:
C. 设晶胞中铁原子的半径为,则晶胞的体积是
D. 已知铁的相对原子质量为,设阿伏加德罗常数的值为,晶体的密度为 ,则铁原子的半径
8. 下列说法正确的是( )
A. 熔融状态的不能导电,的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类是一种共价化合物、非电解质、盐、分子晶体
B. 某单质熔点,是热和电的良导体,该晶体最可能是分子晶体
C. 含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子
D. 固态金属单质都是金属晶体,金属晶体含有金属键;非金属单质晶体都是分子晶体,分子晶体主要含有共价键、范德华力,有些分子晶体还含有氢键
9. 几种晶体的晶胞结构如图所示。已知:、均为立方晶胞。下列说法错误的是
A. 相同条件下,熔点:
B. 另一种晶胞结构中,当处于体心时,则处于棱心
C. 晶胞中点原子坐标参数为,则点原子坐标参数为
D. 三种晶体中,的配位数均为
10. 铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示黑球代表,白球代表。则下列说法不正确的是
A. 铁镁合金的化学式为
B. 晶体中存在的化学键类型为共价键
C. 晶格能:氧化镁氧化钙
D. 该晶胞的质量是 表示阿伏加德罗常数的值
11. 阅读下列材料,完成题。
含氰废水中氰化物的主要形态是和,具有较强的配位能力,能与形成一种无限长链离子,其片段为 ;结合能力弱于。氰化物浓度较低时,可在碱性条件下用或将其转化为;浓度较高时,可加入、和溶液反应生成溶液。
下列说法正确的是
A. 基态核外电子排布式为
B. 中的配位数为
C. 与形成的离子的化学式为
D. 某铁晶体晶胞如右图所示中与每个紧邻的数为
12. 纳米为无定形非晶态白色粉末,颗粒尺寸小、微孔多、比表面积大、对紫外线反射能力强等特点。下列关于纳米的说法正确的是
A. 对光有各向异性
B. 熔点与晶体相同
C. 与晶体互为同分异构体
D. 可用射线衍射实验区分纳米与晶体
13. 下图是种固体的微观示意图,下列说法正确的是
A. Ⅰ有各向异性
B. Ⅱ有固定的容点
C. Ⅰ、Ⅱ的射线衍射图谱相同
D. Ⅰ、Ⅱ在一定条件下,都会自发形成有规则外形的晶体
14. 硫化锌是一种优良的宽带隙半导体锂离子电池负极材料,具有在充电的同时合金化反应的特点。在充电过程中负极材料晶胞的组成变化如下图所示。
下列说法错误的是
A. 转化为是非氧化还原反应
B. 每个晶胞中的个数为
C. 若的晶胞参数为,则间的距离为
D. 在晶胞体对角线的一维空间上会出现“”的排布规律
15. 锂的某些化合物是性能优异的材料。如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为
A. B. C. D.
二、实验题
16. 可用于制防污涂料,其可由热的铜在硫蒸气或 中反应制得.
铜元素在元素周期表中的位置为 ______ ,的核外电子排布式为 ______ ,基态铜原子核外电子共有 ______ 种运动状态.
在一定条件下可被氧化为.
在中原子的杂化轨道类型为 ______ ;、与 互为 ______ ;其中、、第一电离能由大到小顺序为 ______ ;
硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图 表示,图中、 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为,写出环状结构中硅酸根离子的通式 ______ .
甲醇中的羟基被硫羟基取代生成甲硫醇,二者部分物理性质如表:
物质 熔点 沸点 水溶液
甲醇 互溶
甲硫醇 不溶
甲醇和甲硫醇在熔沸点和水溶性方面性质差异的原因是 ______ .
某化合物由、、 三种元素组成,其晶胞结构如图所示,该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度 ______ 保留三位有效数字.
17. 砷是生命的第七元素,可形成多种重要的化合物。回答下列问题:
基态砷原子电子层中的成对电子与单电子的数量比为 ______ 。的第一电离能比大的原因是 ______ 。
雄黄和雌黄在自然界中共生,是提取砷的主要矿物原料,其结构如图所示,雄黄与反应生成,转移电子,则另一种产物为 ______ 。雌黄中的杂化方式为 ______ 。
亚砷酸可以用来治疗白血病,为三元弱酸,试推测的空间构型为 ______ 。其酸性弱于砷酸的原因是 ______ 。
砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。其晶胞结构如图所示,若沿体对角线方向进行投影则得到如图,请在图中将原子的位置涂黑 ______ 。晶体中原子周围与其距离最近的原子的个数为 ______ ,若原子的半径为,原子的半径为,则最近的两个原子的距离为 ______ 。
简答题
18. 不锈钢是生活中常见的一种不锈钢,业内也叫做不锈钢,指必须含有以上的铬,以上的镍的不锈钢。
回答下列问题:
基态铬原子的价电子排布式为_______________________________________,排布时能量最高的电子所占能级的原子轨道有_________________个伸展方向。
铬和镍能形成多种配合物。如为正四面体构型,为正方形构型,、为正八面体构型等。下列说法正确的是_____________________填选项字母。
A.在形成配合物时其配位数只能为,在形成配合物时其配位数只能为
B.的空间构型为正四面体形
C.与互为等电子体,其中分子内键和键的个数比为
D.和中,镍原子均为杂化
年月,云南一化工厂发生铬污染致数万立方米水质变差、牲畜接连死亡的消息引发社会各界的极大关注。与、互为等电子体,六价铬属于强致突变物质,可诱发肺癌和鼻咽癌,的空间构型为_______________________________________。
的晶体结构类型与氯化钠相同,相关离子半径如下表所示:
晶胞中的配位数为______________________________,的熔点比高的原因是_______________________________________。
与处于同一周期,且核外最外层电子构型相同,但金属的熔点和沸点都比金属高,原因为________________________。区分晶体和非晶体的最可靠的科学方法为_______________________________________。
某铬镍合金的晶胞如图所示,设阿伏加德罗常数的值为,该晶体的密度___________用含、、的代数式表示。
19. 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题。
和属于同一周期,且基态原子核外最外层电子构型相同,但金属的熔点比金属低,试解释原因。
晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为,晶胞中、、分别处于顶点、体心、面心位置,如图所示。与原子紧邻的原子有几个?试说明分析思路。
计算晶体中原子与原子间的最短距离。
答案和解析
1.【答案】
【解析】金属键是金属阳离子和自由电子之间的强烈的相互作用,自由电子不专属于某个特定的金属阳离子,而是在整块固态金属中自由移动,所以金属键没有方向性和饱和性,、C正确;
金属键是金属阳离子和自由电子之间强烈的静电作用,既包括吸引作用也包括排斥作用,B错误;
金属晶体中的金属键决定了金属的性质和金属固体的形成,D正确。
2.【答案】
【解析】
【分析】
本题考查晶体的有关知识,题目难度不大,掌握晶体的特点及各类晶体的构成粒子是解题关键。
【解答】
A.可以用射线衍射鉴别晶体与非晶体,故 A正确;
B.晶体具有各向异性和自范性,故 B正确;
C.金属晶体中有阳离子和自由电子,故C错误;
D.利用均摊法,金刚石中含有键的数目为故D正确
故选C。
3.【答案】
【解析】
【分析】
本题主要考查了晶体硅的性质,较为基础,注意晶体的结构特点和物理性质,难度不大。
【解答】
A.晶体的形成都要有一定的形成条件,如温度、压强、结晶速率等,并不是说结晶速率越快越好,速率太快可能导致晶体质量下降,故A错误;
B.晶体有固定熔沸点,故B错误;
C.射线衍射实验能够测出物质的内部结构,根据微粒是否有规则的排列就能区分出晶体与非晶体,故C正确;
D.晶体的形成与晶体的自范性和各向异性都有密切关系,故D错误。
故选C。
4.【答案】
【解析】
【分析】
本题考查晶体的有关性质,难度不大,解答该题要熟练的掌握晶体和非晶体的特性。
【解答】
A.水晶属于晶体,有固定的熔点,普通玻璃属于非晶体,没有固定熔点,故A正确;
B.当单一波长的射线通过晶体时,会在记录仪上看到分立的斑点或谱线,而同一条件下摄取的非晶体图谱中看不到分立的斑点或明锐的谱线,故B正确;
C.晶体都具有自范性,自范性是晶体的本质属性,故C正确;
D.某些非晶体经人工加工也可能呈现规则的几何外形,如玻璃,故D错误;
故选D。
5.【答案】
【解析】
【分析】
本题考查金属晶胞的识别,侧重考查学生空间想象能力、计算能力,知道每种堆积模型中典型金属,难点是计算配位数,题目难度中等。
【解答】
A.由晶胞结构可知为简单立方堆积,为体心立方堆积,为六方最密堆积,为面心立方最密堆积,故A错误;
B.晶胞中原子的配位数应为,故B错误;
C.每个晶胞含有的原子数分别为,,,,故C正确;
D.四种晶体的空间利用率分别为、、、,则空间利用率的大小关系为:,故D错误。
故选C。
6.【答案】
【解析】根据晶胞图可知,银原子处于顶点与面心上,晶胞中含有的银原子数目为,A正确;
银晶体中,根据晶胞图可知,采用沿、、三轴切割的方法知,每个平面上银原子的配位数是,三个面共有个银原子,银原子配位数是,B正确;
在立方体的各个面的对角线上个银原子彼此两两相切,银原子的半径为,故面对角线长为,则棱长为,故晶胞的体积为,C正确;
每个晶胞中含有个原子,故晶胞质量为,晶胞的体积为,故晶体密度为,D错误。
7.【答案】
【解析】
【分析】本题考查晶胞结构与计算,关键是明确原子在晶胞中的位置,理解原子半径与晶胞棱长的关系,需要学生具有一定的数学计算能力,掌握均摊法进行晶胞有关计算。
【解答】
A.根据切割法,晶胞中含有原子的个数为;由图可知,与每个铁原子等距离且最近的铁原子有个,A正确。
B.设原子的半径为,晶胞的棱长为,晶胞含有原子的个数为,由其晶胞结构示意图可得,则,其空间利用率为;晶胞中含有原子的个数为,因其有原子位于面心,则有,解得,其空间利用率为;晶胞中含有原子的个数为,则有,其空间利用率为;故晶体的空间利用率:,B错误。
C.若晶胞中铁原子的半径为,则晶胞的面对角线长为,所以晶胞的棱长为,则该晶胞的体积为,C正确。
D.晶胞中含有原子的个数为,则该晶胞的体积为,其棱长为,该晶胞的体对角线长为棱长的倍,也是原子半径的倍,即,解得,D正确。
8.【答案】
【解析】
【分析】
本题考查了晶体的类型和晶体的性质,题目难度不大,注意在熔融状态下能导电的化合物一定是离子晶体。
【解答】
A、的稀溶液有弱的导电能力,说明是弱电解质,故A错误;
B、分子晶体不导电,而该单质是热和电的良导体,所以不是分子晶体,故B错误;
C、晶体呈电中性,有阴离子的晶体中一定有阳离子,但是有阳离子的晶体中不一定含有阴离子,比如金属晶体没有阴离子而含有电子,故C正确;
D、金刚石、晶体硅是非金属单质晶体,但不是分子晶体,故D错误;
故选:。
9.【答案】
【解析】A. 半径小于 , 的离子键强于 的, 熔点更高,项正确;
B.另一种 晶胞结构中,当 处于体心时, 处于顶角、处于棱心,项正确;
C.由 晶胞结构及点原子坐标参数为 ,可知 点原子坐标参数为, ,项正确;
D. 中 的配位数为,项错误;
故答案为:。
10.【答案】
【解析】
【分析】
本题考查金属晶体堆积模型,为高频考点,侧重考查学生分析及空间想象能力,难点是配位数的判断及空间利用率计算,注意晶胞中哪些原子紧挨着,为易错点。
【解答】
A.位于面心和顶点,数目为:;原子位于晶胞内,数目为,化学式为:,故A正确;
B.晶体中存在的化学键类型为金属键,故B错误;
C.钙离子半径大于镁离子半径,则晶格能:氧化镁氧化钙,故C正确;
D.该晶胞中有个铁原子和个镁原子,则该晶胞的质量为:,故D正确。
故选B。
11.【答案】
【解析】略
12.【答案】
【解析】
【分析】
本题考查的内容为纳米材料的特性,题目不难,掌握纳米材料和一般晶体的区别即可解答。
【解答】
A.纳米对光没有各向异性,故错误;
B.熔点与晶体不相同,故错误;
C.纳米二氧化硅与晶体均没有分子式,故错误;
D.可用射线衍射实验区分纳米与晶体,故正确。
13.【答案】
【解析】
【分析】
本题考查晶体和非晶体,难度不大,理解晶体特征是解题关键。
【解答】由图可知,Ⅰ中微粒呈周期性有序排布,Ⅱ中微粒排列不规则,则Ⅰ为晶体,Ⅱ为非晶体即无定型二氧化硅;
A.Ⅰ形成的固体为晶体,具有各向异性,故A正确;
B.晶体具有固定熔点,非晶体没有固定熔点,Ⅱ为非晶体,没有固定熔点,故B错误;
C.射线衍射可用于区分晶体和非晶体,则Ⅰ、Ⅱ的射线衍射图谱不相同,故C错误;
D.晶体有规则的几何外形,非晶体没有规则的几何外形,Ⅰ会形成有规则外形的晶体,Ⅱ不会,故D错误;
故选A。
14.【答案】
【解析】
【分析】
本题考查晶体结构,侧重考查学生对信息的分析以及晶胞结构、计算的掌握情况,试题难度一般。
【解答】
A.均摊法分析, 晶胞中:个,个,化学式,完全转化为时,可当作立方晶胞计算原子数晶胞中:个,:个,化学式,化合价未改变是非氧化还原反应,故A正确;
B.每个晶胞中个,个离子、在四面体间隙,根据化合价代数和为,可知每个晶胞中的个数为,故B正确;
C.若的晶胞参数为,则间的距离为,故C错误;
D.根据结构,体对角线的一维空间上会出现“”的排布规律,故D正确;
故选C。
15.【答案】
【解析】略
16.【答案】第四周期Ⅰ族;或;;
;等电子体;;
;
与分子、与水分子间易形成氢键,导致其熔沸点较高,且易溶于水;而中的电负性小,不能形成氢键;
。
【解析】
【分析】本题是对物质结构与性质的考查,涉及核外电子排布、等电子体、杂化方式、氢键、晶胞计算等,是对物质结构主干知识的考查,中计算为易错点,题目计算量大,关键是计算晶胞中原子数目。
原子核外电子数为,第四周期Ⅰ 族,根据能量最低原理书写核外电子排布式;基态铜原子核外电子共有种运动状态;
离子中含有个键,没有孤电子对,所以其立体构型是正四面体,硫原子采取杂化;、与 三者原子数是,电子总数是,所以三者互为等电子体;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第族、第族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;根据、的化学式找出规律,然后推断硅原子数目为时含有的氧原子、硅原子数目及所带电荷数,从而确定其化学式;
从分子间形成氢键角度分析解答;
根据均摊法计算晶胞中各原子数目,进而计算晶胞质量,再根据计算晶胞密度。
【解答】原子核外电子数为,第四周期Ⅰ 族,的核外电子排布式为;有个电子就有种运动状态,故答案为:第四周期Ⅰ 族;或;;
离子中含有个键,没有孤电子对,所以其立体构型是正四面体,硫原子采取杂化;、与 三者原子数是,电子总数是,所以三者互为等电子体;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第族、第族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序,所以、、第一电离能由大到小顺序为,故答案为:;等电子体; ;
中含有个四面体结构,所以含有个原子,含有的氧原子数为,含有氧原子数比个硅酸根离子少个,带有的电荷为:;根据图示可知:若一个单环状离子中原子数为,则含有个四面体结构,含有的氧原子比个硅酸根离子恰好少个原子,即:含有个,则含有个,带有的负电荷为:,其化学式为:,故答案为:;
氧的非金属性强于硫,所以甲醇与甲醇分子与分间,甲醇与水分子间易形成氢键,导致熔沸点异常的高,故答案为: 与 分子、 与水分子间易形成氢键,导致其熔沸点较高,且易溶于水;而 中的电负性小,不能形成氢键;
晶胞中原子数目为,原子数目为,原子数目为,故晶胞的质量为,该晶体的密度,
故答案为:。
17.【答案】: 的轨道为半充满,稳定,较大 三角锥形 结构中有个非羟基氧原子而没有,非羟基氧原子越多,酸性越强 或
【解析】解:是号元素,其基态原子的核外电子排布式为:,故基态砷原子电子层中的成对电子与单电子的数量比为:,的轨道为半充满,故A更稳定,较大,
故答案为::;的轨道为半充满,稳定,较大;
依据提示雄黄与反应生成,转移电子,即与反应,依据提示可知反应方程式为:,由图中可知,雌黄中与在周围的个原子形成了个键,孤电子对数为,故其价层电子对数为,故雌黄中的杂化方式为,
故答案为:;;
中与在周围的个原子形成了个键,孤电子对数为,故其价层电子对数为,故A的空间构型为三角锥形,由于结构中有个非羟基氧原子而没有,非羟基氧原子越多,酸性越强,故其酸性弱于砷酸,
故答案为:三角锥形;结构中有个非羟基氧原子而没有,非羟基氧原子越多,酸性越强;
分析晶胞结构可知,若沿体对角线方向进行投影则得到如图,则在图中将原子的位置涂黑为:或,由砷化镓的晶胞结构示意图可知,晶体中原子周围与其距离最近的原子的个数为,而中和原子个数比为:,故两原子的配位数相等,故A原子周围与其距离最近的原子的个数为,若原子的半径为,原子的半径为,则晶胞的边长为:,而最近的两个原子的距离为面对角线的一半,故为,
故答案为:或;;。
是号元素,其基态原子的核外电子排布式为:,据此分析成对单子与成单电子数目及比例,的轨道为半充满,为稳定结构;
雄黄与反应生成,转移电子,即与反应,据此书写方程式,由图中可知,雌黄中与在周围的个原子形成了个键,计算价层电子对数和孤电子对数,进而判断构型;
中与在周围的个原子形成了个键,计算价层电子对数和孤电子对数,进而判断构型,分析两者非羟基氧原子数目,非羟基氧原子越多,酸性越强;
根据砷化镓的晶胞结构示意图可知,若沿体对角线方向进行投影则得到如图,则在图中将原子的位置涂黑为:或,由砷化镓的晶胞结构示意图可知,晶体中原子周围与其距离最近的原子的个数为,而中和原子个数比为:,进而判断配位数,依据均摊法计算原子数目,结合密度公式求算晶胞边长,进而分析最近的两个原子的距离。
本题考查物质结构和性质,涉及晶胞计算、微粒空间构型等知识点,明确原子结构、物质结构是解本题关键,难点是空间利用率计算,会根据密度计算晶胞体积,题目难度中等。
18.【答案】
正四面体形
;离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高
的原子半径较小,价电子数较多,金属键较强;射线衍射法
【解析】
【分析】
本题综合考查物质结构与性质,难度中等,解题关键是理解物质结构与性质的概念、原理与规律。
【解答】
为号元素,基态原子的价电子排布式为,排布时能量最高的电子所占能级为,轨道有个伸展方向。
由可知,在形成配合物时其配位数可以为,故A错误;
B.的空间构型为三角锥形,故B错误;
C.与、互为等电子体,分子内和成三键,故键和键的个数比为,故C正确;
D.为正四面体构型,镍原子为杂化,但为正方形构型,镍离子不为杂化,故D错误,故选C。
与、互为等电子体,、均为正四面体形结构,故的空间构型为正四面体形。
的晶体结构类型与氯化钠相同,根据氯化钠晶体中阴阳离子的配位数均为,则晶胞中的配位数为;、均为离子晶体,影响离子晶体熔点的因素有离子半径和离子所带电荷数,离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高,故的熔点比高。
与均为金属晶体,的原子半径较小,价电子数较多,金属键较强,故金属的熔点和沸点都比金属高;根据晶体和非晶体的差异,区分晶体和非晶体的最可靠的科学方法为射线衍射法。
该晶胞中的个数为,的个数为,晶胞的质量为,晶胞体积为,故晶体密度为。
19.【答案】的原子半径比大且的价电子数比少,则的金属键比弱;
原子处于顶上,原子处于面心,在每个晶胞中,与每个原子紧邻的原子个数为个,而每个原子被个晶胞共有,则与原子紧邻的原子有。
。
【解析】
【分析】
本题主要考查的是物质的结构和性质,涉及金属键、晶胞结构分析和相关计算,意在考查学生的分析能力和知识应用能力。
【解答】
和都属于金属晶体,其熔点、沸点与金属键的强弱有关,和处于同一周期,且核外最外层电子构型相同,但的原子半径比大,且的价电子数比少,则的金属键比弱,因此的熔沸点比低。
根据的化学式及晶胞结构推知,原子处于顶上,原子处于面心,在每个晶胞中,与每个原子紧邻的原子个数为个,而每个原子被个晶胞共有,则与原子紧邻的原子有。
分析晶胞结构可知,与原子之间的最短距离为。
第1页,共1页
