专题3第四单元分子间作用力 分子晶体同步练习(含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题3第四单元分子间作用力 分子晶体同步练习(含解析)2022-2023学年下学期高二化学苏教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 379.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 21:44:35 | ||
图片预览




文档简介
专题3第四单元分子间作用力分子晶体同步练习
一、单选题
1. 下列说法不正确的是 ( )
A. 金刚石、、、晶体的熔点依次降低
B. 低温下就能升华,说明碘原子间的共价键较弱
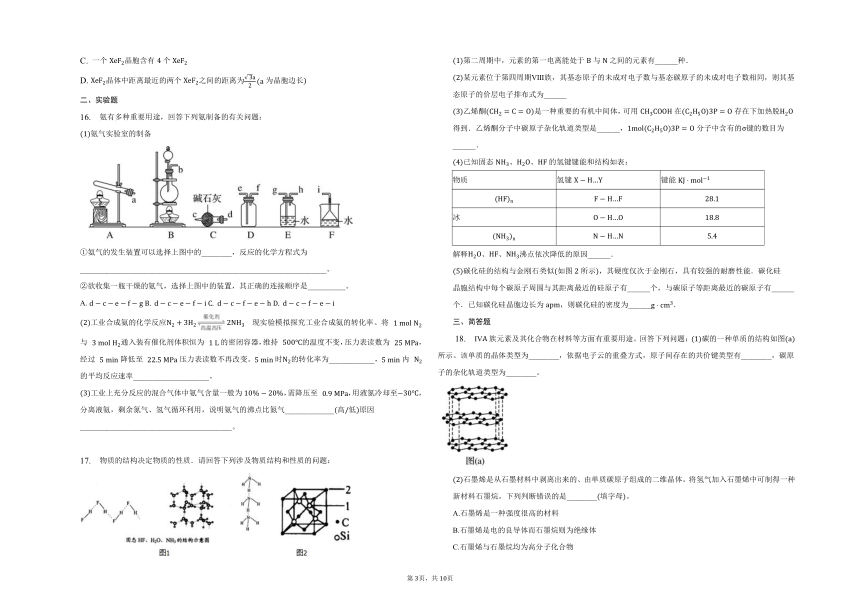
C. 硫酸钠在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性
D. 干冰和石英晶体的物理性质差别很大的原因是所属的晶体类型不同
2. 下列有关性质的比较,正确的是 ( )硬度:
水溶性:3
沸点:
晶格能:
分子或离子中键角:,
熔点:3
沸点:3
熔点:金刚石生铁纯铁钠
熔点:二氧化硅冰
A. B. C. D.
3. 科学家对金表面生长的二维双层冰的边缘结构实现了成像观察,二维冰层的表征细节图及其结构模型图如下。下列说法正确的是( )
A. 受到能量激发时,“准液体”水分子与下层固态水分子脱离,使冰面变滑
B. 固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C. 由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D. 气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
4. 某科学家将水置于一个足够强的电场中,在时,水分子瞬间凝固成“暖冰”。下列关于“暖冰”的说法正确的是 ( )
A. 与晶体类型相同 B. 与所含化学键类型相同
C. 其分子内存在氢键 D. 其密度比水的密度大
5. 下表列出了有关晶体的认识,其中不正确的是( )
晶体 碘化钾 干冰 金刚石 碘
构成晶体的微粒 阴、阳离子 分子 原子 分子
晶体中微粒间存在的作用力 离子键 共价键 共价键 范德华力
A. B. C. D.
6. 下列说法和解释错误的是( )
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物从到,由于相对分子质量增大,范德华力增大,熔、沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性
7. 关于氢键的下列说法中不正确的是( )
A. 晶体冰中每个水分子通过氢键可连接个水分子
B. 的沸点高于,主要因为前者分子间氢键强于后者
C. 邻羟基苯甲醛的沸点低于对羟基苯甲醛,是因为前者形成了分子间氢键,后者形成了分子内氢键
D. 测量接近沸点的水蒸气的相对分子质量大于,是因为相当量的水分子之间通过氢键形成了“缔合分子”
8. 下列关于晶体的说法中一定正确的是( )
A. 分子晶体中都存在共价键
B. 晶体中每个与个相紧邻如图是的晶体结构模型
C. 石墨晶体中存在共价键、范德华力,但没有金属键
D. 金属晶体的熔点都比分子晶体的熔点高
9. 如图为冰晶体的结构模型,大球代表原子,小球代表原子,下列有关说法正确的是 ( )
A. 冰晶体中每个水分子与另外四个水分子形成四面体结构
B. 冰晶体具有空间网状结构,是共价晶体
C. 水分子间通过键形成冰晶体
D. 冰融化时,水分子之间的空隙增大
10. “类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
A. 沸点高低:;则沸点高低:
B. 稳定性强弱:;则稳定性强弱:
C. 干冰是分子晶体;则也是分子晶体
D. 晶体中有阴离子,必有阳离子:则晶体中有阳离子,必有阴离子
11. 北京大学的科技工作者在金表面进行生长的二维双层冰的边缘结构实现了成像观察,二维冰层的表征细节图及其结构模型图如图所示,该成果发表在年月的上。下列说法正确的是( )
A. 受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑
B. 固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C. 由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D. 气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
12. 关于原子结构和微粒间的作用,下列说法错误的是
A. 为 原子的一种激发态
B. F、、、的氢化物沸点随相对分子质量增大依次升高
C. 石墨晶体中既有共价键,又有范德华力,同时还存在类似金属键的作用力
D. 冰中氢键的作用能是指 分解为 和 所需要的能量
13. 下列有关说法正确的是
A. 元素的电负性:
B. 因为二氧化硅的相对分子质量比二氧化碳大,所以沸点:
C. 、、三种离子晶体的熔点:
D. 稳定性:,是因为水分子间存在氢键的缘故
14. 下图分别表示冰晶体结构、干冰晶胞、金刚石晶体结构,下列关于这些晶体的说法正确的是 ( )
A. 冰晶体中只存在分子间作用力和氢键
B. 沸点:金刚石干冰冰
C. 冰晶体中的氧原子和金刚石中的碳原子可形成四面体结构
D. 干冰晶体中每个周围等距离且最近的有个
15. 自从首次合成了第一种稀有气体的化合物以来,人们又相继发现了的一系列化合物,如、等。图甲为的结构示意图,图乙为晶体的晶胞结构图。下列有关说法错误的是 ( )
A. 是由极性键构成的非极性分子
B. 晶体属于分子晶体
C. 一个晶胞含有个
D. 晶体中距离最近的两个之间的距离为为晶胞边长
二、实验题
16. 氨有多种重要用途,回答下列氨制备的有关问题:
氨气实验室的制备
氨气的发生装置可以选择上图中的________,反应的化学方程式为_________________________________________________________________。
欲收集一瓶干燥的氨气,选择上图中的装置,其正确的连接顺序是__________。
A.
工业合成氨的化学反应 现实验模拟探究工业合成氨的转化率。将 与 通入装有催化剂体积恒为 的密闭容器,维持 的温度不变,压力表读数为 ,经过 降低至 压力表读数不再改变。时的转化率为____________,内 的平均反应速率____________________。
工业上充分反应的混合气体中氨气含量一般为,需降压至 ,用液氮冷却至,分离液氨,剩余氮气、氢气循环利用,说明氨气的沸点比氮气_____________高低原因________________________________________。
17. 物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
第二周期中,元素的第一电离能处于与之间的元素有______种.
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为______
乙烯酮是一种重要的有机中间体,可用在存在下加热脱得到.乙烯酮分子中碳原子杂化轨道类型是______,分子中含有的键的数目为______.
已知固态、、的氢键键能和结构如表:
物质 氢键 键能
冰
解释、、沸点依次降低的原因______.
碳化硅的结构与金刚石类似如图所示,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅
晶胞结构中每个碳原子周围与其距离最近的硅原子有______个,与碳原子等距离最近的碳原子有______个.已知碳化硅晶胞边长为,则碳化硅的密度为______.
简答题
18. Ⅳ族元素及其化合物在材料等方面有重要用途。回答下列问题:碳的一种单质的结构如图所示。该单质的晶体类型为________,依据电子云的重叠方式,原子间存在的共价键类型有________,碳原子的杂化轨道类型为________。
石墨烯是从石墨材料中剥离出来的、由单质碳原子组成的二维晶体。将氢气加入石墨烯中可制得一种新材料石墨烷。下列判断错误的是________填字母。
A.石墨烯是一种强度很高的材料
B.石墨烯是电的良导体而石墨烷则为绝缘体
C.石墨烯与石墨烷均为高分子化合物
D.石墨烯与制得石墨烷的反应属于加成反应
、、的熔、沸点依次________填“增大”或“减小”,其原因是_______。
比熔点高的原因是____________________________________________________。
四卤化硅的沸点和二卤化铅的熔点如图所示。
的沸点依、、、次序升高的原因是__________________________________。
结合的沸点和的熔点的变化规律,可推断:依、、、次序,中的化学键的离子性________、共价性________。填“增强”“不变”或“减弱”
19. 请回答以下问题:
第四周期的某主族元素,其第一至五电离能数据如下图所示,则该元素对应原子的层电子排布式为_______________。
如下图所示,每条折线表示周期表ⅣⅦ中的某一族元素简单氢化物的沸点变化。每个小黑点代表一种简单氢化物,其中点代表的是_______________填化学式。简述你的判断依据:_________________________________________________________________________________________________________________________________________________________________________________________________________________________。
在高温高压下所形成的晶体的晶胞如下图所示.该晶体的类型属于_______填“分子”“原子”“离子”或“金属”晶体,该晶体中碳原子轨道的杂化类型为_______________。
在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知半径是的倍,半径是的倍,请回顾课本上和的晶胞,其晶胞边长比为_______________。
的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的图中正确的是_______________。铁原子的配位数是_______________,假设铁原子的半径是,该晶体的密度是,则铁的相对原子质量为_______________设阿伏加德罗常数的值为,表达式中的根号请写在分子上。
答案和解析
1.【答案】
【解析】
【分析】
主要考查了不同晶体的结构微粒及微粒间作用力的区别,常见晶体的结构及物理性质。注意基础知识积累,利用所掌握的基础知识作答即可。
【解答】
A.一般的晶体熔沸点:原子晶体离子晶体分子晶体,金刚石为原子晶体、是离子晶体、为分子晶体,含有氢键的分子晶体熔沸点较高,中含有氢键、不含氢键,则金刚石、、、晶体的熔点依次降低,故 A正确
B.碘升华与分子间作用力有关,与化学键无关,故B错误
C.含有自由移动离子的离子化合物能导电,硫酸钠为离子晶体,熔融状态下离子键被削弱,电离出自由移动阴阳离子,能导电,故C正确
D.干冰和石英都是共价化合物,但是干冰为分子晶体、石英为原子晶体,所属的晶体类型不同,导致其物理性质差异较大,故D正确。
答案:.
2.【答案】
【解析】
【分析】
本题考查了原子晶体、分子晶体、离子晶体的性质比较,难度一般,考查了学生的综合分析能力,要求学生对理论知识了解透彻。
【解答】
,故、、中离子键依次减弱,晶格能依次减小,硬度依次减小,硬度:,故错误;
乙醇分子中有亲水基团,乙醚分子中无亲水基团,故水溶性:,故正确;
分子间能形成氢键,所以沸点高于,故HC,故错误;
中离子电荷数比中离子电荷数大,且离子半径小,所以晶格能:,故错误;
由分子构型可知,键角:,,故正确;
由于,且、、所带电荷数依次增大,所以、、的离子键依次增强,晶格能依次增大,故熔点依次升高,故熔点:,故错误;
分子间氢键作用:,故沸点:,故正确;
因生铁是合金,故熔点小于纯金属,故熔点:金刚石纯铁生铁钠,故错误;
一般情况,熔点:原子晶体离子晶体分子晶体,常温下水为液态,碘为固态,所以熔点:二氧化硅冰,故正确,
所以正确的有,故D正确。
故选D。
3.【答案】
【解析】
【分析】
本题考查了氢键的概念及对物质性质的影响,难度不大,注意氢键只影响物质的物理性质,与物质的稳定性无关。
【解答】
A.受到能量激发时,“准液体”的水分子与下层固态水分子连接的氢键断裂,产生“流动性的水分子”,使冰面变滑,故A正确;
B.水分子之间存在范德华力和氢键,不存在化学键,故B错误;
C.氢键决定水的熔沸点,水分子的稳定性与氢键无关,水分子稳定是因为分子内键的键能较大,故C错误;
D.气相水分子、“准液体”水分子和固态水分子为的不同存在形式,为同一种物质,故D错误。
4.【答案】
【解析】项,“暖冰”是由分子构成的,为分子晶体,是离子晶体,二者晶体类型不同,错误;项,“暖冰”中原子和原子之间形成极性共价键,中原子和原子之间形成极性共价键,二者所含化学键类型相同,正确;项,“暖冰”中水分子间存在氢键,错误;项,“暖冰”中所有水分子中的氢原子都参与形成氢键,使水分子间空隙增大,所以“暖冰”的密度比水的小,错误。
5.【答案】
【解析】
【分析】
本题考查晶体的结构、组成以及微粒间作用力,题目难度不大,明确常见晶体的类型及含有微粒间作用力为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力。
【解答】
A.碘化钾属于离子晶体,阴阳离子通过离子键结合,故A正确;
B.干冰属于分子晶体,构成微粒为分子,晶体微粒间通过范德华力结合,故B错误;
C.金刚石属于共价晶体,构成微粒为原子,晶体微粒间通过共价键结合,故C正确;
D.碘属于分子晶体,分子间通过范德华力结合,故D正确。
故选:。
6.【答案】
【解析】
【分析】
本题考查氢键、分子晶体熔沸点的变化规律、金属的导电性等,题目难度不大。
【解答】
A.水分子间存在范德华力和氢键,冰融化时,需要破坏晶体中的范德华力和部分氢键,冰融化成水时密度变大,故A错误;
B.一般来说,对于组成和结构相似的由分子构成的物质,随相对分子质量的增大,分子间作用力增大,范德华力增大,其熔沸点升高,故B正确;
C.石墨晶体中层与层之间间距较远,是通过范德华力结合起来的,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向,故C正确;
D.金属内部有自由电子,当有外加电压时,电子定向移动,因此金属可以导电,故D正确。
故选A。
7.【答案】
【解析】
【分析】
本题考查氢键与化学键、氢键与物质的性质,为高频考点,明确氢键只影响物质的物理性质是解答本题的关键,题目难度一般,侧重于考查学生对基础知识的应用能力。
【解答】
A.水中的可与两个形成氢键,可与一个形成氢键,则晶体冰中每个水分子通过氢键可连接个水分子,故A正确;
B.氨气形成的氢键数目大于,但的沸点较高,说明的氢键较强,氢键越强,沸点越高,故B正确;
C.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,是因为前者形成分子内氢键,后者形成分子间氢键,故C错误;
D.水分子间存在氢键形成缔合物,所以接近沸点的水蒸气的相对分子质量测量值大于,故D正确。
故选:。
8.【答案】
【解析】
【分析】
本题考查分子晶体、晶胞、晶体类型与熔点的关系等,题目难度不大,解题的关键是对基础知识的灵活运用。
【解答】
A. 分子晶体不一定存在共价键,例如稀有气体分子形成的晶体,单原子分子内没有共价键,只存在分子间作用力,故A错误;
B. 根据晶体的晶胞结构可知,每个周围有个,故B正确;
C. 石墨晶体是混合晶体,每一层的原子间是共价键,层间是范德华力;由于所有的轨道相互平行而且互相重叠,使轨道中的电子可在整个碳原子平面中运动,因此石墨像金属一样有金属键,有导电性,故C错误;
D. 金属晶体的熔沸点跨度较大,一般不和其他三种晶体的熔沸点作比较,比如常温下是液态,而部分分子晶体在常温下呈固态,故金属晶体的熔沸点不一定都比分子晶体的高,故D错误。
9.【答案】
【解析】项,冰晶体属于分子晶体,错误;
项,水分子间通过分子间作用力形成晶体,错误;
项,冰融化时氢键部分断裂,水分子间空隙减小,错误。
10.【答案】
【解析】
【分析】
本题考查元素周期表和元素周期律的应用,涉及元素周期律的递变规律、晶体的组成以及晶体类型的判断,题目难度中等,注意相关知识的积累。
【解析】
A、因第Ⅵ族中,的非金属性最强,且水中分子之间存在氢键,则水的熔、沸点比其他元素氢化物的高,故A错误;
B.元素的非金属性越强,稳定性越大,同周期元素从左到右元素的非金属性逐渐增强,则对应的氢化物的稳定性逐渐增强,故B正确;
C.干冰是分子晶体,而为原子晶体,故C错误。
D.金属晶体组成微粒为金属阳离子和自由电子,不含阴离子,故D错误;
故选:。
11.【答案】
【解析】
【分析】
本题考查了氢键的概念及对物质性质的影响,难度不大,注意氢键只影响物质的物理性质,与物质的稳定性无关。
【解答】
A.受到能量激发时,“准液体”的水分子与下层固态水分子连接的氢键断裂,产生“流动性的水分子”,使冰面变滑,故A正确;
B.水分子之间存在范德华力和氢键,不存在化学键,故B错误;
C.氢键决定水的熔沸点,水分子的稳定性与氢键无关,水分子稳定是因为分子内键的键能较大,故C错误;
D.气相水分子、“准液体”水分子和固态水分子为的不同存在形式,为同一种物质,故D错误。
12.【答案】
【解析】
【分析】
本题主要考查基态和激发态的概念、共价化合物沸点的大小比较、晶体的类型以及作用力等,注意氢键对物质物理性质的影响,题目难度一般。
【解答】
A.表示原子轨道的个电子跃迁到轨道,是原子的一种激发态,故A正确;
B.分子中存在氢键,沸点高于的沸点,故B错误;
C.石墨晶体属于混合晶体,晶体中既有共价键,又有范德华力,同时还存在类似金属键的作用力,故C正确;
D.冰中氢键的作用能是指 分解为 和 所需要的能量,故 D正确。
故选B。
13.【答案】
【解析】
【分析】
本题考查物质性质的比较,掌握元素电负性的递变规律、氢键对物质性质的影响、不同晶体熔沸点的比较是解题的关键,难度不大。
【解答】
A.同周期从左到右,元素的电负性逐渐增强,同主族从上到下,元素的电负性逐渐减弱,故电负性:,故A正确;
B.为原子晶体,为分子晶体,故沸点:,故B错误;
C.离子半径越小,所带电荷越多,晶格能越大,离子晶体的熔点越高,故熔点:,故C错误;
D.稳定性与共价键的强弱有关,与氢键无关,故D错误。
14.【答案】
【解析】
【分析】本题考查了常见晶体的结构与性质,整体难度不大,掌握冰晶体、干冰晶胞、金刚石晶体的结构、所含化学键等知识是解答本题的关键。
【解答】冰晶体中存在的作用力有分子间作用力、氢键、共价键,项错误;
B.金刚石是原子晶体,冰、干冰是分子晶体,所以金刚石的沸点最高,由于冰中存在氢键,其沸点比干冰高,项错误;
C.根据冰和金刚石的结构,冰晶体中个原子与邻近的个原子可形成四面体结构,金刚石中个原子与邻近的个原子可形成四面体结构,项正确;
D.在每个周围等距离且最近的有个,项错误。
15.【答案】
【解析】和之间形成的是极性键,根据的结构示意图可知,该分子为平面正方形结构,正电中心和负电中心重合,所以该分子是由极性键构成的非极性分子,项正确;
晶体是由分子通过范德华力构成的分子晶体,项正确;
根据晶体的晶胞结构可知,一个晶胞中含有的分子的个数为,项错误;
根据晶体的晶胞结构可知,立方体体心的与每个顶点的之间的距离相等且最近,该距离为晶胞体对角线长的一半,即,项正确。
16.【答案】;或;;
;
;;
高;氨气分子间存在氢键。
【解析】
【分析】
本题主要考查的是氨气的实验室制备和反应转化率、反应速率的计算,意在考查学生的实验分析能力和知识应用能力,解题的关键是掌握氨气实验制备的常用方法和转化率、化学反应速率的计算式。
【解答】
实验室中制备氨气时,可选择氯化铵和氢氧化钙作试剂,装置作反应装置,也可选择浓氨水加热的方法,装置作反应装置,故氨气的发生装置可以选择上图中的或,反应的方程式为或,
故答案为:;或;;
氨气密度比空气小,用装置收集时要短口进长口出,氨气极易溶于水,用水尾气处理时要注意防止倒吸,则欲收集一瓶干燥的氨气,图中的装置正确的连接顺序是,故D正确,
故答案为:;
同温同容条件下,气体的压强之比等于气体的物质的量之比,则经过时气体的物质的量为,由反应方程式可知,气体物质的量减少的量与生成的氨气的物质的量相同,则经过 时,生成氨气的物质的量为,由反应方程式可知,消耗氮气的物质的量为,时的转化率为;内的平均反应速率,
故答案为:;;
氨气的沸点比氮气高,原因是氨气分子间存在氢键,容易液化,
故答案为:高;氨气分子间存在氢键。
17.【答案】 和 单个氢键的键能是冰,而平均每个分子含氢键数:冰中个,和只有个,气化要克服的氢键的总键能是冰
【解析】解:同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,半充满的原子和全充满的原子第一电离能要比同周期相邻元素的高,故第一电离能介于、之间的第二周期元素有、、三种元素,
故答案为:;
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,原子的电子排布为,未成对电子数为,则该元素为,其基态原子的价层电子排布图为,
故答案为:;
乙烯酮分子中碳原子均没有孤对电子,中原子形成个键,而中碳原子形成个键,杂化轨道数目分别为、,所以碳原子的杂化轨道类型有和,分子含有个键,分子中含有的键的数目为,
故答案为:和;;
单个氢键的键能是冰,而平均每个分子含氢键数:冰中个,和只有个,气化要克服的氢键的总键能是冰,故H、、沸点依次降低,
故答案为:单个氢键的键能是冰,而平均每个分子含氢键数:冰中个,和只有个,气化要克服的氢键的总键能是冰;
晶胞中原子数目为、原子数目为,每个原子周围有个碳原子,原子配位数与原子数目成反比,则碳原子配位数也是,即碳原子周围与其距离最近的硅原子数目为;
以顶点原子研究,与之距离最近的原子位于面心上,每个顶点原子为个晶胞共用,每个面为个晶胞共用,与碳原子等距离最近的碳原子有个;
晶胞质量为,则晶体密度为,
故答案为:;;.
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第族、第族元素第一电离能大于同周期相邻元素的;
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,碳原子的电子排布为,未成对电子数为,则该元素为;
乙烯酮分子中碳原子均没有孤对电子,中原子形成个键,而中碳原子形成个键,杂化轨道数目分别为、;分子含有个键;
平均每个分子含氢键数:冰中个,和只有个,结合气化要克服的氢键的总键能;
根据均摊法计算晶胞中、原子数目,每个原子周围有个碳原子,原子配位数与原子数目成反比,可以计算碳原子周围与其距离最近的硅原子数目;
以顶点原子研究,与之距离最近的原子位于面心上,每个顶点原子为个晶胞共用,每个面为个晶胞共用;
结合晶胞中原子数目,表示出晶胞质量,再根据计算晶体密度.
本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化轨道、化学键、氢键、晶胞计算等,为易错点、难点,侧重考查学生分析计算能力,难度中等.
18.【答案】混合型晶体;键、键;
增大;三种物质均为分子晶体,结构与组成相似,相对分子质量越大,范德华力越大,熔、沸点越高
为原子晶体而为分子晶体
均为分子晶体,范德华力随相对分子质量增大而增大;减弱增强
【解析】
【分析】本题考查较为综合,涉及杂化类型、晶胞的计算等知识,为高频考点,侧重考查学生的分析能力和计算能力,注意把握石墨的晶体类型以及成键特点,难度中等。
【解答】图表示的晶体结构为石墨,属于混合型晶体。石墨为层状结构,同层的每一个碳原子形成个共价键,以杂化轨道与相邻的三个碳原子以键结合,六个碳原子在同一个平面上形成了正六边形的环,伸展成片层结构,在同一平面的碳原子还各剩下一个轨道,其中有一个电子,这些轨道又都互相平行,并垂直于碳原子杂化轨道构成的平面,形成了大键,故原子间存在的共价键类型有键、键,碳原子的杂化轨道类型为;
石墨烯单层原子间以共价键相结合,强度很高,A正确;
B.石墨烯层与层之间有自由移动的电子,是电的良导体,而石墨烷中没有自由移动的电子,为绝缘体,B正确;
C.石墨烯只含一种碳元素,为碳的单质,C错误;
D.石墨烯与间的反应属于加成反应,D正确。
三种物质均为分子晶体,结构与组成相似,相对分子质量越大,范德华力越大,熔、沸点越高,因此、、的熔、沸点依次增大。
为原子晶体而为分子晶体,所以比熔点高。
四卤化硅为分子晶体,、、、的相对分子质量逐渐增大,沸点与相对分子质量有关,相对分子质量越大,沸点越高。
的熔点先降低后升高,其中为离子晶体,、为分子晶体,可知依、、、次序,中的化学键的离子性减弱、共价性增强。
19.【答案】;
;在ⅣⅦ中的简单氢化物里,、、因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有Ⅳ族元素简单氢化物不存在反常现象;组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,点所在折线对应的是气态氢化物;
原子;;
;
;; 。
【解析】
【分析】
本题主要考查了电离能、氢键、原子杂化方式、晶胞结构的计算、根据密度计算相对原子质量等知识点,综合性较强,需要学生熟记常见晶胞结构特点,掌握均摊法进行晶胞有关计算,注意同周期第一电离能变化异常情况。
【解答】
由该元素的第一至五电离能数据可知,该元素第一二电离能较小,说明容易失去个电子,即最外层有两个电子,已知该元素为第四周期的某主族元素,
则为第四周期,第族元素,其电子排布为、、、,所以层有个电子,则层电子排布式为:;
故答案为:;
在ⅣⅦ中的氢化物里,、、因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有Ⅳ族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,故点代表的应是第族的第二种元素的氢化物,即,
故答案为:;在ⅣⅦ中的氢化物里,、、因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有Ⅳ族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,点所在折线对应的是气态氢化物;
在高温高压下所形成的晶体其晶胞如图所示.该晶体中原子之间通过共价键结合,属于原子晶体;该晶体中原子形成个单键,则原子含有价层电子对,所以原子轨道的杂化类型为,
故答案为:原子;;
设的半径为,则半径为,半径为,氯化钠的晶胞结构如图所示,晶胞的边长为;氯化铯的晶胞结构为,晶胞的体对角线长度为,则晶胞的边长为,所以氯化钠与氯化铯的晶胞边长比为:,
故答案为:;
甲图虚线是沿面对角线的位置,切下之后可以得到一个矩形平面图,在矩形的中心有一个铁原子,而乙图有八个象甲一样的立方体堆积而成,若按甲虚线方向切乙,矩形,且矩形中心有一个原子,符合这一特征的是图;在铁晶胞中,与一个铁原子最近的铁原子距离为立方体边长的,这样的原子有八个,所以铁的配位数为;因为铁原子的半径是 ,根据铁晶胞的结构可知,晶胞的边长为,在每个晶胞中含有铁原子的数目为,设铁原子相对原子质量为,根据密度可得,所以铁的相对原子质量为,
故答案为:;;.
第1页,共1页
一、单选题
1. 下列说法不正确的是 ( )
A. 金刚石、、、晶体的熔点依次降低
B. 低温下就能升华,说明碘原子间的共价键较弱
C. 硫酸钠在熔融状态下离子键被削弱,形成自由移动的离子,具有导电性
D. 干冰和石英晶体的物理性质差别很大的原因是所属的晶体类型不同
2. 下列有关性质的比较,正确的是 ( )硬度:
水溶性:3
沸点:
晶格能:
分子或离子中键角:,
熔点:3
沸点:3
熔点:金刚石生铁纯铁钠
熔点:二氧化硅冰
A. B. C. D.
3. 科学家对金表面生长的二维双层冰的边缘结构实现了成像观察,二维冰层的表征细节图及其结构模型图如下。下列说法正确的是( )
A. 受到能量激发时,“准液体”水分子与下层固态水分子脱离,使冰面变滑
B. 固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C. 由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D. 气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
4. 某科学家将水置于一个足够强的电场中,在时,水分子瞬间凝固成“暖冰”。下列关于“暖冰”的说法正确的是 ( )
A. 与晶体类型相同 B. 与所含化学键类型相同
C. 其分子内存在氢键 D. 其密度比水的密度大
5. 下表列出了有关晶体的认识,其中不正确的是( )
晶体 碘化钾 干冰 金刚石 碘
构成晶体的微粒 阴、阳离子 分子 原子 分子
晶体中微粒间存在的作用力 离子键 共价键 共价键 范德华力
A. B. C. D.
6. 下列说法和解释错误的是( )
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物从到,由于相对分子质量增大,范德华力增大,熔、沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性
7. 关于氢键的下列说法中不正确的是( )
A. 晶体冰中每个水分子通过氢键可连接个水分子
B. 的沸点高于,主要因为前者分子间氢键强于后者
C. 邻羟基苯甲醛的沸点低于对羟基苯甲醛,是因为前者形成了分子间氢键,后者形成了分子内氢键
D. 测量接近沸点的水蒸气的相对分子质量大于,是因为相当量的水分子之间通过氢键形成了“缔合分子”
8. 下列关于晶体的说法中一定正确的是( )
A. 分子晶体中都存在共价键
B. 晶体中每个与个相紧邻如图是的晶体结构模型
C. 石墨晶体中存在共价键、范德华力,但没有金属键
D. 金属晶体的熔点都比分子晶体的熔点高
9. 如图为冰晶体的结构模型,大球代表原子,小球代表原子,下列有关说法正确的是 ( )
A. 冰晶体中每个水分子与另外四个水分子形成四面体结构
B. 冰晶体具有空间网状结构,是共价晶体
C. 水分子间通过键形成冰晶体
D. 冰融化时,水分子之间的空隙增大
10. “类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
A. 沸点高低:;则沸点高低:
B. 稳定性强弱:;则稳定性强弱:
C. 干冰是分子晶体;则也是分子晶体
D. 晶体中有阴离子,必有阳离子:则晶体中有阳离子,必有阴离子
11. 北京大学的科技工作者在金表面进行生长的二维双层冰的边缘结构实现了成像观察,二维冰层的表征细节图及其结构模型图如图所示,该成果发表在年月的上。下列说法正确的是( )
A. 受到能量激发时“准液体”的水分子与下层固态水分子脱离,使冰面变滑
B. 固态水分子之间的化学键较强,“准液体”水分子之间的化学键较弱
C. 由于水分子间的氢键比较牢固,使水分子很稳定,高温下也难分解
D. 气相水分子、“准液体”水分子和固态水分子属于三种不同的化合物
12. 关于原子结构和微粒间的作用,下列说法错误的是
A. 为 原子的一种激发态
B. F、、、的氢化物沸点随相对分子质量增大依次升高
C. 石墨晶体中既有共价键,又有范德华力,同时还存在类似金属键的作用力
D. 冰中氢键的作用能是指 分解为 和 所需要的能量
13. 下列有关说法正确的是
A. 元素的电负性:
B. 因为二氧化硅的相对分子质量比二氧化碳大,所以沸点:
C. 、、三种离子晶体的熔点:
D. 稳定性:,是因为水分子间存在氢键的缘故
14. 下图分别表示冰晶体结构、干冰晶胞、金刚石晶体结构,下列关于这些晶体的说法正确的是 ( )
A. 冰晶体中只存在分子间作用力和氢键
B. 沸点:金刚石干冰冰
C. 冰晶体中的氧原子和金刚石中的碳原子可形成四面体结构
D. 干冰晶体中每个周围等距离且最近的有个
15. 自从首次合成了第一种稀有气体的化合物以来,人们又相继发现了的一系列化合物,如、等。图甲为的结构示意图,图乙为晶体的晶胞结构图。下列有关说法错误的是 ( )
A. 是由极性键构成的非极性分子
B. 晶体属于分子晶体
C. 一个晶胞含有个
D. 晶体中距离最近的两个之间的距离为为晶胞边长
二、实验题
16. 氨有多种重要用途,回答下列氨制备的有关问题:
氨气实验室的制备
氨气的发生装置可以选择上图中的________,反应的化学方程式为_________________________________________________________________。
欲收集一瓶干燥的氨气,选择上图中的装置,其正确的连接顺序是__________。
A.
工业合成氨的化学反应 现实验模拟探究工业合成氨的转化率。将 与 通入装有催化剂体积恒为 的密闭容器,维持 的温度不变,压力表读数为 ,经过 降低至 压力表读数不再改变。时的转化率为____________,内 的平均反应速率____________________。
工业上充分反应的混合气体中氨气含量一般为,需降压至 ,用液氮冷却至,分离液氨,剩余氮气、氢气循环利用,说明氨气的沸点比氮气_____________高低原因________________________________________。
17. 物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
第二周期中,元素的第一电离能处于与之间的元素有______种.
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为______
乙烯酮是一种重要的有机中间体,可用在存在下加热脱得到.乙烯酮分子中碳原子杂化轨道类型是______,分子中含有的键的数目为______.
已知固态、、的氢键键能和结构如表:
物质 氢键 键能
冰
解释、、沸点依次降低的原因______.
碳化硅的结构与金刚石类似如图所示,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅
晶胞结构中每个碳原子周围与其距离最近的硅原子有______个,与碳原子等距离最近的碳原子有______个.已知碳化硅晶胞边长为,则碳化硅的密度为______.
简答题
18. Ⅳ族元素及其化合物在材料等方面有重要用途。回答下列问题:碳的一种单质的结构如图所示。该单质的晶体类型为________,依据电子云的重叠方式,原子间存在的共价键类型有________,碳原子的杂化轨道类型为________。
石墨烯是从石墨材料中剥离出来的、由单质碳原子组成的二维晶体。将氢气加入石墨烯中可制得一种新材料石墨烷。下列判断错误的是________填字母。
A.石墨烯是一种强度很高的材料
B.石墨烯是电的良导体而石墨烷则为绝缘体
C.石墨烯与石墨烷均为高分子化合物
D.石墨烯与制得石墨烷的反应属于加成反应
、、的熔、沸点依次________填“增大”或“减小”,其原因是_______。
比熔点高的原因是____________________________________________________。
四卤化硅的沸点和二卤化铅的熔点如图所示。
的沸点依、、、次序升高的原因是__________________________________。
结合的沸点和的熔点的变化规律,可推断:依、、、次序,中的化学键的离子性________、共价性________。填“增强”“不变”或“减弱”
19. 请回答以下问题:
第四周期的某主族元素,其第一至五电离能数据如下图所示,则该元素对应原子的层电子排布式为_______________。
如下图所示,每条折线表示周期表ⅣⅦ中的某一族元素简单氢化物的沸点变化。每个小黑点代表一种简单氢化物,其中点代表的是_______________填化学式。简述你的判断依据:_________________________________________________________________________________________________________________________________________________________________________________________________________________________。
在高温高压下所形成的晶体的晶胞如下图所示.该晶体的类型属于_______填“分子”“原子”“离子”或“金属”晶体,该晶体中碳原子轨道的杂化类型为_______________。
在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知半径是的倍,半径是的倍,请回顾课本上和的晶胞,其晶胞边长比为_______________。
的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的图中正确的是_______________。铁原子的配位数是_______________,假设铁原子的半径是,该晶体的密度是,则铁的相对原子质量为_______________设阿伏加德罗常数的值为,表达式中的根号请写在分子上。
答案和解析
1.【答案】
【解析】
【分析】
主要考查了不同晶体的结构微粒及微粒间作用力的区别,常见晶体的结构及物理性质。注意基础知识积累,利用所掌握的基础知识作答即可。
【解答】
A.一般的晶体熔沸点:原子晶体离子晶体分子晶体,金刚石为原子晶体、是离子晶体、为分子晶体,含有氢键的分子晶体熔沸点较高,中含有氢键、不含氢键,则金刚石、、、晶体的熔点依次降低,故 A正确
B.碘升华与分子间作用力有关,与化学键无关,故B错误
C.含有自由移动离子的离子化合物能导电,硫酸钠为离子晶体,熔融状态下离子键被削弱,电离出自由移动阴阳离子,能导电,故C正确
D.干冰和石英都是共价化合物,但是干冰为分子晶体、石英为原子晶体,所属的晶体类型不同,导致其物理性质差异较大,故D正确。
答案:.
2.【答案】
【解析】
【分析】
本题考查了原子晶体、分子晶体、离子晶体的性质比较,难度一般,考查了学生的综合分析能力,要求学生对理论知识了解透彻。
【解答】
,故、、中离子键依次减弱,晶格能依次减小,硬度依次减小,硬度:,故错误;
乙醇分子中有亲水基团,乙醚分子中无亲水基团,故水溶性:,故正确;
分子间能形成氢键,所以沸点高于,故HC,故错误;
中离子电荷数比中离子电荷数大,且离子半径小,所以晶格能:,故错误;
由分子构型可知,键角:,,故正确;
由于,且、、所带电荷数依次增大,所以、、的离子键依次增强,晶格能依次增大,故熔点依次升高,故熔点:,故错误;
分子间氢键作用:,故沸点:,故正确;
因生铁是合金,故熔点小于纯金属,故熔点:金刚石纯铁生铁钠,故错误;
一般情况,熔点:原子晶体离子晶体分子晶体,常温下水为液态,碘为固态,所以熔点:二氧化硅冰,故正确,
所以正确的有,故D正确。
故选D。
3.【答案】
【解析】
【分析】
本题考查了氢键的概念及对物质性质的影响,难度不大,注意氢键只影响物质的物理性质,与物质的稳定性无关。
【解答】
A.受到能量激发时,“准液体”的水分子与下层固态水分子连接的氢键断裂,产生“流动性的水分子”,使冰面变滑,故A正确;
B.水分子之间存在范德华力和氢键,不存在化学键,故B错误;
C.氢键决定水的熔沸点,水分子的稳定性与氢键无关,水分子稳定是因为分子内键的键能较大,故C错误;
D.气相水分子、“准液体”水分子和固态水分子为的不同存在形式,为同一种物质,故D错误。
4.【答案】
【解析】项,“暖冰”是由分子构成的,为分子晶体,是离子晶体,二者晶体类型不同,错误;项,“暖冰”中原子和原子之间形成极性共价键,中原子和原子之间形成极性共价键,二者所含化学键类型相同,正确;项,“暖冰”中水分子间存在氢键,错误;项,“暖冰”中所有水分子中的氢原子都参与形成氢键,使水分子间空隙增大,所以“暖冰”的密度比水的小,错误。
5.【答案】
【解析】
【分析】
本题考查晶体的结构、组成以及微粒间作用力,题目难度不大,明确常见晶体的类型及含有微粒间作用力为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力。
【解答】
A.碘化钾属于离子晶体,阴阳离子通过离子键结合,故A正确;
B.干冰属于分子晶体,构成微粒为分子,晶体微粒间通过范德华力结合,故B错误;
C.金刚石属于共价晶体,构成微粒为原子,晶体微粒间通过共价键结合,故C正确;
D.碘属于分子晶体,分子间通过范德华力结合,故D正确。
故选:。
6.【答案】
【解析】
【分析】
本题考查氢键、分子晶体熔沸点的变化规律、金属的导电性等,题目难度不大。
【解答】
A.水分子间存在范德华力和氢键,冰融化时,需要破坏晶体中的范德华力和部分氢键,冰融化成水时密度变大,故A错误;
B.一般来说,对于组成和结构相似的由分子构成的物质,随相对分子质量的增大,分子间作用力增大,范德华力增大,其熔沸点升高,故B正确;
C.石墨晶体中层与层之间间距较远,是通过范德华力结合起来的,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向,故C正确;
D.金属内部有自由电子,当有外加电压时,电子定向移动,因此金属可以导电,故D正确。
故选A。
7.【答案】
【解析】
【分析】
本题考查氢键与化学键、氢键与物质的性质,为高频考点,明确氢键只影响物质的物理性质是解答本题的关键,题目难度一般,侧重于考查学生对基础知识的应用能力。
【解答】
A.水中的可与两个形成氢键,可与一个形成氢键,则晶体冰中每个水分子通过氢键可连接个水分子,故A正确;
B.氨气形成的氢键数目大于,但的沸点较高,说明的氢键较强,氢键越强,沸点越高,故B正确;
C.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,是因为前者形成分子内氢键,后者形成分子间氢键,故C错误;
D.水分子间存在氢键形成缔合物,所以接近沸点的水蒸气的相对分子质量测量值大于,故D正确。
故选:。
8.【答案】
【解析】
【分析】
本题考查分子晶体、晶胞、晶体类型与熔点的关系等,题目难度不大,解题的关键是对基础知识的灵活运用。
【解答】
A. 分子晶体不一定存在共价键,例如稀有气体分子形成的晶体,单原子分子内没有共价键,只存在分子间作用力,故A错误;
B. 根据晶体的晶胞结构可知,每个周围有个,故B正确;
C. 石墨晶体是混合晶体,每一层的原子间是共价键,层间是范德华力;由于所有的轨道相互平行而且互相重叠,使轨道中的电子可在整个碳原子平面中运动,因此石墨像金属一样有金属键,有导电性,故C错误;
D. 金属晶体的熔沸点跨度较大,一般不和其他三种晶体的熔沸点作比较,比如常温下是液态,而部分分子晶体在常温下呈固态,故金属晶体的熔沸点不一定都比分子晶体的高,故D错误。
9.【答案】
【解析】项,冰晶体属于分子晶体,错误;
项,水分子间通过分子间作用力形成晶体,错误;
项,冰融化时氢键部分断裂,水分子间空隙减小,错误。
10.【答案】
【解析】
【分析】
本题考查元素周期表和元素周期律的应用,涉及元素周期律的递变规律、晶体的组成以及晶体类型的判断,题目难度中等,注意相关知识的积累。
【解析】
A、因第Ⅵ族中,的非金属性最强,且水中分子之间存在氢键,则水的熔、沸点比其他元素氢化物的高,故A错误;
B.元素的非金属性越强,稳定性越大,同周期元素从左到右元素的非金属性逐渐增强,则对应的氢化物的稳定性逐渐增强,故B正确;
C.干冰是分子晶体,而为原子晶体,故C错误。
D.金属晶体组成微粒为金属阳离子和自由电子,不含阴离子,故D错误;
故选:。
11.【答案】
【解析】
【分析】
本题考查了氢键的概念及对物质性质的影响,难度不大,注意氢键只影响物质的物理性质,与物质的稳定性无关。
【解答】
A.受到能量激发时,“准液体”的水分子与下层固态水分子连接的氢键断裂,产生“流动性的水分子”,使冰面变滑,故A正确;
B.水分子之间存在范德华力和氢键,不存在化学键,故B错误;
C.氢键决定水的熔沸点,水分子的稳定性与氢键无关,水分子稳定是因为分子内键的键能较大,故C错误;
D.气相水分子、“准液体”水分子和固态水分子为的不同存在形式,为同一种物质,故D错误。
12.【答案】
【解析】
【分析】
本题主要考查基态和激发态的概念、共价化合物沸点的大小比较、晶体的类型以及作用力等,注意氢键对物质物理性质的影响,题目难度一般。
【解答】
A.表示原子轨道的个电子跃迁到轨道,是原子的一种激发态,故A正确;
B.分子中存在氢键,沸点高于的沸点,故B错误;
C.石墨晶体属于混合晶体,晶体中既有共价键,又有范德华力,同时还存在类似金属键的作用力,故C正确;
D.冰中氢键的作用能是指 分解为 和 所需要的能量,故 D正确。
故选B。
13.【答案】
【解析】
【分析】
本题考查物质性质的比较,掌握元素电负性的递变规律、氢键对物质性质的影响、不同晶体熔沸点的比较是解题的关键,难度不大。
【解答】
A.同周期从左到右,元素的电负性逐渐增强,同主族从上到下,元素的电负性逐渐减弱,故电负性:,故A正确;
B.为原子晶体,为分子晶体,故沸点:,故B错误;
C.离子半径越小,所带电荷越多,晶格能越大,离子晶体的熔点越高,故熔点:,故C错误;
D.稳定性与共价键的强弱有关,与氢键无关,故D错误。
14.【答案】
【解析】
【分析】本题考查了常见晶体的结构与性质,整体难度不大,掌握冰晶体、干冰晶胞、金刚石晶体的结构、所含化学键等知识是解答本题的关键。
【解答】冰晶体中存在的作用力有分子间作用力、氢键、共价键,项错误;
B.金刚石是原子晶体,冰、干冰是分子晶体,所以金刚石的沸点最高,由于冰中存在氢键,其沸点比干冰高,项错误;
C.根据冰和金刚石的结构,冰晶体中个原子与邻近的个原子可形成四面体结构,金刚石中个原子与邻近的个原子可形成四面体结构,项正确;
D.在每个周围等距离且最近的有个,项错误。
15.【答案】
【解析】和之间形成的是极性键,根据的结构示意图可知,该分子为平面正方形结构,正电中心和负电中心重合,所以该分子是由极性键构成的非极性分子,项正确;
晶体是由分子通过范德华力构成的分子晶体,项正确;
根据晶体的晶胞结构可知,一个晶胞中含有的分子的个数为,项错误;
根据晶体的晶胞结构可知,立方体体心的与每个顶点的之间的距离相等且最近,该距离为晶胞体对角线长的一半,即,项正确。
16.【答案】;或;;
;
;;
高;氨气分子间存在氢键。
【解析】
【分析】
本题主要考查的是氨气的实验室制备和反应转化率、反应速率的计算,意在考查学生的实验分析能力和知识应用能力,解题的关键是掌握氨气实验制备的常用方法和转化率、化学反应速率的计算式。
【解答】
实验室中制备氨气时,可选择氯化铵和氢氧化钙作试剂,装置作反应装置,也可选择浓氨水加热的方法,装置作反应装置,故氨气的发生装置可以选择上图中的或,反应的方程式为或,
故答案为:;或;;
氨气密度比空气小,用装置收集时要短口进长口出,氨气极易溶于水,用水尾气处理时要注意防止倒吸,则欲收集一瓶干燥的氨气,图中的装置正确的连接顺序是,故D正确,
故答案为:;
同温同容条件下,气体的压强之比等于气体的物质的量之比,则经过时气体的物质的量为,由反应方程式可知,气体物质的量减少的量与生成的氨气的物质的量相同,则经过 时,生成氨气的物质的量为,由反应方程式可知,消耗氮气的物质的量为,时的转化率为;内的平均反应速率,
故答案为:;;
氨气的沸点比氮气高,原因是氨气分子间存在氢键,容易液化,
故答案为:高;氨气分子间存在氢键。
17.【答案】 和 单个氢键的键能是冰,而平均每个分子含氢键数:冰中个,和只有个,气化要克服的氢键的总键能是冰
【解析】解:同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,半充满的原子和全充满的原子第一电离能要比同周期相邻元素的高,故第一电离能介于、之间的第二周期元素有、、三种元素,
故答案为:;
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,原子的电子排布为,未成对电子数为,则该元素为,其基态原子的价层电子排布图为,
故答案为:;
乙烯酮分子中碳原子均没有孤对电子,中原子形成个键,而中碳原子形成个键,杂化轨道数目分别为、,所以碳原子的杂化轨道类型有和,分子含有个键,分子中含有的键的数目为,
故答案为:和;;
单个氢键的键能是冰,而平均每个分子含氢键数:冰中个,和只有个,气化要克服的氢键的总键能是冰,故H、、沸点依次降低,
故答案为:单个氢键的键能是冰,而平均每个分子含氢键数:冰中个,和只有个,气化要克服的氢键的总键能是冰;
晶胞中原子数目为、原子数目为,每个原子周围有个碳原子,原子配位数与原子数目成反比,则碳原子配位数也是,即碳原子周围与其距离最近的硅原子数目为;
以顶点原子研究,与之距离最近的原子位于面心上,每个顶点原子为个晶胞共用,每个面为个晶胞共用,与碳原子等距离最近的碳原子有个;
晶胞质量为,则晶体密度为,
故答案为:;;.
同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第族、第族元素第一电离能大于同周期相邻元素的;
某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,碳原子的电子排布为,未成对电子数为,则该元素为;
乙烯酮分子中碳原子均没有孤对电子,中原子形成个键,而中碳原子形成个键,杂化轨道数目分别为、;分子含有个键;
平均每个分子含氢键数:冰中个,和只有个,结合气化要克服的氢键的总键能;
根据均摊法计算晶胞中、原子数目,每个原子周围有个碳原子,原子配位数与原子数目成反比,可以计算碳原子周围与其距离最近的硅原子数目;
以顶点原子研究,与之距离最近的原子位于面心上,每个顶点原子为个晶胞共用,每个面为个晶胞共用;
结合晶胞中原子数目,表示出晶胞质量,再根据计算晶体密度.
本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化轨道、化学键、氢键、晶胞计算等,为易错点、难点,侧重考查学生分析计算能力,难度中等.
18.【答案】混合型晶体;键、键;
增大;三种物质均为分子晶体,结构与组成相似,相对分子质量越大,范德华力越大,熔、沸点越高
为原子晶体而为分子晶体
均为分子晶体,范德华力随相对分子质量增大而增大;减弱增强
【解析】
【分析】本题考查较为综合,涉及杂化类型、晶胞的计算等知识,为高频考点,侧重考查学生的分析能力和计算能力,注意把握石墨的晶体类型以及成键特点,难度中等。
【解答】图表示的晶体结构为石墨,属于混合型晶体。石墨为层状结构,同层的每一个碳原子形成个共价键,以杂化轨道与相邻的三个碳原子以键结合,六个碳原子在同一个平面上形成了正六边形的环,伸展成片层结构,在同一平面的碳原子还各剩下一个轨道,其中有一个电子,这些轨道又都互相平行,并垂直于碳原子杂化轨道构成的平面,形成了大键,故原子间存在的共价键类型有键、键,碳原子的杂化轨道类型为;
石墨烯单层原子间以共价键相结合,强度很高,A正确;
B.石墨烯层与层之间有自由移动的电子,是电的良导体,而石墨烷中没有自由移动的电子,为绝缘体,B正确;
C.石墨烯只含一种碳元素,为碳的单质,C错误;
D.石墨烯与间的反应属于加成反应,D正确。
三种物质均为分子晶体,结构与组成相似,相对分子质量越大,范德华力越大,熔、沸点越高,因此、、的熔、沸点依次增大。
为原子晶体而为分子晶体,所以比熔点高。
四卤化硅为分子晶体,、、、的相对分子质量逐渐增大,沸点与相对分子质量有关,相对分子质量越大,沸点越高。
的熔点先降低后升高,其中为离子晶体,、为分子晶体,可知依、、、次序,中的化学键的离子性减弱、共价性增强。
19.【答案】;
;在ⅣⅦ中的简单氢化物里,、、因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有Ⅳ族元素简单氢化物不存在反常现象;组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,点所在折线对应的是气态氢化物;
原子;;
;
;; 。
【解析】
【分析】
本题主要考查了电离能、氢键、原子杂化方式、晶胞结构的计算、根据密度计算相对原子质量等知识点,综合性较强,需要学生熟记常见晶胞结构特点,掌握均摊法进行晶胞有关计算,注意同周期第一电离能变化异常情况。
【解答】
由该元素的第一至五电离能数据可知,该元素第一二电离能较小,说明容易失去个电子,即最外层有两个电子,已知该元素为第四周期的某主族元素,
则为第四周期,第族元素,其电子排布为、、、,所以层有个电子,则层电子排布式为:;
故答案为:;
在ⅣⅦ中的氢化物里,、、因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有Ⅳ族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,故点代表的应是第族的第二种元素的氢化物,即,
故答案为:;在ⅣⅦ中的氢化物里,、、因分子间存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有Ⅳ族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,点所在折线对应的是气态氢化物;
在高温高压下所形成的晶体其晶胞如图所示.该晶体中原子之间通过共价键结合,属于原子晶体;该晶体中原子形成个单键,则原子含有价层电子对,所以原子轨道的杂化类型为,
故答案为:原子;;
设的半径为,则半径为,半径为,氯化钠的晶胞结构如图所示,晶胞的边长为;氯化铯的晶胞结构为,晶胞的体对角线长度为,则晶胞的边长为,所以氯化钠与氯化铯的晶胞边长比为:,
故答案为:;
甲图虚线是沿面对角线的位置,切下之后可以得到一个矩形平面图,在矩形的中心有一个铁原子,而乙图有八个象甲一样的立方体堆积而成,若按甲虚线方向切乙,矩形,且矩形中心有一个原子,符合这一特征的是图;在铁晶胞中,与一个铁原子最近的铁原子距离为立方体边长的,这样的原子有八个,所以铁的配位数为;因为铁原子的半径是 ,根据铁晶胞的结构可知,晶胞的边长为,在每个晶胞中含有铁原子的数目为,设铁原子相对原子质量为,根据密度可得,所以铁的相对原子质量为,
故答案为:;;.
第1页,共1页
