人教版(2019)选择性必修一 2.1.1 化学反应速率 课件(共25张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 2.1.1 化学反应速率 课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 22:51:55 | ||
图片预览







文档简介
(共25张PPT)
第二章 化学反应速率和化学平衡
2019人教版选择性必修一
第一节 化学反应速率
第一课时 化学反应速率
化学反应有快有慢
如何控制快慢?
如何表示快慢?
煤的形成
岩石的风化
溶液中的离子反应
如何表示化学反应的快慢?
化学反应速率是用来衡量化学反应进行快慢程度的物理量。
Δc
Δt
计算公式:υ =
通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
Δn
VΔt
=
单位:mol·L-1·s-1 mol/(L·s)
或 mol·L-1·min-1 mol/(L·min)
例.判断正误(正确的打“√”,错误的打“x”)。
(1)化学反应速率是指一定时间内任何一种反应物浓度的减少或生成物浓度的增加( )
(2)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )
(3)由v计算平均速率,用反应物表示为正值,用生成物表示为负值。( )
(4)根据化学反应速率的大小可以推知化学反应进行的快慢( )
(5)对于化学反应来说,反应速率越大,反应现象就越明显( )
(6)有时也可以用单位时间内生成某物质质量的变化量来表示化学反应速率。
( )
√
×
×
×
√
×
如何表示化学反应的快慢
如何表示化学反应的快慢?
Δc
Δt
计算公式:υ =
Δn
VΔt
=
①无论反应物还是生成物,其反应速率永远取正值
②一段时间内的平均速率,而非瞬时速率
③用浓度变化表示化学反应速率适用于气体和溶液中的溶质,不适用于固体和纯液体。
④对于同一个反应来说,用不同的物质来表示该反应的速率时,其数值可能不同,但表达的意义相同。
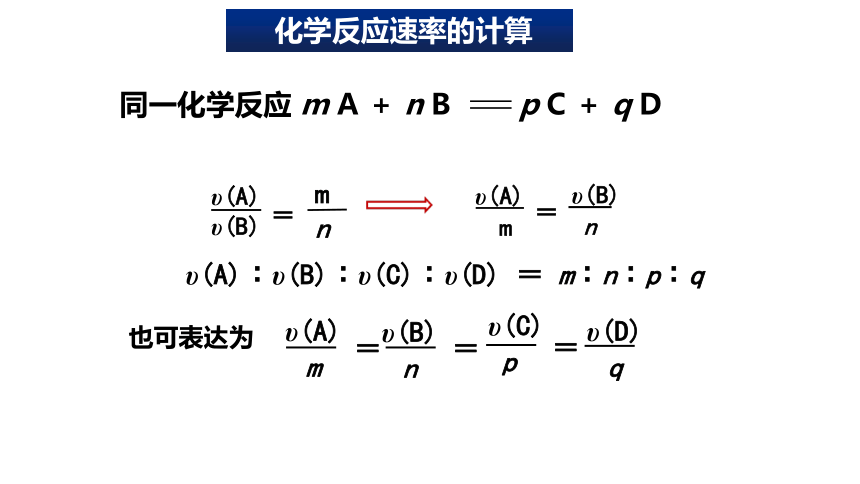
υ(A)︰υ(B)︰υ(C)︰υ(D) = m︰n︰p︰q
也可表达为
m
n
υ(A)
υ(B)
=
υ(B)
n
υ(A)
m
=
同一化学反应 m A + n B p C + q D
υ(A)
m
υ(B)
n
υ(C)
p
υ(D)
q
=
=
=
化学反应速率的计算
化学反应速率的计算
例:在2L密闭容器中加入1molN2 和3molH2发生反应
N2 + 3H2 2NH3 ,2s末时测得容器中含有0.4 moNH3, 求该反应的化学反应速率。
催化剂
高温、高压
1.三段式的应用
N2 + 3H2 2NH3
催化剂
高温、高压
C起始 0.5 1.5 0
ΔC
C2s末
0.2
0.2
0.1
0.3
0.4 1.2
等于系数比
υ(N2)=
Δc(N2)
Δt
=
0.1 mol/L
2 s
= 0.05 mol/(L.min)
υ(NH3)=
Δc(NH3)
Δt
=
0.2 mol/L
2 s
= 0.10 mol/(L.min)
υ(H2)=
Δc(H2)
Δt
=
0.3 mol/L
2 s
= 0.15 mol/(L.min)
速率之比等于方程式前的系数比
例:反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.15mol·L-1·s-1 ②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1 ④v(D)=0.45mol·L-1·s-1
则该反应在不同条件下速率的快慢顺序为:
化学反应速率的计算
④>③=②>①
②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1
④v(D)=0.45mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.225mol·L-1·s-1
v(A)
1
①
=0.15mol·L-1·s-1
v(B)
3
②
=0.2mol·L-1·s-1
v(C)
2
③
=0.2mol·L-1·s-1
v(D)
2
④
=0.225mol·L-1·s-1
①v(A)=0.15mol·L-1·s-1
方法二:比值法
方法一:归一法
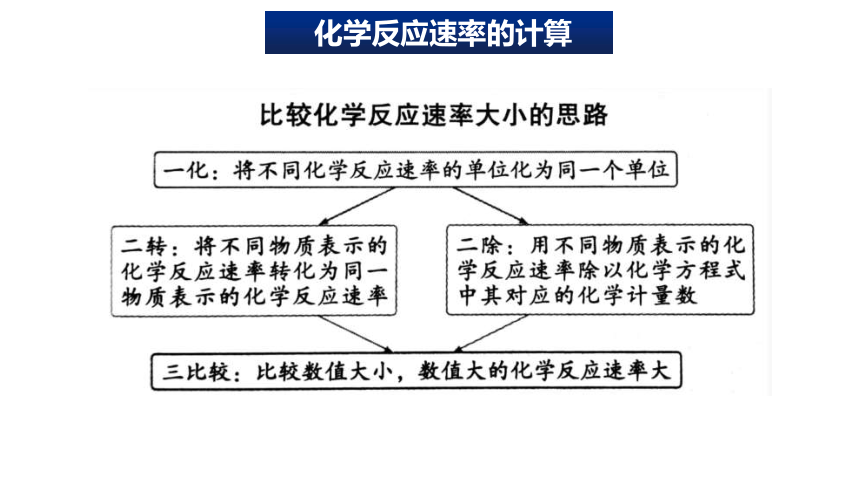
2.比较化学反应速率的快慢
注意:换算成同一物质、同一
单位表示,再比较数值的大小
化学反应速率的计算
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
化学反应速率的测定
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
例:在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2↑
催化剂
υ(O2)
υ(H2O2)
测量
化学反应速率的测定
选择可观测、易操作的变量
浓度变化容易测量吗?我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测哪些物理量呢?
化学反应速率的测定
MnO2
H2O2溶液
MnO2
MnO2
H2O2溶液
(3)视线与量气管凹液面最低处相平
气体体积的测定
(2)调节量气管高度,使量气管与水准管两端液面相平
(1)恢复到室温状态
读数时注意:
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
在一定温度下,10 mL 0.40 mol/L H2O2 溶液发生催化分解,不同时刻测得生成的 O2 的体积(已折算为标准状况)如下表(溶液体积变化忽略不计)。求0~6 min时段的化学反应速率。
化学反应速率的测定
0~6 min:
Δn(O2)=
0.0224 L
22.4 L/mol
= 1.0×10-3 mol
Vm
Δ V(O2)
=
2H2O2 2H2O + O2↑
催化剂
1.0×10-3
n /(mol)
2.0×10-3
≈ 3.3×10-2 mol/(L·min)
υ(H2O2)= =
Δc(H2O2)
Δt
=
0.01L×6 min
2.0×10-3 mol
Δn(H2O2)
V ·Δt
用实验法比较化学反应速率大小
你有哪些方法比较锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液化学反应速率的大小?
设计方案
确定变量:
2.控制不变的因素:
硫酸的浓度
反应的体系
反应物
反应条件
溶液的体积
锌粒的表面积
锌粒的质量
温度
压强
设计方案
确定变量:______________
控制不变的因素:_______________________________
3. 测定数据
硫酸的浓度
锌粒的质量
锌粒的表面积
溶液的体积
温度
压强
a.固定体积,测时间?
b.固定时间,测体积?
用实验法比较化学反应速率大小
你有哪些方法比较锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液化学反应速率的大小?
用实验法比较化学反应速率大小
加入试剂 反应时间(min)
反应速率(mL/min)
1mol/LH2SO4
4mol/LH2SO4
质量相同、颗粒大小相同的锌粒分别与1mol/LH2SO4 、4mol/LH2SO4 反应时,与4mol/LH2SO4 反应的速率快,即反应物的浓度越大,反应越快。
长
短
大
小
用实验法比较化学反应速率大小
思考:采用如图所示实验装置测定锌与稀硫酸反应的速率。(1)检查该装置气密性的操作方法是:
(2)同学们在实验操作中发现本实验设计存在明显不足,例如:
(3)如何改进?
关闭分液温斗活塞,向外拉注射器的活塞,若活塞能回到原位,则气密性良好。
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气体体积,从而消除由于加入液体引起的氢气体积误差。
基于变量控制法测定化学反应速率的思路
寻找
控制
改变
明确
探究问题
关联时间
其他因素
研究因素
测定某条件下的化学反应速率
选择可观测、易操作的变量
控制相关变量相同
测量与反应物浓度相关的物理量
定性描述:化学反应特征现象出现的快、慢
定量描述:
实验测定:控制单一变量,找与浓度相关
可测量、易操作变量
化学反应速率
小结:如何表征化学反应速率
Δc
Δt
υ =
Δn
VΔt
=
达标检测
1.把下列四种X溶液,分别加进四个盛有10mL浓度为2 mol·L-1 的盐酸的烧杯中,并都加水稀释至50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最大的是( )
A.10 mL、2 mol·L-1 B.20 mL、2 mol·L-1
C.10 mL、4 mol·L-1 D.20 mL、3 mol·L-1
D
达标检测
2.反应4A(g)+5B(g)= 4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是( )
A. A的平均反应速率是0.010 mol·L-1·s-1
B. 容器中含D的物质的量至少为0.45mol
C.容器中A、B、C、D的物质的量比一定是4:5:4:6
D. 容器中A的物质的量一定增加了0.3mol
B
3.根据右图填空:
(1)反应物是 ;
生成物是 ;
(2)在2min内A、B、C三者的反应速率值各是多少?
该反应的化学方程式 。
O
2
6
8
B
A
C
4
2
c/mol·L-1
t/min
A、B
C
3mol·L-1·min-1
2mol·L-1·min-1
3mol·L-1·min-1
3A+2B 3C
达标检测
1.氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应,金属Li的化学性质与镁相似。
测定Li3N产品纯度:取a g Li3N产品按如下图所示装置实验。
(1)连接好装置后,检查装置气密性的操作是_______。装好药品,启动反应的操作是_________。
向水准管中加水至左右出现液面差,静置,若液面差保持稳定,则装置气密性良好
倾斜Y形管,将蒸馏水全部注入a g产品中
1.氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应,金属Li的化学性质与镁相似。
测定Li3N产品纯度:取a g Li3N产品按如下图所示装置实验。
(2)反应完毕并冷却之后,将气体全部排入量气管①中,量气管①的读数为V1 mL(已换算成标准状况,下同),将量气管①中气体缓慢导入量气管②,读数为V2 mL。该样品的纯度为___________(用含a、V1、V2的代数式表示,不必化简)。若在量气管②中V2读数时,水准管液面高于左侧液面,测得产品纯度将_______(填“偏高”“偏低”或“无影响”)。
偏高
Li3N+3H2O=3LiOH+ NH3↑
第二章 化学反应速率和化学平衡
2019人教版选择性必修一
第一节 化学反应速率
第一课时 化学反应速率
化学反应有快有慢
如何控制快慢?
如何表示快慢?
煤的形成
岩石的风化
溶液中的离子反应
如何表示化学反应的快慢?
化学反应速率是用来衡量化学反应进行快慢程度的物理量。
Δc
Δt
计算公式:υ =
通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
Δn
VΔt
=
单位:mol·L-1·s-1 mol/(L·s)
或 mol·L-1·min-1 mol/(L·min)
例.判断正误(正确的打“√”,错误的打“x”)。
(1)化学反应速率是指一定时间内任何一种反应物浓度的减少或生成物浓度的增加( )
(2)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )
(3)由v计算平均速率,用反应物表示为正值,用生成物表示为负值。( )
(4)根据化学反应速率的大小可以推知化学反应进行的快慢( )
(5)对于化学反应来说,反应速率越大,反应现象就越明显( )
(6)有时也可以用单位时间内生成某物质质量的变化量来表示化学反应速率。
( )
√
×
×
×
√
×
如何表示化学反应的快慢
如何表示化学反应的快慢?
Δc
Δt
计算公式:υ =
Δn
VΔt
=
①无论反应物还是生成物,其反应速率永远取正值
②一段时间内的平均速率,而非瞬时速率
③用浓度变化表示化学反应速率适用于气体和溶液中的溶质,不适用于固体和纯液体。
④对于同一个反应来说,用不同的物质来表示该反应的速率时,其数值可能不同,但表达的意义相同。
υ(A)︰υ(B)︰υ(C)︰υ(D) = m︰n︰p︰q
也可表达为
m
n
υ(A)
υ(B)
=
υ(B)
n
υ(A)
m
=
同一化学反应 m A + n B p C + q D
υ(A)
m
υ(B)
n
υ(C)
p
υ(D)
q
=
=
=
化学反应速率的计算
化学反应速率的计算
例:在2L密闭容器中加入1molN2 和3molH2发生反应
N2 + 3H2 2NH3 ,2s末时测得容器中含有0.4 moNH3, 求该反应的化学反应速率。
催化剂
高温、高压
1.三段式的应用
N2 + 3H2 2NH3
催化剂
高温、高压
C起始 0.5 1.5 0
ΔC
C2s末
0.2
0.2
0.1
0.3
0.4 1.2
等于系数比
υ(N2)=
Δc(N2)
Δt
=
0.1 mol/L
2 s
= 0.05 mol/(L.min)
υ(NH3)=
Δc(NH3)
Δt
=
0.2 mol/L
2 s
= 0.10 mol/(L.min)
υ(H2)=
Δc(H2)
Δt
=
0.3 mol/L
2 s
= 0.15 mol/(L.min)
速率之比等于方程式前的系数比
例:反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.15mol·L-1·s-1 ②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1 ④v(D)=0.45mol·L-1·s-1
则该反应在不同条件下速率的快慢顺序为:
化学反应速率的计算
④>③=②>①
②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1
④v(D)=0.45mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.225mol·L-1·s-1
v(A)
1
①
=0.15mol·L-1·s-1
v(B)
3
②
=0.2mol·L-1·s-1
v(C)
2
③
=0.2mol·L-1·s-1
v(D)
2
④
=0.225mol·L-1·s-1
①v(A)=0.15mol·L-1·s-1
方法二:比值法
方法一:归一法
2.比较化学反应速率的快慢
注意:换算成同一物质、同一
单位表示,再比较数值的大小
化学反应速率的计算
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
化学反应速率的测定
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
例:在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2↑
催化剂
υ(O2)
υ(H2O2)
测量
化学反应速率的测定
选择可观测、易操作的变量
浓度变化容易测量吗?我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测哪些物理量呢?
化学反应速率的测定
MnO2
H2O2溶液
MnO2
MnO2
H2O2溶液
(3)视线与量气管凹液面最低处相平
气体体积的测定
(2)调节量气管高度,使量气管与水准管两端液面相平
(1)恢复到室温状态
读数时注意:
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
在一定温度下,10 mL 0.40 mol/L H2O2 溶液发生催化分解,不同时刻测得生成的 O2 的体积(已折算为标准状况)如下表(溶液体积变化忽略不计)。求0~6 min时段的化学反应速率。
化学反应速率的测定
0~6 min:
Δn(O2)=
0.0224 L
22.4 L/mol
= 1.0×10-3 mol
Vm
Δ V(O2)
=
2H2O2 2H2O + O2↑
催化剂
1.0×10-3
n /(mol)
2.0×10-3
≈ 3.3×10-2 mol/(L·min)
υ(H2O2)= =
Δc(H2O2)
Δt
=
0.01L×6 min
2.0×10-3 mol
Δn(H2O2)
V ·Δt
用实验法比较化学反应速率大小
你有哪些方法比较锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液化学反应速率的大小?
设计方案
确定变量:
2.控制不变的因素:
硫酸的浓度
反应的体系
反应物
反应条件
溶液的体积
锌粒的表面积
锌粒的质量
温度
压强
设计方案
确定变量:______________
控制不变的因素:_______________________________
3. 测定数据
硫酸的浓度
锌粒的质量
锌粒的表面积
溶液的体积
温度
压强
a.固定体积,测时间?
b.固定时间,测体积?
用实验法比较化学反应速率大小
你有哪些方法比较锌粒和 1 mol/L H2SO4 溶液、4 mol/L H2SO4 溶液化学反应速率的大小?
用实验法比较化学反应速率大小
加入试剂 反应时间(min)
反应速率(mL/min)
1mol/LH2SO4
4mol/LH2SO4
质量相同、颗粒大小相同的锌粒分别与1mol/LH2SO4 、4mol/LH2SO4 反应时,与4mol/LH2SO4 反应的速率快,即反应物的浓度越大,反应越快。
长
短
大
小
用实验法比较化学反应速率大小
思考:采用如图所示实验装置测定锌与稀硫酸反应的速率。(1)检查该装置气密性的操作方法是:
(2)同学们在实验操作中发现本实验设计存在明显不足,例如:
(3)如何改进?
关闭分液温斗活塞,向外拉注射器的活塞,若活塞能回到原位,则气密性良好。
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气体体积,从而消除由于加入液体引起的氢气体积误差。
基于变量控制法测定化学反应速率的思路
寻找
控制
改变
明确
探究问题
关联时间
其他因素
研究因素
测定某条件下的化学反应速率
选择可观测、易操作的变量
控制相关变量相同
测量与反应物浓度相关的物理量
定性描述:化学反应特征现象出现的快、慢
定量描述:
实验测定:控制单一变量,找与浓度相关
可测量、易操作变量
化学反应速率
小结:如何表征化学反应速率
Δc
Δt
υ =
Δn
VΔt
=
达标检测
1.把下列四种X溶液,分别加进四个盛有10mL浓度为2 mol·L-1 的盐酸的烧杯中,并都加水稀释至50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最大的是( )
A.10 mL、2 mol·L-1 B.20 mL、2 mol·L-1
C.10 mL、4 mol·L-1 D.20 mL、3 mol·L-1
D
达标检测
2.反应4A(g)+5B(g)= 4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是( )
A. A的平均反应速率是0.010 mol·L-1·s-1
B. 容器中含D的物质的量至少为0.45mol
C.容器中A、B、C、D的物质的量比一定是4:5:4:6
D. 容器中A的物质的量一定增加了0.3mol
B
3.根据右图填空:
(1)反应物是 ;
生成物是 ;
(2)在2min内A、B、C三者的反应速率值各是多少?
该反应的化学方程式 。
O
2
6
8
B
A
C
4
2
c/mol·L-1
t/min
A、B
C
3mol·L-1·min-1
2mol·L-1·min-1
3mol·L-1·min-1
3A+2B 3C
达标检测
1.氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应,金属Li的化学性质与镁相似。
测定Li3N产品纯度:取a g Li3N产品按如下图所示装置实验。
(1)连接好装置后,检查装置气密性的操作是_______。装好药品,启动反应的操作是_________。
向水准管中加水至左右出现液面差,静置,若液面差保持稳定,则装置气密性良好
倾斜Y形管,将蒸馏水全部注入a g产品中
1.氮化锂(Li3N)是有机合成的催化剂,Li3N遇水剧烈反应,金属Li的化学性质与镁相似。
测定Li3N产品纯度:取a g Li3N产品按如下图所示装置实验。
(2)反应完毕并冷却之后,将气体全部排入量气管①中,量气管①的读数为V1 mL(已换算成标准状况,下同),将量气管①中气体缓慢导入量气管②,读数为V2 mL。该样品的纯度为___________(用含a、V1、V2的代数式表示,不必化简)。若在量气管②中V2读数时,水准管液面高于左侧液面,测得产品纯度将_______(填“偏高”“偏低”或“无影响”)。
偏高
Li3N+3H2O=3LiOH+ NH3↑
