人教版(2019)选择性必修一 2.4 化学反应的调控 课件(共21张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 2.4 化学反应的调控 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 22:55:21 | ||
图片预览






文档简介
(共21张PPT)
“工业合成氨”有话对你说
人教版(2019)选择性必修一 第二章 化学反应速率与平衡
第四节 化学反应的调控
哈伯
博施
向天要化肥
N2(g)+3H2(g) 2NH3(g) △H=-92KJ/mol
合成氨
工艺原理
速率层面
平衡层面
视角一
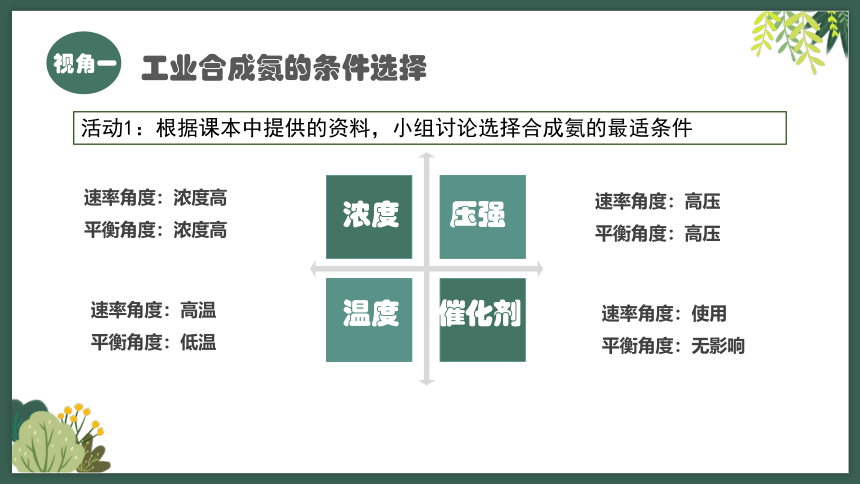
工业合成氨的条件选择
快
多
问题1:从经济效益角度来看,工业生产应该考虑哪些方面的问题?
问题2:请从浓度、温度、压强、催化剂四个维度判断应该如何提高合成氨反应的速率以及提高平衡时氨的含量影响
速率角度:高压
平衡角度:高压
速率角度:使用
平衡角度:无影响
速率角度:浓度高
平衡角度:浓度高
速率角度:高温
平衡角度:低温
浓度
压强
温度
催化剂
视角一
工业合成氨的条件选择
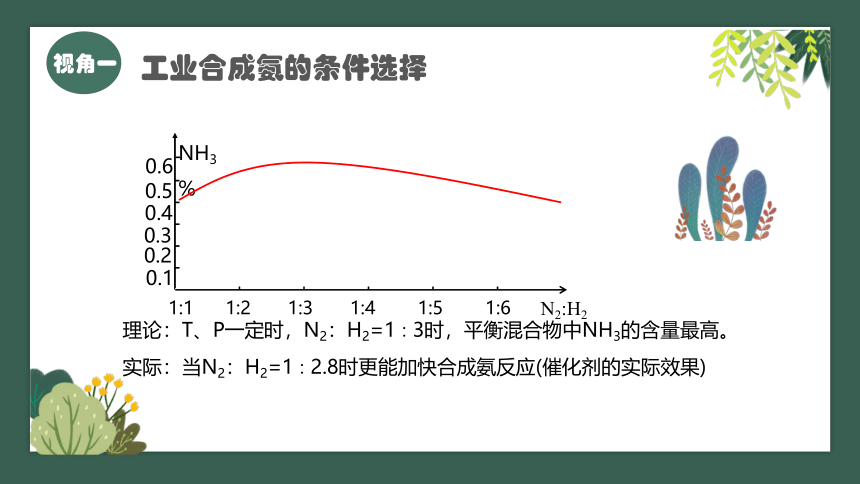
活动1:根据课本中提供的资料,小组讨论选择合成氨的最适条件
原料气中N2相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。
1:1 1:2 1:3 1:4 1:5 1:6
0.5
0.4
0.3
0.1
NH3%
N2:H2
0.2
0.6
理论:T、P一定时,N2:H2=1∶3时,平衡混合物中NH3的含量最高。
实际:当N2:H2=1∶2.8时更能加快合成氨反应(催化剂的实际效果)
视角一
工业合成氨的条件选择
视角一
工业合成氨的条件选择
资料补充
温度 /℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
催化剂 /种类 特点 最适温度 性质 来源 价格
锇 500-600℃ 难加工、易被空气氧化 稀有金属 世界上储量极少 高昂
铀-碳化铀 600℃ 不稳定、对水敏感 放射性元素 稀少 高昂
铁触媒(含铅镁促进剂) 400-500℃ 稳定 地壳中含量多 较为廉价
最优条件:
投料比N2:H2=1∶2.8前提下,选择400-500℃,10MPa-30MPa的条件
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*NH*;NH*+ H*??NH;NH+H*NH
脱附:NHNH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
视角一
工业合成氨的条件选择
哈伯合成氨所用装置
冷却室
反应器
出水口
干燥室
液态NH3
出口
进水口
未反应气体通过循环泵返回
压缩
N2和H2进口
哈伯
1918年获得诺贝尔化学奖
“合成氨的基础开发工作”
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*NH*;NH*+ H*??NH;NH+H*NH
脱附:NHNH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
视角二
工业合成氨的实际生产
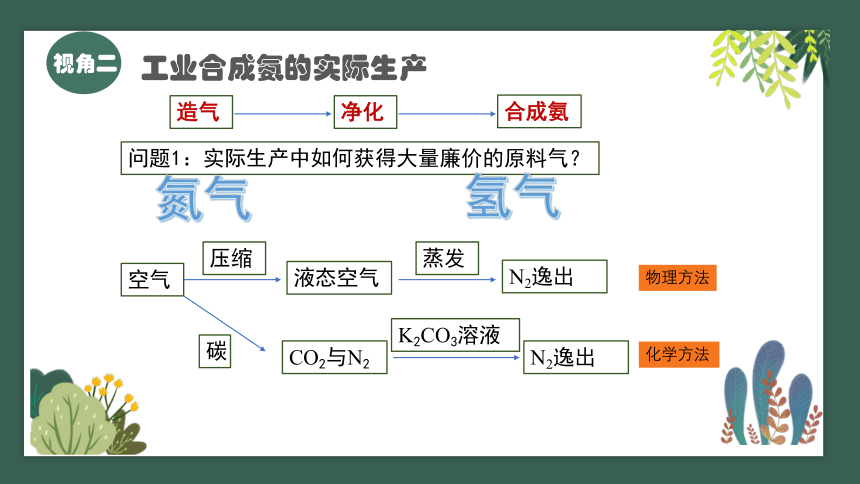
问题1:实际生产中如何获得大量廉价的原料气?
氮气
氢气
空气
压缩
液态空气
蒸发
N2逸出
物理方法
化学方法
碳
CO2与N2
K2CO3溶液
N2逸出
造气
净化
合成氨
你化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*NH*;NH*+ H*??NH;NH+H*NH
脱附:NHNH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
视角二
工业合成氨的实际生产
氢气
方案1:活泼金属与酸的置换反应
方案2:电解水获取氢气
方案3:利用水煤气(主要成分H2和CO)制备氢气
C+H2O CO+H2
CH4+H2O CO+3H2
CO+H2O CO2+H2
问题2:水煤气法中为什么要继续将CO转化为CO2?
煤
天然气
防止催化剂中毒
视角二
工业合成氨的实际生产
资料补充
H2S CO CO2 O2
原料气中主要的杂质气体
问题3:如何在合成氨工业中对原料气进行净化?
①稀氨水吸收H2S:NH3 H2O+H2S==NH4HS+H2O
②使CO转化为CO2:
CO+H2O CO2+H2
③CO2用K2CO3溶液吸收: CO2+ K2CO3+H2O==2KHCO3
④最后原料气还需精制处理,用醋酸、铜、氨配制成的溶液来吸收上述所有气体
铁触媒
博施团队经过了超2万次的实验,最终筛选出铁触媒作为工业合成氨的催化剂
博施
1931年获得诺贝尔化学奖
实现了合成氨的工业化
巴斯夫公司合成氨塔遗址
位于德国路德维尔,是合成氨历史上具有里程碑意义的一次重要创举
视角二
工业合成氨的实际生产
视角二
工业合成氨的实际生产
问题4:即使在选择的最优条件下,合成氨平衡体积分数也只有26.4%,还应如何提高反应物的转化率?
资料
补充
N2 H2 NH3
沸点/℃ -195.8 -252.7 -33.5
N2、 H2 、NH3的常压下沸点
NH3在不同压强下的沸点
压强/MPa 0.1 1 2 5 10 20 50
沸点/℃ -33.5 25 48 86 121 164 237
合成氨的高压条件下,氨气沸点已高于100 ℃,可采用冷凝水冷却
解决
措施
迅速冷却,使气态氨液化,并从平衡混合物中分离出去,促进化学反应向生成氨的方向移动
措施一 分离液氨
将液氨分离后的混合气体循环至热交换器,并不断补充N2、 H2 ,使反应物保持一定浓度,利于合成氨反应
措施二 原料循环
视角二
工业合成氨的实际生产
问题4:即使在选择的最优条件下,合成氨平衡体积分数也只有26.4%,还应如何提高反应物的转化率?
视角二
工业合成氨的实际生产
活动1:请你从天然气为出发,作出工业合成氨的流程图(可考虑副产品)
正确且合适的化学反应
理论条件与实际因素相结合,选出最利于生产的方案
寻找最优的生产设备
视角二
工业合成氨的实际生产
原理
条件
设备
活动2:请你总结化工生产的一般规划
埃特尔
2007年诺贝尔化学奖获得者
研究吸附催化的反应机理
揭开了合成氨的“天机”
视角三
工业合成氨的现状与前景
原料气中N2相对易得,适度过量
有利于提高H2的转化率;N2在催
化剂上的吸附是决速步骤,适度过
量有利于提高整体反应速率。
3.5亿吨
40亿吨
据统计,每年,全世界在合成氨工业中消耗3.5亿吨能源,占全人类能源消耗的1%-2%。
每年,全世界在合成氨工业中向外排放CO2高达40亿吨
视角三
工业合成氨的现状与前景
问题1:你认为哈伯-博施法的合成氨工业还有什么方面亟需突破?
降低能耗
节能减排
温和条件
【展望1】电化学法合成氨
视角三
工业合成氨的现状与前景
【展望2】仿生固氮酶催化剂
视角三
工业合成氨的现状与前景
生物固氮具有条件温和,转化率高达100%的特点,通过生物的固氮酶可以协同活化氮分子,削弱或打开氮氮三键。
化学家若能在仿生固氮酶的研发方面进一步拓展,即有望实现温和条件下的氨合成。
早在20世纪60年代
中国结构化学先驱卢嘉锡院士
提出固氮酶活性中心的结构模型
2016年,中国科学院大连化学物理研究所的科学家们研制出了新型催化剂,将合成氨的温度、压强降到了350℃、1MPa。
大连化物所陈萍研究员所带团队研究锰基催化剂取得新进展
视角三
工业合成氨的现状与前景
【展望3】抗毒能力强的新型催化剂
感谢各位同学聆听
因此,合成氨的研究一直在路上……
启示:只有在那崎岖的小路上不畏艰险奋勇攀登的人,才有希望达
到光辉的顶点。
然而,盛年不重来,一日难再晨,及时当勉励,岁月不待人
“工业合成氨”有话对你说
人教版(2019)选择性必修一 第二章 化学反应速率与平衡
第四节 化学反应的调控
哈伯
博施
向天要化肥
N2(g)+3H2(g) 2NH3(g) △H=-92KJ/mol
合成氨
工艺原理
速率层面
平衡层面
视角一
工业合成氨的条件选择
快
多
问题1:从经济效益角度来看,工业生产应该考虑哪些方面的问题?
问题2:请从浓度、温度、压强、催化剂四个维度判断应该如何提高合成氨反应的速率以及提高平衡时氨的含量影响
速率角度:高压
平衡角度:高压
速率角度:使用
平衡角度:无影响
速率角度:浓度高
平衡角度:浓度高
速率角度:高温
平衡角度:低温
浓度
压强
温度
催化剂
视角一
工业合成氨的条件选择
活动1:根据课本中提供的资料,小组讨论选择合成氨的最适条件
原料气中N2相对易得,适度过量有利于提高H2的转化率;N2在Fe催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率。
1:1 1:2 1:3 1:4 1:5 1:6
0.5
0.4
0.3
0.1
NH3%
N2:H2
0.2
0.6
理论:T、P一定时,N2:H2=1∶3时,平衡混合物中NH3的含量最高。
实际:当N2:H2=1∶2.8时更能加快合成氨反应(催化剂的实际效果)
视角一
工业合成氨的条件选择
视角一
工业合成氨的条件选择
资料补充
温度 /℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
催化剂 /种类 特点 最适温度 性质 来源 价格
锇 500-600℃ 难加工、易被空气氧化 稀有金属 世界上储量极少 高昂
铀-碳化铀 600℃ 不稳定、对水敏感 放射性元素 稀少 高昂
铁触媒(含铅镁促进剂) 400-500℃ 稳定 地壳中含量多 较为廉价
最优条件:
投料比N2:H2=1∶2.8前提下,选择400-500℃,10MPa-30MPa的条件
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*NH*;NH*+ H*??NH;NH+H*NH
脱附:NHNH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
视角一
工业合成氨的条件选择
哈伯合成氨所用装置
冷却室
反应器
出水口
干燥室
液态NH3
出口
进水口
未反应气体通过循环泵返回
压缩
N2和H2进口
哈伯
1918年获得诺贝尔化学奖
“合成氨的基础开发工作”
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*NH*;NH*+ H*??NH;NH+H*NH
脱附:NHNH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
视角二
工业合成氨的实际生产
问题1:实际生产中如何获得大量廉价的原料气?
氮气
氢气
空气
压缩
液态空气
蒸发
N2逸出
物理方法
化学方法
碳
CO2与N2
K2CO3溶液
N2逸出
造气
净化
合成氨
你化学吸附:N2(g)→2N*;H2(g)→2H*;
表面反应:N*+ H*NH*;NH*+ H*??NH;NH+H*NH
脱附:NHNH3(g)
其中, N2的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
视角二
工业合成氨的实际生产
氢气
方案1:活泼金属与酸的置换反应
方案2:电解水获取氢气
方案3:利用水煤气(主要成分H2和CO)制备氢气
C+H2O CO+H2
CH4+H2O CO+3H2
CO+H2O CO2+H2
问题2:水煤气法中为什么要继续将CO转化为CO2?
煤
天然气
防止催化剂中毒
视角二
工业合成氨的实际生产
资料补充
H2S CO CO2 O2
原料气中主要的杂质气体
问题3:如何在合成氨工业中对原料气进行净化?
①稀氨水吸收H2S:NH3 H2O+H2S==NH4HS+H2O
②使CO转化为CO2:
CO+H2O CO2+H2
③CO2用K2CO3溶液吸收: CO2+ K2CO3+H2O==2KHCO3
④最后原料气还需精制处理,用醋酸、铜、氨配制成的溶液来吸收上述所有气体
铁触媒
博施团队经过了超2万次的实验,最终筛选出铁触媒作为工业合成氨的催化剂
博施
1931年获得诺贝尔化学奖
实现了合成氨的工业化
巴斯夫公司合成氨塔遗址
位于德国路德维尔,是合成氨历史上具有里程碑意义的一次重要创举
视角二
工业合成氨的实际生产
视角二
工业合成氨的实际生产
问题4:即使在选择的最优条件下,合成氨平衡体积分数也只有26.4%,还应如何提高反应物的转化率?
资料
补充
N2 H2 NH3
沸点/℃ -195.8 -252.7 -33.5
N2、 H2 、NH3的常压下沸点
NH3在不同压强下的沸点
压强/MPa 0.1 1 2 5 10 20 50
沸点/℃ -33.5 25 48 86 121 164 237
合成氨的高压条件下,氨气沸点已高于100 ℃,可采用冷凝水冷却
解决
措施
迅速冷却,使气态氨液化,并从平衡混合物中分离出去,促进化学反应向生成氨的方向移动
措施一 分离液氨
将液氨分离后的混合气体循环至热交换器,并不断补充N2、 H2 ,使反应物保持一定浓度,利于合成氨反应
措施二 原料循环
视角二
工业合成氨的实际生产
问题4:即使在选择的最优条件下,合成氨平衡体积分数也只有26.4%,还应如何提高反应物的转化率?
视角二
工业合成氨的实际生产
活动1:请你从天然气为出发,作出工业合成氨的流程图(可考虑副产品)
正确且合适的化学反应
理论条件与实际因素相结合,选出最利于生产的方案
寻找最优的生产设备
视角二
工业合成氨的实际生产
原理
条件
设备
活动2:请你总结化工生产的一般规划
埃特尔
2007年诺贝尔化学奖获得者
研究吸附催化的反应机理
揭开了合成氨的“天机”
视角三
工业合成氨的现状与前景
原料气中N2相对易得,适度过量
有利于提高H2的转化率;N2在催
化剂上的吸附是决速步骤,适度过
量有利于提高整体反应速率。
3.5亿吨
40亿吨
据统计,每年,全世界在合成氨工业中消耗3.5亿吨能源,占全人类能源消耗的1%-2%。
每年,全世界在合成氨工业中向外排放CO2高达40亿吨
视角三
工业合成氨的现状与前景
问题1:你认为哈伯-博施法的合成氨工业还有什么方面亟需突破?
降低能耗
节能减排
温和条件
【展望1】电化学法合成氨
视角三
工业合成氨的现状与前景
【展望2】仿生固氮酶催化剂
视角三
工业合成氨的现状与前景
生物固氮具有条件温和,转化率高达100%的特点,通过生物的固氮酶可以协同活化氮分子,削弱或打开氮氮三键。
化学家若能在仿生固氮酶的研发方面进一步拓展,即有望实现温和条件下的氨合成。
早在20世纪60年代
中国结构化学先驱卢嘉锡院士
提出固氮酶活性中心的结构模型
2016年,中国科学院大连化学物理研究所的科学家们研制出了新型催化剂,将合成氨的温度、压强降到了350℃、1MPa。
大连化物所陈萍研究员所带团队研究锰基催化剂取得新进展
视角三
工业合成氨的现状与前景
【展望3】抗毒能力强的新型催化剂
感谢各位同学聆听
因此,合成氨的研究一直在路上……
启示:只有在那崎岖的小路上不畏艰险奋勇攀登的人,才有希望达
到光辉的顶点。
然而,盛年不重来,一日难再晨,及时当勉励,岁月不待人
