人教版(2019)选择性必修一 3.2.2 水的电离和溶液的PH 课件(共19张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修一 3.2.2 水的电离和溶液的PH 课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-18 22:56:33 | ||
图片预览






文档简介
(共19张PPT)
第二节 水的电离和溶液的PH
选修一 第三章 水溶液中的离子反应与平衡
( 2课时)
前课小结:
电离平衡只是化学平衡的一种具体形式。它的主体是弱电解质(弱酸、弱碱、水)在一定溶剂中建立的化学平衡,符合化学平衡的基本特征。
讨论:
通HCl气体
CH3COOH H++CH3COO- H >0
H+为0.1mol·L-1的醋酸溶液
加水
加0.1mol·L-1的盐酸
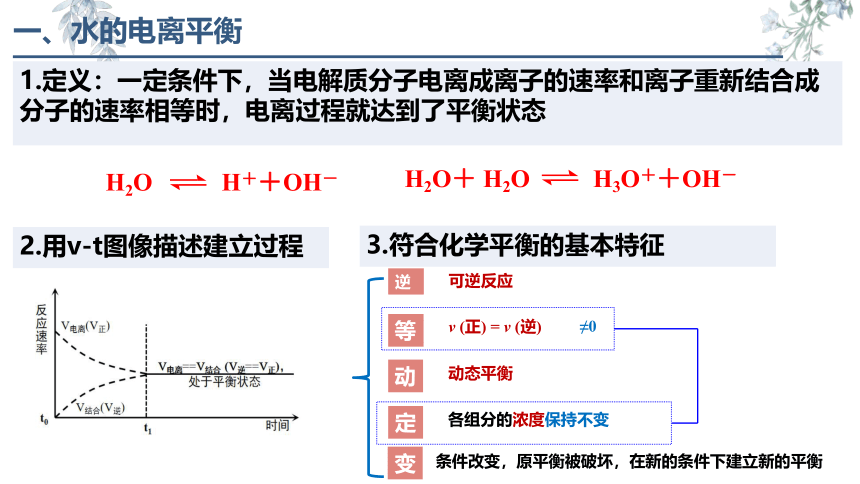
1.定义:一定条件下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态
H2O H++OH-
2.用v-t图像描述建立过程
一、水的电离平衡
3.符合化学平衡的基本特征
可逆反应
ν (正) = ν (逆)
逆
等
动
≠0
动态平衡
定
各组分的浓度保持不变
变
条件改变,原平衡被破坏,在新的条件下建立新的平衡
H2O+ H2O H3O++OH-
4.水的离子积常数
(1)表达式:
一、水的电离平衡
H2O H++OH- △H >0
注:c(H2O)=
1 L
1000 g
18 g·mol-1
室温下55.6mol H2O中有1×10-7mol H2O电离,因此c(H2O)可视为常数。
KW=c(H+)·c(OH-)
K电离 .c(H2O) =c(H+) .c(OH-)
Kw
已知 25℃ 时,1 L 纯水电离出的 n(H+) = n(OH-) = 1×10-7 mol
则 Kw = c(H+)×c(OH-) = 1×10-14
4.水的离子积常数
(1)表达式:
一、水的电离平衡
H2O H++OH- △H >0
(2)影响因素:
(3)适用范围:
KW=c(H+)·c(OH-)
已知 25℃ 时,1 L 纯水电离出的 n(H+) = n(OH-) = 1×10-7 mol
则 Kw = c(H+)×c(OH-) = 1×10-14
纯水、稀溶液
1.某温度下,纯水中c(H+)=2.0×10-7 mol·L-1,则此时c(OH-)=_____________
温度不变,向水中滴入盐酸使c(H+)=5.0 mol·L-1,则溶液中c(OH)=_____________。
解析:纯水中c(H+)始终等于c(OH-),所以c(OH-)=2.0×10-7 mol·L-1。此温度下,KW=c(H+)·c(OH-)=4.0×10-14。向水中滴加盐酸,KW不变,
2.0×10-7 mol·L-1
8.0×10-15 mol·L-1
课堂评价
c(OH-)/mol/L
c(H+)
/mol/L
O
5.影响水电离平衡的因素
一、水的电离平衡
平衡移动方向 c(H+) c(OH-) 电离 程度 Kw
升温
降温
通入HCl气体
NaOH固体
加活泼金属 如Na
加NaHSO4
越热越电离
同离子效应
②外因
①内因:水是一种极弱电解质
H2O H++OH- △H >0
25°C 1L水只有10-7molH2O发生电离
5.影响水电离平衡的因素
一、水的电离平衡
0.1mol·L-1的硫酸 0.1mol·L-1的盐酸 0.1mol·L-1的醋酸 0.1mol·L-1的NaOH 0.1mol·L-1的氨水 0.1mol·L-1的氯化铵
温度 25℃ 25℃ 25℃ 25℃ 25℃ 25℃
Kw
c(H+)
c(OH-)
PH 11 5
c(H+)水
c(OH-)水
定量讨论
H2O H++OH- △H >0
基于以上知识:KW=c(H+)·c(OH-) 补充: pH=﹣lgc(H+) ; c(H+)=10-pH
2、室温下,某溶液中由水电离产生的c(H+) H2O= 10-12 mol/L ,则该溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?
解答: c(H+) H2O= c(OH-) H2O= 10-12 mol/L
若c(H+) aq= c(H+) H2O= 10-12 mol/L 则 c(OH-) aq= 10-2 mol/L 溶液显碱性
若c(OH-) aq= c(OH-) H2O = 10-12 mol/L 则 c(H+) aq= 10-2 mol/L 溶液显酸性
讨论
3.如图中三条曲线表示不同温度下水的离子积常数,下列说法不正确的是 ( )
A.图中温度:T3>T2>T1
B.图中pH关系:pH(B)=pH(D)=pH(E)
C.图中五点Kw间的关系:E>D>A=B=C
D.C点的溶液可能显酸性
D
【解析】选。升高温度促进水的电离,根据图象知,离子积常数KW3>KW2>KW1,所以温度T3>T2>T1,A正确;根据图象知,B、D、E三点溶液的c(H+)相等,则pH相等,B正确;温度越高,离子积常数越大,KW间的关系:E>D>A=B=C,C正确;C点时,Kw=1×10-14,c(OH-)=1×10-6,溶液的pH=8,显碱性,D错误。
课堂评价
基于以上知识:KW=c(H+)·c(OH-) 补充: pH=﹣lgc(H+) ; c(H+)=10-pH
讨论 .
请判断下列溶液一定为酸性的是?并给出关于溶液酸碱性判断的合理建议。
①含有H+的水溶液
②c(H+)>c(OH-)的溶液
③某温度下,c(H+)=2×10-7mol·L-1的纯水溶液
④25℃时,c(H+)=1×10-6mol·L-1的溶液
⑤ pH<7的溶液
⑥常温下,能使石蕊变红的溶液
⑦c(H+)= 的溶液
⑧pH=pOH的溶液
1.绝对标准是:c(H+)与c(OH-)的相对大小
根本依据 常用依据一(室温) 常用依据二(室温) 结论
2.溶液酸碱性判断“三判据”
c(H+) >c(OH-)
c(H+) >10-7 mol/L
c(H+) = c(OH-)
c(H+) < c(OH-)
c(H+)= 1×10-7 mol/L
c(H+) < 1×10-7 mol/L
pH<7
溶液呈酸性
溶液呈碱性
溶液呈中性
pH=7
pH>7
二、溶液酸碱性判断依据
1.酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
三、溶液pH的测定方法
广泛pH试纸
精密pH试纸
2.pH试纸法(定量粗略测量)
注 意:
使用pH试纸不能用蒸馏水润湿。润湿后相当于稀释了溶液。
若是酸性溶液,则润湿后测得pH偏大;
若是碱性溶液,则润湿后测得pH偏小;
若是中性溶液,则无影响;
pH计又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
3.pH计法
(1)pH=2的HCl溶液和pH=2的H2SO4溶液中c(H+)相等吗 它们混合后c(H+)如何变化
提示:只要两溶液中的pH相等,则它们的c(H+)一定相等;c(H+)相等的两强酸溶液混合后,c(H+)不会发生变化。
(2)在一定温度下,强碱的pH一定比弱碱的pH大吗
提示:不一定。pH的大小,取决于溶液中c(OH-)的大小。强碱溶液中c(OH-)不一定大,弱碱溶液中c(OH-)不一定小。
本课小结:
感谢聆听
Chemistry = Chem + is + try
--that is, Chemistry is try!
中科院院士陆熙炎
第二节 水的电离和溶液的PH
选修一 第三章 水溶液中的离子反应与平衡
( 2课时)
前课小结:
电离平衡只是化学平衡的一种具体形式。它的主体是弱电解质(弱酸、弱碱、水)在一定溶剂中建立的化学平衡,符合化学平衡的基本特征。
讨论:
通HCl气体
CH3COOH H++CH3COO- H >0
H+为0.1mol·L-1的醋酸溶液
加水
加0.1mol·L-1的盐酸
1.定义:一定条件下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态
H2O H++OH-
2.用v-t图像描述建立过程
一、水的电离平衡
3.符合化学平衡的基本特征
可逆反应
ν (正) = ν (逆)
逆
等
动
≠0
动态平衡
定
各组分的浓度保持不变
变
条件改变,原平衡被破坏,在新的条件下建立新的平衡
H2O+ H2O H3O++OH-
4.水的离子积常数
(1)表达式:
一、水的电离平衡
H2O H++OH- △H >0
注:c(H2O)=
1 L
1000 g
18 g·mol-1
室温下55.6mol H2O中有1×10-7mol H2O电离,因此c(H2O)可视为常数。
KW=c(H+)·c(OH-)
K电离 .c(H2O) =c(H+) .c(OH-)
Kw
已知 25℃ 时,1 L 纯水电离出的 n(H+) = n(OH-) = 1×10-7 mol
则 Kw = c(H+)×c(OH-) = 1×10-14
4.水的离子积常数
(1)表达式:
一、水的电离平衡
H2O H++OH- △H >0
(2)影响因素:
(3)适用范围:
KW=c(H+)·c(OH-)
已知 25℃ 时,1 L 纯水电离出的 n(H+) = n(OH-) = 1×10-7 mol
则 Kw = c(H+)×c(OH-) = 1×10-14
纯水、稀溶液
1.某温度下,纯水中c(H+)=2.0×10-7 mol·L-1,则此时c(OH-)=_____________
温度不变,向水中滴入盐酸使c(H+)=5.0 mol·L-1,则溶液中c(OH)=_____________。
解析:纯水中c(H+)始终等于c(OH-),所以c(OH-)=2.0×10-7 mol·L-1。此温度下,KW=c(H+)·c(OH-)=4.0×10-14。向水中滴加盐酸,KW不变,
2.0×10-7 mol·L-1
8.0×10-15 mol·L-1
课堂评价
c(OH-)/mol/L
c(H+)
/mol/L
O
5.影响水电离平衡的因素
一、水的电离平衡
平衡移动方向 c(H+) c(OH-) 电离 程度 Kw
升温
降温
通入HCl气体
NaOH固体
加活泼金属 如Na
加NaHSO4
越热越电离
同离子效应
②外因
①内因:水是一种极弱电解质
H2O H++OH- △H >0
25°C 1L水只有10-7molH2O发生电离
5.影响水电离平衡的因素
一、水的电离平衡
0.1mol·L-1的硫酸 0.1mol·L-1的盐酸 0.1mol·L-1的醋酸 0.1mol·L-1的NaOH 0.1mol·L-1的氨水 0.1mol·L-1的氯化铵
温度 25℃ 25℃ 25℃ 25℃ 25℃ 25℃
Kw
c(H+)
c(OH-)
PH 11 5
c(H+)水
c(OH-)水
定量讨论
H2O H++OH- △H >0
基于以上知识:KW=c(H+)·c(OH-) 补充: pH=﹣lgc(H+) ; c(H+)=10-pH
2、室温下,某溶液中由水电离产生的c(H+) H2O= 10-12 mol/L ,则该溶液呈酸性还是碱性?并求算该溶液中 c(H+)的可能值 ?
解答: c(H+) H2O= c(OH-) H2O= 10-12 mol/L
若c(H+) aq= c(H+) H2O= 10-12 mol/L 则 c(OH-) aq= 10-2 mol/L 溶液显碱性
若c(OH-) aq= c(OH-) H2O = 10-12 mol/L 则 c(H+) aq= 10-2 mol/L 溶液显酸性
讨论
3.如图中三条曲线表示不同温度下水的离子积常数,下列说法不正确的是 ( )
A.图中温度:T3>T2>T1
B.图中pH关系:pH(B)=pH(D)=pH(E)
C.图中五点Kw间的关系:E>D>A=B=C
D.C点的溶液可能显酸性
D
【解析】选。升高温度促进水的电离,根据图象知,离子积常数KW3>KW2>KW1,所以温度T3>T2>T1,A正确;根据图象知,B、D、E三点溶液的c(H+)相等,则pH相等,B正确;温度越高,离子积常数越大,KW间的关系:E>D>A=B=C,C正确;C点时,Kw=1×10-14,c(OH-)=1×10-6,溶液的pH=8,显碱性,D错误。
课堂评价
基于以上知识:KW=c(H+)·c(OH-) 补充: pH=﹣lgc(H+) ; c(H+)=10-pH
讨论 .
请判断下列溶液一定为酸性的是?并给出关于溶液酸碱性判断的合理建议。
①含有H+的水溶液
②c(H+)>c(OH-)的溶液
③某温度下,c(H+)=2×10-7mol·L-1的纯水溶液
④25℃时,c(H+)=1×10-6mol·L-1的溶液
⑤ pH<7的溶液
⑥常温下,能使石蕊变红的溶液
⑦c(H+)= 的溶液
⑧pH=pOH的溶液
1.绝对标准是:c(H+)与c(OH-)的相对大小
根本依据 常用依据一(室温) 常用依据二(室温) 结论
2.溶液酸碱性判断“三判据”
c(H+) >c(OH-)
c(H+) >10-7 mol/L
c(H+) = c(OH-)
c(H+) < c(OH-)
c(H+)= 1×10-7 mol/L
c(H+) < 1×10-7 mol/L
pH<7
溶液呈酸性
溶液呈碱性
溶液呈中性
pH=7
pH>7
二、溶液酸碱性判断依据
1.酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
三、溶液pH的测定方法
广泛pH试纸
精密pH试纸
2.pH试纸法(定量粗略测量)
注 意:
使用pH试纸不能用蒸馏水润湿。润湿后相当于稀释了溶液。
若是酸性溶液,则润湿后测得pH偏大;
若是碱性溶液,则润湿后测得pH偏小;
若是中性溶液,则无影响;
pH计又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
3.pH计法
(1)pH=2的HCl溶液和pH=2的H2SO4溶液中c(H+)相等吗 它们混合后c(H+)如何变化
提示:只要两溶液中的pH相等,则它们的c(H+)一定相等;c(H+)相等的两强酸溶液混合后,c(H+)不会发生变化。
(2)在一定温度下,强碱的pH一定比弱碱的pH大吗
提示:不一定。pH的大小,取决于溶液中c(OH-)的大小。强碱溶液中c(OH-)不一定大,弱碱溶液中c(OH-)不一定小。
本课小结:
感谢聆听
Chemistry = Chem + is + try
--that is, Chemistry is try!
中科院院士陆熙炎
