人教版(2019)选择性必修第三册 4.4 氢原子光谱和玻尔的原子模型 课件(共20张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修第三册 4.4 氢原子光谱和玻尔的原子模型 课件(共20张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2023-06-19 07:32:41 | ||
图片预览





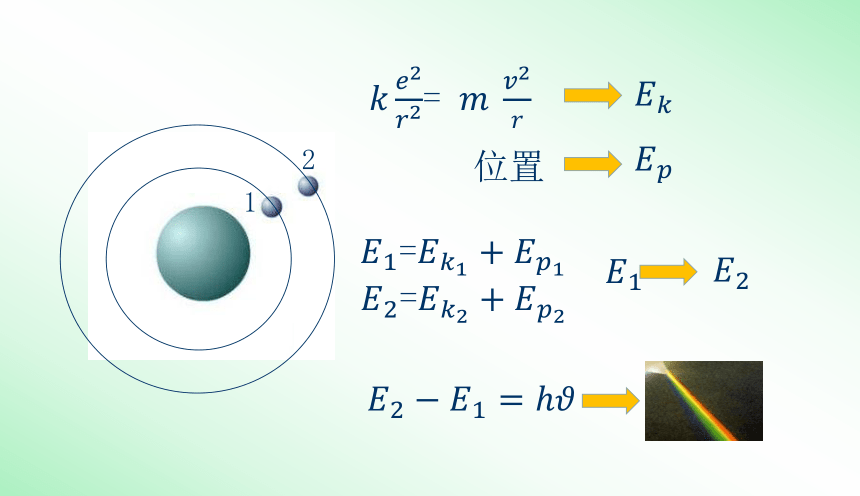

文档简介
(共20张PPT)
第四章 原子结构和波粒二象性
4.4 氢原子光谱和玻尔的氢原子模型
原子具有核式结构,那么核外电子如何运动?
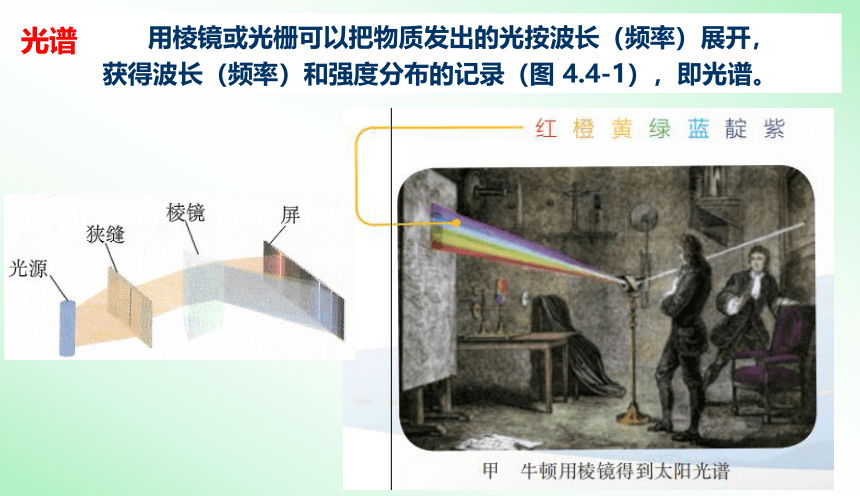
光谱
用棱镜或光栅可以把物质发出的光按波长(频率)展开,
获得波长(频率)和强度分布的记录(图 4.4-1),即光谱。
把食盐放在火中灼烧,会发出黄色的光.食盐为什么发黄光而不发其他颜色的光呢
一、光谱
1.光谱:用棱镜或光栅可以把物质发出的光按波长(频率)展开,获得波长(频率)和强度分布的记录.
2.光谱的分类
(1)发射光谱:物体发光直接产生的光谱叫做发射光谱.
①线状谱:光谱是一条条的亮线.
②连续谱:光谱是连在一起的光带.
线状谱是由游离状态的原子发射的,所以也叫原子光谱.
——炽热的固体、液体和高压气体发光.
只含有一些不连续的亮线的光谱叫做明线光谱(叫线状谱).
明线光谱中的亮线叫谱线,各条谱线对应不同波长的光.
——可分为发射光谱、吸收光谱、散射光谱
(稀薄气体或金属的蒸气的发射光谱是线状谱)
(2)吸收光谱:是一束具有连续波长的光(炽热物体发出的光)通过物质时,某些波长的光被吸收后产生的光谱.
2.光谱的分类
(1)发射光谱:物体发光直接产生的光谱叫做发射光谱.
①线状谱:光谱是一条条的亮线.
线状谱是由游离状态的原子发射的,所以也叫原子光谱.
②连续谱:光谱是连在一起的光带.
——炽热的固体、液体和高压气体发光.
——气体发光
3.特征谱线:每种原子只能发出具有本身特征的某些频率的光.
4.光谱分析:鉴别物质和确定物质的组成成分,发现新元素.
优点:灵敏度高,元素含量达到10-13kg就可以检测到.
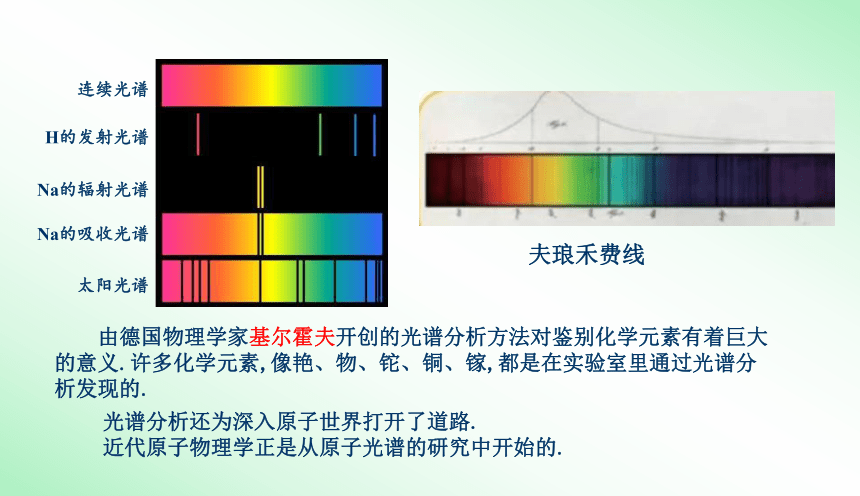
各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱中的一条明线相对应.这表明,低温气体原子吸收的光,恰好就是这种原子在高温时发出的光.因此吸收光谱中的暗谱线,也是原子的特征谱线.
Na的发射光谱
Na的发射光谱
太阳光谱
连续光谱
H的发射光谱
Na的辐射光谱
Na的吸收光谱
由德国物理学家基尔霍夫开创的光谱分析方法对鉴别化学元素有着巨大的意义.许多化学元素,像艳、物、铊、铜、镓,都是在实验室里通过光谱分析发现的.
夫琅禾费线
光谱分析还为深入原子世界打开了道路.
近代原子物理学正是从原子光谱的研究中开始的.
1
2
=
位置
=
=
二、氢原子光谱的实验规律
光谱的结果显示氢原子只能发出一系列特定波长的光.
测出氢原子光谱的谱线位置之后,那么它有什么规律呢
可见光区谱线规律——巴尔末公式
瑞士,巴尔末
n=3、4、5...
里德伯常量:
n的两层含义:
①每一个n值分别对应一条谱线.
②n只能取正整数3,4,5…,不能取连续值,反映氢原子光谱波长的分立特征(线状谱)
核外电子绕核运动
辐射电磁波
电子轨道半径连续变小
原子不稳定
辐射电磁波频率连续变化
原子是稳定的
原子光谱是线状谱 —— 分立
三、经典理论的困难
1、轨道量子化:原子中的电子在库仑力的作用下,绕原子核做圆周运动,服从经典力学的规律。
四、玻尔原子理论的基本假设
但是,电子轨道半径不是任意的,只有当半径大小符合一定条件时,这样的轨道才是可能的。即电子的轨道是量子化的。 电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射。
氢原子中电子轨道的最小半径
2、能级(定态)假设:当电子在不同轨道上运动时,原子处于不同状态,具有不同能量,所以原子能量也是量子化的。
四、玻尔原子理论的基本假设
这些量子化的能量值叫能级;原子中这些具有确定能量的稳定状态叫定态。
能量最低的状态叫基态,其他状态叫激发态。
4 3 2 1
E4
E3
E2
E1
定态假设
轨道与能级相对应
氢原子在基态(第一能级)的能量:
3、跃迁假设:当电子从能量较高的定态轨道(设能量为Em)跃迁到能量较低的定态轨道(设能量为En,m>n)时,它辐射出一定频率的光子,光子的能量由这两种定态的能量差决定,即
四、玻尔原子理论的基本假设
反之,当电子吸收光子时会从较低的能量态跃迁到较高的能量态,吸收的光子的能量同样由两种定态的能量差决定。
(频率条件或辐射条件)
跃迁假设
4 3 2 1
E4
E3
E2
E1
量子数
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
基态
激发态
轨道与能级相对应
四、玻尔原子理论的基本假设
假说2.能级(定态)假说
假说1.电子轨道是量子化的
假说3:频率条件(跃迁假说)
原子在始、末两个能级Em和En间跃迁时,发射(或吸收)光子的频率可以由前后能级的能量差决定:
五、玻尔理论对氢光谱的解释
玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢的电子可能的轨道半径和对应的能量值(能级).
(n=1、2、3....)
氢原子的能级图
用图表示氢原子各能级
赖曼系
赖曼系
巴耳末系
巴耳末系
帕邢系
帕邢系
布喇开系
布喇开系
逢德系
逢德系
玻尔理论成功解释了氢光谱的所有谱线
五、玻尔理论对氢光谱的解释
1.玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢的电子可能的轨道半径和对应的能量值(能级).
n→∞:电子脱离核束缚
氢原子的能级图
Hδ
Hγ
Hβ
Hα
H
可见光光子的能量范围为:1.62eV~3.11eV
2.解释气体导电发光与特征谱线
气体放电管中的原子受到高速运动的电子的撞击,发生跃迁到激发态,放出光子,最终回到基态.
能级分立
→能量分立
→分立的亮线
各种气体原子的能级不同,跃迁时发射光子的能量各异.
→特征谱线
玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性.
在解决核外电子的运动时
成功引入了量子化的观念
同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律.
除了氢原子光谱外,在解决其他问题上遇到了很大的困难.
氦原子光谱
量子化条件的引进没有适当的理论解释.
六、玻耳原子模型的局限性
②无法解释谱线的强度
①复杂一点的原子,就无法解释它的光谱现象.
玻尔
修正玻尔理论
→建立量子力学
必须彻底放弃经典概念,用电子云概念取代经典的轨道概念
汤姆孙发现电子
a粒子散射实验
卢瑟福的核式
结构模型
原子不可割
汤姆孙的
西瓜模型
原子稳定性事实氢光谱实验
玻尔模型
复杂(氦)原子光谱
量子力学理论
否 定
建 立
否 定
建 立
否 定
汤姆孙的
西瓜模型
卢瑟福的核式
结构模型
建 立
修正
矛 盾
矛 盾
矛 盾
否 定
玻尔模型
建 立
修正
拓展:原子结构的发展简史
怎样修改玻耳原子模型呢
思想:必须彻底放弃经典概念
关键:用电子云概念取代经典的轨道概念
电子在某处单位体积内出现的概率—— 电子云
观察与实验所获得的事实
建
立
科
学
模
型
提
出
科
学
假
说
第四章 原子结构和波粒二象性
4.4 氢原子光谱和玻尔的氢原子模型
原子具有核式结构,那么核外电子如何运动?
光谱
用棱镜或光栅可以把物质发出的光按波长(频率)展开,
获得波长(频率)和强度分布的记录(图 4.4-1),即光谱。
把食盐放在火中灼烧,会发出黄色的光.食盐为什么发黄光而不发其他颜色的光呢
一、光谱
1.光谱:用棱镜或光栅可以把物质发出的光按波长(频率)展开,获得波长(频率)和强度分布的记录.
2.光谱的分类
(1)发射光谱:物体发光直接产生的光谱叫做发射光谱.
①线状谱:光谱是一条条的亮线.
②连续谱:光谱是连在一起的光带.
线状谱是由游离状态的原子发射的,所以也叫原子光谱.
——炽热的固体、液体和高压气体发光.
只含有一些不连续的亮线的光谱叫做明线光谱(叫线状谱).
明线光谱中的亮线叫谱线,各条谱线对应不同波长的光.
——可分为发射光谱、吸收光谱、散射光谱
(稀薄气体或金属的蒸气的发射光谱是线状谱)
(2)吸收光谱:是一束具有连续波长的光(炽热物体发出的光)通过物质时,某些波长的光被吸收后产生的光谱.
2.光谱的分类
(1)发射光谱:物体发光直接产生的光谱叫做发射光谱.
①线状谱:光谱是一条条的亮线.
线状谱是由游离状态的原子发射的,所以也叫原子光谱.
②连续谱:光谱是连在一起的光带.
——炽热的固体、液体和高压气体发光.
——气体发光
3.特征谱线:每种原子只能发出具有本身特征的某些频率的光.
4.光谱分析:鉴别物质和确定物质的组成成分,发现新元素.
优点:灵敏度高,元素含量达到10-13kg就可以检测到.
各种原子的吸收光谱中的每一条暗线都跟该种原子的发射光谱中的一条明线相对应.这表明,低温气体原子吸收的光,恰好就是这种原子在高温时发出的光.因此吸收光谱中的暗谱线,也是原子的特征谱线.
Na的发射光谱
Na的发射光谱
太阳光谱
连续光谱
H的发射光谱
Na的辐射光谱
Na的吸收光谱
由德国物理学家基尔霍夫开创的光谱分析方法对鉴别化学元素有着巨大的意义.许多化学元素,像艳、物、铊、铜、镓,都是在实验室里通过光谱分析发现的.
夫琅禾费线
光谱分析还为深入原子世界打开了道路.
近代原子物理学正是从原子光谱的研究中开始的.
1
2
=
位置
=
=
二、氢原子光谱的实验规律
光谱的结果显示氢原子只能发出一系列特定波长的光.
测出氢原子光谱的谱线位置之后,那么它有什么规律呢
可见光区谱线规律——巴尔末公式
瑞士,巴尔末
n=3、4、5...
里德伯常量:
n的两层含义:
①每一个n值分别对应一条谱线.
②n只能取正整数3,4,5…,不能取连续值,反映氢原子光谱波长的分立特征(线状谱)
核外电子绕核运动
辐射电磁波
电子轨道半径连续变小
原子不稳定
辐射电磁波频率连续变化
原子是稳定的
原子光谱是线状谱 —— 分立
三、经典理论的困难
1、轨道量子化:原子中的电子在库仑力的作用下,绕原子核做圆周运动,服从经典力学的规律。
四、玻尔原子理论的基本假设
但是,电子轨道半径不是任意的,只有当半径大小符合一定条件时,这样的轨道才是可能的。即电子的轨道是量子化的。 电子在这些轨道上绕核的转动是稳定的,不产生电磁辐射。
氢原子中电子轨道的最小半径
2、能级(定态)假设:当电子在不同轨道上运动时,原子处于不同状态,具有不同能量,所以原子能量也是量子化的。
四、玻尔原子理论的基本假设
这些量子化的能量值叫能级;原子中这些具有确定能量的稳定状态叫定态。
能量最低的状态叫基态,其他状态叫激发态。
4 3 2 1
E4
E3
E2
E1
定态假设
轨道与能级相对应
氢原子在基态(第一能级)的能量:
3、跃迁假设:当电子从能量较高的定态轨道(设能量为Em)跃迁到能量较低的定态轨道(设能量为En,m>n)时,它辐射出一定频率的光子,光子的能量由这两种定态的能量差决定,即
四、玻尔原子理论的基本假设
反之,当电子吸收光子时会从较低的能量态跃迁到较高的能量态,吸收的光子的能量同样由两种定态的能量差决定。
(频率条件或辐射条件)
跃迁假设
4 3 2 1
E4
E3
E2
E1
量子数
E4
1
2
3
4
5
E1
E3
E2
E5
E∞
n
基态
激发态
轨道与能级相对应
四、玻尔原子理论的基本假设
假说2.能级(定态)假说
假说1.电子轨道是量子化的
假说3:频率条件(跃迁假说)
原子在始、末两个能级Em和En间跃迁时,发射(或吸收)光子的频率可以由前后能级的能量差决定:
五、玻尔理论对氢光谱的解释
玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢的电子可能的轨道半径和对应的能量值(能级).
(n=1、2、3....)
氢原子的能级图
用图表示氢原子各能级
赖曼系
赖曼系
巴耳末系
巴耳末系
帕邢系
帕邢系
布喇开系
布喇开系
逢德系
逢德系
玻尔理论成功解释了氢光谱的所有谱线
五、玻尔理论对氢光谱的解释
1.玻尔从上述假设出发,利用库仑定律和牛顿运动定律,计算出了氢的电子可能的轨道半径和对应的能量值(能级).
n→∞:电子脱离核束缚
氢原子的能级图
Hδ
Hγ
Hβ
Hα
H
可见光光子的能量范围为:1.62eV~3.11eV
2.解释气体导电发光与特征谱线
气体放电管中的原子受到高速运动的电子的撞击,发生跃迁到激发态,放出光子,最终回到基态.
能级分立
→能量分立
→分立的亮线
各种气体原子的能级不同,跃迁时发射光子的能量各异.
→特征谱线
玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性.
在解决核外电子的运动时
成功引入了量子化的观念
同时又应用了“粒子、轨道”等经典概念和有关牛顿力学规律.
除了氢原子光谱外,在解决其他问题上遇到了很大的困难.
氦原子光谱
量子化条件的引进没有适当的理论解释.
六、玻耳原子模型的局限性
②无法解释谱线的强度
①复杂一点的原子,就无法解释它的光谱现象.
玻尔
修正玻尔理论
→建立量子力学
必须彻底放弃经典概念,用电子云概念取代经典的轨道概念
汤姆孙发现电子
a粒子散射实验
卢瑟福的核式
结构模型
原子不可割
汤姆孙的
西瓜模型
原子稳定性事实氢光谱实验
玻尔模型
复杂(氦)原子光谱
量子力学理论
否 定
建 立
否 定
建 立
否 定
汤姆孙的
西瓜模型
卢瑟福的核式
结构模型
建 立
修正
矛 盾
矛 盾
矛 盾
否 定
玻尔模型
建 立
修正
拓展:原子结构的发展简史
怎样修改玻耳原子模型呢
思想:必须彻底放弃经典概念
关键:用电子云概念取代经典的轨道概念
电子在某处单位体积内出现的概率—— 电子云
观察与实验所获得的事实
建
立
科
学
模
型
提
出
科
学
假
说
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
