第一章有机化合物的结构特点与研究方法检测题高二下学期化学人教版(2019)选择性必修3(含解析)
文档属性
| 名称 | 第一章有机化合物的结构特点与研究方法检测题高二下学期化学人教版(2019)选择性必修3(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 12:21:07 | ||
图片预览



文档简介
第一章《有机化合物的结构特点与研究方法》检测题
一、单选题(共13题)
1.下列除去括号内杂质的有关操作正确的是
A.苯(硝基苯):加少量蒸馏水振荡,待分层后分液
B.乙醇(水):加新制生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):通入氢气发生加成反应
2.以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.为除去溴苯中的少量Br2,向混合物加入足量NaOH溶液,充分反应后分液
C.用核磁共振氢谱鉴别1—丙醇和2—丙醇
D.一定条件下用H2除去乙烷中混有的乙烯
3.有关化学用语正确的是
A.溴乙烷的分子式:C2H5Br
B.乙炔分子的比例模型示意图:
C.四氯化碳的电子式:
D.乙烯的最简式:C2H4
4.下列各组物质中,属于同分异构体的是
A.O2和O3
B.CH2=CHCH3和CH3CH=CHCH3
C.CH3CH2CH3和CH3(CH2)2CH3
D.CH3CH2OH和CH3OCH3
5.下列对各组物质关系的描述不正确的是
A.与互为同素异形体 B.和互为同系物
C.互为同位素 D.和互为同分异构体
6.下列有机物中,一氯取代物不止一种的是
A.新戊烷 B.环己烷() C.立方烷() D.对二甲苯
7.下列化学用语的表达正确的是
A.比更能反映甲烷的分子结构
B.羟基的电子式:
C.羰基硫(COS)的结构式:O=C=S
D.乙醚的化学式为:C2H6O
8.下列说法正确的是
A.乙醇和CH3OCH3,他们的质谱图完全相同
B.X射线单晶衍射仪可用于测定有机化合物分子准确的三维空间,包含键长,键角,构型等分子结构信息
C.CH3COOH和HCOOCH3的核磁共振氢谱完全相同
D.通过用红外光谱图分析不能区分乙醇和乙酸乙酯
9.目前已知化合物中数量、品种最多的是碳的化合物,下列关于其原因的叙述中不正确的是
A.碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键
B.碳原子性质活泼,可以与多数非金属元素原子形成共价键
C.碳原子之间既可以形成稳定的单键,又可以形成双键和三键
D.多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合
10.某气态有机化合物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,至少需要的条件是
①X中所含碳元素的质量分数
②X中所含氢元素的质量分数
③X在标准状况下的体积
④X的相对分子质量
⑤X的质量
A.①② B.①②④ C.①②⑤ D.③④⑤
11.某气态烃对空气的相对密度为 2,在氧气中充分燃烧 1.16 g这种烃,并将所得产物通过装有无水氯化钙的干燥管和装有碱石灰的干燥管,当称量这两个干燥管的质量时,它们依次增重 1.8g和 3.52 g。这种烃的化学式是
A.C2H6 B.C4H10 C.C5H10 D.C5H12
12.下列说法不正确的是
A.碳原子核外最外电子层有4个电子
B.1个碳原子可以与其他非金属原子形成4个共价键
C.两个碳原子之间能形成单键、双键或三键
D.所有有机化合物中都含有极性键和非极性键
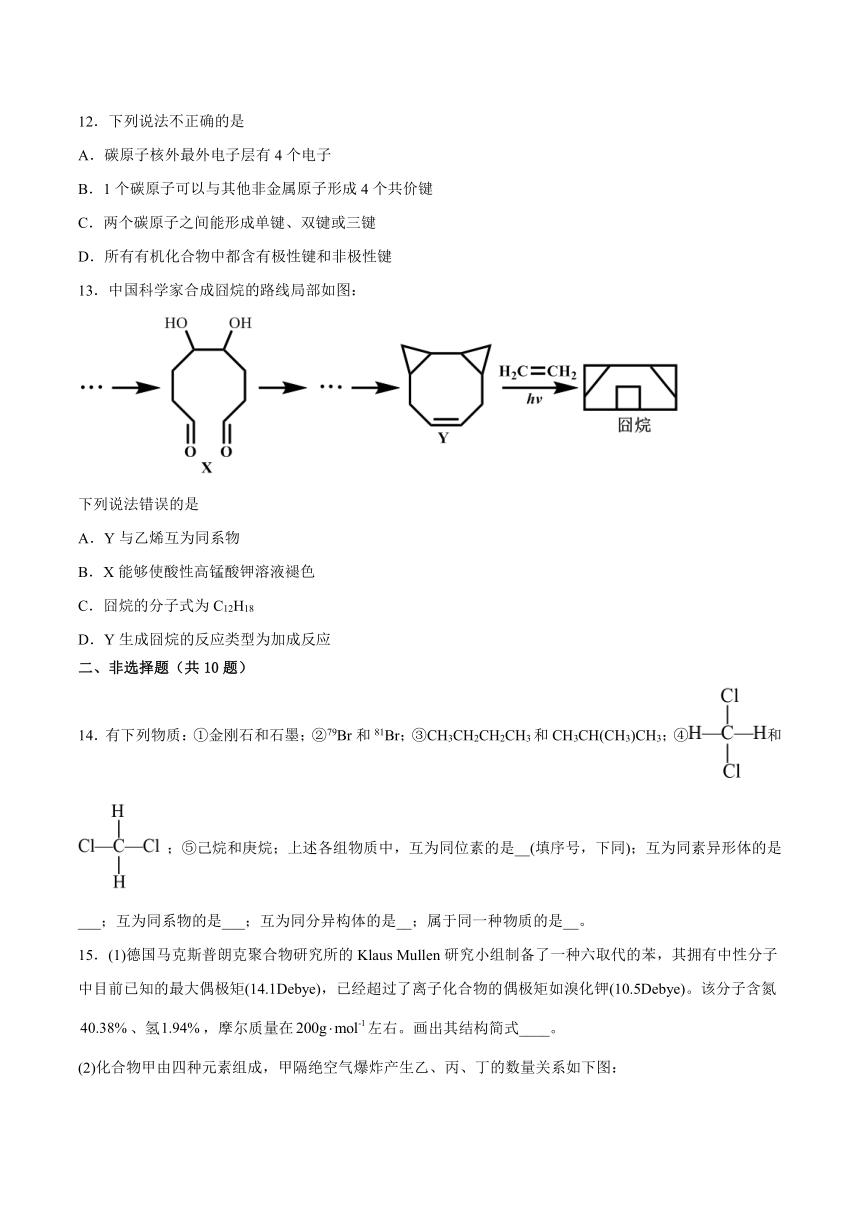
13.中国科学家合成囧烷的路线局部如图:
下列说法错误的是
A.Y与乙烯互为同系物
B.X能够使酸性高锰酸钾溶液褪色
C.囧烷的分子式为C12H18
D.Y生成囧烷的反应类型为加成反应
二、非选择题(共10题)
14.有下列物质:①金刚石和石墨;②79Br和81Br;③CH3CH2CH2CH3和CH3CH(CH3)CH3;④和 ;⑤己烷和庚烷;上述各组物质中,互为同位素的是__(填序号,下同);互为同素异形体的是___;互为同系物的是___;互为同分异构体的是__;属于同一种物质的是__。
15.(1)德国马克斯普朗克聚合物研究所的Klaus Mullen研究小组制备了一种六取代的苯,其拥有中性分子中目前已知的最大偶极矩(14.1Debye),已经超过了离子化合物的偶极矩如溴化钾(10.5Debye)。该分子含氮、氢,摩尔质量在左右。画出其结构简式____。
(2)化合物甲由四种元素组成,甲隔绝空气爆炸产生乙、丙、丁的数量关系如下图:
丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。给出甲的化学式____。
(3)含铬配合物X由四种元素组成,元素分析结果如下:含氯、含氧、含氢。将溶于水中,加入过量使其溶解;再在溶液中加入过量硝酸银至沉淀完全,收集沉淀、将沉淀干燥,得产物,1.066gA在干燥空气中缓慢加热至100°C时有0.144g水。
①给出配合物X的化学式(写明内界和外界)____。
②画出配合物X中阳离子的几何异构体____。
三、实验题
16.(一)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
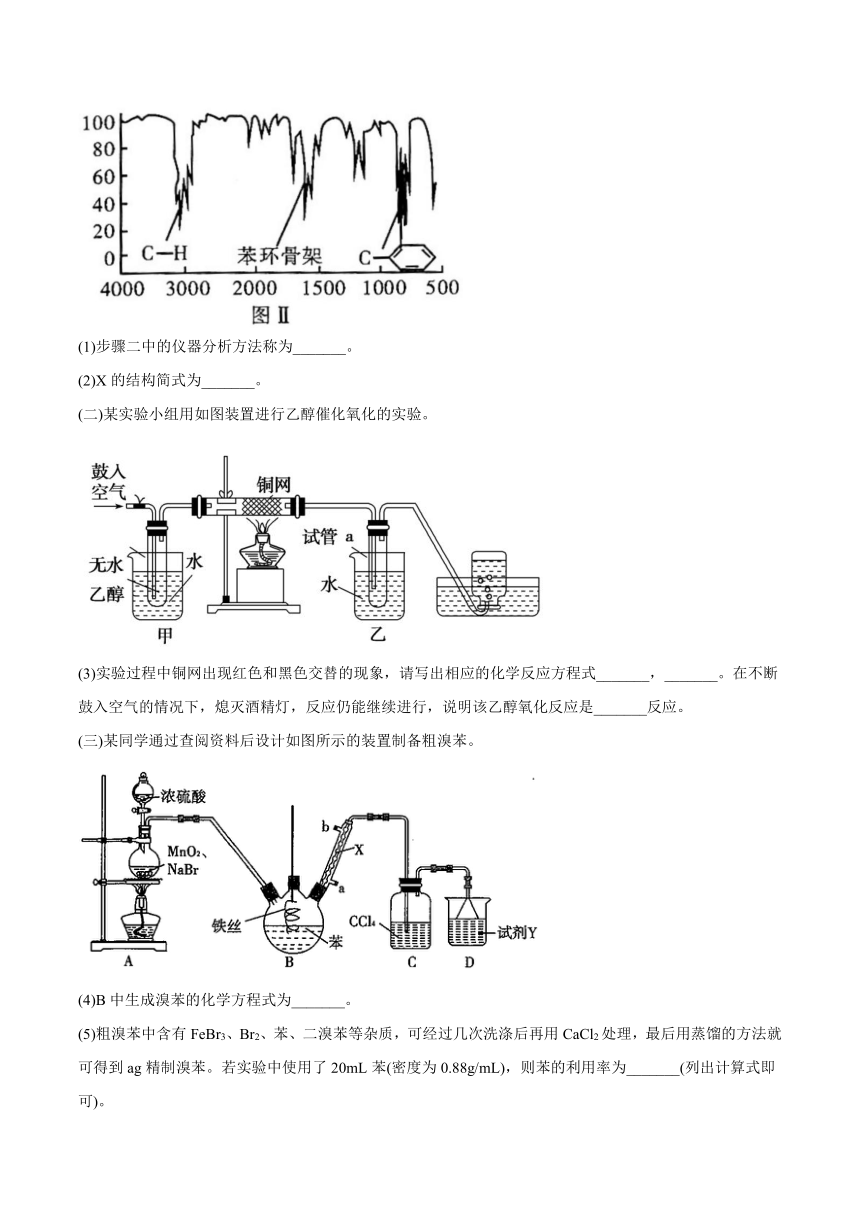
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3(如图Ⅰ)
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_______。
(2)X的结构简式为_______。
(二)某实验小组用如图装置进行乙醇催化氧化的实验。
(3)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式_______,_______。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是_______反应。
(三)某同学通过查阅资料后设计如图所示的装置制备粗溴苯。
(4)B中生成溴苯的化学方程式为_______。
(5)粗溴苯中含有FeBr3、Br2、苯、二溴苯等杂质,可经过几次洗涤后再用CaCl2处理,最后用蒸馏的方法就可得到ag精制溴苯。若实验中使用了20mL苯(密度为0.88g/mL),则苯的利用率为_______(列出计算式即可)。
17.(1)某实验小组尝试用燃烧法确定有机物M的分子式,所用装置如下:
①产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是(以上装置不能重复使用):g→fe→hi→ __________ → ___________ →jk。
②F装置作用是________________。
③若准确称取有机物M(只含C、H、O三种元素中的两种或三种)3.24g,经充分燃烧后,A管质量增加9.24g,B管质量增加2.16 g,则该有机物的实验式为________。
④已知在相同条件下该M蒸气相对氢气的密度为54,且能与Na反应但不与NaOH溶液反应,写出该物质在灼热的铜丝条件下与氧气的反应方程式 _________________________________。
(2)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2∶3,试确定该烃的结构简式为________;该烃在光照下生成的一氯代物在核磁共振谱中产生的吸收峰强度比为________。
四、计算题
18.含C 40%、O 53.3%、H 6.7%对空气相对密度2.069的有机物A,显酸性;另有相对分子质量与A相等的B,显中性。两者在浓硫酸脱水下生成不溶于水具香味的有机物C。推断A、B、C的结构简式_______。
19.Ⅰ.已知有机物A是最简单的烷烃,有机物B含有与A相同数目的氢原子,B分子中碳、氢的质量分数分别是40%、6.6%,其余为氧。请通过计算回答:
(1)该有机物B的分子式是_____________。
(2)若有机物B在核磁共振氢谱图(1H—NMR)上有三个峰,其结构简式为_______________。
Ⅱ.只含C、H、O三种元素的有机化合物R的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%。请通过计算回答:
(1)该有机物R的分子式是_______________。
(2)该有机物R分子中最多含________个碳氧双键。
20.有机化合物A经李比希法测得其中含碳72.0%、含氢6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为2:2:2:1:3,如图甲所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图乙所示。
请回答:
(1)A的分子式为___。
(2)A的分子中含一个甲基的依据是___(填序号)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(3)经测定A中含有乙基,那么A的结构简式为___。
(4)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基。A的同分异构体共有___种。
21.将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。经质谱法测得该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗O2的质量是多少______?
(2)求此化合物的分子式______。
(3)经红外光谱分析,该化合物分子中存在苯环和羟基,试写出其可能的结构简式______。
(4)进一步实验表明,该化合物的核磁共振氢谱存在四个峰,且峰面积之比为1:2:2:3,试确定该化合物的结构简式______。
22.0.2mol有机物和0.4molO2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,浓H2SO4质量增加10.8g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2g,最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g。
(1)试推断该有机物的分子式。_____________。
(2)若0.2mol该有机物恰好能与9.2g金属钠完全反应,试确定该有机物的结构简式。_____________。
23.有机化合物的元素定量分析最早是由德国化学家李比希提出的,装置如下图,他用CuO作氧化剂,在750℃左右使有机物在氧气流中全部转化为和,用盛有NaOH固体和无水的吸收管分别吸收和。
试回答下列问题:
(1)甲装置中盛放的是___________(填化学式)。
(2)将7.4g有机物A进行实验,测得生成和,则A的实验式(最简式)为___________。
(3)已知A的最简式能否确定A的分子式(填“能”或“不能”)___________。也可以通过___________法快速、精确测定其相对分子质量,进而确定分子式。
(4)①若A为醇,且A的核磁共振氢谱图申有两组峰,则A的结构简式为___________。
②若A的红外光谱如图所示,则其官能团的名称为___________。
参考答案:
1.B 2.D 3.A 4.D 5.B 6.D 7.C 8.B 9.B 10.B 11.B 12.D 13.A
14. ② ① ⑤ ③ ④
15. AgOCN [Cr(H2O)4Cl2]Cl·2H2O
16. 质谱法 2Cu+O22CuO CH3CH2OH+CuOCH3CHO+Cu+H2O 放热 +Br2HBr+
17. cd(dc) ab(ba) 防止空气中水和二氧化碳进入装置,干扰实验结果 C7H8O 2+O2 2 +2H2O 2:2:2:3
18.A为CH3COOH,B为 CH3CH2CH2OH或CH3CH(CH3)OH,C为CH3COOCH2CH2CH3 或 CH3COOCH(CH3)CH3;
19. C2H4O2 HOCH2CHO C5H10O4 1
20. C9H10O2 bc 5
21. 8.16g C7H8O
22. C2H6O2 CH2OHCH2OH
23.(1)CaCl2
(2)C4H10O
(3) 能 质谱
(4) (CH3)3C-OH 醚键
一、单选题(共13题)
1.下列除去括号内杂质的有关操作正确的是
A.苯(硝基苯):加少量蒸馏水振荡,待分层后分液
B.乙醇(水):加新制生石灰,蒸馏
C.CO2(HCl、水蒸气):通过盛有碱石灰的干燥管
D.乙烷(乙烯):通入氢气发生加成反应
2.以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.为除去溴苯中的少量Br2,向混合物加入足量NaOH溶液,充分反应后分液
C.用核磁共振氢谱鉴别1—丙醇和2—丙醇
D.一定条件下用H2除去乙烷中混有的乙烯
3.有关化学用语正确的是
A.溴乙烷的分子式:C2H5Br
B.乙炔分子的比例模型示意图:
C.四氯化碳的电子式:
D.乙烯的最简式:C2H4
4.下列各组物质中,属于同分异构体的是
A.O2和O3
B.CH2=CHCH3和CH3CH=CHCH3
C.CH3CH2CH3和CH3(CH2)2CH3
D.CH3CH2OH和CH3OCH3
5.下列对各组物质关系的描述不正确的是
A.与互为同素异形体 B.和互为同系物
C.互为同位素 D.和互为同分异构体
6.下列有机物中,一氯取代物不止一种的是
A.新戊烷 B.环己烷() C.立方烷() D.对二甲苯
7.下列化学用语的表达正确的是
A.比更能反映甲烷的分子结构
B.羟基的电子式:
C.羰基硫(COS)的结构式:O=C=S
D.乙醚的化学式为:C2H6O
8.下列说法正确的是
A.乙醇和CH3OCH3,他们的质谱图完全相同
B.X射线单晶衍射仪可用于测定有机化合物分子准确的三维空间,包含键长,键角,构型等分子结构信息
C.CH3COOH和HCOOCH3的核磁共振氢谱完全相同
D.通过用红外光谱图分析不能区分乙醇和乙酸乙酯
9.目前已知化合物中数量、品种最多的是碳的化合物,下列关于其原因的叙述中不正确的是
A.碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键
B.碳原子性质活泼,可以与多数非金属元素原子形成共价键
C.碳原子之间既可以形成稳定的单键,又可以形成双键和三键
D.多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合
10.某气态有机化合物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,至少需要的条件是
①X中所含碳元素的质量分数
②X中所含氢元素的质量分数
③X在标准状况下的体积
④X的相对分子质量
⑤X的质量
A.①② B.①②④ C.①②⑤ D.③④⑤
11.某气态烃对空气的相对密度为 2,在氧气中充分燃烧 1.16 g这种烃,并将所得产物通过装有无水氯化钙的干燥管和装有碱石灰的干燥管,当称量这两个干燥管的质量时,它们依次增重 1.8g和 3.52 g。这种烃的化学式是
A.C2H6 B.C4H10 C.C5H10 D.C5H12
12.下列说法不正确的是
A.碳原子核外最外电子层有4个电子
B.1个碳原子可以与其他非金属原子形成4个共价键
C.两个碳原子之间能形成单键、双键或三键
D.所有有机化合物中都含有极性键和非极性键
13.中国科学家合成囧烷的路线局部如图:
下列说法错误的是
A.Y与乙烯互为同系物
B.X能够使酸性高锰酸钾溶液褪色
C.囧烷的分子式为C12H18
D.Y生成囧烷的反应类型为加成反应
二、非选择题(共10题)
14.有下列物质:①金刚石和石墨;②79Br和81Br;③CH3CH2CH2CH3和CH3CH(CH3)CH3;④和 ;⑤己烷和庚烷;上述各组物质中,互为同位素的是__(填序号,下同);互为同素异形体的是___;互为同系物的是___;互为同分异构体的是__;属于同一种物质的是__。
15.(1)德国马克斯普朗克聚合物研究所的Klaus Mullen研究小组制备了一种六取代的苯,其拥有中性分子中目前已知的最大偶极矩(14.1Debye),已经超过了离子化合物的偶极矩如溴化钾(10.5Debye)。该分子含氮、氢,摩尔质量在左右。画出其结构简式____。
(2)化合物甲由四种元素组成,甲隔绝空气爆炸产生乙、丙、丁的数量关系如下图:
丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。给出甲的化学式____。
(3)含铬配合物X由四种元素组成,元素分析结果如下:含氯、含氧、含氢。将溶于水中,加入过量使其溶解;再在溶液中加入过量硝酸银至沉淀完全,收集沉淀、将沉淀干燥,得产物,1.066gA在干燥空气中缓慢加热至100°C时有0.144g水。
①给出配合物X的化学式(写明内界和外界)____。
②画出配合物X中阳离子的几何异构体____。
三、实验题
16.(一)某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2:3(如图Ⅰ)
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_______。
(2)X的结构简式为_______。
(二)某实验小组用如图装置进行乙醇催化氧化的实验。
(3)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式_______,_______。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是_______反应。
(三)某同学通过查阅资料后设计如图所示的装置制备粗溴苯。
(4)B中生成溴苯的化学方程式为_______。
(5)粗溴苯中含有FeBr3、Br2、苯、二溴苯等杂质,可经过几次洗涤后再用CaCl2处理,最后用蒸馏的方法就可得到ag精制溴苯。若实验中使用了20mL苯(密度为0.88g/mL),则苯的利用率为_______(列出计算式即可)。
17.(1)某实验小组尝试用燃烧法确定有机物M的分子式,所用装置如下:
①产生的氧气按从左到右方向流动,所选装置各导管的连接顺序是(以上装置不能重复使用):g→fe→hi→ __________ → ___________ →jk。
②F装置作用是________________。
③若准确称取有机物M(只含C、H、O三种元素中的两种或三种)3.24g,经充分燃烧后,A管质量增加9.24g,B管质量增加2.16 g,则该有机物的实验式为________。
④已知在相同条件下该M蒸气相对氢气的密度为54,且能与Na反应但不与NaOH溶液反应,写出该物质在灼热的铜丝条件下与氧气的反应方程式 _________________________________。
(2)在常温下测得的某烃C8H10(不能与溴水反应)的核磁共振谱上,观察到两种类型的H原子给出的信号,其强度之比为2∶3,试确定该烃的结构简式为________;该烃在光照下生成的一氯代物在核磁共振谱中产生的吸收峰强度比为________。
四、计算题
18.含C 40%、O 53.3%、H 6.7%对空气相对密度2.069的有机物A,显酸性;另有相对分子质量与A相等的B,显中性。两者在浓硫酸脱水下生成不溶于水具香味的有机物C。推断A、B、C的结构简式_______。
19.Ⅰ.已知有机物A是最简单的烷烃,有机物B含有与A相同数目的氢原子,B分子中碳、氢的质量分数分别是40%、6.6%,其余为氧。请通过计算回答:
(1)该有机物B的分子式是_____________。
(2)若有机物B在核磁共振氢谱图(1H—NMR)上有三个峰,其结构简式为_______________。
Ⅱ.只含C、H、O三种元素的有机化合物R的相对分子质量大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%。请通过计算回答:
(1)该有机物R的分子式是_______________。
(2)该有机物R分子中最多含________个碳氧双键。
20.有机化合物A经李比希法测得其中含碳72.0%、含氢6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为2:2:2:1:3,如图甲所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图乙所示。
请回答:
(1)A的分子式为___。
(2)A的分子中含一个甲基的依据是___(填序号)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(3)经测定A中含有乙基,那么A的结构简式为___。
(4)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基。A的同分异构体共有___种。
21.将含有C、H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。经质谱法测得该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗O2的质量是多少______?
(2)求此化合物的分子式______。
(3)经红外光谱分析,该化合物分子中存在苯环和羟基,试写出其可能的结构简式______。
(4)进一步实验表明,该化合物的核磁共振氢谱存在四个峰,且峰面积之比为1:2:2:3,试确定该化合物的结构简式______。
22.0.2mol有机物和0.4molO2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,浓H2SO4质量增加10.8g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2g,最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g。
(1)试推断该有机物的分子式。_____________。
(2)若0.2mol该有机物恰好能与9.2g金属钠完全反应,试确定该有机物的结构简式。_____________。
23.有机化合物的元素定量分析最早是由德国化学家李比希提出的,装置如下图,他用CuO作氧化剂,在750℃左右使有机物在氧气流中全部转化为和,用盛有NaOH固体和无水的吸收管分别吸收和。
试回答下列问题:
(1)甲装置中盛放的是___________(填化学式)。
(2)将7.4g有机物A进行实验,测得生成和,则A的实验式(最简式)为___________。
(3)已知A的最简式能否确定A的分子式(填“能”或“不能”)___________。也可以通过___________法快速、精确测定其相对分子质量,进而确定分子式。
(4)①若A为醇,且A的核磁共振氢谱图申有两组峰,则A的结构简式为___________。
②若A的红外光谱如图所示,则其官能团的名称为___________。
参考答案:
1.B 2.D 3.A 4.D 5.B 6.D 7.C 8.B 9.B 10.B 11.B 12.D 13.A
14. ② ① ⑤ ③ ④
15. AgOCN [Cr(H2O)4Cl2]Cl·2H2O
16. 质谱法 2Cu+O22CuO CH3CH2OH+CuOCH3CHO+Cu+H2O 放热 +Br2HBr+
17. cd(dc) ab(ba) 防止空气中水和二氧化碳进入装置,干扰实验结果 C7H8O 2+O2 2 +2H2O 2:2:2:3
18.A为CH3COOH,B为 CH3CH2CH2OH或CH3CH(CH3)OH,C为CH3COOCH2CH2CH3 或 CH3COOCH(CH3)CH3;
19. C2H4O2 HOCH2CHO C5H10O4 1
20. C9H10O2 bc 5
21. 8.16g C7H8O
22. C2H6O2 CH2OHCH2OH
23.(1)CaCl2
(2)C4H10O
(3) 能 质谱
(4) (CH3)3C-OH 醚键
