第一章物质及其变化测试题高一上学期化学人教版(2019)必修第一册(含解析)
文档属性
| 名称 | 第一章物质及其变化测试题高一上学期化学人教版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 12:21:53 | ||
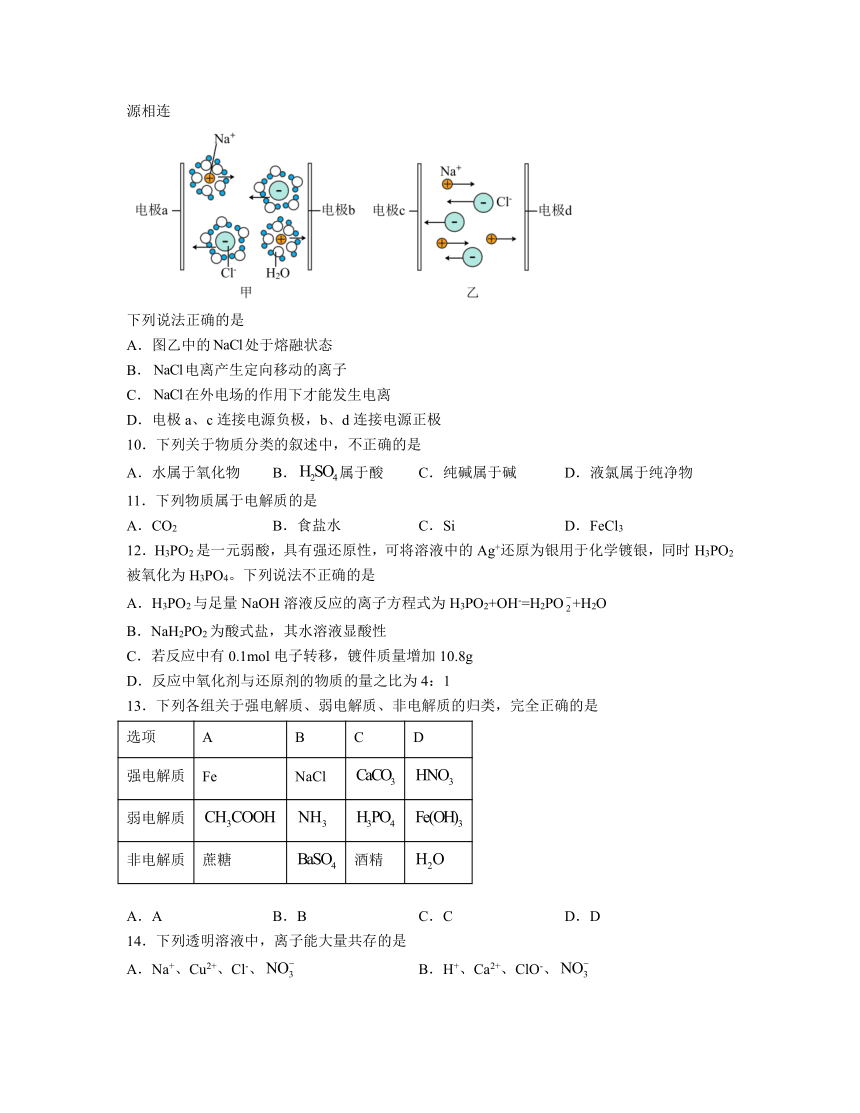
图片预览



文档简介
第一章 物质及其变化 测试题
一、选择题
1.固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示。下列叙述正确的是
A.转化过程中所涉及的元素均呈现了两种价态
B.反应①②③均为氧化还原反应
C.Li是催化剂,只有是中间产物
D.整个过程的总反应可表示为
2.反应中,被氧化的磷原子与被还原的磷原子个数比是
A. B. C. D.
3.下列四种物质Fe粉、石灰水、Na2CO3溶液、稀盐酸两两混合后将发生的离子反应有
A.1个 B.2 个 C.3 个 D.4 个
4.下列说法正确的是
①只含有一种元素的物质一定是纯净物
②“卤水点豆腐”“黄河入海口处三角洲的形成”都与胶体的性质有关
③与反应生成和,故是酸性氧化物
④向胶体中加入过量稀硫酸,先有红褐色沉淀生成,然后沉淀溶解形成棕黄色溶液
⑤碱性氧化物一定是金属氧化物
⑥两种盐反应一定生成两种新盐
A.①③⑥ B.①②③④⑥ C.②④⑤ D.②④⑥
5.随着神舟十五号飞船的成功发射,6名中国航天员在空间站实现在轨交接。空间站中有一套完善的再生式环境控制与生命保障系统,可实现舱内氧气和水的循环利用,保障航天员长时间在轨驻留的需求。下列过程属于物理变化的是
A.长征二号遥十五火箭点火发射 B.冷凝回收舱内的水蒸气
C.利用循环水电解制氧气 D.还原去除舱内的二氧化碳
6.是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
A.途径①与物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.反应②的方程式为:
D.后面途径转化中,加入的Y物质体现了其氧化性
7.中国传统文化博大精深,蕴含着丰富的化学知识,以下语句与图中变化相符的是
A.庭草留霜池结冰
B.李商隐《相见时难别亦难》:“春蚕到死丝方尽,蜡炬成灰泪始干。”
C.千锤万凿出深山,烈火焚烧若等闲
D.有以硫黄、雄黄合硝石,并蜜烧之,焰起烧手面,及烬屋舍者
8.下列反应的离子方程式书写正确的是
A.氢氧化钡溶液与过量硫酸氢钠溶液混合:SO+H++OH-+Ba2+=BaSO4↓+H2O
B.氢氧化镁固体和稀盐酸反应的离子方程式为: H+ +OH﹣=H2O
C.向碳酸氢钙溶液中加入盐酸:HCO+H+= CO2↑+H2O
D.将CO2通入CaCl2溶液中:CO2+H2O+Ca2+= CaCO3↓+2H+
9.是一种常见的电解质,其两种状态下的导电示意图如图所示,其中电极a、b、均与电源相连
下列说法正确的是
A.图乙中的处于熔融状态
B.电离产生定向移动的离子
C.在外电场的作用下才能发生电离
D.电极a、c连接电源负极,b、d连接电源正极
10.下列关于物质分类的叙述中,不正确的是
A.水属于氧化物 B.属于酸 C.纯碱属于碱 D.液氯属于纯净物
11.下列物质属于电解质的是
A.CO2 B.食盐水 C.Si D.FeCl3
12.H3PO2是一元弱酸,具有强还原性,可将溶液中的Ag+还原为银用于化学镀银,同时H3PO2被氧化为H3PO4。下列说法不正确的是
A.H3PO2与足量NaOH溶液反应的离子方程式为H3PO2+OH-=H2PO+H2O
B.NaH2PO2为酸式盐,其水溶液显酸性
C.若反应中有0.1mol电子转移,镀件质量增加10.8g
D.反应中氧化剂与还原剂的物质的量之比为4:1
13.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 A B C D
强电解质 Fe NaCl
弱电解质
非电解质 蔗糖 酒精
A.A B.B C.C D.D
14.下列透明溶液中,离子能大量共存的是
A.Na+、Cu2+、Cl-、 B.H+、Ca2+、ClO-、
C.Fe2+、H+、、 D.Na+、、OH-、K+
15.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
二、填空题
16.反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中:
(1)KMnO4中Mn元素被______,氧化剂______,还原剂______。
(2)HCl中氯原子______(填“得到”或“失去”)电子。
(3)氧化产物______,还原产物______,被氧化的HCl和体现酸性的HCl分子数之比是______。
(4)用单线桥法表示该反应中电子转移情况:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O______。
(5)比较KMnO4和Cl2的氧化性:KMnO4______Cl2(填>或<)。
17.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点表示在t1℃时两物质的溶解度关系为b____c(填“>”、“<”或“=”)。
(2)t2℃时,a、b、c三种物质的饱和溶液中溶质的质量分数由大到小的关系为____。
(3)t2℃时,将40 g b物质加入到50 g水中充分溶解后,所得溶液的质量为____。
(4)当b中含有少量的a,若要提纯b,可采用____结晶的方法。
18.如图以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同。结合此图回答下列问题。
(1)稀盐酸中阳离子的符号是_______。
(2)反应①中石蕊溶液变为_______色。
(3)反应⑤的离子方程式为_______。
(4)图中只生成盐和水的反应有_______(填序号)。
(5)若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是BaCl2、CuSO4、Na2CO3中的_______。
三、计算题
19.现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示,请回答下列问题:
(1)在a→b的反应过程中,其中的氧化剂为_______,被氧化的元素为_______。
(2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应离子方程式_______;
(3)已知c→d发生反应:2BrO+I2=2IO+Br2;当加入KBrO3量n(KBrO3)=4.2时,则此时余下单质碘的量n(I2)=_______mol;依题综合分析可推出含6 mol KI的硫酸溶液充分反应最终所能消耗n(KBrO3)的最大值为_______mol。
20.将SO2通入用硫酸酸化的重铬酸钾溶液中,可制得硫酸铬钾KCr(SO4)2,反应的化学方程式为_______;如果溶液的酸碱性控制不当,可能会有Cr(OH)SO4杂质生成。现从得到的硫酸铬钾产品中取出3.160g样品加入足量盐酸和BaCl2溶液后,得到白色沉淀5.126g。若产品中杂质只有Cr(OH)SO4,则该产品中KCr(SO4)2的质量分数为_______(用百分数表示,保留1位小数)。[摩尔质量/g·mol-1:KCr(SO4)2283;Cr(OH)SO4165]
四、元素或物质推断题
21.无色透明溶液,欲确定其是否含有下列离子:H+、Mg2+、、Fe3+、Ba2+、、Cl-、,实验如下:
①用玻璃棒蘸取少量该溶液,点在pH试纸中部,试纸变为红色;
②取少量该溶液,加入过量BaCl2溶液,有白色沉淀生成;
③取②中反应后的上层清液,加入AgNO3溶液,有白色沉淀生成,且不溶于稀硝酸;
④取少量原溶液,加入过量的NaOH溶液,有白色沉淀生成,加热时有气体生成。
已知:+OH-NH3↑+H2O。回答下列问题:
(1)溶液中一定存在的离子是_______;溶液中肯定不存在的离子是_______。
(2)写出实验步骤③中发生反应的离子方程式:_______。
(3)写出实验步骤④中生成的沉淀的化学式:_______。
(4)如何验证某离子是否存在,请设计实验证明_______。
22.已知有以下物质相互转化,其中A为常见金属,C为碱。
试回答:
(1)写出F的化学式_______________,H的化学式___________________。
(2)写出由E转变成F的化学方程式:_________________________________。
(3)向G溶液加入A的有关反应离子方程式:____________________。
(4)写出A在一定条件下与水反应的化学方程式并用双线桥标出该反应的电子转移情况__________________。
五、实验题
23.为探究固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
已知溶液B仅含一种溶质,气体C的摩尔质量为。请回答:
(1)组成固体X的两种元素为_______。
(2)固体X与适量稀硫酸反应的离子方程式为_______。
(3)白色沉淀在空气中灼烧的化学方程式为_______。
(4)气体C和按物质的量之比1:4通入水中恰好完全反应。请设计实验检验产物的阴离子_______。
24.(1)将5-6滴__________(填化学式)饱和溶液滴入煮沸的蒸馏水中,继续加热至液体变为_______色,制得Fe(OH)3胶体。Fe(OH)3胶体与Fe(OH)3沉淀的本质区别在于 _________________________________。
(2)写出制备Fe(OH)3胶体的化学方程式_____________________。
(3)怎样证明制得的物质是胶体?请简述操作过程____________________。
【参考答案】
一、选择题
1.D
解析:A.根据转化关系可知:在转化过程中H始终呈+1价,A错误;
B.反应②为,该反应过程中元素化合价不变,因此反应属于非氧化还原反应,B错误;
C.Li是催化剂,和LiOH均是中间产物,C错误;
D.根据分析,整个过程的总反应为氮气和水生成氨气和氧气,可表示为,D正确;
故选D。
2.A
解析:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,得电子化合价降低的P原子被还原,失电子化合价升高的P原子被氧化;如果有11molP参加氧化还原反应,有5molP化合价降低被还原生成5molCu3P,有6molP化合价升高被氧化生成6molH3PO4,所以被氧化的P原子与被还原的P原子个数比是6∶5,
故选A。
3.D
【分析】Fe粉和稀盐酸反应,和石灰水、碳酸钠溶液不反应;石灰水和碳酸钠溶液、稀盐酸反应;碳酸钠溶液和稀盐酸反应;据此分析解答。
解析:(1)铁粉与稀盐酸的反应,其离子反应方程式为Fe+2H+=Fe2++H2↑
(2)石灰水与稀盐酸的反应,其离子反应方程式为OH-+H+=H2O
(3)Na2CO3溶液与稀盐酸,其离子反应方程式为CO+2H+=CO2+H2O
(4)石灰水与Na2CO3溶液的反应,其离子反应方程式为Ca2++CO =CaCO3↓
能发生离子反应的有4个,故选D。
4.C
解析:①只含有一种元素的物质不一定是纯净物,如O2、O3的混合物中只含O元素,故①错误;
②“卤水点豆腐”“黄河入海口处三角洲的形成”都与胶体的聚沉有关,故②正确;
③与反应生成和,不是酸性氧化物,故③错误;
④向胶体中加入过量稀硫酸,先发生胶体聚沉有红褐色沉淀生成,然后氢氧化铁和硫酸反应生成硫酸铁和水,沉淀溶解形成棕黄色溶液,故④正确;
⑤碱性氧化物一定是金属氧化物,故⑤正确;
⑥两种盐反应不一定生成两种新盐,如NaHSO4和NaHCO3反应生成Na2SO4、二氧化碳、水,故⑥错误;
正确的是②④⑤,选C。
5.B
解析:A.火箭点火发射时燃料燃烧,属于化学变化,A不选;
B.冷凝水蒸气得到液态水,没有生成新物质,属于物理变化,B选;
C.电解水制氧气有新物质生成,属于化学变化,C不选;
D.用氢气还原去除舱内的二氧化碳生成水,有新物质生成,属于化学变化,D不选;
故选:B。
6.D
解析:A.途径①中Cu和、反应生成CuSO4,Cu与混酸反应的离子反应为3Cu+8H++2NO=3Cu2++2NO+4H2O,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,要使途径①所得溶液只含3mol CuSO4,则消耗的物质的量为2mol时,的物质的量为3mol,所用混酸中与物质的量之比最好为3:2,故A正确;
B.①③中生成有毒气体,②中Cu、氧气、硫酸反应生成硫酸铜和水,则途径②更好地体现了绿色化学思想,故B正确;
C.反应②中Cu和氧气、硫酸反应生成硫酸铜和水,化学方程式为:,故C正确;
D.硫酸铜与氢氧化钠生成氢氧化铜沉淀,与Y生成氧化亚铜,知Y可为葡萄糖,葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,该过程中Cu元素化合价下降,Cu(OH)2作为氧化剂,C6H12O6是还原剂,体现还原性,故D错误;
故选D。
7.C
解析:图中表示反应物的总能量低于生成物的总能量,为吸热反应。
A.庭草留霜池结冰是物理变化,A错误;
B.燃烧为放热反应,B错误;
C.石灰石高温分解为吸热反应,C正确;
D.黑火药燃烧爆炸为放热反应,D错误;
故选C。
8.C
解析:A.氢氧化钡溶液与过量硫酸氢钠溶液混合生成硫酸钡、硫酸钠和水,方程式为:SO+2H++2OH-+Ba2+=BaSO4↓+2H2O,A错误;
B.氢氧化镁固体难溶,和稀盐酸反应的离子方程式为:2H++Mg(OH)2=Mg2++2H2O,B错误;
C.向碳酸氢钙溶液中加入盐酸生成氯化钙、水和二氧化碳,离子方程式为:HCO+H+= CO2↑+H2O,C正确;
D.碳酸的酸性弱于盐酸,将CO2通入CaCl2溶液中不反应,D错误;
答案选C。
9.A
解析:A.图乙中只有钠离子和氯离子,则说明处于熔融状态,图甲是水合钠离子和水合氯离子,说明NaCl处于水溶液中,故A正确;
B.电离产生的离子是自由移动的,在电场的作用下离子作定向移动,故B错误;
C.根据甲得到在水中发生电离,并不是在外电场的作用下才能发生电离,故C错误;
D.根据“异性相吸”,电极a、c连接电源正极,b、d连接电源负极,则D错误。
综上所述,答案为A。
10.C
解析:A.水是氢元素与氧元素形成的氧化物,故A正确;
B.硫酸是二元强酸,故B正确;
C. 纯碱是碳酸钠,属于盐而不是碱,故C错误;
D. 液氯是氯气的液态,属于纯净物,故D正确;
故选C。
11.D
解析:A.CO2自身不能电离出自由移动的离子,为非电解质,A不符合题意;
B.食盐水为混合物,既不是电解质又不是非电解质,B不符合题意;
C.Si为单质,既不是电解质又不是非电解质,C不符合题意;
D.FeCl3为化合物,溶于水可以导电,为电解质,D符合题意;
综上所述答案为D。
12.B
解析:A.是一元弱酸,与足量NaOH溶液反应的离子方程式为,A说法正确;
B.是一元弱酸,为正盐,其水溶液显中性,B说法错误;
C.若反应中有0.1mol电子转移,则有0.1mol被还原为银,镀件质量增加10.8g,C说法正确;
D.1个转化为Ag转移1个,1个转化为转移4个,根据得失电子守恒得关系式:氧化剂与还原剂的物质的量之比为4:1,D说法正确;
故答案选B。
13.C
解析:A.是单质,既不是电解质也不是非电解质,选项A错误;
B.不能电离,属于非电解质,溶于水的部分完全电离,属于强电解质,选项B错误;
C.溶于水的部分完全电离,属于强电解质,为弱电解质,酒精为非电解质,选项C正确;
D.H2O是弱电解质,不是非电解质,选项D错误;
答案选C。
14.A
解析:A.选项离子之间不能发生任何反应,可以大量共存,A符合题意;
B.H+、生成HClO,不能大量共存,B不符合题意;
C.Fe2+、H+、 反应产生Fe3+、NO、H2O,不能大量共存,C不符合题意;
D.与OH-生成H2O、CO,不能大量共存,D不符合题意;
故合理选项是A。
15.B
解析:反应为浓盐酸和盐的反应,体现了浓盐酸的酸性;反应HCl中氯元素化合价部分升高,发生氧化反应,HCl为还原剂,体现了其还原性;
故选B。
二、填空题
16.(1) 还原 KMnO4 HCl
(2)失去
(3) Cl2 MnCl2 10∶6或5∶3
(4)
(5)KMnO4>Cl2
解析:(1)Mn元素化合价变化为KMnO4→MnCl2,由+7价降低为+2价,故Mn元素被还原,KMnO4作氧化剂,HCl中Cl元素化合价升高,作还原剂。
(2)HCl中氯原子元素化合价升高,失去电子。
(3)Mn元素化合价降低,被还原,生成MnCl2为还原产物,Cl元素化合价升高,被氧化,生成Cl2为氧化产物;反应16molHCl中被氧化的HCl为10mol,体现酸性的为6mol,故被氧化的HCl和体现酸性的HCl分子数之比是10:6或5:3。
(4)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,16molHCl中Cl失去10mol电子,KMnO4得到10mol电子,故单线桥为 。
(5)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,故氧化性KMnO4>Cl2。
17.(1)=(2)b>a>c(3)75 g(4)降温(或冷却热饱和溶液)
解析:(1)根据图示可知:P点表示在t1℃时b、c两物质的溶解度相同,因此两种物质的溶解度大小关系为b=c;
(2)根据物质的溶解度与溶液中溶质质量分数关系关系可知:物质的溶解度越大,形成的该温度下的饱和溶液的质量分数就越大。在t2℃时,a、b、c三种物质的溶解度大小关系为:b>a>c,因此三种物质形成的饱和溶液中溶质的质量分数由大到小的关系为:b>a>c;
(3)根据图示t2℃时,b物质的溶解度是50 g,表示100 g水最多可溶解50 b形成150 g该温度下的饱和溶液,则在该温度下,若将40 g b物质加入到50 g水中充分溶解后,50 g水最多可溶解25 g的b物质,所得溶液的质量m(溶液)=50 g+25 g=75 g;
(4)根据图象可知:b物质的溶解度受温度的影响变化较大,而a物质的溶解度受温度的影响变化较小,所以当b中含有少量的a杂质时,若要提纯b,可采用降温结晶(或冷却热饱和溶液)的方法提纯b物质。
18.(1)H+(2)红(3)Al2O3+6H+=2Al3++3H2O(4)③⑤(5)Na2CO3
解析:(1)HCl在水溶液中电离出阳离子H+和阴离子Cl-,故此处填:H+;
(2)稀盐酸属于酸溶液,遇石蕊变红,故此处填:红;
(3)Al2O3与盐酸反应生成AlCl3和H2O,对应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
(4)反应③:Ca(OH)2与稀盐酸反应只生成盐CaCl2和水,由第(3)问,反应⑤也符合题意,故此处填:③⑤;
(5)BaCl2与稀盐酸和Ca(OH)2均不反应,CuSO4与稀盐酸不反应,Na2CO3与稀盐酸和Ca(OH)2均反应,故此处填:Na2CO3。
三、计算题
19. KBrO3 I 1.5 mol 7.2
解析:(1)a→b的反应过程中含碘物质由6 mol KI转变成3mol,根据元素守恒可知1mol产物中含有2molI,应为碘单质,KBrO3作氧化剂,将KI氧化成碘单质,被氧化的元素为I,故答案为:KBrO3;I;
(2)b→c过程中,仅有溴元素发生化合价变化,可知是KBrO3氧化a→b过程中生成的溴离子的反应,反应产物为溴单质,反应的离子方程式为:,故答案为:;
(3)由以上分析可知a→b的反应为:,该过程中6molKI完全反应时消耗1molKBrO3,同时生成1mol溴离子和3mol碘单质;b→c过程中发生的反应为:,该过程中1mol的溴离子消耗0.2molKBrO3,c→d发生反应:2BrO+I2=2IO+Br2,加入KBrO3量n(KBrO3)=4.2时前两个阶段消耗1.2mol,该过程中消耗3mol,则反应的碘单质为1.5mol,剩余的碘单质为3mol-1.5mol=1.5mol,若3mol碘单质完全被消耗时c→d过程中消耗的KBrO3为6mol,则整个过程中消耗的KBrO3物质的量为:7.2mol,故答案为:1.5mol;7.2;
20. K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O 89.6%
解析:由题意可知,二氧化硫与酸性重铬酸钾溶液反应生成硫酸铬钾和水,反应的化学方程式为K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O;设硫酸铬钾的物质的量为x,Cr(OH)SO4的物质的量为y,由质量可得:283x+165y=3.160,由反应生成5.126g白色沉淀可得:2x+y=,解联立方程可得x=0.01、y=0.002,则样品中硫酸铬钾的质量分数×100%=89.6%,故答案为:K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O;89.6%。
四、元素或物质推断题
21.(1) H+、Mg2+、、 、Fe3+、Ba2+
(2)Ag++Cl-=AgCl↓
(3)Mg(OH)2
(4)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有
解析:溶液无色透明,所以不含Fe3+,根据①可知该溶液显酸性,存在大量H+,所以一定不含;实验②加入过量氯化钡产生白色沉淀,说明含有,则原溶液中一定不含Ba2+;实验③取②中反应后的上层清液,加入AgNO3溶液,有白色沉淀生成,且不溶于稀硝酸,白色沉淀为氯化银,因②引入Cl-,所以不能确定是否含Cl-;实验④中取少量原溶液,加入过量的NaOH溶液,有白色沉淀生成,说明含有Mg2+,该沉淀为氢氧化镁,加热时有气体生成,结合题目所给条件可知该气体为NH3,原溶液中含有。
(1)根据分析可知溶液中一定存在的离子是H+、Mg2+、、,溶液中肯定不存在的离子是、Fe3+、Ba2+;
(2)实验③中为氯离子和银离子反应生成沉淀,离子方程式为Ag++Cl-=AgCl↓;
(3)根据分析可知白色沉淀为Mg(OH)2;
(4)根据分析可知不能确定的离子是Cl-,检验方法是为:取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有。
22. Fe(OH)3 AgCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe3++Fe=3Fe2+
【分析】白色沉淀E在空气中转变为红褐色沉淀F,可推出E为氢氧化亚铁,F为氢氧化铁,F为氯化铁,故B中含有亚铁离子,透过蓝色钴玻璃观察焰色反应为紫色,可知D中含有K元素,又因为D与硝酸银生成白色沉淀H,可知H为AgCl,D为KCl,所以B中含有氯离子,故B为氯化亚铁,D为KCl和氯化亚铁的混合物,则A为Fe。
解析:(1)由分析可知,F为Fe(OH)3,H为AgCl;
(2)氢氧化亚铁转化为氢氧化铁的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)向G溶液加入A的有关反应离子方程式为2Fe3++Fe=3Fe2+;
(4)Fe与水反应的方程式的电子转移可表示为。
五、实验题
23.(1)、
(2)
(3)
(4)取适量反应后的溶液于试管中,加入足量溶液,产生白色沉淀,则证明存在。静置,向上清液中加入酸化的溶液,产生白色沉淀,则证明存在
【分析】根据固体X加入稀硫酸,生成黄色单质A,A为S,溶液B中加入足量后,生成白色沉淀,再灼烧沉淀,生成红棕色的固体,质量为16g,物质的量为0.1mol,铁元素物质的量为0.2mol,质量为,S元素的质量为,物质的量为:0.15mol,可知固体X中一定含有的元素为:、,化学式为:;溶液B仅含一种溶质,加入足量后,生成白色沉淀,B中的溶质为,生成的白色沉淀为,气体C的摩尔质量为,为。
解析:(1)根据固体X加入稀硫酸,生成黄色单质A,A为S,溶液B中加入足量后,在灼烧沉淀,生成红棕色的固体,可知固体X中一定含有的元素为:、;
(2)根据以上分析,固体X和稀硫酸反应生成S单质,和,反应的离子方程式为:;
(3)色沉淀为,在空气中灼烧生成红棕色的,反应的化学方程式为:;
(4)和按物质的量之比1:4通入水中恰好完全反应,根据氧化还原反应中电子转移数目相等,4mol转移8mol电子,还原产物为,1mol转移8mol电子,化合价升高8,生成氧化产物为,设计实验检验溶液中的:取适量反应后的溶液于试管中,加入足量溶液,产生白色沉淀,则证明存在。静置,向上清液中加入酸化的溶液,产生白色沉淀,则证明存在。
24. FeCl3 红褐 分散质微粒直径大小不同 FeCl3+3H2OFe(OH)3(胶体)+3HCl 用激光笔照射制取得到的红褐色液体,若从侧面看到有一条光亮的通路,就证明产生了胶体。
解析:(1)将5-6滴饱和FeCl3溶液滴入到200 mL煮沸的蒸馏水中,继续加热至液体变为红褐色,停止加热,就制取得到Fe(OH)3胶体。Fe(OH)3胶体与Fe(OH)3沉淀的本质区别在于分散质微粒直径大小不同。Fe(OH)3胶体中分散质微粒直径在1-100 nm之间,而Fe(OH)3沉淀的分散质微粒直径大于100 nm;
(2)将5-6滴饱和FeCl3溶液滴入到200 mL煮沸的蒸馏水中,继续加热至液体变为红褐色,停止加热,就制取得到Fe(OH)3胶体,制备Fe(OH)3胶体的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(3)用激光笔照射制取得到的红褐色液体,若从侧面看到有一条光亮的通路,就证明产生了胶体,这种现象为胶体特有的性质,即胶体能够产生丁达尔效应。
一、选择题
1.固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图所示。下列叙述正确的是
A.转化过程中所涉及的元素均呈现了两种价态
B.反应①②③均为氧化还原反应
C.Li是催化剂,只有是中间产物
D.整个过程的总反应可表示为
2.反应中,被氧化的磷原子与被还原的磷原子个数比是
A. B. C. D.
3.下列四种物质Fe粉、石灰水、Na2CO3溶液、稀盐酸两两混合后将发生的离子反应有
A.1个 B.2 个 C.3 个 D.4 个
4.下列说法正确的是
①只含有一种元素的物质一定是纯净物
②“卤水点豆腐”“黄河入海口处三角洲的形成”都与胶体的性质有关
③与反应生成和,故是酸性氧化物
④向胶体中加入过量稀硫酸,先有红褐色沉淀生成,然后沉淀溶解形成棕黄色溶液
⑤碱性氧化物一定是金属氧化物
⑥两种盐反应一定生成两种新盐
A.①③⑥ B.①②③④⑥ C.②④⑤ D.②④⑥
5.随着神舟十五号飞船的成功发射,6名中国航天员在空间站实现在轨交接。空间站中有一套完善的再生式环境控制与生命保障系统,可实现舱内氧气和水的循环利用,保障航天员长时间在轨驻留的需求。下列过程属于物理变化的是
A.长征二号遥十五火箭点火发射 B.冷凝回收舱内的水蒸气
C.利用循环水电解制氧气 D.还原去除舱内的二氧化碳
6.是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
A.途径①与物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.反应②的方程式为:
D.后面途径转化中,加入的Y物质体现了其氧化性
7.中国传统文化博大精深,蕴含着丰富的化学知识,以下语句与图中变化相符的是
A.庭草留霜池结冰
B.李商隐《相见时难别亦难》:“春蚕到死丝方尽,蜡炬成灰泪始干。”
C.千锤万凿出深山,烈火焚烧若等闲
D.有以硫黄、雄黄合硝石,并蜜烧之,焰起烧手面,及烬屋舍者
8.下列反应的离子方程式书写正确的是
A.氢氧化钡溶液与过量硫酸氢钠溶液混合:SO+H++OH-+Ba2+=BaSO4↓+H2O
B.氢氧化镁固体和稀盐酸反应的离子方程式为: H+ +OH﹣=H2O
C.向碳酸氢钙溶液中加入盐酸:HCO+H+= CO2↑+H2O
D.将CO2通入CaCl2溶液中:CO2+H2O+Ca2+= CaCO3↓+2H+
9.是一种常见的电解质,其两种状态下的导电示意图如图所示,其中电极a、b、均与电源相连
下列说法正确的是
A.图乙中的处于熔融状态
B.电离产生定向移动的离子
C.在外电场的作用下才能发生电离
D.电极a、c连接电源负极,b、d连接电源正极
10.下列关于物质分类的叙述中,不正确的是
A.水属于氧化物 B.属于酸 C.纯碱属于碱 D.液氯属于纯净物
11.下列物质属于电解质的是
A.CO2 B.食盐水 C.Si D.FeCl3
12.H3PO2是一元弱酸,具有强还原性,可将溶液中的Ag+还原为银用于化学镀银,同时H3PO2被氧化为H3PO4。下列说法不正确的是
A.H3PO2与足量NaOH溶液反应的离子方程式为H3PO2+OH-=H2PO+H2O
B.NaH2PO2为酸式盐,其水溶液显酸性
C.若反应中有0.1mol电子转移,镀件质量增加10.8g
D.反应中氧化剂与还原剂的物质的量之比为4:1
13.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 A B C D
强电解质 Fe NaCl
弱电解质
非电解质 蔗糖 酒精
A.A B.B C.C D.D
14.下列透明溶液中,离子能大量共存的是
A.Na+、Cu2+、Cl-、 B.H+、Ca2+、ClO-、
C.Fe2+、H+、、 D.Na+、、OH-、K+
15.工业上制备ClO2的反应原理常采用:2NaClO3+4HCl(浓)=2ClO2↑+Cl2↑+2H2O+2NaCl。浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
二、填空题
16.反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中:
(1)KMnO4中Mn元素被______,氧化剂______,还原剂______。
(2)HCl中氯原子______(填“得到”或“失去”)电子。
(3)氧化产物______,还原产物______,被氧化的HCl和体现酸性的HCl分子数之比是______。
(4)用单线桥法表示该反应中电子转移情况:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O______。
(5)比较KMnO4和Cl2的氧化性:KMnO4______Cl2(填>或<)。
17.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点表示在t1℃时两物质的溶解度关系为b____c(填“>”、“<”或“=”)。
(2)t2℃时,a、b、c三种物质的饱和溶液中溶质的质量分数由大到小的关系为____。
(3)t2℃时,将40 g b物质加入到50 g水中充分溶解后,所得溶液的质量为____。
(4)当b中含有少量的a,若要提纯b,可采用____结晶的方法。
18.如图以稀盐酸为例的反应关系体现了酸的化学性质,其中X与图中所给物质的类别不同。结合此图回答下列问题。
(1)稀盐酸中阳离子的符号是_______。
(2)反应①中石蕊溶液变为_______色。
(3)反应⑤的离子方程式为_______。
(4)图中只生成盐和水的反应有_______(填序号)。
(5)若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是BaCl2、CuSO4、Na2CO3中的_______。
三、计算题
19.现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示,请回答下列问题:
(1)在a→b的反应过程中,其中的氧化剂为_______,被氧化的元素为_______。
(2)已知b→c过程中,仅有溴元素发生化合价变化,写出并配平该反应离子方程式_______;
(3)已知c→d发生反应:2BrO+I2=2IO+Br2;当加入KBrO3量n(KBrO3)=4.2时,则此时余下单质碘的量n(I2)=_______mol;依题综合分析可推出含6 mol KI的硫酸溶液充分反应最终所能消耗n(KBrO3)的最大值为_______mol。
20.将SO2通入用硫酸酸化的重铬酸钾溶液中,可制得硫酸铬钾KCr(SO4)2,反应的化学方程式为_______;如果溶液的酸碱性控制不当,可能会有Cr(OH)SO4杂质生成。现从得到的硫酸铬钾产品中取出3.160g样品加入足量盐酸和BaCl2溶液后,得到白色沉淀5.126g。若产品中杂质只有Cr(OH)SO4,则该产品中KCr(SO4)2的质量分数为_______(用百分数表示,保留1位小数)。[摩尔质量/g·mol-1:KCr(SO4)2283;Cr(OH)SO4165]
四、元素或物质推断题
21.无色透明溶液,欲确定其是否含有下列离子:H+、Mg2+、、Fe3+、Ba2+、、Cl-、,实验如下:
①用玻璃棒蘸取少量该溶液,点在pH试纸中部,试纸变为红色;
②取少量该溶液,加入过量BaCl2溶液,有白色沉淀生成;
③取②中反应后的上层清液,加入AgNO3溶液,有白色沉淀生成,且不溶于稀硝酸;
④取少量原溶液,加入过量的NaOH溶液,有白色沉淀生成,加热时有气体生成。
已知:+OH-NH3↑+H2O。回答下列问题:
(1)溶液中一定存在的离子是_______;溶液中肯定不存在的离子是_______。
(2)写出实验步骤③中发生反应的离子方程式:_______。
(3)写出实验步骤④中生成的沉淀的化学式:_______。
(4)如何验证某离子是否存在,请设计实验证明_______。
22.已知有以下物质相互转化,其中A为常见金属,C为碱。
试回答:
(1)写出F的化学式_______________,H的化学式___________________。
(2)写出由E转变成F的化学方程式:_________________________________。
(3)向G溶液加入A的有关反应离子方程式:____________________。
(4)写出A在一定条件下与水反应的化学方程式并用双线桥标出该反应的电子转移情况__________________。
五、实验题
23.为探究固体X(仅含两种元素)的组成和性质,设计并完成如下实验:
已知溶液B仅含一种溶质,气体C的摩尔质量为。请回答:
(1)组成固体X的两种元素为_______。
(2)固体X与适量稀硫酸反应的离子方程式为_______。
(3)白色沉淀在空气中灼烧的化学方程式为_______。
(4)气体C和按物质的量之比1:4通入水中恰好完全反应。请设计实验检验产物的阴离子_______。
24.(1)将5-6滴__________(填化学式)饱和溶液滴入煮沸的蒸馏水中,继续加热至液体变为_______色,制得Fe(OH)3胶体。Fe(OH)3胶体与Fe(OH)3沉淀的本质区别在于 _________________________________。
(2)写出制备Fe(OH)3胶体的化学方程式_____________________。
(3)怎样证明制得的物质是胶体?请简述操作过程____________________。
【参考答案】
一、选择题
1.D
解析:A.根据转化关系可知:在转化过程中H始终呈+1价,A错误;
B.反应②为,该反应过程中元素化合价不变,因此反应属于非氧化还原反应,B错误;
C.Li是催化剂,和LiOH均是中间产物,C错误;
D.根据分析,整个过程的总反应为氮气和水生成氨气和氧气,可表示为,D正确;
故选D。
2.A
解析:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,得电子化合价降低的P原子被还原,失电子化合价升高的P原子被氧化;如果有11molP参加氧化还原反应,有5molP化合价降低被还原生成5molCu3P,有6molP化合价升高被氧化生成6molH3PO4,所以被氧化的P原子与被还原的P原子个数比是6∶5,
故选A。
3.D
【分析】Fe粉和稀盐酸反应,和石灰水、碳酸钠溶液不反应;石灰水和碳酸钠溶液、稀盐酸反应;碳酸钠溶液和稀盐酸反应;据此分析解答。
解析:(1)铁粉与稀盐酸的反应,其离子反应方程式为Fe+2H+=Fe2++H2↑
(2)石灰水与稀盐酸的反应,其离子反应方程式为OH-+H+=H2O
(3)Na2CO3溶液与稀盐酸,其离子反应方程式为CO+2H+=CO2+H2O
(4)石灰水与Na2CO3溶液的反应,其离子反应方程式为Ca2++CO =CaCO3↓
能发生离子反应的有4个,故选D。
4.C
解析:①只含有一种元素的物质不一定是纯净物,如O2、O3的混合物中只含O元素,故①错误;
②“卤水点豆腐”“黄河入海口处三角洲的形成”都与胶体的聚沉有关,故②正确;
③与反应生成和,不是酸性氧化物,故③错误;
④向胶体中加入过量稀硫酸,先发生胶体聚沉有红褐色沉淀生成,然后氢氧化铁和硫酸反应生成硫酸铁和水,沉淀溶解形成棕黄色溶液,故④正确;
⑤碱性氧化物一定是金属氧化物,故⑤正确;
⑥两种盐反应不一定生成两种新盐,如NaHSO4和NaHCO3反应生成Na2SO4、二氧化碳、水,故⑥错误;
正确的是②④⑤,选C。
5.B
解析:A.火箭点火发射时燃料燃烧,属于化学变化,A不选;
B.冷凝水蒸气得到液态水,没有生成新物质,属于物理变化,B选;
C.电解水制氧气有新物质生成,属于化学变化,C不选;
D.用氢气还原去除舱内的二氧化碳生成水,有新物质生成,属于化学变化,D不选;
故选:B。
6.D
解析:A.途径①中Cu和、反应生成CuSO4,Cu与混酸反应的离子反应为3Cu+8H++2NO=3Cu2++2NO+4H2O,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,要使途径①所得溶液只含3mol CuSO4,则消耗的物质的量为2mol时,的物质的量为3mol,所用混酸中与物质的量之比最好为3:2,故A正确;
B.①③中生成有毒气体,②中Cu、氧气、硫酸反应生成硫酸铜和水,则途径②更好地体现了绿色化学思想,故B正确;
C.反应②中Cu和氧气、硫酸反应生成硫酸铜和水,化学方程式为:,故C正确;
D.硫酸铜与氢氧化钠生成氢氧化铜沉淀,与Y生成氧化亚铜,知Y可为葡萄糖,葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,该过程中Cu元素化合价下降,Cu(OH)2作为氧化剂,C6H12O6是还原剂,体现还原性,故D错误;
故选D。
7.C
解析:图中表示反应物的总能量低于生成物的总能量,为吸热反应。
A.庭草留霜池结冰是物理变化,A错误;
B.燃烧为放热反应,B错误;
C.石灰石高温分解为吸热反应,C正确;
D.黑火药燃烧爆炸为放热反应,D错误;
故选C。
8.C
解析:A.氢氧化钡溶液与过量硫酸氢钠溶液混合生成硫酸钡、硫酸钠和水,方程式为:SO+2H++2OH-+Ba2+=BaSO4↓+2H2O,A错误;
B.氢氧化镁固体难溶,和稀盐酸反应的离子方程式为:2H++Mg(OH)2=Mg2++2H2O,B错误;
C.向碳酸氢钙溶液中加入盐酸生成氯化钙、水和二氧化碳,离子方程式为:HCO+H+= CO2↑+H2O,C正确;
D.碳酸的酸性弱于盐酸,将CO2通入CaCl2溶液中不反应,D错误;
答案选C。
9.A
解析:A.图乙中只有钠离子和氯离子,则说明处于熔融状态,图甲是水合钠离子和水合氯离子,说明NaCl处于水溶液中,故A正确;
B.电离产生的离子是自由移动的,在电场的作用下离子作定向移动,故B错误;
C.根据甲得到在水中发生电离,并不是在外电场的作用下才能发生电离,故C错误;
D.根据“异性相吸”,电极a、c连接电源正极,b、d连接电源负极,则D错误。
综上所述,答案为A。
10.C
解析:A.水是氢元素与氧元素形成的氧化物,故A正确;
B.硫酸是二元强酸,故B正确;
C. 纯碱是碳酸钠,属于盐而不是碱,故C错误;
D. 液氯是氯气的液态,属于纯净物,故D正确;
故选C。
11.D
解析:A.CO2自身不能电离出自由移动的离子,为非电解质,A不符合题意;
B.食盐水为混合物,既不是电解质又不是非电解质,B不符合题意;
C.Si为单质,既不是电解质又不是非电解质,C不符合题意;
D.FeCl3为化合物,溶于水可以导电,为电解质,D符合题意;
综上所述答案为D。
12.B
解析:A.是一元弱酸,与足量NaOH溶液反应的离子方程式为,A说法正确;
B.是一元弱酸,为正盐,其水溶液显中性,B说法错误;
C.若反应中有0.1mol电子转移,则有0.1mol被还原为银,镀件质量增加10.8g,C说法正确;
D.1个转化为Ag转移1个,1个转化为转移4个,根据得失电子守恒得关系式:氧化剂与还原剂的物质的量之比为4:1,D说法正确;
故答案选B。
13.C
解析:A.是单质,既不是电解质也不是非电解质,选项A错误;
B.不能电离,属于非电解质,溶于水的部分完全电离,属于强电解质,选项B错误;
C.溶于水的部分完全电离,属于强电解质,为弱电解质,酒精为非电解质,选项C正确;
D.H2O是弱电解质,不是非电解质,选项D错误;
答案选C。
14.A
解析:A.选项离子之间不能发生任何反应,可以大量共存,A符合题意;
B.H+、生成HClO,不能大量共存,B不符合题意;
C.Fe2+、H+、 反应产生Fe3+、NO、H2O,不能大量共存,C不符合题意;
D.与OH-生成H2O、CO,不能大量共存,D不符合题意;
故合理选项是A。
15.B
解析:反应为浓盐酸和盐的反应,体现了浓盐酸的酸性;反应HCl中氯元素化合价部分升高,发生氧化反应,HCl为还原剂,体现了其还原性;
故选B。
二、填空题
16.(1) 还原 KMnO4 HCl
(2)失去
(3) Cl2 MnCl2 10∶6或5∶3
(4)
(5)KMnO4>Cl2
解析:(1)Mn元素化合价变化为KMnO4→MnCl2,由+7价降低为+2价,故Mn元素被还原,KMnO4作氧化剂,HCl中Cl元素化合价升高,作还原剂。
(2)HCl中氯原子元素化合价升高,失去电子。
(3)Mn元素化合价降低,被还原,生成MnCl2为还原产物,Cl元素化合价升高,被氧化,生成Cl2为氧化产物;反应16molHCl中被氧化的HCl为10mol,体现酸性的为6mol,故被氧化的HCl和体现酸性的HCl分子数之比是10:6或5:3。
(4)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,16molHCl中Cl失去10mol电子,KMnO4得到10mol电子,故单线桥为 。
(5)根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,故氧化性KMnO4>Cl2。
17.(1)=(2)b>a>c(3)75 g(4)降温(或冷却热饱和溶液)
解析:(1)根据图示可知:P点表示在t1℃时b、c两物质的溶解度相同,因此两种物质的溶解度大小关系为b=c;
(2)根据物质的溶解度与溶液中溶质质量分数关系关系可知:物质的溶解度越大,形成的该温度下的饱和溶液的质量分数就越大。在t2℃时,a、b、c三种物质的溶解度大小关系为:b>a>c,因此三种物质形成的饱和溶液中溶质的质量分数由大到小的关系为:b>a>c;
(3)根据图示t2℃时,b物质的溶解度是50 g,表示100 g水最多可溶解50 b形成150 g该温度下的饱和溶液,则在该温度下,若将40 g b物质加入到50 g水中充分溶解后,50 g水最多可溶解25 g的b物质,所得溶液的质量m(溶液)=50 g+25 g=75 g;
(4)根据图象可知:b物质的溶解度受温度的影响变化较大,而a物质的溶解度受温度的影响变化较小,所以当b中含有少量的a杂质时,若要提纯b,可采用降温结晶(或冷却热饱和溶液)的方法提纯b物质。
18.(1)H+(2)红(3)Al2O3+6H+=2Al3++3H2O(4)③⑤(5)Na2CO3
解析:(1)HCl在水溶液中电离出阳离子H+和阴离子Cl-,故此处填:H+;
(2)稀盐酸属于酸溶液,遇石蕊变红,故此处填:红;
(3)Al2O3与盐酸反应生成AlCl3和H2O,对应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
(4)反应③:Ca(OH)2与稀盐酸反应只生成盐CaCl2和水,由第(3)问,反应⑤也符合题意,故此处填:③⑤;
(5)BaCl2与稀盐酸和Ca(OH)2均不反应,CuSO4与稀盐酸不反应,Na2CO3与稀盐酸和Ca(OH)2均反应,故此处填:Na2CO3。
三、计算题
19. KBrO3 I 1.5 mol 7.2
解析:(1)a→b的反应过程中含碘物质由6 mol KI转变成3mol,根据元素守恒可知1mol产物中含有2molI,应为碘单质,KBrO3作氧化剂,将KI氧化成碘单质,被氧化的元素为I,故答案为:KBrO3;I;
(2)b→c过程中,仅有溴元素发生化合价变化,可知是KBrO3氧化a→b过程中生成的溴离子的反应,反应产物为溴单质,反应的离子方程式为:,故答案为:;
(3)由以上分析可知a→b的反应为:,该过程中6molKI完全反应时消耗1molKBrO3,同时生成1mol溴离子和3mol碘单质;b→c过程中发生的反应为:,该过程中1mol的溴离子消耗0.2molKBrO3,c→d发生反应:2BrO+I2=2IO+Br2,加入KBrO3量n(KBrO3)=4.2时前两个阶段消耗1.2mol,该过程中消耗3mol,则反应的碘单质为1.5mol,剩余的碘单质为3mol-1.5mol=1.5mol,若3mol碘单质完全被消耗时c→d过程中消耗的KBrO3为6mol,则整个过程中消耗的KBrO3物质的量为:7.2mol,故答案为:1.5mol;7.2;
20. K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O 89.6%
解析:由题意可知,二氧化硫与酸性重铬酸钾溶液反应生成硫酸铬钾和水,反应的化学方程式为K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O;设硫酸铬钾的物质的量为x,Cr(OH)SO4的物质的量为y,由质量可得:283x+165y=3.160,由反应生成5.126g白色沉淀可得:2x+y=,解联立方程可得x=0.01、y=0.002,则样品中硫酸铬钾的质量分数×100%=89.6%,故答案为:K2Cr2O7+3SO2+H2SO4=2KCr(SO4)2+H2O;89.6%。
四、元素或物质推断题
21.(1) H+、Mg2+、、 、Fe3+、Ba2+
(2)Ag++Cl-=AgCl↓
(3)Mg(OH)2
(4)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有
解析:溶液无色透明,所以不含Fe3+,根据①可知该溶液显酸性,存在大量H+,所以一定不含;实验②加入过量氯化钡产生白色沉淀,说明含有,则原溶液中一定不含Ba2+;实验③取②中反应后的上层清液,加入AgNO3溶液,有白色沉淀生成,且不溶于稀硝酸,白色沉淀为氯化银,因②引入Cl-,所以不能确定是否含Cl-;实验④中取少量原溶液,加入过量的NaOH溶液,有白色沉淀生成,说明含有Mg2+,该沉淀为氢氧化镁,加热时有气体生成,结合题目所给条件可知该气体为NH3,原溶液中含有。
(1)根据分析可知溶液中一定存在的离子是H+、Mg2+、、,溶液中肯定不存在的离子是、Fe3+、Ba2+;
(2)实验③中为氯离子和银离子反应生成沉淀,离子方程式为Ag++Cl-=AgCl↓;
(3)根据分析可知白色沉淀为Mg(OH)2;
(4)根据分析可知不能确定的离子是Cl-,检验方法是为:取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,说明有Cl-,反之则没有。
22. Fe(OH)3 AgCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe3++Fe=3Fe2+
【分析】白色沉淀E在空气中转变为红褐色沉淀F,可推出E为氢氧化亚铁,F为氢氧化铁,F为氯化铁,故B中含有亚铁离子,透过蓝色钴玻璃观察焰色反应为紫色,可知D中含有K元素,又因为D与硝酸银生成白色沉淀H,可知H为AgCl,D为KCl,所以B中含有氯离子,故B为氯化亚铁,D为KCl和氯化亚铁的混合物,则A为Fe。
解析:(1)由分析可知,F为Fe(OH)3,H为AgCl;
(2)氢氧化亚铁转化为氢氧化铁的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)向G溶液加入A的有关反应离子方程式为2Fe3++Fe=3Fe2+;
(4)Fe与水反应的方程式的电子转移可表示为。
五、实验题
23.(1)、
(2)
(3)
(4)取适量反应后的溶液于试管中,加入足量溶液,产生白色沉淀,则证明存在。静置,向上清液中加入酸化的溶液,产生白色沉淀,则证明存在
【分析】根据固体X加入稀硫酸,生成黄色单质A,A为S,溶液B中加入足量后,生成白色沉淀,再灼烧沉淀,生成红棕色的固体,质量为16g,物质的量为0.1mol,铁元素物质的量为0.2mol,质量为,S元素的质量为,物质的量为:0.15mol,可知固体X中一定含有的元素为:、,化学式为:;溶液B仅含一种溶质,加入足量后,生成白色沉淀,B中的溶质为,生成的白色沉淀为,气体C的摩尔质量为,为。
解析:(1)根据固体X加入稀硫酸,生成黄色单质A,A为S,溶液B中加入足量后,在灼烧沉淀,生成红棕色的固体,可知固体X中一定含有的元素为:、;
(2)根据以上分析,固体X和稀硫酸反应生成S单质,和,反应的离子方程式为:;
(3)色沉淀为,在空气中灼烧生成红棕色的,反应的化学方程式为:;
(4)和按物质的量之比1:4通入水中恰好完全反应,根据氧化还原反应中电子转移数目相等,4mol转移8mol电子,还原产物为,1mol转移8mol电子,化合价升高8,生成氧化产物为,设计实验检验溶液中的:取适量反应后的溶液于试管中,加入足量溶液,产生白色沉淀,则证明存在。静置,向上清液中加入酸化的溶液,产生白色沉淀,则证明存在。
24. FeCl3 红褐 分散质微粒直径大小不同 FeCl3+3H2OFe(OH)3(胶体)+3HCl 用激光笔照射制取得到的红褐色液体,若从侧面看到有一条光亮的通路,就证明产生了胶体。
解析:(1)将5-6滴饱和FeCl3溶液滴入到200 mL煮沸的蒸馏水中,继续加热至液体变为红褐色,停止加热,就制取得到Fe(OH)3胶体。Fe(OH)3胶体与Fe(OH)3沉淀的本质区别在于分散质微粒直径大小不同。Fe(OH)3胶体中分散质微粒直径在1-100 nm之间,而Fe(OH)3沉淀的分散质微粒直径大于100 nm;
(2)将5-6滴饱和FeCl3溶液滴入到200 mL煮沸的蒸馏水中,继续加热至液体变为红褐色,停止加热,就制取得到Fe(OH)3胶体,制备Fe(OH)3胶体的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(3)用激光笔照射制取得到的红褐色液体,若从侧面看到有一条光亮的通路,就证明产生了胶体,这种现象为胶体特有的性质,即胶体能够产生丁达尔效应。
