专题2化学反应速率与化学平衡强化基础高二上学期化学苏教版(2019)选择性必修1(含解析)
文档属性
| 名称 | 专题2化学反应速率与化学平衡强化基础高二上学期化学苏教版(2019)选择性必修1(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 670.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 12:22:38 | ||
图片预览



文档简介
专题2《化学反应速率与化学平衡》强化基础
一、单选题
1.在容积不变的密闭容器中加入一定量的A和B,发生反应:,在相同时间内,测得不同温度下A的转化率如下表所示。下列说法正确的是
温度/℃ 100 200 300 400 500
转化率% 30 75 75 50 18
A.该反应的正反应是吸热反应
B.一定温度下,容器内气体密度不变,说明反应达到平衡状态
C.200℃,A的转化率为75%时,反应达到平衡状态
D.400℃时,若B的平衡浓度为,则该反应的平衡常数
2.臭氧分解的反应历程包括以下反应:
反应①:(快)
反应②:(慢)
大气中的氯氟烃光解产生的氯自由基能够催化分解,加速臭氧层的破坏。下列说法正确的是
A.活化能:反应①<反应②
B.只参与反应①,改变分解的反应历程
C.分解为的速率主要由反应①决定
D.参与反应提高了分解为的平衡转化率
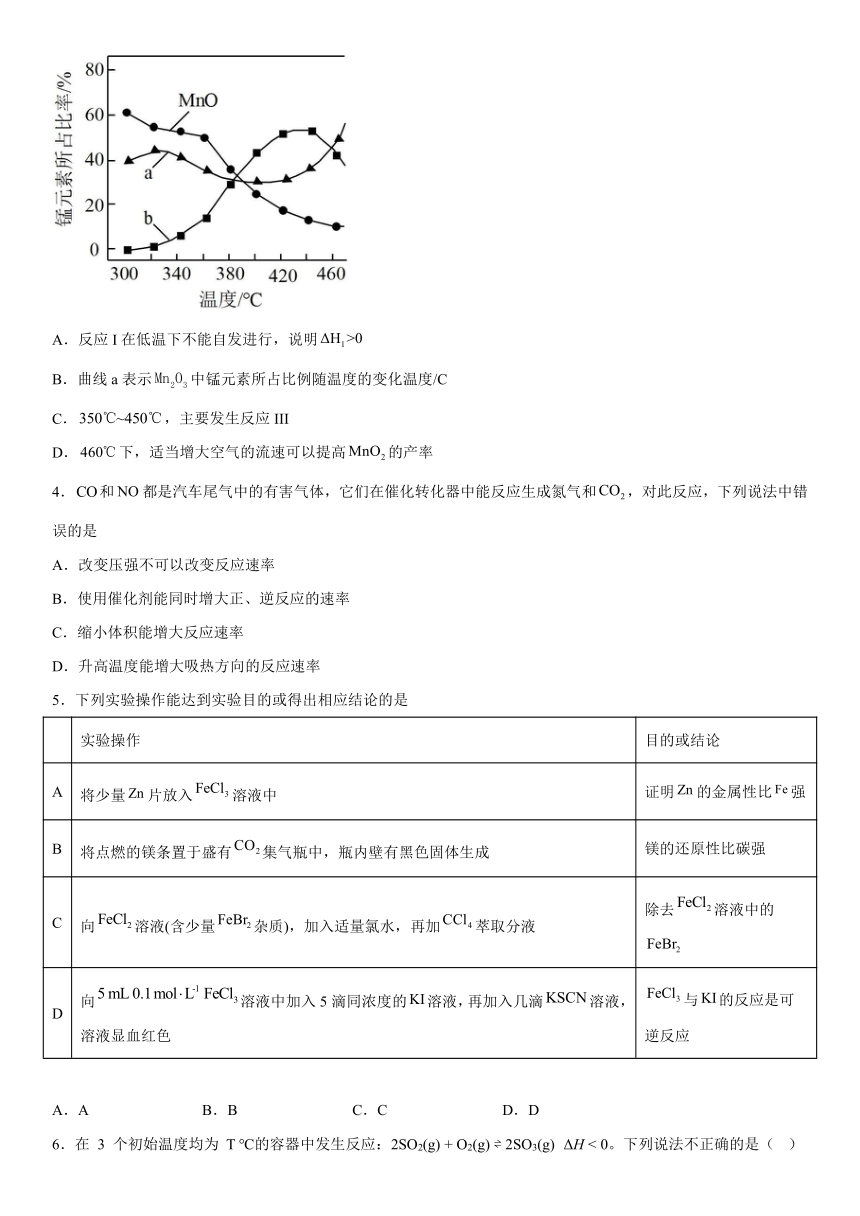
3.在一定空气流速下,热解得到三种价态锰的氧化物。相同时间内锰元素所占比例()随热解温度变化的曲线如图所示。坐标系中主要发生如下反应:
反应I:
反应II:
反应III:
下列说法错误的是
A.反应I在低温下不能自发进行,说明
B.曲线a表示中锰元素所占比例随温度的变化温度/C
C.,主要发生反应III
D.下,适当增大空气的流速可以提高的产率
4.和都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和,对此反应,下列说法中错误的是
A.改变压强不可以改变反应速率
B.使用催化剂能同时增大正、逆反应的速率
C.缩小体积能增大反应速率
D.升高温度能增大吸热方向的反应速率
5.下列实验操作能达到实验目的或得出相应结论的是
实验操作 目的或结论
A 将少量片放入溶液中 证明的金属性比强
B 将点燃的镁条置于盛有集气瓶中,瓶内壁有黑色固体生成 镁的还原性比碳强
C 向溶液(含少量杂质),加入适量氯水,再加萃取分液 除去溶液中的
D 向溶液中加入5滴同浓度的溶液,再加入几滴溶液,溶液显血红色 与的反应是可逆反应
A.A B.B C.C D.D
6.在 3 个初始温度均为 T ℃的容器中发生反应:2SO2(g) + O2(g) 2SO3(g) ΔH < 0。下列说法不正确的是( )
容器编号 容器类型 初始体积 反应物起始物质的量(mol) 平衡时 n(SO3)/ mol
SO2 O2 SO3
I 恒温恒容 1.0 L 2 1 0 1.6
II 绝热恒容 1.0 L 2 1 0 a
III 恒温恒压 0.5 L 1 0.5 0 b
A.a < 1.6
B.b < 0.8
C.平衡时,以 SO2 表示的正反应速率:v(I) < v(II)
D.若起始时向容器 I 中充入 0.4 mol SO2(g)、0.3 mol O2(g)和 1.6 mol SO3(g),反应正向进行
7.在容积固定的2 L密闭容器中发生反应:CO(g)+2H2(g)CH3OH(g) △H=a kJ·mol-1,若充入2 mol CO(g)和4 mol H2(g),在不同温度、不同时段下H2的转化率如下表:(已知a1≠a2)
15分钟 30分钟 45分钟 1小时
T1 45% 75% 85% 85%
T2 40% 60% a1 a2
下列说法中错误的是A.T1℃下,45分钟该反应达到平衡状态
B.根据数据判断:T1C.T2℃下,在前30分钟内用CO表示的化学反应速率为1.20 mol/(L·h)
D.该反应的△H>0
8.一定条件下存在反应:CO(g)+H2O(g)CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.两容器中正反应速率:I<II
B.两容器中的平衡常数:I>II
C.容器Ⅰ 中CO2的物质的量比容器Ⅱ中CO2的少
D.容器Ⅰ 中CO 的转化率与容器II中CO2 的转化率之和大于1
9.3.25 g锌与100 mL 1 mol·L-1的稀硫酸反应,为了加快反应速率而不改变H2的产量,可采取的措施是
A.滴加几滴浓盐酸 B.滴加几滴浓硝酸
C.滴加几滴硫酸铜溶液 D.加入少量锌粒
10.下列不能用平衡移动原理解释的是( )
A.合成氨时将氨液化分离,可提高原料的利用率
B.H2、I2、HI混合气体加压后颜色变深
C.实验室用排饱和NaCl溶液的方法收集Cl2
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
11.在下列反应CO+H2O CO2+H2中,加入C18O后,则18O存在于
A.只存在于CO和CO2中 B.存在于CO、H2O、CO2中
C.只存在于CO中 D.存在于CO、H2O、CO2、H2中
12.甲苯(用C7H8表示)是一种挥发性的大气污染物。热催化氧化消除技术是指在Mn2O3作催化剂时,用O2将甲苯氧化分解为CO2和H2O。热催化氧化消除技术的装置及反应机理如图所示,下列说法中错误的是
A.反应Ⅱ的方程式为
B.反应Ⅰ中Mn元素的化合价升高
C.反应Ⅱ中O-H键的形成会释放能量
D.Mn2O3作催化剂可降低总反应的焓变
13.在一定条件下,反应2A(g)+2B(g)3C(g)+D(g),达到平衡状态的标志是:
A.单位时间内生成2nmolA,同时生成nmolD B.容器内压强不随时间而变化
C.单位时间内生成nmolB,同时消耗1.5nmolC D.容器内混合气体密度不随时间而变化
14.催化某反应的一种催化机理如图所示,其中是氢氧自由基,是醛基自由基,下列叙述不正确的是
A.使用催化时,该反应的不变
B.不是所有过程都发生氧化还原反应
C.总反应为
D.为中间产物之一,与中所含阴离子相同
二、填空题
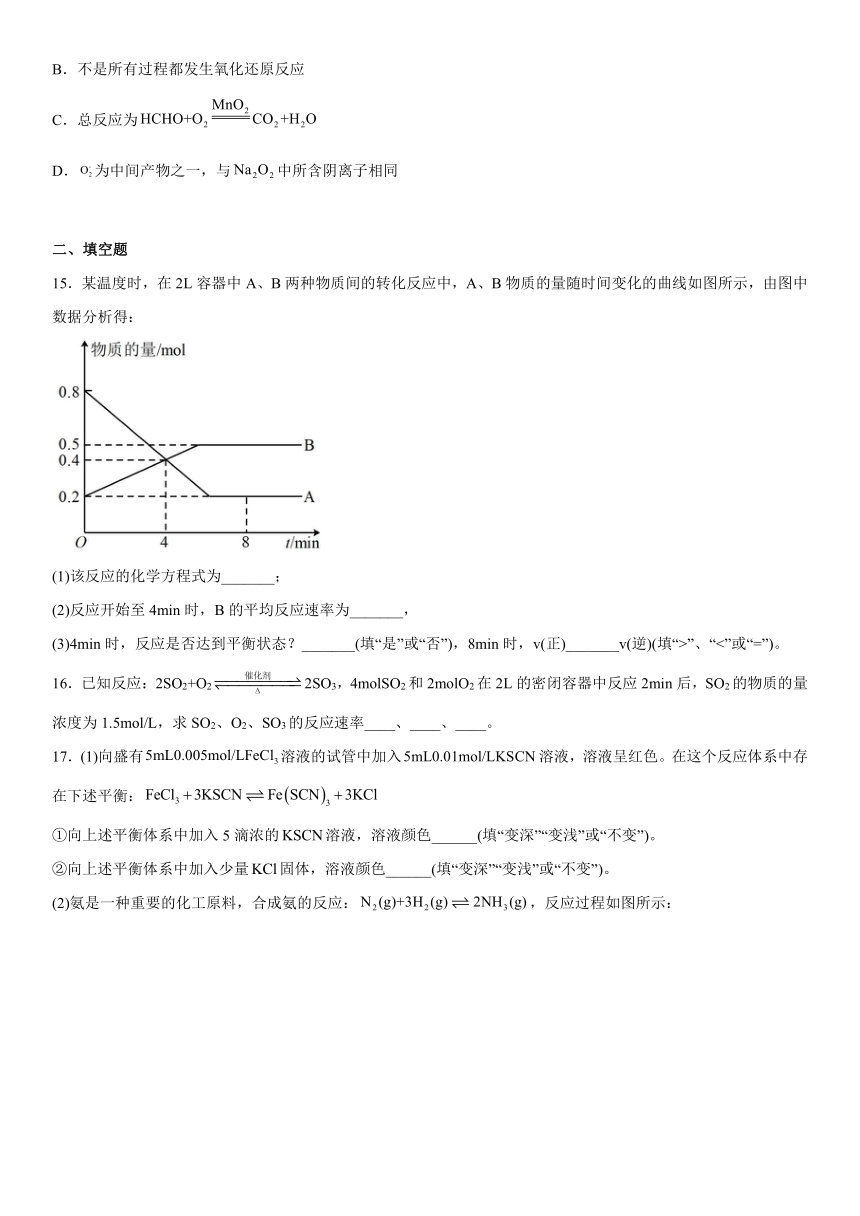
15.某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为_______;
(2)反应开始至4min时,B的平均反应速率为_______,
(3)4min时,反应是否达到平衡状态?_______(填“是”或“否”),8min时,v(正)_______v(逆)(填“>”、“<”或“=”)。
16.已知反应:2SO2+O22SO3,4molSO2和2molO2在2L的密闭容器中反应2min后,SO2的物质的量浓度为1.5mol/L,求SO2、O2、SO3的反应速率____、____、____。
17.(1)向盛有溶液的试管中加入溶液,溶液呈红色。在这个反应体系中存在下述平衡:
①向上述平衡体系中加入5滴浓的溶液,溶液颜色______(填“变深”“变浅”或“不变”)。
②向上述平衡体系中加入少量固体,溶液颜色______(填“变深”“变浅”或“不变”)。
(2)氨是一种重要的化工原料,合成氨的反应:,反应过程如图所示:
① ______(用含、的式子表示)。
②加催化剂的曲线______(填“Ⅰ”或“Ⅱ”)。
③在一定条件下,能说明反应一定达到平衡的是______(填字母代号)。
A.
B.单位时间内消耗的同时消耗
C.的物质的量之比为
D.混合气体中保持不变
18.一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的气体物质的量为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是
A.断开3molH-H键的同时断开2molN-H键 B.c(N2) : c(H2): c(NH3) =1:3:2
C.混合气体的平均相对分子质量不变 D.容器内密度不变
(2)N2的转化率α1%=_______,若相同条件下,此反应在容积可变的容器中进行,保持压强不变,达到平衡,则N2的转化率α2%_______α1%(填“>”、“<”或“=”)
(3)该温度下,反应的化学平衡常数K=_______,若此时再加入0.6molN2和0.4mol NH3,则平衡_______(填“向左移动”、“向右移动”或“不移动”)
19.在一密闭容器中发生反应N2+3H2=2NH3 ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是___________(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻___________;t3时刻___________;t4时刻___________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是___________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线______。
20.下列说法中能说明2HI(g) H2(g)+I2(g)已达平衡状态的是_______。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③c(HI)=c(I2)
④反应速率:v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(I2)∶c(H2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
21.一定温度下,在容积为1L的密闭容器内放入2molN2O4和8molNO2,发生如下反应:2NO2(红棕色)N2O4(无色)( ΔH<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:___________mol·L-1·s-1
(2)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:___________
(3)t1时,正反应速率___________(填“>”、“<”或“=”)逆反应速率
(4)维持容器的温度不变,若缩小容器的体积,则平衡向___________移动(填“正反应方向”、“逆反应方向”或“不移动”)
(5)维持容器的体积不变,升高温度,达到新平衡时体系的颜色___________(填“变深”、“变浅”或“不变”)
22.某化工厂利用CH4制取CO和H2,其生产流程如图。回答下列问题:
(1)该流程中第Ⅰ步反应为CH4(g)+H2O(g) CO(g)+3H2(g) H,一定条件下,CH4的平衡转化率与温度、压强的关系如图,则P1______(填“”“”或“”,下同) P2, H ______0。
(2)该流程中第Ⅱ步反应的平衡常数随温度的变化如下表:
温度/℃ 300 500 830
平衡常数K 12 9 1
①据上表信息分析判断,该反应的 H ______(填“”“”或“”)0。
②写出第Ⅱ步反应的化学方程式:______。在830℃时,设起始时CO和H2O(g)的浓度均为0.10mol/L,在该条件下反应达到平衡时,CO的转化率为______。
23.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应: H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=_______。平衡时H2的转化率为_______%。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: H<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ 200 300 400
K K1 K2 0.5
请完成下列问题:
①写出化学平衡常数K的表达式_______。
②试比较K1、K2的大小,K1_______K2(填“>”、“<”或“=”);
③400℃时,反应的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正_______v(N2)逆(填“>”、“<”或“=”)。
24.硫酸工业中, 是重要一步反应。回答下列问题:
(1)某温度下,若的平衡常数,则在同一温度下,反应的平衡常数K=___________。
(2)在恒温下,向恒容密闭容器中加入和发生反应,时反应达到平衡。测得内,平衡后的转化率α1=___________。其他条件不变,反应若在恒压条件下进行,平衡时的转化率α2___________(填“>”“=”或“<”)α1,平衡常数___________(填“增大”“不变”或“减小”,若要使平衡常数减小,可采取的措施是___________。
(3)一定条件下,在恒温恒容的密闭容器中按一定比例充入和,平衡时的体积分数随的变化如图所示。则A、B、C三状态中,的转化率最大的是___________点,当达到平衡状态的体积分数可能是D、E、F三点中的___________点。
参考答案:
1.D
【详解】A.温度升高,化学反应速率加快,在相同时间内,反应物的转化率应增大,但由表中数据可知,从300℃升至400℃、500℃时,A的转化率反而降低,说明温度升高,该平衡向逆反应方向移动,该反应的正反应为放热反应,A项错误;
B.在容积不变的容器下,气体体积不变,反应物总质量与生成物总质量相等,故不论反应是否达到平衡状态,容器内气体密度均不变,B项错误;
C.该反应的正反应是放热反应,若200℃已达到平衡状态,则A的转化率大于300℃时A的转化率,但表中数据显示这两个温度时A的转化率相等,说明200℃时,反应没有达到平衡状态,C项错误;
D.400℃时,反应达到平衡,A的平衡转化率为50%,根据反应可知,平衡时,B的平衡浓度为,则该反应的平衡常数,D项正确;
答案选D。
2.A
【详解】A.活化能越大,反应速率越慢,由反应②速率慢,则②活化能大,活化能:反应②>反应①,故A正确;
B.氯自由基(Cl )能够催化O3分解,加速臭氧层的破坏,催化剂可降低最大的活化能来增大速率,则Cl 主要参与反应②,故B错误;
C.化学反应由反应速率慢的一步反应决定,则O3分解为O2的速率主要由反应②决定,故C错误;
D.Cl 是催化剂,只改变反应历程,不影响平衡,则O3分解为O2的平衡转化率不变,故D错误;
故选:A。
3.D
【详解】A.由反应I可知该反应ΔS>0,根据吉布斯自由能公式ΔG=ΔH-TΔS,故该I在低温下不能自发进行,则,A正确;
B.温度越高,反应越快,根据反应个反应,可以发现二氧化锰是反应III的产物,故温度升高时,相同时间内,二氧化锰会越来越多,即b代表二氧化锰,a代表,B正确;
C.由图可知时,二氧化锰一直增大,故此时发生的主要反应为反应III,C正确;
D.由图可知450℃时二氧化锰的含量较大,此时适当增大空气的流速可以提高的产率,但是温度较低时,二氧化锰含量较低,增大空气的流速不利于提高的产率,D错误;
故选D。
4.A
【详解】A. 改变压强,如果改变容器的容积,能改变物质的浓度,则可以改变反应速率,A错误;
B. 使用催化剂可同时增大正、逆反应的速率,B正确;
C. 缩小体积相当于增大压强,能增大反应速率,C正确;
D. 升高温度,吸热方向、放热方向的反应速率均增大,只是吸热方向的速率增大的程度更大,D正确;
故选A。
5.B
【详解】A.将少量片放入溶液中,发生反应,没有铁被置换出来,不能证明的金属性比强,故不选A;
B.将点燃的镁条置于盛有集气瓶中,发生反应,镁是还原剂、C是还原产物,证明镁的还原性比碳强,故选B;
C.Fe2+还原性大于Br-,氯气先氧化Fe2+,向溶液(含少量杂质)中加入适量氯水,不能除去溶液中的,故不选C;
D.向溶液中加入5滴同浓度的溶液,过量,再加入几滴溶液,溶液显血红色,不能证明与的反应是可逆反应,故不选D;
选B。
6.B
【详解】A.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则平衡向逆反应方向移动,三氧化硫的物质的量减小,则a <1.6,故A正确;
B.该反应为气体体积减小的反应,恒温恒压与恒温恒容相比,相当于增大压强,则平衡向正反应方向移动,三氧化硫的物质的量增大,则b>0.8,故B错误;
C.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则化学反应速率增大,则平衡时,以SO2表示的正反应速率:v(I) < v(II),故C正确;
D.若起始时向容器I中充入0.4 mol SO2(g)、0.3 molO2(g)和1.6 molSO3(g),等效为起始时向容器 I 中充入SO2(g)为(0.4 +1.6)mol=2.0mol 、O2(g) 为(0.3+0.8) mol=1.1mol,与I相比,相当于增大氧气的浓度,增大反应物浓度,平衡向正反应方向移动,故D正确;
故选B。
7.B
【分析】根据平衡的定义,当物质的浓度保持不变时达到的状态即为平衡状态进行判断平衡点,根据转换率可表示单位时间内转换的快慢可以判断反应速率。根据速率公式进行计算速率。
【详解】A.T1℃下,45分钟到1小时氢气的转化率不变,故可判断达到平衡,故A正确;B.根据a1≠a2判断T2时达到平衡的时间在45分钟后,T2比T1的反应慢,故温度低,B不正确;
C.T2℃下,在前30分钟内氢气的转化率为60%,则转换了的氢气的物质的量为:4 mol ×60%=2.4mol,则转换的一氧化碳根据方程式计算得:1.2mol,根据速率公式得:,故C正确;
D.根据温度T2到T1的转化率降低,说明平衡相对向逆移,而温度降低,故逆反应为放热,正反应时吸热反应,故D正确;
故选答案B。
【点睛】注意反应是吸热还是放热,根据温度对平衡的影响进行判断,升高温度平衡向吸热方向移动。
8.C
【详解】A.若两容器保持恒温,则为等效平衡,正反应速率相等,现为恒容绝热容器,I中温度升高,II中温度降低,所以达平衡时,混合气体的温度I比II高,正反应速率:I>II,A不正确;
B.由A中分析可知,达平衡时容器I的温度比II高,由于正反应为放热反应,温度越高平衡常数越小,所以两容器中的平衡常数:I<II,B不正确;
C.若温度不变,容器I和容器II中CO2的物质的量相等,现达平衡时,容器I的温度比II高,升温时平衡逆向移动,所以容器Ⅰ中CO2的物质的量比容器Ⅱ中CO2的少,C正确;
D.若温度不变,容器I和容器II为等效平衡,则此时容器Ⅰ中CO 的转化率与容器II中CO2 的转化率之和等于1,现容器II的温度比容器I低,相当于容器I降温,平衡正向移动,容器II中CO2的转化率减小,所以容器Ⅰ 中CO 的转化率与容器II中CO2 的转化率之和小于1,D不正确;
故选C。
9.A
【详解】A.3.25 g Zn的物质的量n(Zn)=,100 mL 1 mol·L-1的稀硫酸中溶质的物质的量n(H2SO4)=1 mol/L×0.1 L=0.1 mol,根据方程式Zn+H2SO4=ZnSO4+H2↑可知:二者反应的物质的量的比是1:1,故硫酸过量,反应放出H2要以不足量的Zn为标准计算。滴加几滴浓盐酸,增加了溶液中c(H+),反应速率加快,A符合题意;
B.硝酸具有强氧化性,与Zn反应不能产生氢气,B不符合题意;
C.Zn与CuSO4发生置换反应产生Cu和ZnSO4,Zn、Cu及硫酸构成原电池,使反应速率加快;但由于Zn消耗,导致反应产生H2的量减少,C不符合题意;
D.加入少量的Zn,由于Zn是固体,浓度不变,因此反应速率不变,但由于不足量的Zn的量增加,以Zn为标准反应产生的H2的量增多,D不符合题意;
故合理选项是A。
10.B
【详解】A.将氨液化分离,即减小氨气浓度,促进平衡向正向移动,提高反应物的转化率,A能用平衡移动原理解释,不符合题意;
B.对于反应 ,由于反应前后气体体积不变,故压强对其平衡无影响,加压颜色加深,是因为体积缩小,导致c(I2)增大,B不能用平衡移动原理解释,符合题意;
C.Cl2在水中存在如下平衡:,在饱和NaCl溶液中,c(Cl-)增大,促使平衡逆向移动,降低Cl2溶解度,故可以用排饱和食盐水收集Cl2,C能用平衡移动原理解释,不符合题意;
D.体系中存在平衡: ,加压体积缩小,导致c(NO2)瞬间增大,体系颜色加深,由于加压平衡正向移动,c(NO2)又逐渐减小,故颜色逐渐变浅,D能用平衡移动原理解释,不符合题意;
故答案选B。
11.B
【详解】由于反应CO+H2O CO2+H2为可逆反应,正反应、逆反应同时进行,则含有O元素的物质中均含有18O,故选B。
12.D
【分析】从图中可以看出,反应Ⅰ中,Mn2O3与O2反应转化为MnO2,反应Ⅱ中,MnO2将C7H8氧化,重新生成Mn2O3。
【详解】A.由图中可以看出,反应Ⅱ中,MnO2转化为Mn2O3,C7H8生成CO2和H2O,方程式为,A正确;
B.反应Ⅰ中,Mn2O3与O2反应转化为MnO2,Mn元素的化合价升高,B正确;
C.反应Ⅱ中,C7H8与MnO2反应生成H2O等,形成O-H键,从而释放能量,C正确;
D.Mn2O3作催化剂,可降低总反应的活化能,但不能改变反应的焓变,D错误;
故选D。
13.A
【详解】A.单位时间内生成2nmolA,同时生成nmolD,反应进行的方向相反,且物质的量的变化量之比等于化学计量数之比,达到了化学平衡状态,A符合题意;
B.因为反应前后气体的分子数相等,压强始终保持不变,所以当容器内压强不随时间而变化时,不能确定反应达平衡状态,B不符合题意;
C.单位时间内生成nmolB,同时消耗1.5nmolC,反应进行的方向相同,不一定达平衡状态,C不符合题意;
D.容器内混合气体的质量、容器的体积始终不变,密度始终不变,所以当密度不随时间而变化,反应不一定达平衡状态,D不符合题意;
故选A。
14.D
【详解】A.催化剂能降低反应的活化能,但不能改变反应热,使用MnO2催化时,该反应的 H不会发生变化,A项正确;
B.催化机理中存在与H+反应生成CO2和H2O的过程,该过程不是氧化还原反应,B项正确;
C.根据图示的催化机理可知总反应为:,C项正确;
D.Na2O2中的阴离子是,与不一样,D项错误;
答案选D。
15.(1)2A B
(2)0.025mol/(L·min)
(3) 否 =
【详解】(1)由图象可看出A为反应物,B为生成物,物质的量不变时反应达到平衡状态,A反应的物质的量=0.8mol-0.2mol=0.6mol;B生成的物质的量=0.5mol-0.2mol=0.3mol,所以A、B转化的物质的量之比为2:1,根据A、B转化的物质的量之比=化学方程式的计量数之比,反应的化学方程式为:2AB;
(2)反应开始至4min时,B物质的量变化0.4mol-0.2mol=0.2mol,B的平均反应速率为 ;
(3)由图象分析可知,4 min时,随时间变化A、B物质的量发生变化,说明未达到平衡;8 min时随时间变化A、B物质的量不再发生变化,说明达到平衡,故v(正) =v(逆)。
16.
【详解】初始SO2浓度为,依题意,
于是:。
由于,于是;
。
17. 变深 不变 (E1-E2)kJ/mol Ⅱ BD
【详解】(1) ①在这个反应体系中存在下述平衡:,其离子方程式为: ,向上述平衡体系中加入5滴浓的溶液,SCN 浓度增大,平衡右移,则溶液颜色变深。
②向上述平衡体系中加入少量固体,反应相关的粒子浓度均未改变,故平衡不移动,溶液颜色不变。
(2)①焓变=生成物总能量-反应物总能量=反应物总键能-生成物总键能=正反应活化能—逆反应活化能,则 (E1-E2)kJ/mol;。
②催化剂能降低反应的活化能,故加催化剂的曲线Ⅱ。
③A.若,则说明未平衡,A不选;
B.单位时间内消耗的必定生成、同时消耗,则,故已平衡,B选;
C.的物质的量之比取决于起始物质的量,时难以说明各成分的量是否不再改变,不一定平衡,C不选;
D.混合气体中保持不变,说明已经平衡,D选;
则答案为BD。
18.(1)C
(2) 50%, >
(3) L2/mol2 不移动
【分析】题中发生反应N2+3H22NH3,根据题中信息进行分析。
(1)
A.断开3molH-H键应断开6molN-H键,A错误;
B.各物质的浓度成比例关系,不能说明达到平衡状态,B错误;
C.平均相对分子质量可表示为,体系中质量守恒m恒定,当不变时,不变,反应前后气体系数发生变化,故不变说明达到平衡状态,C正确;
D.密度,m恒定,V恒定,故密度为定值,故密度不变不能说明达到平衡状态,D错误;
故选C。
(2)
由题得:0.4-x+1.2-3x+2x=1.6×=1.2 x=0.2mol
N2的转化率;
反应正向进行,压强减小,要求压强不变相当于加压,平衡正移,N2的转化率增大,故α2%>α1%。
(3)
,将(2)中数值转化成物质的量浓度,代入可得K=L2/mol2;再加入0.6molN2和0.4mol NH3,则N2为0.8mol,H2为0.6mol,NH3为0.8mol,转化成浓度,代入平衡常数公式,可得K’=L2/mol2,故平衡不移动。
19. ACDF C E B A
【详解】(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。
(2)t1时,v正、v逆同时增大,且v逆增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线为 。
20.②⑥⑨
【分析】当可逆反应达到平衡状态时,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,据此解答。
【详解】①单位时间内生成nmol H2的同时生成nmol HI,速率之比不等于物质的量之比,故错误;
②一个H-H键断裂的同时有两个H-I键断裂,由于一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,反应达到平衡状态,故正确;
③未知起始投入量,c(HI)=c()不能说明反应达平衡状态,故错误;
④反应速率v(H2)=v(I2)=v(HI),未体现正与逆的关系,故错误;
⑤c(HI):c(H2):c(I2)=2:1:1,浓度比与化学计量数比相等并不能证明反应达平衡,故错误;
⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故正确;
⑦前后气体系数和相同,容器压强始终不变,故错误;
⑧反应前后气体总质量不变,总物质的量也不变,相对分子质量一直不变,故错误;
⑨温度和体积一定时,混合气体颜色不再变化,说明c(I2)不再发生变化,反应达到平衡状态,正确;
⑩温度和压强一定时,由于反应前后体积和气体的质量始终不变,则混合气体的密度始终不变,即密度不再变化不能说明反应达到平衡状态,错误;
故答案为:②⑥⑨。
21.(1)0.1
(2)t3
(3)>
(4)正反应方向
(5)变深
【详解】(1)从t1至t2时N2O4的物质的量增加了4mol-3mol=1mol,所以反应速率是=0.1mol/(L·s);
(2)根据图象可知,t3时刻物质的物质的量不再发生变化,所以此时反应达到平衡状态;
(3)t1时NO2的物质的量逐渐减小,说明反应是向正反应方向进行的,即正反应速率大于逆反应速率;
(4)反应前后是体积减小的,所以缩小容积,压强增大,平衡向正反应方向移动;
(5)正反应是放热反应,所以升高温度,平衡向逆反应方向移动,NO2的浓度增大,颜色变深。
22. < > < CO+H2O(g)H2+CO2 50%
【详解】(1)该反应为气体计量数增大的反应,增大压强,平衡逆向移动,则甲烷的平衡转化率降低,根据图象可知,温度相同时,P1的转化率大于P2,则P1<P2;根据图象,升高温度,甲烷的平衡转化率增大,即平衡正向移动,则正反应为吸热反应, H>0;
(2)①根据表中数据,升高温度,平衡常数减小,即平衡逆向移动,则逆反应为吸热反应,故正反应放热反应, H<0;
②根据流程可知,CO与水反应生成二氧化碳和氢气,方程式为CO+H2O(g)H2+CO2;起始时CO和H2O(g)的浓度均为0.10mol/L,
=1,解得x=0.05mol/L,转化率=×100%=50%。
23.(1) 0.05mol/L 50%
(2)CD
(3) > 2 >
【解析】(1)
若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol,消耗0.1mol氮气,平衡时氮气的浓度是=0.05mol/L,消耗氢气的物质的量是0.2mol×1.5=0.3mol,氢气的转化率为:;
(2)
A.加了催化剂加快反应速率,不影响平衡移动,氢气转化率不变,A项不选;
B.增大容器体积,压强减小,平衡向逆反应方向移动,氢气转化率减小,B项不选;
C.正反应为放热反应,降低反应体系的温度,平衡正向移动,氢气转化率增大,C项选;
D.加入一定量N2,平衡正向移动,氢气转化率增大,D项选;
答案选CD;
(3)
①由反应可知平衡常数的表达式为:K=;
②正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故K1>K2;
③400℃时,反应2NH3(g)N2(g)+3H2(g)的化学平衡常数与N2(g)+3H2(g) 2NH3(g)的平衡常数互为倒数,则400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数K==2;此时浓度商Qc==v(N2)逆。
24.(1)
(2) 75% > 不变 升高温度
(3) A D
【分析】的平衡常数K=,的平衡常数K=,据此分析解答;根据v==,结合化学平衡的影响因素分析解答;若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,结合图象分析解答。
【详解】(1)某温度下,若的平衡常数,即K==100;则在同一温度下,反应的平衡常数K===,故答案为:;
(2)测得10min内,则△n()=7.5×10-3mol L-1 min-1×10min×2L=0.15mol,由方程式可知,反应的的物质的量为0.15mol,则的转化率为×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,转化率增大,即转化率α2>α1;
平衡常数只受温度影响,温度不变,平衡常数不变;正反应是放热反应,若要使平衡常数减小,可以升高温度,平衡逆向移动,平衡常数减小,故答案为:75%;>;不变;升高温度;
(3)若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,的转化率越大,因此的转化率最大的是A点;根据图象,的比值越大,平衡时的体积分数越大,当达到平衡状态的体积分数应该大于C,可能是D、E、F三点中的D点,故答案为:A;D。
一、单选题
1.在容积不变的密闭容器中加入一定量的A和B,发生反应:,在相同时间内,测得不同温度下A的转化率如下表所示。下列说法正确的是
温度/℃ 100 200 300 400 500
转化率% 30 75 75 50 18
A.该反应的正反应是吸热反应
B.一定温度下,容器内气体密度不变,说明反应达到平衡状态
C.200℃,A的转化率为75%时,反应达到平衡状态
D.400℃时,若B的平衡浓度为,则该反应的平衡常数
2.臭氧分解的反应历程包括以下反应:
反应①:(快)
反应②:(慢)
大气中的氯氟烃光解产生的氯自由基能够催化分解,加速臭氧层的破坏。下列说法正确的是
A.活化能:反应①<反应②
B.只参与反应①,改变分解的反应历程
C.分解为的速率主要由反应①决定
D.参与反应提高了分解为的平衡转化率
3.在一定空气流速下,热解得到三种价态锰的氧化物。相同时间内锰元素所占比例()随热解温度变化的曲线如图所示。坐标系中主要发生如下反应:
反应I:
反应II:
反应III:
下列说法错误的是
A.反应I在低温下不能自发进行,说明
B.曲线a表示中锰元素所占比例随温度的变化温度/C
C.,主要发生反应III
D.下,适当增大空气的流速可以提高的产率
4.和都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和,对此反应,下列说法中错误的是
A.改变压强不可以改变反应速率
B.使用催化剂能同时增大正、逆反应的速率
C.缩小体积能增大反应速率
D.升高温度能增大吸热方向的反应速率
5.下列实验操作能达到实验目的或得出相应结论的是
实验操作 目的或结论
A 将少量片放入溶液中 证明的金属性比强
B 将点燃的镁条置于盛有集气瓶中,瓶内壁有黑色固体生成 镁的还原性比碳强
C 向溶液(含少量杂质),加入适量氯水,再加萃取分液 除去溶液中的
D 向溶液中加入5滴同浓度的溶液,再加入几滴溶液,溶液显血红色 与的反应是可逆反应
A.A B.B C.C D.D
6.在 3 个初始温度均为 T ℃的容器中发生反应:2SO2(g) + O2(g) 2SO3(g) ΔH < 0。下列说法不正确的是( )
容器编号 容器类型 初始体积 反应物起始物质的量(mol) 平衡时 n(SO3)/ mol
SO2 O2 SO3
I 恒温恒容 1.0 L 2 1 0 1.6
II 绝热恒容 1.0 L 2 1 0 a
III 恒温恒压 0.5 L 1 0.5 0 b
A.a < 1.6
B.b < 0.8
C.平衡时,以 SO2 表示的正反应速率:v(I) < v(II)
D.若起始时向容器 I 中充入 0.4 mol SO2(g)、0.3 mol O2(g)和 1.6 mol SO3(g),反应正向进行
7.在容积固定的2 L密闭容器中发生反应:CO(g)+2H2(g)CH3OH(g) △H=a kJ·mol-1,若充入2 mol CO(g)和4 mol H2(g),在不同温度、不同时段下H2的转化率如下表:(已知a1≠a2)
15分钟 30分钟 45分钟 1小时
T1 45% 75% 85% 85%
T2 40% 60% a1 a2
下列说法中错误的是A.T1℃下,45分钟该反应达到平衡状态
B.根据数据判断:T1
D.该反应的△H>0
8.一定条件下存在反应:CO(g)+H2O(g)CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.两容器中正反应速率:I<II
B.两容器中的平衡常数:I>II
C.容器Ⅰ 中CO2的物质的量比容器Ⅱ中CO2的少
D.容器Ⅰ 中CO 的转化率与容器II中CO2 的转化率之和大于1
9.3.25 g锌与100 mL 1 mol·L-1的稀硫酸反应,为了加快反应速率而不改变H2的产量,可采取的措施是
A.滴加几滴浓盐酸 B.滴加几滴浓硝酸
C.滴加几滴硫酸铜溶液 D.加入少量锌粒
10.下列不能用平衡移动原理解释的是( )
A.合成氨时将氨液化分离,可提高原料的利用率
B.H2、I2、HI混合气体加压后颜色变深
C.实验室用排饱和NaCl溶液的方法收集Cl2
D.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
11.在下列反应CO+H2O CO2+H2中,加入C18O后,则18O存在于
A.只存在于CO和CO2中 B.存在于CO、H2O、CO2中
C.只存在于CO中 D.存在于CO、H2O、CO2、H2中
12.甲苯(用C7H8表示)是一种挥发性的大气污染物。热催化氧化消除技术是指在Mn2O3作催化剂时,用O2将甲苯氧化分解为CO2和H2O。热催化氧化消除技术的装置及反应机理如图所示,下列说法中错误的是
A.反应Ⅱ的方程式为
B.反应Ⅰ中Mn元素的化合价升高
C.反应Ⅱ中O-H键的形成会释放能量
D.Mn2O3作催化剂可降低总反应的焓变
13.在一定条件下,反应2A(g)+2B(g)3C(g)+D(g),达到平衡状态的标志是:
A.单位时间内生成2nmolA,同时生成nmolD B.容器内压强不随时间而变化
C.单位时间内生成nmolB,同时消耗1.5nmolC D.容器内混合气体密度不随时间而变化
14.催化某反应的一种催化机理如图所示,其中是氢氧自由基,是醛基自由基,下列叙述不正确的是
A.使用催化时,该反应的不变
B.不是所有过程都发生氧化还原反应
C.总反应为
D.为中间产物之一,与中所含阴离子相同
二、填空题
15.某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)该反应的化学方程式为_______;
(2)反应开始至4min时,B的平均反应速率为_______,
(3)4min时,反应是否达到平衡状态?_______(填“是”或“否”),8min时,v(正)_______v(逆)(填“>”、“<”或“=”)。
16.已知反应:2SO2+O22SO3,4molSO2和2molO2在2L的密闭容器中反应2min后,SO2的物质的量浓度为1.5mol/L,求SO2、O2、SO3的反应速率____、____、____。
17.(1)向盛有溶液的试管中加入溶液,溶液呈红色。在这个反应体系中存在下述平衡:
①向上述平衡体系中加入5滴浓的溶液,溶液颜色______(填“变深”“变浅”或“不变”)。
②向上述平衡体系中加入少量固体,溶液颜色______(填“变深”“变浅”或“不变”)。
(2)氨是一种重要的化工原料,合成氨的反应:,反应过程如图所示:
① ______(用含、的式子表示)。
②加催化剂的曲线______(填“Ⅰ”或“Ⅱ”)。
③在一定条件下,能说明反应一定达到平衡的是______(填字母代号)。
A.
B.单位时间内消耗的同时消耗
C.的物质的量之比为
D.混合气体中保持不变
18.一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的气体物质的量为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是
A.断开3molH-H键的同时断开2molN-H键 B.c(N2) : c(H2): c(NH3) =1:3:2
C.混合气体的平均相对分子质量不变 D.容器内密度不变
(2)N2的转化率α1%=_______,若相同条件下,此反应在容积可变的容器中进行,保持压强不变,达到平衡,则N2的转化率α2%_______α1%(填“>”、“<”或“=”)
(3)该温度下,反应的化学平衡常数K=_______,若此时再加入0.6molN2和0.4mol NH3,则平衡_______(填“向左移动”、“向右移动”或“不移动”)
19.在一密闭容器中发生反应N2+3H2=2NH3 ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是___________(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻___________;t3时刻___________;t4时刻___________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是___________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线______。
20.下列说法中能说明2HI(g) H2(g)+I2(g)已达平衡状态的是_______。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③c(HI)=c(I2)
④反应速率:v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(I2)∶c(H2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
21.一定温度下,在容积为1L的密闭容器内放入2molN2O4和8molNO2,发生如下反应:2NO2(红棕色)N2O4(无色)( ΔH<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:___________mol·L-1·s-1
(2)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:___________
(3)t1时,正反应速率___________(填“>”、“<”或“=”)逆反应速率
(4)维持容器的温度不变,若缩小容器的体积,则平衡向___________移动(填“正反应方向”、“逆反应方向”或“不移动”)
(5)维持容器的体积不变,升高温度,达到新平衡时体系的颜色___________(填“变深”、“变浅”或“不变”)
22.某化工厂利用CH4制取CO和H2,其生产流程如图。回答下列问题:
(1)该流程中第Ⅰ步反应为CH4(g)+H2O(g) CO(g)+3H2(g) H,一定条件下,CH4的平衡转化率与温度、压强的关系如图,则P1______(填“”“”或“”,下同) P2, H ______0。
(2)该流程中第Ⅱ步反应的平衡常数随温度的变化如下表:
温度/℃ 300 500 830
平衡常数K 12 9 1
①据上表信息分析判断,该反应的 H ______(填“”“”或“”)0。
②写出第Ⅱ步反应的化学方程式:______。在830℃时,设起始时CO和H2O(g)的浓度均为0.10mol/L,在该条件下反应达到平衡时,CO的转化率为______。
23.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2mol的N2和0.6mol的H2在一定条件下发生反应: H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时c(N2)=_______。平衡时H2的转化率为_______%。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: H<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ 200 300 400
K K1 K2 0.5
请完成下列问题:
①写出化学平衡常数K的表达式_______。
②试比较K1、K2的大小,K1_______K2(填“>”、“<”或“=”);
③400℃时,反应的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3mol、2mol和2mol时,则该反应的v(N2)正_______v(N2)逆(填“>”、“<”或“=”)。
24.硫酸工业中, 是重要一步反应。回答下列问题:
(1)某温度下,若的平衡常数,则在同一温度下,反应的平衡常数K=___________。
(2)在恒温下,向恒容密闭容器中加入和发生反应,时反应达到平衡。测得内,平衡后的转化率α1=___________。其他条件不变,反应若在恒压条件下进行,平衡时的转化率α2___________(填“>”“=”或“<”)α1,平衡常数___________(填“增大”“不变”或“减小”,若要使平衡常数减小,可采取的措施是___________。
(3)一定条件下,在恒温恒容的密闭容器中按一定比例充入和,平衡时的体积分数随的变化如图所示。则A、B、C三状态中,的转化率最大的是___________点,当达到平衡状态的体积分数可能是D、E、F三点中的___________点。
参考答案:
1.D
【详解】A.温度升高,化学反应速率加快,在相同时间内,反应物的转化率应增大,但由表中数据可知,从300℃升至400℃、500℃时,A的转化率反而降低,说明温度升高,该平衡向逆反应方向移动,该反应的正反应为放热反应,A项错误;
B.在容积不变的容器下,气体体积不变,反应物总质量与生成物总质量相等,故不论反应是否达到平衡状态,容器内气体密度均不变,B项错误;
C.该反应的正反应是放热反应,若200℃已达到平衡状态,则A的转化率大于300℃时A的转化率,但表中数据显示这两个温度时A的转化率相等,说明200℃时,反应没有达到平衡状态,C项错误;
D.400℃时,反应达到平衡,A的平衡转化率为50%,根据反应可知,平衡时,B的平衡浓度为,则该反应的平衡常数,D项正确;
答案选D。
2.A
【详解】A.活化能越大,反应速率越慢,由反应②速率慢,则②活化能大,活化能:反应②>反应①,故A正确;
B.氯自由基(Cl )能够催化O3分解,加速臭氧层的破坏,催化剂可降低最大的活化能来增大速率,则Cl 主要参与反应②,故B错误;
C.化学反应由反应速率慢的一步反应决定,则O3分解为O2的速率主要由反应②决定,故C错误;
D.Cl 是催化剂,只改变反应历程,不影响平衡,则O3分解为O2的平衡转化率不变,故D错误;
故选:A。
3.D
【详解】A.由反应I可知该反应ΔS>0,根据吉布斯自由能公式ΔG=ΔH-TΔS,故该I在低温下不能自发进行,则,A正确;
B.温度越高,反应越快,根据反应个反应,可以发现二氧化锰是反应III的产物,故温度升高时,相同时间内,二氧化锰会越来越多,即b代表二氧化锰,a代表,B正确;
C.由图可知时,二氧化锰一直增大,故此时发生的主要反应为反应III,C正确;
D.由图可知450℃时二氧化锰的含量较大,此时适当增大空气的流速可以提高的产率,但是温度较低时,二氧化锰含量较低,增大空气的流速不利于提高的产率,D错误;
故选D。
4.A
【详解】A. 改变压强,如果改变容器的容积,能改变物质的浓度,则可以改变反应速率,A错误;
B. 使用催化剂可同时增大正、逆反应的速率,B正确;
C. 缩小体积相当于增大压强,能增大反应速率,C正确;
D. 升高温度,吸热方向、放热方向的反应速率均增大,只是吸热方向的速率增大的程度更大,D正确;
故选A。
5.B
【详解】A.将少量片放入溶液中,发生反应,没有铁被置换出来,不能证明的金属性比强,故不选A;
B.将点燃的镁条置于盛有集气瓶中,发生反应,镁是还原剂、C是还原产物,证明镁的还原性比碳强,故选B;
C.Fe2+还原性大于Br-,氯气先氧化Fe2+,向溶液(含少量杂质)中加入适量氯水,不能除去溶液中的,故不选C;
D.向溶液中加入5滴同浓度的溶液,过量,再加入几滴溶液,溶液显血红色,不能证明与的反应是可逆反应,故不选D;
选B。
6.B
【详解】A.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则平衡向逆反应方向移动,三氧化硫的物质的量减小,则a <1.6,故A正确;
B.该反应为气体体积减小的反应,恒温恒压与恒温恒容相比,相当于增大压强,则平衡向正反应方向移动,三氧化硫的物质的量增大,则b>0.8,故B错误;
C.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则化学反应速率增大,则平衡时,以SO2表示的正反应速率:v(I) < v(II),故C正确;
D.若起始时向容器I中充入0.4 mol SO2(g)、0.3 molO2(g)和1.6 molSO3(g),等效为起始时向容器 I 中充入SO2(g)为(0.4 +1.6)mol=2.0mol 、O2(g) 为(0.3+0.8) mol=1.1mol,与I相比,相当于增大氧气的浓度,增大反应物浓度,平衡向正反应方向移动,故D正确;
故选B。
7.B
【分析】根据平衡的定义,当物质的浓度保持不变时达到的状态即为平衡状态进行判断平衡点,根据转换率可表示单位时间内转换的快慢可以判断反应速率。根据速率公式进行计算速率。
【详解】A.T1℃下,45分钟到1小时氢气的转化率不变,故可判断达到平衡,故A正确;B.根据a1≠a2判断T2时达到平衡的时间在45分钟后,T2比T1的反应慢,故温度低,B不正确;
C.T2℃下,在前30分钟内氢气的转化率为60%,则转换了的氢气的物质的量为:4 mol ×60%=2.4mol,则转换的一氧化碳根据方程式计算得:1.2mol,根据速率公式得:,故C正确;
D.根据温度T2到T1的转化率降低,说明平衡相对向逆移,而温度降低,故逆反应为放热,正反应时吸热反应,故D正确;
故选答案B。
【点睛】注意反应是吸热还是放热,根据温度对平衡的影响进行判断,升高温度平衡向吸热方向移动。
8.C
【详解】A.若两容器保持恒温,则为等效平衡,正反应速率相等,现为恒容绝热容器,I中温度升高,II中温度降低,所以达平衡时,混合气体的温度I比II高,正反应速率:I>II,A不正确;
B.由A中分析可知,达平衡时容器I的温度比II高,由于正反应为放热反应,温度越高平衡常数越小,所以两容器中的平衡常数:I<II,B不正确;
C.若温度不变,容器I和容器II中CO2的物质的量相等,现达平衡时,容器I的温度比II高,升温时平衡逆向移动,所以容器Ⅰ中CO2的物质的量比容器Ⅱ中CO2的少,C正确;
D.若温度不变,容器I和容器II为等效平衡,则此时容器Ⅰ中CO 的转化率与容器II中CO2 的转化率之和等于1,现容器II的温度比容器I低,相当于容器I降温,平衡正向移动,容器II中CO2的转化率减小,所以容器Ⅰ 中CO 的转化率与容器II中CO2 的转化率之和小于1,D不正确;
故选C。
9.A
【详解】A.3.25 g Zn的物质的量n(Zn)=,100 mL 1 mol·L-1的稀硫酸中溶质的物质的量n(H2SO4)=1 mol/L×0.1 L=0.1 mol,根据方程式Zn+H2SO4=ZnSO4+H2↑可知:二者反应的物质的量的比是1:1,故硫酸过量,反应放出H2要以不足量的Zn为标准计算。滴加几滴浓盐酸,增加了溶液中c(H+),反应速率加快,A符合题意;
B.硝酸具有强氧化性,与Zn反应不能产生氢气,B不符合题意;
C.Zn与CuSO4发生置换反应产生Cu和ZnSO4,Zn、Cu及硫酸构成原电池,使反应速率加快;但由于Zn消耗,导致反应产生H2的量减少,C不符合题意;
D.加入少量的Zn,由于Zn是固体,浓度不变,因此反应速率不变,但由于不足量的Zn的量增加,以Zn为标准反应产生的H2的量增多,D不符合题意;
故合理选项是A。
10.B
【详解】A.将氨液化分离,即减小氨气浓度,促进平衡向正向移动,提高反应物的转化率,A能用平衡移动原理解释,不符合题意;
B.对于反应 ,由于反应前后气体体积不变,故压强对其平衡无影响,加压颜色加深,是因为体积缩小,导致c(I2)增大,B不能用平衡移动原理解释,符合题意;
C.Cl2在水中存在如下平衡:,在饱和NaCl溶液中,c(Cl-)增大,促使平衡逆向移动,降低Cl2溶解度,故可以用排饱和食盐水收集Cl2,C能用平衡移动原理解释,不符合题意;
D.体系中存在平衡: ,加压体积缩小,导致c(NO2)瞬间增大,体系颜色加深,由于加压平衡正向移动,c(NO2)又逐渐减小,故颜色逐渐变浅,D能用平衡移动原理解释,不符合题意;
故答案选B。
11.B
【详解】由于反应CO+H2O CO2+H2为可逆反应,正反应、逆反应同时进行,则含有O元素的物质中均含有18O,故选B。
12.D
【分析】从图中可以看出,反应Ⅰ中,Mn2O3与O2反应转化为MnO2,反应Ⅱ中,MnO2将C7H8氧化,重新生成Mn2O3。
【详解】A.由图中可以看出,反应Ⅱ中,MnO2转化为Mn2O3,C7H8生成CO2和H2O,方程式为,A正确;
B.反应Ⅰ中,Mn2O3与O2反应转化为MnO2,Mn元素的化合价升高,B正确;
C.反应Ⅱ中,C7H8与MnO2反应生成H2O等,形成O-H键,从而释放能量,C正确;
D.Mn2O3作催化剂,可降低总反应的活化能,但不能改变反应的焓变,D错误;
故选D。
13.A
【详解】A.单位时间内生成2nmolA,同时生成nmolD,反应进行的方向相反,且物质的量的变化量之比等于化学计量数之比,达到了化学平衡状态,A符合题意;
B.因为反应前后气体的分子数相等,压强始终保持不变,所以当容器内压强不随时间而变化时,不能确定反应达平衡状态,B不符合题意;
C.单位时间内生成nmolB,同时消耗1.5nmolC,反应进行的方向相同,不一定达平衡状态,C不符合题意;
D.容器内混合气体的质量、容器的体积始终不变,密度始终不变,所以当密度不随时间而变化,反应不一定达平衡状态,D不符合题意;
故选A。
14.D
【详解】A.催化剂能降低反应的活化能,但不能改变反应热,使用MnO2催化时,该反应的 H不会发生变化,A项正确;
B.催化机理中存在与H+反应生成CO2和H2O的过程,该过程不是氧化还原反应,B项正确;
C.根据图示的催化机理可知总反应为:,C项正确;
D.Na2O2中的阴离子是,与不一样,D项错误;
答案选D。
15.(1)2A B
(2)0.025mol/(L·min)
(3) 否 =
【详解】(1)由图象可看出A为反应物,B为生成物,物质的量不变时反应达到平衡状态,A反应的物质的量=0.8mol-0.2mol=0.6mol;B生成的物质的量=0.5mol-0.2mol=0.3mol,所以A、B转化的物质的量之比为2:1,根据A、B转化的物质的量之比=化学方程式的计量数之比,反应的化学方程式为:2AB;
(2)反应开始至4min时,B物质的量变化0.4mol-0.2mol=0.2mol,B的平均反应速率为 ;
(3)由图象分析可知,4 min时,随时间变化A、B物质的量发生变化,说明未达到平衡;8 min时随时间变化A、B物质的量不再发生变化,说明达到平衡,故v(正) =v(逆)。
16.
【详解】初始SO2浓度为,依题意,
于是:。
由于,于是;
。
17. 变深 不变 (E1-E2)kJ/mol Ⅱ BD
【详解】(1) ①在这个反应体系中存在下述平衡:,其离子方程式为: ,向上述平衡体系中加入5滴浓的溶液,SCN 浓度增大,平衡右移,则溶液颜色变深。
②向上述平衡体系中加入少量固体,反应相关的粒子浓度均未改变,故平衡不移动,溶液颜色不变。
(2)①焓变=生成物总能量-反应物总能量=反应物总键能-生成物总键能=正反应活化能—逆反应活化能,则 (E1-E2)kJ/mol;。
②催化剂能降低反应的活化能,故加催化剂的曲线Ⅱ。
③A.若,则说明未平衡,A不选;
B.单位时间内消耗的必定生成、同时消耗,则,故已平衡,B选;
C.的物质的量之比取决于起始物质的量,时难以说明各成分的量是否不再改变,不一定平衡,C不选;
D.混合气体中保持不变,说明已经平衡,D选;
则答案为BD。
18.(1)C
(2) 50%, >
(3) L2/mol2 不移动
【分析】题中发生反应N2+3H22NH3,根据题中信息进行分析。
(1)
A.断开3molH-H键应断开6molN-H键,A错误;
B.各物质的浓度成比例关系,不能说明达到平衡状态,B错误;
C.平均相对分子质量可表示为,体系中质量守恒m恒定,当不变时,不变,反应前后气体系数发生变化,故不变说明达到平衡状态,C正确;
D.密度,m恒定,V恒定,故密度为定值,故密度不变不能说明达到平衡状态,D错误;
故选C。
(2)
由题得:0.4-x+1.2-3x+2x=1.6×=1.2 x=0.2mol
N2的转化率;
反应正向进行,压强减小,要求压强不变相当于加压,平衡正移,N2的转化率增大,故α2%>α1%。
(3)
,将(2)中数值转化成物质的量浓度,代入可得K=L2/mol2;再加入0.6molN2和0.4mol NH3,则N2为0.8mol,H2为0.6mol,NH3为0.8mol,转化成浓度,代入平衡常数公式,可得K’=L2/mol2,故平衡不移动。
19. ACDF C E B A
【详解】(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。
(2)t1时,v正、v逆同时增大,且v逆增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线为 。
20.②⑥⑨
【分析】当可逆反应达到平衡状态时,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,据此解答。
【详解】①单位时间内生成nmol H2的同时生成nmol HI,速率之比不等于物质的量之比,故错误;
②一个H-H键断裂的同时有两个H-I键断裂,由于一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,反应达到平衡状态,故正确;
③未知起始投入量,c(HI)=c()不能说明反应达平衡状态,故错误;
④反应速率v(H2)=v(I2)=v(HI),未体现正与逆的关系,故错误;
⑤c(HI):c(H2):c(I2)=2:1:1,浓度比与化学计量数比相等并不能证明反应达平衡,故错误;
⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故正确;
⑦前后气体系数和相同,容器压强始终不变,故错误;
⑧反应前后气体总质量不变,总物质的量也不变,相对分子质量一直不变,故错误;
⑨温度和体积一定时,混合气体颜色不再变化,说明c(I2)不再发生变化,反应达到平衡状态,正确;
⑩温度和压强一定时,由于反应前后体积和气体的质量始终不变,则混合气体的密度始终不变,即密度不再变化不能说明反应达到平衡状态,错误;
故答案为:②⑥⑨。
21.(1)0.1
(2)t3
(3)>
(4)正反应方向
(5)变深
【详解】(1)从t1至t2时N2O4的物质的量增加了4mol-3mol=1mol,所以反应速率是=0.1mol/(L·s);
(2)根据图象可知,t3时刻物质的物质的量不再发生变化,所以此时反应达到平衡状态;
(3)t1时NO2的物质的量逐渐减小,说明反应是向正反应方向进行的,即正反应速率大于逆反应速率;
(4)反应前后是体积减小的,所以缩小容积,压强增大,平衡向正反应方向移动;
(5)正反应是放热反应,所以升高温度,平衡向逆反应方向移动,NO2的浓度增大,颜色变深。
22. < > < CO+H2O(g)H2+CO2 50%
【详解】(1)该反应为气体计量数增大的反应,增大压强,平衡逆向移动,则甲烷的平衡转化率降低,根据图象可知,温度相同时,P1的转化率大于P2,则P1<P2;根据图象,升高温度,甲烷的平衡转化率增大,即平衡正向移动,则正反应为吸热反应, H>0;
(2)①根据表中数据,升高温度,平衡常数减小,即平衡逆向移动,则逆反应为吸热反应,故正反应放热反应, H<0;
②根据流程可知,CO与水反应生成二氧化碳和氢气,方程式为CO+H2O(g)H2+CO2;起始时CO和H2O(g)的浓度均为0.10mol/L,
=1,解得x=0.05mol/L,转化率=×100%=50%。
23.(1) 0.05mol/L 50%
(2)CD
(3) > 2 >
【解析】(1)
若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol,消耗0.1mol氮气,平衡时氮气的浓度是=0.05mol/L,消耗氢气的物质的量是0.2mol×1.5=0.3mol,氢气的转化率为:;
(2)
A.加了催化剂加快反应速率,不影响平衡移动,氢气转化率不变,A项不选;
B.增大容器体积,压强减小,平衡向逆反应方向移动,氢气转化率减小,B项不选;
C.正反应为放热反应,降低反应体系的温度,平衡正向移动,氢气转化率增大,C项选;
D.加入一定量N2,平衡正向移动,氢气转化率增大,D项选;
答案选CD;
(3)
①由反应可知平衡常数的表达式为:K=;
②正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故K1>K2;
③400℃时,反应2NH3(g)N2(g)+3H2(g)的化学平衡常数与N2(g)+3H2(g) 2NH3(g)的平衡常数互为倒数,则400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数K==2;此时浓度商Qc==
24.(1)
(2) 75% > 不变 升高温度
(3) A D
【分析】的平衡常数K=,的平衡常数K=,据此分析解答;根据v==,结合化学平衡的影响因素分析解答;若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,结合图象分析解答。
【详解】(1)某温度下,若的平衡常数,即K==100;则在同一温度下,反应的平衡常数K===,故答案为:;
(2)测得10min内,则△n()=7.5×10-3mol L-1 min-1×10min×2L=0.15mol,由方程式可知,反应的的物质的量为0.15mol,则的转化率为×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,转化率增大,即转化率α2>α1;
平衡常数只受温度影响,温度不变,平衡常数不变;正反应是放热反应,若要使平衡常数减小,可以升高温度,平衡逆向移动,平衡常数减小,故答案为:75%;>;不变;升高温度;
(3)若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,的转化率越大,因此的转化率最大的是A点;根据图象,的比值越大,平衡时的体积分数越大,当达到平衡状态的体积分数应该大于C,可能是D、E、F三点中的D点,故答案为:A;D。
