人教版(2019)必修第二册 5.1 硫及其化合物 课件(共39张PPT)
文档属性
| 名称 | 人教版(2019)必修第二册 5.1 硫及其化合物 课件(共39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 30.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 16:25:19 | ||
图片预览



文档简介
(共39张PPT)
硫及其化合物
必修二
1
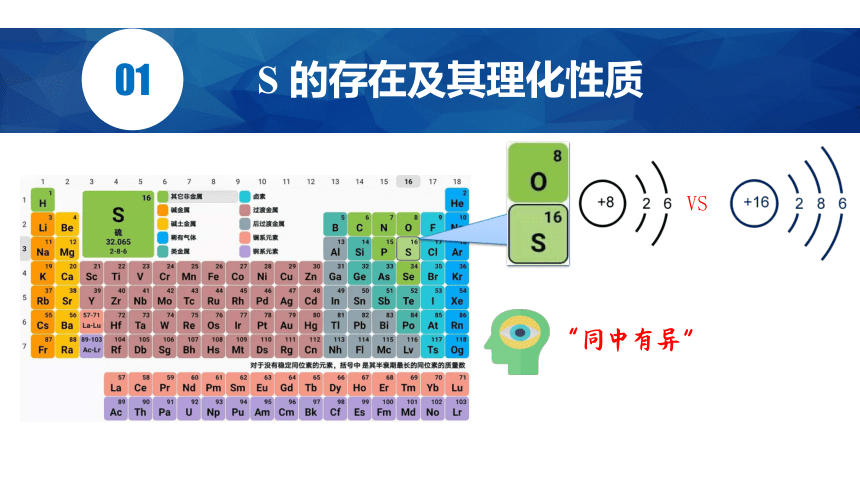
S 的存在及其理化性质
2
S 的化合物代表SO2 SO3
3
认识浓硫酸的三大性质
4
S 元素的价类二维图
目
录
CONTENTS
S 的存在及其理化性质
01
“同中有异”
VS
S 的存在及其理化性质
S 的存在及其理化性质
01
火山迸发口
(游离态)
天然含硫矿石
(化合态)
同
素
异
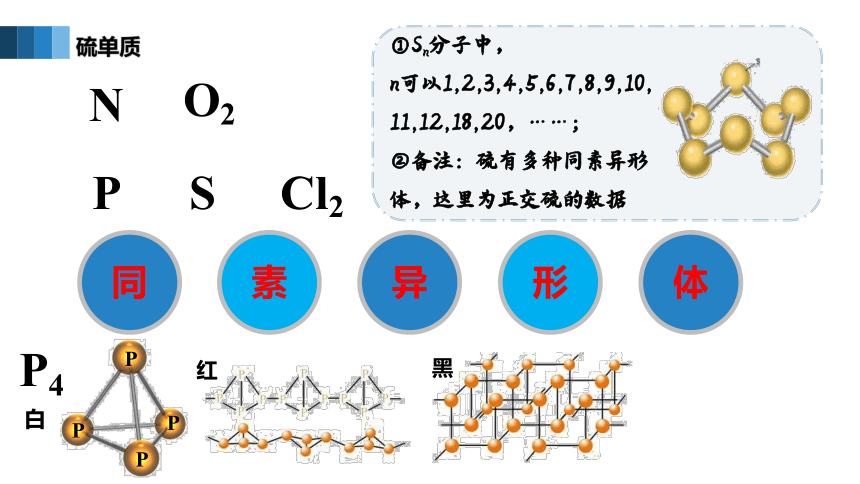
硫单质
形
体
Cl
S
O
2
2
N
①Sn分子中,
n可以1,2,3,4,5,6,7,8,9,10,
11,12,18,20,……;
②备注:硫有多种同素异形体,这里为正交硫的数据
P
P
P
P
P
P4
白
红
黑
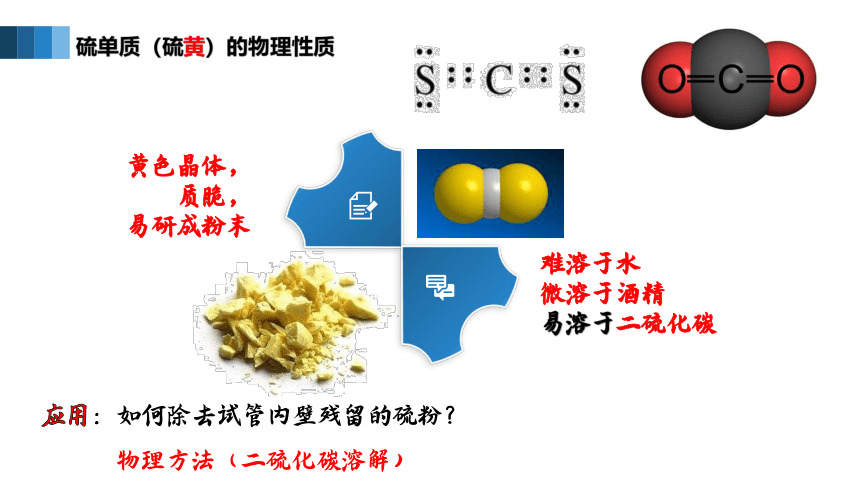
难溶于水
微溶于酒精
易溶于二硫化碳
黄色晶体,
质脆,
易研成粉末
硫单质(硫黄)的物理性质
应用:如何除去试管内壁残留的硫粉?
物理方法(二硫化碳溶解)
01
03
04
06
02
05
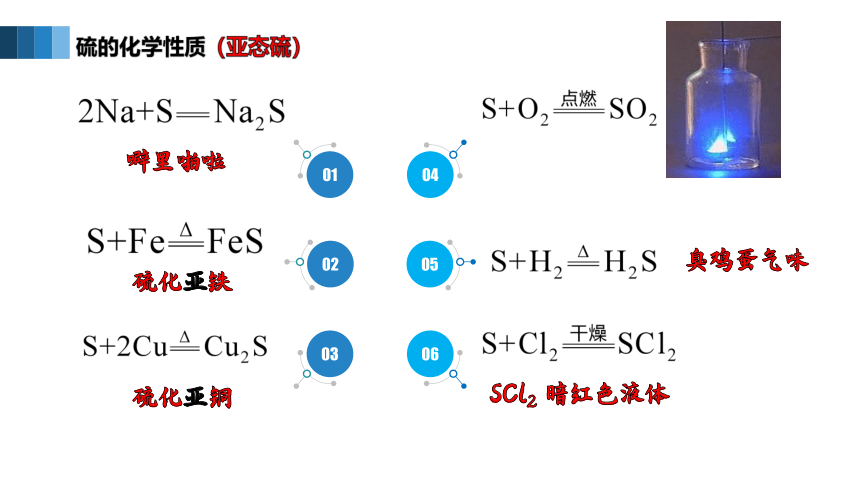
硫的化学性质(亚态硫)
噼里啪啦
硫化亚铁
硫化亚铜
臭鸡蛋气味
SCl2 暗红色液体
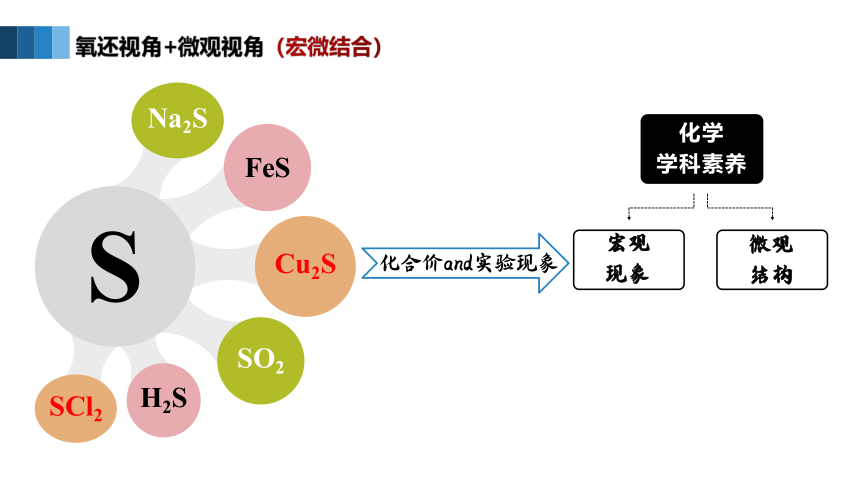
氧还视角+微观视角(宏微结合)
Cu2S
FeS
Na2S
SO2
SCl2
H2S
S
化学
学科素养
微观
结构
宏观
现象
化合价and实验现象
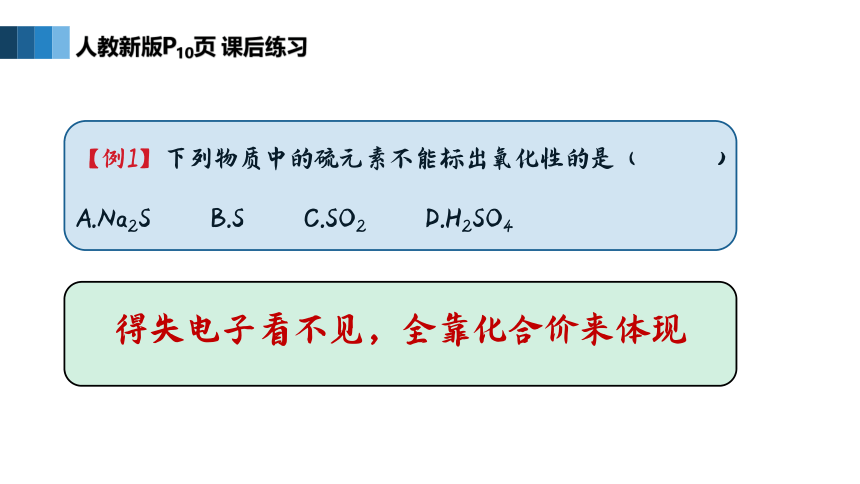
人教新版P10页 课后练习
【例1】下列物质中的硫元素不能标出氧化性的是( )
A.Na2S B.S C.SO2 D.H2SO4
得失电子看不见,全靠化合价来体现
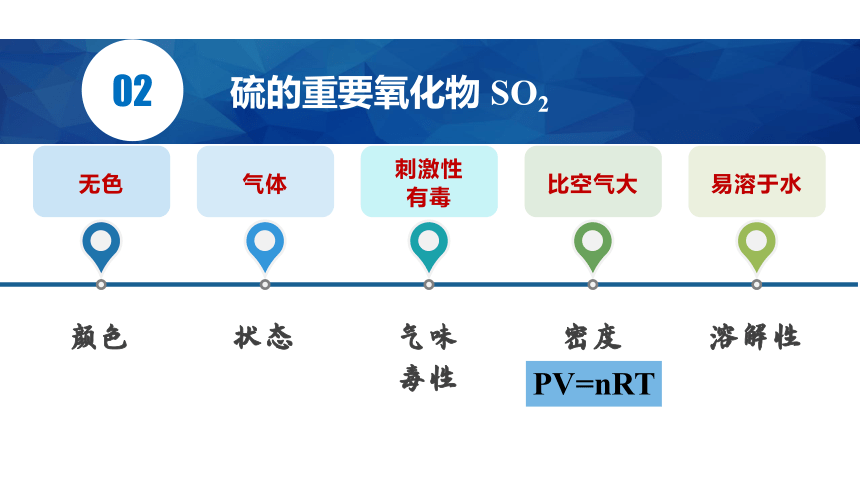
硫的重要氧化物 SO2
02
无色
颜色
气体
刺激性
有毒
比空气大
易溶于水
状态
气味
毒性
密度
溶解性
PV=nRT
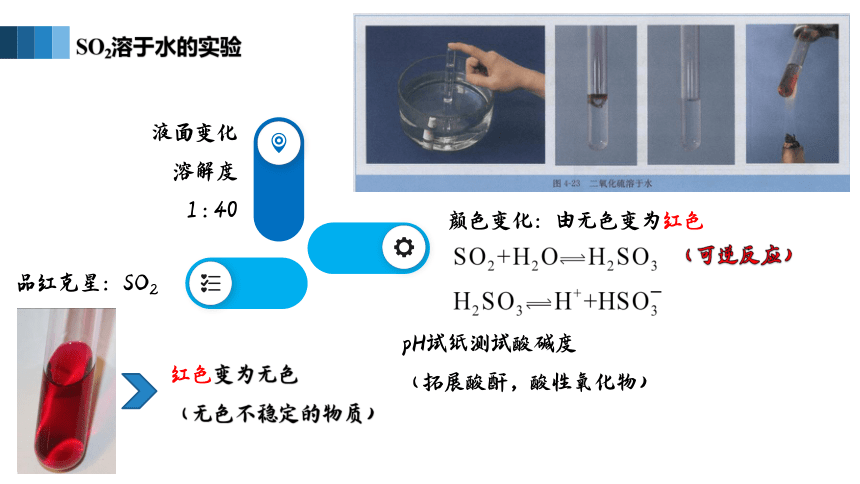
颜色变化:由无色变为红色
pH试纸测试酸碱度
(拓展酸酐,酸性氧化物)
液面变化
溶解度
1 : 40
SO2溶于水的实验
_
品红克星:SO2
红色变为无色
(无色不稳定的物质)
(可逆反应)
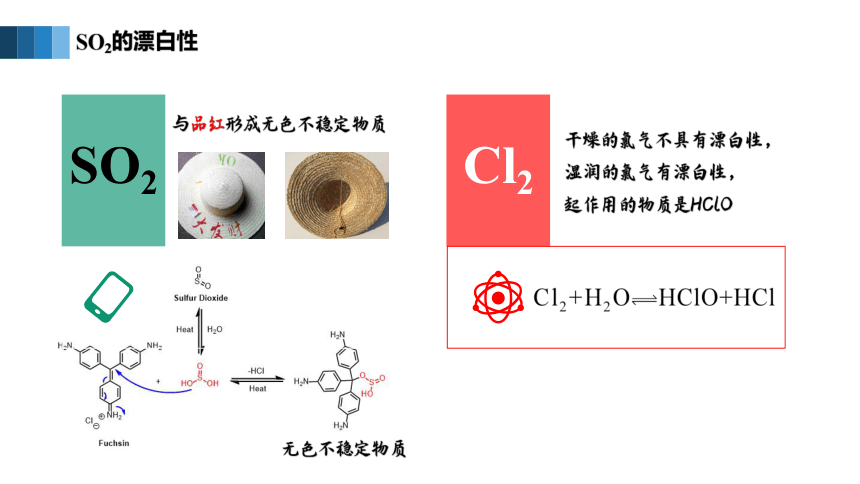
SO2的漂白性
SO2
Cl2
与品红形成无色不稳定物质
干燥的氯气不具有漂白性,
湿润的氯气有漂白性,
起作用的物质是HClO
无色不稳定物质
有
机
色
素
物理吸附(活性炭):疏松多孔结构
漂白性(不可逆):
Cl2(HClO),Na2O2,O3等
漂白性(可逆):
SO2(常考伴侣:品红)
有色的无机物褪色不叫漂白
漂白性总结
【精读课本】二氧化硫具有漂白作用,工业上常用二氧化硫来漂白纸浆、毛、丝等。二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质。这些无色物质容易分解而使有色物质回复原来的颜色。此外,二氧化硫可用于杀菌消毒,还是一种食品添加剂。
红酒中的SO2
醒酒器
抑细菌
抗氧化
O2
Cl2/Br2/I2
H2O2/Na2O2
最大使用量为0.25g/L
非金属氧化物
(酸性氧化物)
化合价
(价态律)
特殊性
(漂白性、抑菌性)
SO2的化学性质
O2/Cl2/Br2/I2/H2O2/Na2O2
人教新版P10页 课后练习
【例2】下列关于SO2的叙述正确的是( )
A. SO2是无色、无味、有毒的气体
B. SO2与NaOH溶液反应生成Na2SO4
C. SO2能使紫色的KMnO4溶液褪色
D. SO2有毒,不能用作食品添加剂
浓硫酸的化学性质
03
医药
干燥剂
化学试剂
化肥
铅蓄电池
炸药
98.3%浓硫酸的三大性质
1
吸水性
3
强氧化性
2
脱水性
CuSO4·5H2O
CuSO4
有机物中的氢元素和氧元素
以H2O的形式被吸收
为何
膨胀
浓硫酸的强氧化性
脱水性
强氧化性
强氧化性的强如何体现?
浓硫酸的强氧化性
稀硫酸有强氧化性吗?
稀硫酸有氧化性吗?
没有对比就没有伤害
氧化性:得电子的能力
强氧化性:得电子能力强
何为氧化性的强?
变化观念核心素养:氧化性or还原性并非一层不变!用发展的眼光看待氧化性和还原性,也受外界环境的影响。比如物质的浓度!
比如:实验室制取氯气;
浓硫酸与非金属的反应 (C.S.P)
2P+5H2SO4 = 5SO2+2H2O+2H3PO4
△
P4O10的吸水能力极强。(P2O5只是个替身)
在水溶液中不可能形成其氧化物。
P4O10+6H2O=4H3PO4
从非金属到金属(模型认识)
氧化还原模型:非金属碳失去电子
金属!你怎么想?
浓硫酸与金属Cu的反应
在带导管的橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。在试管中加入2mL浓硫酸,塞好橡胶塞,使铜丝与浓硫酸接触。加热,将产生的气体先后通入品红溶液和石蕊溶液中,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色。
①加热引发的思考?
②溶液的颜色能说明什么呢?
浓硫酸与金属Cu的反应
浓硫酸:氧化性、酸性
Tips:浓度影响物质的氧化性。随着反应的进行,浓硫酸慢慢变成稀硫酸,不再体现中心硫元素的氧化性。稀硫酸中氢离子也有氧化性,可以与活泼金属反应产生氢气。可惜,铜是氢后金属。反应就这样停止了!
铜可以和浓硫酸反应在加热的条件下反应,
请预测下锌与浓硫酸的反应?
浓硫酸与金属Zn的反应
【例3】将一定量的锌粉与 100mL 18.4mol/L 浓硫酸充分反应后,锌粉完全溶解,同时生成16.8L气体X(标准状况)。将反应后所得的溶液稀释到1L,测得溶液中的c(H+)=1mol/L。求生成的气体成分?
【例4】下列事实与括号中浓硫酸的性质对应正确的是( )
A. 空气中敞口久置的浓硫酸质量增大(挥发性)
B. 浓硫酸在加热条件下与铜反应(脱水性)
C. 用浓硫酸在纸上书写的字迹变黑(氧化性)
D. 浓硫酸可用来干燥某些气体(吸水性)
人教新版P10页 课后练习
【例5】在实验室中,几位同学围绕浓硫酸的化学性质进行如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生有刺激性气味的气体。
(1)生成的黑色物质是 (填化学式)
(2)有刺激性气味的气体的主要成分是 (填化学式),
写出产生改气体的反应化学方程式: 。
(3)上述实验现象表明浓硫酸具有 (填字母)
a. 酸性 b. 吸水性 c. 脱水性 d. 强氧化性
人教新版P10页 课后练习
硫酸的工业制备
04
沸腾炉
接触室
吸收塔
常考问题
①热量的充分利用
②SO3的吸收
放热反应
硫酸根离子的检验及硫酸盐介绍
05
先加稀盐酸酸化,再加BaCl2溶液
CO3
SO3
2-
2-
排出
干扰
投石问路
Ag+
SO4的检验
2-
BaSO4
白色沉淀
经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐及MgCl2、CaCl2等杂质。如果按照下表所示顺序出去他们,应加入什么试剂?写出相关反应的离子方程式。
人教新版P6页 思考与讨论(粗盐提纯)
杂质 加入的试剂 离子方程式
硫酸盐
MgCl2
CaCl2
解题技巧: BaCl2 Na2CO3 NaOH
人教版P10页 课后练习
【例6】如何证明酸雨中含有硫酸?请简述相关的实验操作步骤。
(1)收集酸雨,并取样
(2)加入一定量的盐酸
(3)滴加BaCl2溶液,观察是否产生不溶于酸的白色沉淀
【酸雨】是指pH小于5.6的雨雪或其他形式的降水,主要是人为的向大气中排放大量酸性物质所造成的。
为什么选择了5.6作为标准?
饱和的碳酸溶液的pH=5.6
常见硫酸盐介绍
硫酸钙
自然界中的硫酸钙常以石膏(CaSO4·2H2O)的形式存在。石膏被加热时会失去结晶水而变成熟石膏(2CaSO4·H2O)。熟石膏与水混合成糊状会很快凝固,被用来制作各种模型和石膏绷带。在工业上,石膏还被用来调节水泥的硬化速率。
硫酸钡
硫酸铜
自然界中的硫酸钡以重晶石(BaSO4)的形式存在。硫酸钡不溶于水和酸,且不溶于被X射线穿透,因此在医疗上可被用作消化系统X射线检查的内药剂(造影剂),俗称“钡餐”
CuSO4是白色粉末,结合水后会变成蓝色晶体,俗称胆矾(CuSO4·5H2O)。硫酸铜的这一性质可以用来检验酒精中是否含有少量水。胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
不同价态含硫物质的转化
06
硫元素广泛存在于自然界,是植物生长不可缺少的元素,组成生命体的蛋白质中就含有硫元素。游离态的硫存在于火山口附近或地壳的岩层中。在岩层深处和海底的无氧环境下,硫元素与铁、铜等金属元素形成的化合物通常以硫化物的形式存在。如黄铁矿(FeS2)、黄铜矿(CuFeS2)等。在地表附近,由于受氧气和谁的长期作用,硫化物会转化为硫酸盐,如石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)等。火山口附近的硫单质胡被大气中的氧气氧化成SO2,SO2可进一步被氧化成SO3。
硫元素思维导图
硫的化合价与性质的关系
-2
0
+4
+6
只有还原性
既有氧化性
又有还原性
只有氧化性
价类二维图
-2
+6
+4
0
单质or氧化剂
酸
盐
S
SO2
SO3
H2S
H2SO3
H2SO4
Na2SO4
物质类别
化合价
Na2S
Na2SO3
方程式汇总
人教版P10页 课后练习
【例7】现有两支分别盛有相同体积浓硫酸和稀硫酸的试管,请用简单的方法区别它们。
(1)用玻璃棒蘸取试液,滴在白纸上——脱水性
(2)pH试纸——脱水性,酸性
人教版P10页 课后练习
【例8】某工厂使用的煤中硫的质量分数为0.64%,该工厂每天燃烧这种煤100t,是计算:
(1)如果煤中的硫全部转化为SO2,该厂每天产生SO2的质量及这些SO2在标准状况下的体积;
(2)如果把产生的SO2全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量。
守恒大法:一切简便思维皆守恒
硫及其化合物
必修二
1
S 的存在及其理化性质
2
S 的化合物代表SO2 SO3
3
认识浓硫酸的三大性质
4
S 元素的价类二维图
目
录
CONTENTS
S 的存在及其理化性质
01
“同中有异”
VS
S 的存在及其理化性质
S 的存在及其理化性质
01
火山迸发口
(游离态)
天然含硫矿石
(化合态)
同
素
异
硫单质
形
体
Cl
S
O
2
2
N
①Sn分子中,
n可以1,2,3,4,5,6,7,8,9,10,
11,12,18,20,……;
②备注:硫有多种同素异形体,这里为正交硫的数据
P
P
P
P
P
P4
白
红
黑
难溶于水
微溶于酒精
易溶于二硫化碳
黄色晶体,
质脆,
易研成粉末
硫单质(硫黄)的物理性质
应用:如何除去试管内壁残留的硫粉?
物理方法(二硫化碳溶解)
01
03
04
06
02
05
硫的化学性质(亚态硫)
噼里啪啦
硫化亚铁
硫化亚铜
臭鸡蛋气味
SCl2 暗红色液体
氧还视角+微观视角(宏微结合)
Cu2S
FeS
Na2S
SO2
SCl2
H2S
S
化学
学科素养
微观
结构
宏观
现象
化合价and实验现象
人教新版P10页 课后练习
【例1】下列物质中的硫元素不能标出氧化性的是( )
A.Na2S B.S C.SO2 D.H2SO4
得失电子看不见,全靠化合价来体现
硫的重要氧化物 SO2
02
无色
颜色
气体
刺激性
有毒
比空气大
易溶于水
状态
气味
毒性
密度
溶解性
PV=nRT
颜色变化:由无色变为红色
pH试纸测试酸碱度
(拓展酸酐,酸性氧化物)
液面变化
溶解度
1 : 40
SO2溶于水的实验
_
品红克星:SO2
红色变为无色
(无色不稳定的物质)
(可逆反应)
SO2的漂白性
SO2
Cl2
与品红形成无色不稳定物质
干燥的氯气不具有漂白性,
湿润的氯气有漂白性,
起作用的物质是HClO
无色不稳定物质
有
机
色
素
物理吸附(活性炭):疏松多孔结构
漂白性(不可逆):
Cl2(HClO),Na2O2,O3等
漂白性(可逆):
SO2(常考伴侣:品红)
有色的无机物褪色不叫漂白
漂白性总结
【精读课本】二氧化硫具有漂白作用,工业上常用二氧化硫来漂白纸浆、毛、丝等。二氧化硫的漂白作用是由于它能与某些有色物质生成不稳定的无色物质。这些无色物质容易分解而使有色物质回复原来的颜色。此外,二氧化硫可用于杀菌消毒,还是一种食品添加剂。
红酒中的SO2
醒酒器
抑细菌
抗氧化
O2
Cl2/Br2/I2
H2O2/Na2O2
最大使用量为0.25g/L
非金属氧化物
(酸性氧化物)
化合价
(价态律)
特殊性
(漂白性、抑菌性)
SO2的化学性质
O2/Cl2/Br2/I2/H2O2/Na2O2
人教新版P10页 课后练习
【例2】下列关于SO2的叙述正确的是( )
A. SO2是无色、无味、有毒的气体
B. SO2与NaOH溶液反应生成Na2SO4
C. SO2能使紫色的KMnO4溶液褪色
D. SO2有毒,不能用作食品添加剂
浓硫酸的化学性质
03
医药
干燥剂
化学试剂
化肥
铅蓄电池
炸药
98.3%浓硫酸的三大性质
1
吸水性
3
强氧化性
2
脱水性
CuSO4·5H2O
CuSO4
有机物中的氢元素和氧元素
以H2O的形式被吸收
为何
膨胀
浓硫酸的强氧化性
脱水性
强氧化性
强氧化性的强如何体现?
浓硫酸的强氧化性
稀硫酸有强氧化性吗?
稀硫酸有氧化性吗?
没有对比就没有伤害
氧化性:得电子的能力
强氧化性:得电子能力强
何为氧化性的强?
变化观念核心素养:氧化性or还原性并非一层不变!用发展的眼光看待氧化性和还原性,也受外界环境的影响。比如物质的浓度!
比如:实验室制取氯气;
浓硫酸与非金属的反应 (C.S.P)
2P+5H2SO4 = 5SO2+2H2O+2H3PO4
△
P4O10的吸水能力极强。(P2O5只是个替身)
在水溶液中不可能形成其氧化物。
P4O10+6H2O=4H3PO4
从非金属到金属(模型认识)
氧化还原模型:非金属碳失去电子
金属!你怎么想?
浓硫酸与金属Cu的反应
在带导管的橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。在试管中加入2mL浓硫酸,塞好橡胶塞,使铜丝与浓硫酸接触。加热,将产生的气体先后通入品红溶液和石蕊溶液中,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色。
①加热引发的思考?
②溶液的颜色能说明什么呢?
浓硫酸与金属Cu的反应
浓硫酸:氧化性、酸性
Tips:浓度影响物质的氧化性。随着反应的进行,浓硫酸慢慢变成稀硫酸,不再体现中心硫元素的氧化性。稀硫酸中氢离子也有氧化性,可以与活泼金属反应产生氢气。可惜,铜是氢后金属。反应就这样停止了!
铜可以和浓硫酸反应在加热的条件下反应,
请预测下锌与浓硫酸的反应?
浓硫酸与金属Zn的反应
【例3】将一定量的锌粉与 100mL 18.4mol/L 浓硫酸充分反应后,锌粉完全溶解,同时生成16.8L气体X(标准状况)。将反应后所得的溶液稀释到1L,测得溶液中的c(H+)=1mol/L。求生成的气体成分?
【例4】下列事实与括号中浓硫酸的性质对应正确的是( )
A. 空气中敞口久置的浓硫酸质量增大(挥发性)
B. 浓硫酸在加热条件下与铜反应(脱水性)
C. 用浓硫酸在纸上书写的字迹变黑(氧化性)
D. 浓硫酸可用来干燥某些气体(吸水性)
人教新版P10页 课后练习
【例5】在实验室中,几位同学围绕浓硫酸的化学性质进行如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察到蔗糖逐渐变黑,体积膨胀,并产生有刺激性气味的气体。
(1)生成的黑色物质是 (填化学式)
(2)有刺激性气味的气体的主要成分是 (填化学式),
写出产生改气体的反应化学方程式: 。
(3)上述实验现象表明浓硫酸具有 (填字母)
a. 酸性 b. 吸水性 c. 脱水性 d. 强氧化性
人教新版P10页 课后练习
硫酸的工业制备
04
沸腾炉
接触室
吸收塔
常考问题
①热量的充分利用
②SO3的吸收
放热反应
硫酸根离子的检验及硫酸盐介绍
05
先加稀盐酸酸化,再加BaCl2溶液
CO3
SO3
2-
2-
排出
干扰
投石问路
Ag+
SO4的检验
2-
BaSO4
白色沉淀
经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐及MgCl2、CaCl2等杂质。如果按照下表所示顺序出去他们,应加入什么试剂?写出相关反应的离子方程式。
人教新版P6页 思考与讨论(粗盐提纯)
杂质 加入的试剂 离子方程式
硫酸盐
MgCl2
CaCl2
解题技巧: BaCl2 Na2CO3 NaOH
人教版P10页 课后练习
【例6】如何证明酸雨中含有硫酸?请简述相关的实验操作步骤。
(1)收集酸雨,并取样
(2)加入一定量的盐酸
(3)滴加BaCl2溶液,观察是否产生不溶于酸的白色沉淀
【酸雨】是指pH小于5.6的雨雪或其他形式的降水,主要是人为的向大气中排放大量酸性物质所造成的。
为什么选择了5.6作为标准?
饱和的碳酸溶液的pH=5.6
常见硫酸盐介绍
硫酸钙
自然界中的硫酸钙常以石膏(CaSO4·2H2O)的形式存在。石膏被加热时会失去结晶水而变成熟石膏(2CaSO4·H2O)。熟石膏与水混合成糊状会很快凝固,被用来制作各种模型和石膏绷带。在工业上,石膏还被用来调节水泥的硬化速率。
硫酸钡
硫酸铜
自然界中的硫酸钡以重晶石(BaSO4)的形式存在。硫酸钡不溶于水和酸,且不溶于被X射线穿透,因此在医疗上可被用作消化系统X射线检查的内药剂(造影剂),俗称“钡餐”
CuSO4是白色粉末,结合水后会变成蓝色晶体,俗称胆矾(CuSO4·5H2O)。硫酸铜的这一性质可以用来检验酒精中是否含有少量水。胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
不同价态含硫物质的转化
06
硫元素广泛存在于自然界,是植物生长不可缺少的元素,组成生命体的蛋白质中就含有硫元素。游离态的硫存在于火山口附近或地壳的岩层中。在岩层深处和海底的无氧环境下,硫元素与铁、铜等金属元素形成的化合物通常以硫化物的形式存在。如黄铁矿(FeS2)、黄铜矿(CuFeS2)等。在地表附近,由于受氧气和谁的长期作用,硫化物会转化为硫酸盐,如石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)等。火山口附近的硫单质胡被大气中的氧气氧化成SO2,SO2可进一步被氧化成SO3。
硫元素思维导图
硫的化合价与性质的关系
-2
0
+4
+6
只有还原性
既有氧化性
又有还原性
只有氧化性
价类二维图
-2
+6
+4
0
单质or氧化剂
酸
盐
S
SO2
SO3
H2S
H2SO3
H2SO4
Na2SO4
物质类别
化合价
Na2S
Na2SO3
方程式汇总
人教版P10页 课后练习
【例7】现有两支分别盛有相同体积浓硫酸和稀硫酸的试管,请用简单的方法区别它们。
(1)用玻璃棒蘸取试液,滴在白纸上——脱水性
(2)pH试纸——脱水性,酸性
人教版P10页 课后练习
【例8】某工厂使用的煤中硫的质量分数为0.64%,该工厂每天燃烧这种煤100t,是计算:
(1)如果煤中的硫全部转化为SO2,该厂每天产生SO2的质量及这些SO2在标准状况下的体积;
(2)如果把产生的SO2全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量。
守恒大法:一切简便思维皆守恒
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
