人教版(2019)必修二 8.1.1 海水资源的开发利用 课件(共29张PPT)
文档属性
| 名称 | 人教版(2019)必修二 8.1.1 海水资源的开发利用 课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 25.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 16:27:04 | ||
图片预览





文档简介
(共29张PPT)
海水资源的开发利用
海洋约占地球表面积的71% ,
我们能从海洋中获得哪些资源呢?
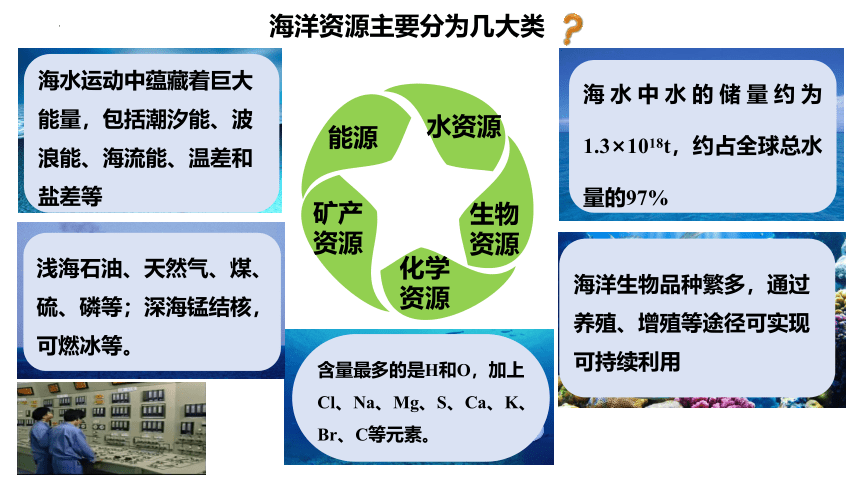
海洋资源主要分为几大类
水资源
生物资源
化学资源
矿产资源
能源
氯
钠
溴
碘
镁
钾
钴
锰
锌
锡
钛
铀
金
海水中水的储量约为1.3×1018t,约占全球总水量的97%
海洋生物品种繁多,通过养殖、增殖等途径可实现可持续利用
含量最多的是H和O,加上Cl、Na、Mg、S、Ca、K、Br、C等元素。
浅海石油、天然气、煤、硫、磷等;深海锰结核,可燃冰等。
海水运动中蕴藏着巨大能量,包括潮汐能、波浪能、海流能、温差和盐差等
分散性
元素种类很多,总计含有80多种元素
许多元素的富集程度很低(金总含量1x106t而1t海水仅含1x10-4t)
多样性
海水资源有什么特点?
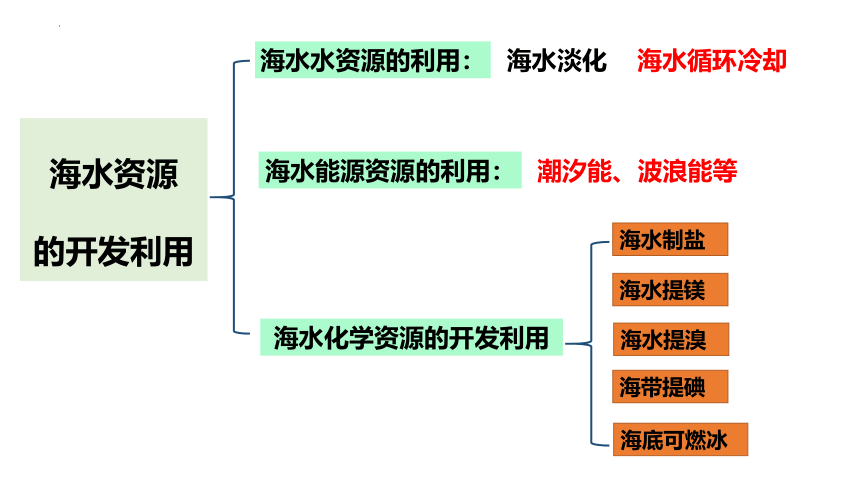
海水能源资源的利用:
海水资源
的开发利用
海水水资源的利用:
海水化学资源的开发利用
海水提镁
海水提溴
海带提碘
海水制盐
潮汐能、波浪能等
海底可燃冰
海水循环冷却
海水淡化
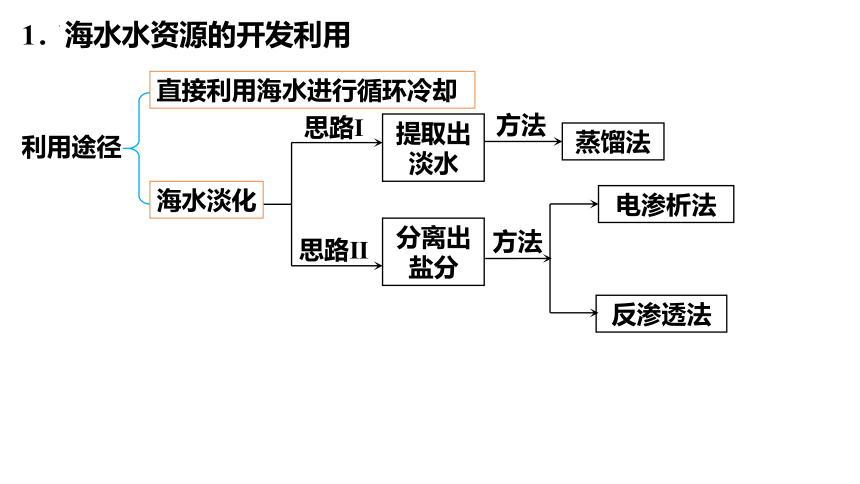
1.海水水资源的开发利用
利用途径
直接利用
海水循环冷却核电站
海水灌溉
工业用水
生活用水
沿海大部分工业用冷却水都采用海水,占到了海水直接利用总量的90%。此外,海水也被沿海城市直接使用冲厕和用作消防用水等;还有海水灌溉低盐度海水农作物——如袁隆平院士开发的海水稻等,这些都是海水直接利用的途径。
利用途径
直接利用
1.海水水资源的开发利用
利用途径
直接利用海水进行循环冷却
海水淡化
思路Ⅰ
思路Ⅱ
提取出淡水
方法
蒸馏法
分离出盐分
方法
电渗析法
反渗透法
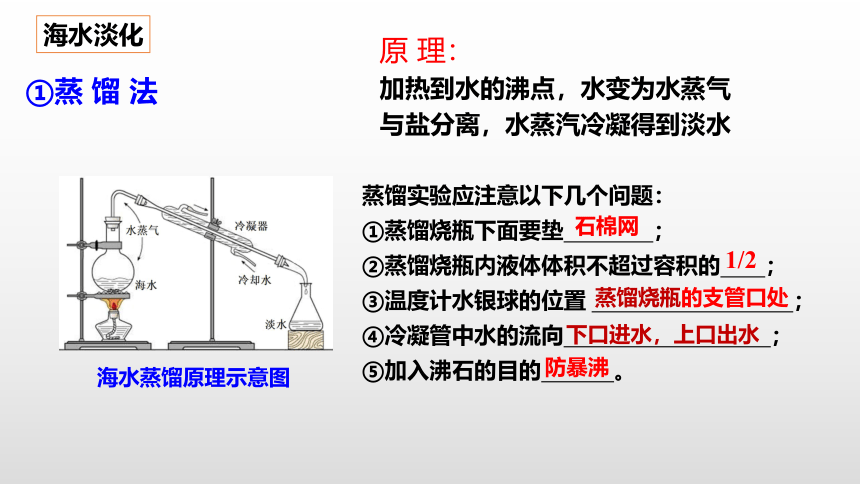
①蒸 馏 法
海水蒸馏原理示意图
原 理:
加热到水的沸点,水变为水蒸气与盐分离,水蒸汽冷凝得到淡水
蒸馏实验应注意以下几个问题:
①蒸馏烧瓶下面要垫 ;
②蒸馏烧瓶内液体体积不超过容积的 ;
③温度计水银球的位置 ;
④冷凝管中水的流向 ;
⑤加入沸石的目的 。
石棉网
1/2
蒸馏烧瓶的支管口处
下口进水,上口出水
防暴沸
海水淡化
②电渗析法
电渗析原理图
当海水进入时,在直流电场的作用下,海水中的阴、阳离子分别向两侧定向迁移,从而实现海水变淡水的过程。
海水淡化
③反渗透法
反渗透装置示意图
该法是利用只允许溶剂水分子透过、不允许溶质离子透过的半透膜,将海水与淡水分隔开。
海水淡化
2.海水中的化学资源的开发利用
海水中80多种元素,最多的是O、H两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素,其总量超过99%其余1%为70多种含量微少的元素。
——海水晒盐
海水化学资源综合利用
⑴ 定义:
从海水中提取食盐的传统方法称为“盐田法”,又称“滩晒法”,是最简便和经济有效的方法。
⑵ 原理:
蒸发、结晶
⑶ 过程:
海水
盐田
饱和食盐水
粗盐
精盐
风吹日晒
水分蒸发
风吹日晒
水分蒸发
引入
提纯
海水日晒制盐
粗盐中的杂质:泥沙、Ca2+、Mg2+、SO42-
除杂试剂:
①Na2CO3
②NaOH
③BaCl2
试剂加入顺序:
②③① \\ ③②① \\ ③①②
基本原则: 先加BaCl2,后加Na2CO3
过滤沉淀,最后加盐酸除CO32-、OH-
粗盐的提纯
海水制盐——用途
NaCl +NH3 + CO2 +H2O ==NaHCO3 ↓+NH4Cl
2NaHCO3 == Na2CO3 + CO2+H2O
[俗称“氯碱工业”]
(2)制金属Na
(3)制纯碱(Na2CO3)
(1) NaCl的水溶液制NaOH 、 Cl2 、 H2
2NaCl + 2H2O === H2 + Cl2 + 2NaOH
电解
2NaCl(熔融)=== 2Na + Cl2
电解
侯式制碱法
①饱和食盐水中通入NH3后,再通入足量的CO2
②小苏打受热分解得到纯碱
重要的化工原料(制盐酸、漂白液等)
食 盐
淡水
直接利用
海水
纯碱
钠
氢气
氯气
烧碱
苦卤
浓度较高Cl-、Na+、Mg2+、K+、Br-……
成分
科学视野
镁具有重量轻、强度高等特点,被广泛应用于火箭、导弹、飞机制造、汽车、舰艇、精密机器等各个领域,在军事工业和民用企业上具有极其重要的意义,被誉为“国防金属”。海水盐分中镁的占有量仅次于氯和钠,总储量约为2.1×1015 t。
目前世界生产的镁60%来自海水
海水化学资源综合利用
——海水提镁
Mg
无水MgCl2
熔融
电解
苦卤 (含Mg2+)
如何把Mg2+从混合液中分离出来?
生成沉淀!
物质 Mg(OH)2 MgCO3
20℃溶解度(g/100g) 0.00096 0.039
Mg
无水MgCl2
熔融
电解
苦卤 (含Mg2+)
——海水提镁
海水化学资源综合利用
Mg
无水MgCl2
熔融
电解
苦卤
(含Mg2+)
Mg(OH)2
沉淀
MgCl2 溶液
加碱
过滤
盐酸
?
——海水提镁
海水化学资源综合利用
试剂 KOH NaOH Ca(OH)2 Ba(OH)2
价格(元/吨) 6500 2900 580 6000
工业级试剂价格
报价信息:来自阿里巴巴热销货源平台
石灰乳
溶液
Mg(OH)2
沉淀
盐酸
MgCl2溶液
Mg
无水MgCl2
熔融 电解
海水
(含Mg2+)
过滤
MgCl2+Ca(OH)2 == Mg(OH)2↓+CaCl2
就地取材-贝壳(CaCO3)
Mg(OH)2+2HCl == MgCl2+2H2O
MgCl2(熔融) == Mg+Cl2↑
电解
CaO+H2O == Ca(OH)2
△
CaCO3 == CaO+CO2↑
——海水提镁
海水化学资源综合利用
——海水提溴
溴是海洋元素,地球上99%的溴分布在海水中,以Br-的形式存在。海水中的溴元素含量约为67mg/L. 只有把海水中的溴元素提取出来,成为溴单质或制成其他化合物,才能有效的被使用。
海水化学资源综合利用
工业上常用的一种海水提溴技术叫做“吹出法”,其过程主要包括氧化(用氯气氧化海水中的溴离子)、吹出(用空气将生成的溴吹出)吸收(用二氧化硫作还原剂使溴转化为氢溴酸,以使其与空气分离)、蒸馏(再用氯气将氢溴酸氧化为溴后蒸馏分离)等环节(如图8-4)。
海水提溴的工艺流程
阅读课本P101【思考与讨论】画出简易的工艺流程图写出相应的化学方程式
海水
富集
(浓缩)
氧化室
吹出塔
吸收塔
蒸馏塔
冷凝器
Br2
酸和Cl2
空气
SO2和H2O
Cl2和H2O
目标产品
物质转化、分离提纯
工业原料
富集
“吹出法”海水提溴 p101 环节 作用 化学方程式(或离子方程式)
氧化
用氯气氧化海水中的溴离子
2Br-+Cl2=2Cl-+Br2
吹出
用空气将生成的溴吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
吸收
Br2+SO2+2H2O=4H++SO42-+2Br-
Br2+SO2+2H2O=H2SO4+2HBr
再用氯气将氢溴酸氧化为溴后蒸馏分离
蒸馏
2HBr+Cl2=2HCl+Br2
2Br-+Cl2=2Cl-+Br2
冷凝
将气态溴转化为液态溴
海带
海带灰
浸泡过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
2H++2I-+H2O2 == I2+2H2O
氧化
蒸馏
晶体碘
——海水提碘p106
海水化学资源综合利用
海水化学资源的开发利用
海水资源的开发利用是一个利用物理或化学方法进行转化、分离和提纯的过程!
海水资源的开发利用
海洋约占地球表面积的71% ,
我们能从海洋中获得哪些资源呢?
海洋资源主要分为几大类
水资源
生物资源
化学资源
矿产资源
能源
氯
钠
溴
碘
镁
钾
钴
锰
锌
锡
钛
铀
金
海水中水的储量约为1.3×1018t,约占全球总水量的97%
海洋生物品种繁多,通过养殖、增殖等途径可实现可持续利用
含量最多的是H和O,加上Cl、Na、Mg、S、Ca、K、Br、C等元素。
浅海石油、天然气、煤、硫、磷等;深海锰结核,可燃冰等。
海水运动中蕴藏着巨大能量,包括潮汐能、波浪能、海流能、温差和盐差等
分散性
元素种类很多,总计含有80多种元素
许多元素的富集程度很低(金总含量1x106t而1t海水仅含1x10-4t)
多样性
海水资源有什么特点?
海水能源资源的利用:
海水资源
的开发利用
海水水资源的利用:
海水化学资源的开发利用
海水提镁
海水提溴
海带提碘
海水制盐
潮汐能、波浪能等
海底可燃冰
海水循环冷却
海水淡化
1.海水水资源的开发利用
利用途径
直接利用
海水循环冷却核电站
海水灌溉
工业用水
生活用水
沿海大部分工业用冷却水都采用海水,占到了海水直接利用总量的90%。此外,海水也被沿海城市直接使用冲厕和用作消防用水等;还有海水灌溉低盐度海水农作物——如袁隆平院士开发的海水稻等,这些都是海水直接利用的途径。
利用途径
直接利用
1.海水水资源的开发利用
利用途径
直接利用海水进行循环冷却
海水淡化
思路Ⅰ
思路Ⅱ
提取出淡水
方法
蒸馏法
分离出盐分
方法
电渗析法
反渗透法
①蒸 馏 法
海水蒸馏原理示意图
原 理:
加热到水的沸点,水变为水蒸气与盐分离,水蒸汽冷凝得到淡水
蒸馏实验应注意以下几个问题:
①蒸馏烧瓶下面要垫 ;
②蒸馏烧瓶内液体体积不超过容积的 ;
③温度计水银球的位置 ;
④冷凝管中水的流向 ;
⑤加入沸石的目的 。
石棉网
1/2
蒸馏烧瓶的支管口处
下口进水,上口出水
防暴沸
海水淡化
②电渗析法
电渗析原理图
当海水进入时,在直流电场的作用下,海水中的阴、阳离子分别向两侧定向迁移,从而实现海水变淡水的过程。
海水淡化
③反渗透法
反渗透装置示意图
该法是利用只允许溶剂水分子透过、不允许溶质离子透过的半透膜,将海水与淡水分隔开。
海水淡化
2.海水中的化学资源的开发利用
海水中80多种元素,最多的是O、H两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素,其总量超过99%其余1%为70多种含量微少的元素。
——海水晒盐
海水化学资源综合利用
⑴ 定义:
从海水中提取食盐的传统方法称为“盐田法”,又称“滩晒法”,是最简便和经济有效的方法。
⑵ 原理:
蒸发、结晶
⑶ 过程:
海水
盐田
饱和食盐水
粗盐
精盐
风吹日晒
水分蒸发
风吹日晒
水分蒸发
引入
提纯
海水日晒制盐
粗盐中的杂质:泥沙、Ca2+、Mg2+、SO42-
除杂试剂:
①Na2CO3
②NaOH
③BaCl2
试剂加入顺序:
②③① \\ ③②① \\ ③①②
基本原则: 先加BaCl2,后加Na2CO3
过滤沉淀,最后加盐酸除CO32-、OH-
粗盐的提纯
海水制盐——用途
NaCl +NH3 + CO2 +H2O ==NaHCO3 ↓+NH4Cl
2NaHCO3 == Na2CO3 + CO2+H2O
[俗称“氯碱工业”]
(2)制金属Na
(3)制纯碱(Na2CO3)
(1) NaCl的水溶液制NaOH 、 Cl2 、 H2
2NaCl + 2H2O === H2 + Cl2 + 2NaOH
电解
2NaCl(熔融)=== 2Na + Cl2
电解
侯式制碱法
①饱和食盐水中通入NH3后,再通入足量的CO2
②小苏打受热分解得到纯碱
重要的化工原料(制盐酸、漂白液等)
食 盐
淡水
直接利用
海水
纯碱
钠
氢气
氯气
烧碱
苦卤
浓度较高Cl-、Na+、Mg2+、K+、Br-……
成分
科学视野
镁具有重量轻、强度高等特点,被广泛应用于火箭、导弹、飞机制造、汽车、舰艇、精密机器等各个领域,在军事工业和民用企业上具有极其重要的意义,被誉为“国防金属”。海水盐分中镁的占有量仅次于氯和钠,总储量约为2.1×1015 t。
目前世界生产的镁60%来自海水
海水化学资源综合利用
——海水提镁
Mg
无水MgCl2
熔融
电解
苦卤 (含Mg2+)
如何把Mg2+从混合液中分离出来?
生成沉淀!
物质 Mg(OH)2 MgCO3
20℃溶解度(g/100g) 0.00096 0.039
Mg
无水MgCl2
熔融
电解
苦卤 (含Mg2+)
——海水提镁
海水化学资源综合利用
Mg
无水MgCl2
熔融
电解
苦卤
(含Mg2+)
Mg(OH)2
沉淀
MgCl2 溶液
加碱
过滤
盐酸
?
——海水提镁
海水化学资源综合利用
试剂 KOH NaOH Ca(OH)2 Ba(OH)2
价格(元/吨) 6500 2900 580 6000
工业级试剂价格
报价信息:来自阿里巴巴热销货源平台
石灰乳
溶液
Mg(OH)2
沉淀
盐酸
MgCl2溶液
Mg
无水MgCl2
熔融 电解
海水
(含Mg2+)
过滤
MgCl2+Ca(OH)2 == Mg(OH)2↓+CaCl2
就地取材-贝壳(CaCO3)
Mg(OH)2+2HCl == MgCl2+2H2O
MgCl2(熔融) == Mg+Cl2↑
电解
CaO+H2O == Ca(OH)2
△
CaCO3 == CaO+CO2↑
——海水提镁
海水化学资源综合利用
——海水提溴
溴是海洋元素,地球上99%的溴分布在海水中,以Br-的形式存在。海水中的溴元素含量约为67mg/L. 只有把海水中的溴元素提取出来,成为溴单质或制成其他化合物,才能有效的被使用。
海水化学资源综合利用
工业上常用的一种海水提溴技术叫做“吹出法”,其过程主要包括氧化(用氯气氧化海水中的溴离子)、吹出(用空气将生成的溴吹出)吸收(用二氧化硫作还原剂使溴转化为氢溴酸,以使其与空气分离)、蒸馏(再用氯气将氢溴酸氧化为溴后蒸馏分离)等环节(如图8-4)。
海水提溴的工艺流程
阅读课本P101【思考与讨论】画出简易的工艺流程图写出相应的化学方程式
海水
富集
(浓缩)
氧化室
吹出塔
吸收塔
蒸馏塔
冷凝器
Br2
酸和Cl2
空气
SO2和H2O
Cl2和H2O
目标产品
物质转化、分离提纯
工业原料
富集
“吹出法”海水提溴 p101 环节 作用 化学方程式(或离子方程式)
氧化
用氯气氧化海水中的溴离子
2Br-+Cl2=2Cl-+Br2
吹出
用空气将生成的溴吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
吸收
Br2+SO2+2H2O=4H++SO42-+2Br-
Br2+SO2+2H2O=H2SO4+2HBr
再用氯气将氢溴酸氧化为溴后蒸馏分离
蒸馏
2HBr+Cl2=2HCl+Br2
2Br-+Cl2=2Cl-+Br2
冷凝
将气态溴转化为液态溴
海带
海带灰
浸泡过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
2H++2I-+H2O2 == I2+2H2O
氧化
蒸馏
晶体碘
——海水提碘p106
海水化学资源综合利用
海水化学资源的开发利用
海水资源的开发利用是一个利用物理或化学方法进行转化、分离和提纯的过程!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
