第1章认识化学科学检测题高一上学期化学鲁科版(2019)必修第一册(含解析)
文档属性
| 名称 | 第1章认识化学科学检测题高一上学期化学鲁科版(2019)必修第一册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 456.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 17:14:52 | ||
图片预览



文档简介
第1章《认识化学科学》检测题
一、单选题
1.代表阿伏加德罗常数的值。下列说法正确的是
A.的羟基与的氢氧根离子所含电子数均为9
B.石墨烯(单层石墨)中含有六元环的个数为
C.25℃时的溶液中由水电离出的的数目为0.1
D.标准状况下,甲烷和氯气混合物在光照条件下反应后,所得混合物的分子数为0.5
2.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
A.1.4 g乙烯和丙烯的混合物中含碳原子数为0.l5×6.02×1023
B.16.2 g淀粉和纤维素混合物中共含碳原子数为0.1×6.02×1023
C.1.5g C2H6中含有共价键的数目为7×3.01×1022
D.标准状况下,2.24L CCl4中含有的分子数为0.1×6.02×1023
3.下列各组物质中,不能用“物质的量”计量的是
A.氯化氢分子 B.氯化钠中的阳离子 C.市售食盐 D.氯离子的核外电子
4.下列有关物质及其用途的描述,正确的是
①Al2O3(作耐火坩埚) ② Na2CO3(治疗胃酸过多) ③KAl(SO4)2·12H2O(作净水剂) ④NaHCO3(作食用碱) ⑤钠、钾、锶、钡等化合物(作烟花的焰色) ⑥Na2O(作供氧剂)
A.①④⑤⑥ B.①②⑤⑥ C.①③④⑤ D.全部
5.等质量的二氧化硫和氧气的物质的量之比是
A.1:1 B.1:2 C.2:1 D.2:3
6.以下关于金属钠的叙述中正确的是( )
A.金属钠可保存在煤油中
B.金属钠可将铁从其盐溶液中置换出来
C.钠投入水中立即熔化成小球,说明钠的熔点低,且钠与水反应为吸热反应
D.钠在空气中能发生缓慢氧化而发生自燃
7.下列叙述正确的是
A.1.5molO2体积是33.6L B.在标准状况下,2molH2的体积是44.8L
C.等质量的CO和N2的体积相等 D.32gO2的物质的量是1mol,其体积是22.4L
8.下列有关Cl2制备或性质的说法正确的是
A.Cl2是无色无味气体
B.将紫色石蕊试液逐滴滴入新制氯水中仅证明新制氯水具有酸性
C.纯净的氢气在氯气中燃烧发出苍白色火焰
D.向田鼠洞里通入氯气杀灭田鼠,仅利用了氯气有毒的性质
9.用表示阿伏加德罗常数的值,下列说法正确的是
A.在1 L 0.1 mol/L的碳酸钠溶液中,氧原子总数为0.3
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1
C.常温常压下,32 g中所含电子的数目为20
D.标准状况下,11.2 L乙醇中含有分子的数目为0.5
10.用NaOH固体配制溶液,在下列仪器中不需要用到的是
A. B. C. D.
11.用NA代表阿伏加德罗常数的值,下列说法正确的是
A.7.8gNa2O2中的离子总数为0.4NA B.pH=2的盐酸中的H+总数为0.01NA
C.2.3gNa和足量氧气反应转移电子数为0.1NA D.5.6LH2S所含S-H键的数目为0.5NA
12.假若你是卫生防疫人员,用容量瓶配制0.06mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
A.KMnO4固体受潮 B.溶解搅拌时有液体溅出
C.定容时俯视容量瓶刻度线 D.摇匀后见液面下降,再加水至刻度线
13.通过“食盐的精制”实验的启发,请你思考:要除去溶液中混有的少量杂质,得到纯净的溶液,操作正确的是
A.加入适量的溶液,过滤
B.加入足量的溶液,过滤
C.先加入过量的溶液,过滤,再向滤液中加入适量的稀硝酸
D.先加入过量的溶液,过滤,再向滤液中加入适量的稀盐酸
14.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”这里的“石碱”是指( )
A.KOH B.KAl(SO4)2
C.KHCO3 D.K2CO3
15.将6mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度
A.mol/L B.mol/L C.mol/L D.mol/L
二、填空题
16.
(1)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2
所占的体积由大到小的顺序是(填序号,下同)____;
密度由大到小的顺序是____。
所含原子数由多到少的顺序是______;
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为____。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,该混合气体的平均摩尔质量为__,NH3的体积分数为___。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中的物质的量浓度是__mol/L。
17.物质的量的单位( ),气体摩尔体积的单位( )。
三、实验题
18.自1807年戴维通过电解获得金属钠开始,钠及其化合物在生产、生活和科学研究中的地位越来越重要。
(1)钠的氧化物中,能用于呼吸面具和潜水艇中作供氧剂的是______________(填化学式)。
(2)精选种子有利于提高农作物的产量。某农场工作人员配制1 L一定物质的量浓度的NaCl溶液进行选种,所需玻璃仪器有烧杯、玻璃棒、量筒、______________.
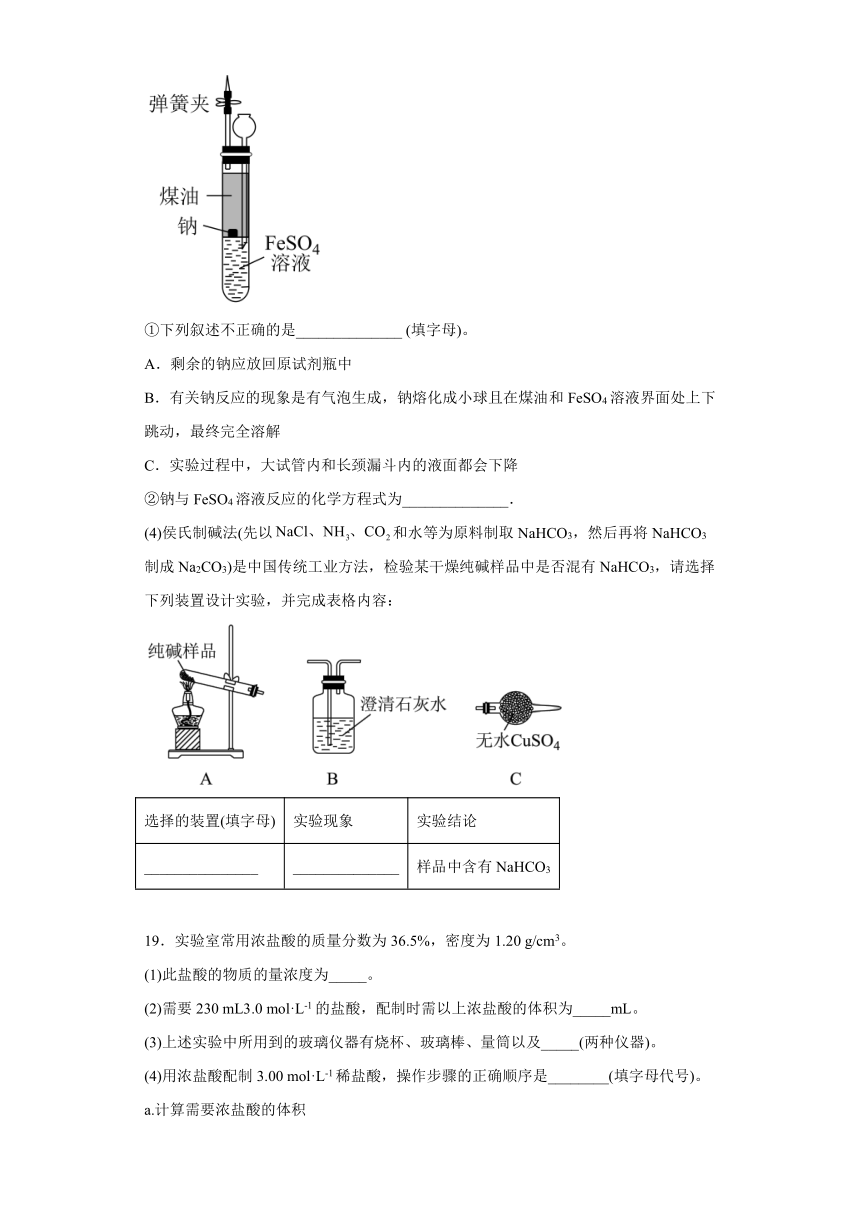
(3)在隔绝空气条件下让钠与FeSO4溶液反应,实验装置如图。向100 mL大试管中先加入40 mL煤油,取一小块金属钠放入大试管后塞上橡皮塞通过长颈漏斗加入FeSO4溶液使煤油的液面至橡胶塞,并夹紧弹簧夹。
①下列叙述不正确的是______________ (填字母)。
A.剩余的钠应放回原试剂瓶中
B.有关钠反应的现象是有气泡生成,钠熔化成小球且在煤油和FeSO4溶液界面处上下跳动,最终完全溶解
C.实验过程中,大试管内和长颈漏斗内的液面都会下降
②钠与FeSO4溶液反应的化学方程式为______________.
(4)侯氏制碱法(先以和水等为原料制取NaHCO3,然后再将NaHCO3制成Na2CO3)是中国传统工业方法,检验某干燥纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成表格内容:
选择的装置(填字母) 实验现象 实验结论
_______________ ______________ 样品中含有NaHCO3
19.实验室常用浓盐酸的质量分数为36.5%,密度为1.20 g/cm3。
(1)此盐酸的物质的量浓度为_____。
(2)需要230 mL3.0 mol·L-1的盐酸,配制时需以上浓盐酸的体积为_____mL。
(3)上述实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒以及_____(两种仪器)。
(4)用浓盐酸配制3.00 mol·L-1稀盐酸,操作步骤的正确顺序是________(填字母代号)。
a.计算需要浓盐酸的体积
b.用量筒量取浓盐酸
c.将烧杯中的溶液注入所需容积的容量瓶中,瓶用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶
d.把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却
e.盖好瓶塞,反复上下颠倒,摇匀
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm处,改用某仪器小心滴加蒸馏水至凹液面与刻度线相平
(5)下列操作使溶液物质的量浓度偏高的是:________。
A.量取浓盐酸时仰视刻度线
B.容量瓶洗净后未经干燥处理
C.未冷却至室温就转移定容
D.将洗涤量筒的洗涤液转移到容量瓶中
E.定容时俯视刻度线
F.摇匀后立即观察,发现溶液未达到刻度线,再加几滴蒸馏水至刻度线
四、计算题
20.碳酸钙与盐酸反应产生标准状况下的CO2气体3.36L,求参加反应的碳酸钙的质量是多少?________________。
21.用能氧化浓盐酸。反应的化学方程式如下:
,请计算回答下列问题:
(1)当15.8 g 反应时,被氧化HCl的物质的量为多少______?
(2)当15.8 g 反应时,产生的在标准状况下的体积为多少______?
(3)当15.8 g 反应时,转移电子的数目为多少______?
参考答案:
1.D
【详解】A.的羟基所含电子数均为9,的氢氧根离子所含电子数均为10,A错误;
B.石墨烯(单层石墨)的物质的量为:,在石墨烯中,每个碳原子被三个六元环公用,1个六元环中含有个碳原子,1个碳原子形成0.5个六元环,0.5mol石墨烯中含有六元环的个数为0.25,B错误;
C.25℃时的溶液中由水电离出的c(H+)=1×10-14÷10-13=0.1mol/L,由水电离出的c()=10-13 mol/L ,的数目为10-13,C错误;
D.标准状况下,甲烷为0.5mol,和氯气混合物在光照条件下反应后,生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳还有HCl,所得混合物的分子数为0.5,D正确;
答案选D。
2.C
【详解】A.1.4g乙烯、丙烯中含有0.1molCH2,即含有0.1molC,选项A错误;
B.淀粉和纤维素的通式是(C6H10O5)n,16.2g混合物含有0.1molC6H10O5,故含有0.6molC,选项B错误;
C.1.5g丙烷的物质的量为0.05mol,一分子乙烷中含有7个共价键,故1.5g乙烷中含有7×0.05×6.02×1023 =7×3.01×1022,选项C正确;
D.标况下,四氯化碳是液态,不是气体,选项D错误;
答案选C。
3.C
【详解】物质的量不能用来表示宏观物质,只能用来表示微观粒子,如:分子、原子、离子、电子、质子、中子等,其单位是mol,故市售食盐不能用“物质的量”计量;
答案选C。
4.C
【详解】①Al2O3熔点高,可作耐火坩埚;
② Na2CO3碱性比较强,不能治疗胃酸过多,治疗胃酸过多应该用NaHCO3;
③KAl(SO4)2·12H2O溶于水电离产生的Al3+能水解生成Al(OH)3胶体,可以吸附水中的杂质,作净水剂 ;
④NaHCO3水溶液呈弱碱性,可用作食用碱;
⑤钠、钾、锶、钡等化合物在灼烧时呈现不同的颜色,可作烟花的焰色;
⑥Na2O不能产生氧气,Na2O2能和二氧化碳以及水反应生成氧气,可作供氧剂;
所以正确的是①③④⑤,故选C。
5.B
【详解】设质量都为mg,则有:,故选B。
6.A
【详解】A. 金属钠的密度大于煤油,并且不和煤油反应,可以保存在煤油中,故A正确;
B. 金属钠和盐溶液的反应实质是先和水反应,不会将金属从其盐中置换出来,故B错误;
C. 钠的熔点低,钠与水反应为放热反应,所以会熔成小球,故C正确;
D. 金属钠在空气中会被氧化为氧化钠,不会自燃,故D错误。
答案选A。
【点睛】钠是一种非常活泼的金属,密度比水小,钠与水反应现象是浮,熔,游,响,红,需注意钠与溶液反应时会优先和溶液中的水反应。
7.B
【详解】A.未明确标准状况,不能用公式V=22.4·n 计算气体的体积,A项错误;
B.在标准状况下,2molH2的体积=22.4L/mol×2mol=44.8L,B项正确;
C.因为CO和N2的摩尔质量相等,所以等质量的CO和N2的物质的量相等,但题目没有明确两气体所处的温度和压强是否相同,所以无法判断等质量的CO和N2的体积是否一定相等。C项错误;
D.未明确标准状况,不能用公式V=22.4·n 计算气体的体积,D项错误;答案选B。
【点睛】利用公式V= 22.4·n计算物质的体积时,一定要明确两点:一是物质的状态必须是“气体”,二是温度和压强必须是“标准状况(即00C和101kPa)”。
8.C
【详解】A.Cl2是黄绿色具有刺激性气味的有毒气体,A不正确;
B.将紫色石蕊试液逐滴滴入新制氯水中,先变红后褪色,可证明新制氯水具有酸性和强氧化性,B不正确;
C.在点燃条件下,纯净的氢气在氯气中剧烈燃烧,并发出苍白色火焰,C正确;
D.向田鼠洞里通入氯气杀灭田鼠,不仅利用了氯气有毒的性质,还利用氯气的密度比空气大,D不正确;
故选C。
9.C
【详解】A.在1 L 0.1 mol/L的碳酸钠溶液中,除了溶质外,还存在大量的水,所以氧原子总数远大于0.3,故A错误;
B.该溶液的体积未知,不能进行相关计算,故B错误;
C.每个中含有10个电子,32 g中所含电子的数目为,故C正确;
D.标准状况下,乙醇为液态,不能用进行计算,故D错误;
故选C。
10.C
【详解】用NaOH固体配制溶液,需要用托盘天平称量氢氧化钠,用烧杯溶解氢氧化钠固体,用容量瓶定容,A是托盘天平、B是烧杯、C是圆底烧瓶、D是容量瓶,不需要用圆底烧瓶,故选C。
11.C
【详解】A.Na2O2中含有两个Na+和一个,所以7.8gNa2O2中的有0.3mol离子,所以离子总数为0.3NA,故A错误;
B.pH=2的盐酸中总浓度为0.01mol/L,没有溶液体积,无法计算H+总数,故B错误;
C.2.3gNa为0.1mol,反应方程式为,Na失去1个电子,所以转移电子数为0.1mol,转移电子数为0.1NA,故C正确;
D.标准情况下才有5.6LH2S有,所含S-H键的数目为0.5NA,故D错误;
故答案选C。
12.C
【详解】A.KMnO4固体受潮,实际量取的KMnO4的质量偏小,所配溶液的浓度偏低,A错误;
B.溶解搅拌时有液体飞溅,少量KMnO4损失,移入容量瓶内KMnO4的量减少,所配溶液的浓度偏低,B错误;
C.定容时俯视容量瓶刻度线,导致所配溶液体积偏小,所配溶液的浓度偏高,C正确;
D.摇匀后液面下降,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,导致溶液的体积偏大,所配溶液的浓度偏低,D错误;
答案选C。
13.C
【详解】A.加入适量的溶液,引入钠离子,A错误;
B.加入足量的溶液,过滤,过量的碳酸根离子仍然在溶液中,B错误;
C.先加入过量的溶液生成碳酸钡沉淀,过滤,再向滤液中加入适量的稀硝酸除去过量的碳酸钾,C正确;
D.先加入过量的溶液,过滤,再向滤液中加入适量的稀盐酸,引入氯离子,D错误;
答案选C。
14.D
【详解】“采蒿蓼之属,晒干烧灰”,说明“石碱”成分来自植物烧成的灰中的成分,“以水淋汁”,该成分易溶于水,久则凝淀如石,亦去垢,能洗去油污,发面,能作为发酵剂,排除KOH、KAl(SO4)2,植物烧成的灰中的成分主要为碳酸盐,所以碳酸钾符合,同时符合久则凝淀如石,而KHCO3久则分解生成粉末状的碳酸钾,故D符合,故答案为D。
15.A
【详解】6mol/L的Mg(NO3)2溶液中NO3-的浓度为:6mol/L×2=12 mol/L,
将a mL稀释至b mL,稀释过程中NO3-的物质的量不变,则稀释后溶液中NO3-的物质的量浓度为: =mol/L,A项正确;
答案选A。
【点睛】掌握稀释前后溶质的物质的量保持不变是解题的突破口,要特别注意粒子之间的关系。
16.(1) ②④③①⑤ ⑤①③④② ②④①③⑤
(2)4:3
(3) 16.8g/mol 80%
(4)
【详解】(1)同温同压下,气体体积比=物质的量之比,结合可知,体积和摩尔质量成反比,①的摩尔质量为44g·mol-1,②的摩尔质量为2g·mol-1,③的摩尔质量为32g·mol-1,④的摩尔质量为16g·mol-1,⑤的摩尔质量为64g·mol-1,故体积由大到小的顺序是②④③①⑤;
根据阿伏加德罗推论,相同条件下,气体密度之比=摩尔质量之比,故密度由大到小顺序是⑤①③④②;
设质量为mg,则①原子的物质的量是,②原子物质的量为m mol,③原子的物质的量,④原子物质的量为,⑤原子物质的量为,因此原子数由大到小的顺序是②④①③⑤;
(2)含相同数目的H原子,则n(NH3)×3=n(CH4)×4,因此有n(NH3):n(CH4)=4:3;
(3)平均摩尔质量=22.4×ρ标=22.4×0.75g·mol-1=16.8g·mol-1,根据平均摩尔质量定义,n(NH3)×17+n(CH4)×16/[n(NH3)+n(CH4]=16.8,n(NH3):n(CH4)=4:1,氨气的体积分数为×100%=80%;
(4)n(Al3+)=mol,n()=mol=mol,VmL溶液中c()=mol·L-1,取出的mL溶液中c()=mol·L-1,稀释过程中n()不变,mol·L-1×mL = c’()×VmL,则c’()= 。
17. 摩尔或mol L/mol(或Lmol-1)
【分析】根据物质的量与气体摩尔体积的概念及定义作答。
【详解】物质的量是一个物理量,单位为摩尔或mol,简称摩;气体摩尔体积是指单位物质的量的气体所占的体积,常用单位为L/mol(或Lmol-1),故答案为摩尔或mol;L/mol(或Lmol-1)。
18.(1)Na2O2
(2)1000 mL容量瓶、胶头滴管
(3) C 2Na+2H2O+FeSO4=Fe(OH)2↓+Na2SO4+H2↑
(4) AB或AC或ACB B中溶液变浑浊或C中固体变蓝或C中固体变蓝,B中溶液变浑浊
【解析】(1)
钠元素可形成Na2O、Na2O2两种氧化物,其中Na2O2能够与人呼吸产生的CO2、H2O发生反应产生O2,因此可帮助人呼吸,因此钠的氧化物中,能用于呼吸面具和潜水艇中作供氧剂的是Na2O2;
(2)
精选种子有利于提高农作物的产量。某农场工作人员配制1 L一定物质的量浓度的NaCl溶液进行选种,所需玻璃仪器有烧杯、玻璃棒、量筒、1000 mL容量瓶、胶头滴管;
(3)
①A.由于钠性质活泼,容易与水及空气中的氧气发生化学反应,所以剩余的钠应放回原试剂瓶中,A正确;
B.Na与H2O发生反应:2Na+2H2O=2NaOH+H2↑,该反应是放热反应,放出是热使熔点低的钠熔化为小球,小球在煤油和FeSO4溶液界面处上下跳动,最终完全溶解,反应放出氢气,因此看到有气泡生成,B正确;
C.该反应中有氢气生成,所以大试管内气体的压强增大,压强大于外界大气压,导致大试管内的溶液下降,把试管内的溶液压入长颈漏斗中,使长颈漏斗中液面逐渐上升,C错误;
故合理选项是C;
②将Na放入FeSO4溶液中,首先Na与H2O反应产生NaOH、H2,反应方程式为:2Na+2H2O=2NaOH+H2↑,然后是NaOH与FeSO4发生复分解反应产生Fe(OH)2沉淀和Na2SO4,反应方程式为:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4,将两个方程式叠加,可得钠与FeSO4溶液反应的总化学方程式为:2Na+2H2O+FeSO4=Fe(OH)2↓+Na2SO4+H2↑;
(4)
NaHCO3不稳定,受热分解产生Na2CO3、H2O、CO2,CO2与澄清石灰水作用产生CaCO3沉淀,使石灰水变浑浊;H2O能够使无水CuSO4由白色粉末变为CuSO4·5H2O蓝色晶体,而Na2CO3稳定,受热不分解,因此检验某干燥纯碱样品中是否混有NaHCO3,可以选择装置A、B检验,实验现象是:B中溶液变浑浊;或使用装置A、C进行检验,现象是C中固体变蓝;或使用A、C、B进行检验,实验现象是C中固体变蓝,B中溶液变浑浊。
19. 12 mol/L 62.5 250mL容量瓶、胶头滴管 abdcfe ACDE
【详解】(1)质量分数为36.5%,密度为1.20 g/cm3的浓盐酸的物质的量浓度c= mol/L=12 mol/L,答案:12 mol/L;
(2)配制230 mL3.0 mol·L-1的盐酸,应选择250mL的容量瓶,设需要浓盐酸的体积为V,稀释前后溶质HCl的物质的量不变,则V×12 mol/L=250 mL ×3.0 mol·L-1,解得V=62.5mL,答案:62.5;
(3)配制一定物质的量浓度溶液步骤为计算、称量、溶解、转移、洗涤、定容、摇匀、装瓶贴签等,用到的玻璃仪器有250mL容量瓶、量筒、胶头滴管、烧杯、玻璃棒,答案:250mL容量瓶、胶头滴管;
(4)配制一定物质的量浓度溶液步骤为计算、称量、溶解、转移、洗涤、定容、摇匀、装瓶贴签等,所以正确的操作步骤为abdcfe,答案:abdcfe;
(5)A.量取浓盐酸时仰视读数,浓盐酸体积偏大,溶质HCl物质的量偏大,根据c=,配制的溶液浓度偏高,A符合题意;
B.定容时需要加入蒸馏水,所以将烧杯中溶液转移到容量瓶之前,容量瓶洗净后未经干燥处理,对溶液浓度无影响,B不符合题意;
C.未冷却至室温就转移定容,冷却后溶液体积偏小,根据c=,配制的溶液浓度偏高,C符合题意;
D.将洗涤量筒的洗涤液转移到容量瓶中,溶质HCl物质的量偏大,根据c=,配制的溶液浓度偏高,D符合题意;
E.定容时俯视刻度线,溶液体积偏小,根据c=,配制的溶液浓度偏高,E符合题意;
F.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线,导致溶液体积偏大,根据c=,配制的溶液浓度偏低,F不符合题意;
答案选ACDE。
【点睛】当所配制溶液体积与所选容量瓶体积不同时,应按所选容量瓶的体积计算。
20.15g
【详解】碳酸钙与盐酸反应的方程式为CaCO3 + 2HCl= CaCl2+H2O+CO2,生成二氧化碳的物质的量n(CO2)=n(CaCO3)==0.15mol,碳酸钙的质量为:0.15mol100g/mol=15g。
21. 0.5mol 5.6L 3.01×1023
【详解】根据反应方程式进行计算如下:解得:V(Cl2)=5.6L,n(HCl)=0.5mol, n(e-)=0.5mol,故N(e-)=n(e-)NA=0.5mol×6.02×1023mol-1=3.01×1023,故答案为:0.5mol;5.6L;3.01×1023。
一、单选题
1.代表阿伏加德罗常数的值。下列说法正确的是
A.的羟基与的氢氧根离子所含电子数均为9
B.石墨烯(单层石墨)中含有六元环的个数为
C.25℃时的溶液中由水电离出的的数目为0.1
D.标准状况下,甲烷和氯气混合物在光照条件下反应后,所得混合物的分子数为0.5
2.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
A.1.4 g乙烯和丙烯的混合物中含碳原子数为0.l5×6.02×1023
B.16.2 g淀粉和纤维素混合物中共含碳原子数为0.1×6.02×1023
C.1.5g C2H6中含有共价键的数目为7×3.01×1022
D.标准状况下,2.24L CCl4中含有的分子数为0.1×6.02×1023
3.下列各组物质中,不能用“物质的量”计量的是
A.氯化氢分子 B.氯化钠中的阳离子 C.市售食盐 D.氯离子的核外电子
4.下列有关物质及其用途的描述,正确的是
①Al2O3(作耐火坩埚) ② Na2CO3(治疗胃酸过多) ③KAl(SO4)2·12H2O(作净水剂) ④NaHCO3(作食用碱) ⑤钠、钾、锶、钡等化合物(作烟花的焰色) ⑥Na2O(作供氧剂)
A.①④⑤⑥ B.①②⑤⑥ C.①③④⑤ D.全部
5.等质量的二氧化硫和氧气的物质的量之比是
A.1:1 B.1:2 C.2:1 D.2:3
6.以下关于金属钠的叙述中正确的是( )
A.金属钠可保存在煤油中
B.金属钠可将铁从其盐溶液中置换出来
C.钠投入水中立即熔化成小球,说明钠的熔点低,且钠与水反应为吸热反应
D.钠在空气中能发生缓慢氧化而发生自燃
7.下列叙述正确的是
A.1.5molO2体积是33.6L B.在标准状况下,2molH2的体积是44.8L
C.等质量的CO和N2的体积相等 D.32gO2的物质的量是1mol,其体积是22.4L
8.下列有关Cl2制备或性质的说法正确的是
A.Cl2是无色无味气体
B.将紫色石蕊试液逐滴滴入新制氯水中仅证明新制氯水具有酸性
C.纯净的氢气在氯气中燃烧发出苍白色火焰
D.向田鼠洞里通入氯气杀灭田鼠,仅利用了氯气有毒的性质
9.用表示阿伏加德罗常数的值,下列说法正确的是
A.在1 L 0.1 mol/L的碳酸钠溶液中,氧原子总数为0.3
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1
C.常温常压下,32 g中所含电子的数目为20
D.标准状况下,11.2 L乙醇中含有分子的数目为0.5
10.用NaOH固体配制溶液,在下列仪器中不需要用到的是
A. B. C. D.
11.用NA代表阿伏加德罗常数的值,下列说法正确的是
A.7.8gNa2O2中的离子总数为0.4NA B.pH=2的盐酸中的H+总数为0.01NA
C.2.3gNa和足量氧气反应转移电子数为0.1NA D.5.6LH2S所含S-H键的数目为0.5NA
12.假若你是卫生防疫人员,用容量瓶配制0.06mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
A.KMnO4固体受潮 B.溶解搅拌时有液体溅出
C.定容时俯视容量瓶刻度线 D.摇匀后见液面下降,再加水至刻度线
13.通过“食盐的精制”实验的启发,请你思考:要除去溶液中混有的少量杂质,得到纯净的溶液,操作正确的是
A.加入适量的溶液,过滤
B.加入足量的溶液,过滤
C.先加入过量的溶液,过滤,再向滤液中加入适量的稀硝酸
D.先加入过量的溶液,过滤,再向滤液中加入适量的稀盐酸
14.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面。”这里的“石碱”是指( )
A.KOH B.KAl(SO4)2
C.KHCO3 D.K2CO3
15.将6mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度
A.mol/L B.mol/L C.mol/L D.mol/L
二、填空题
16.
(1)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2
所占的体积由大到小的顺序是(填序号,下同)____;
密度由大到小的顺序是____。
所含原子数由多到少的顺序是______;
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为____。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,该混合气体的平均摩尔质量为__,NH3的体积分数为___。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中的物质的量浓度是__mol/L。
17.物质的量的单位( ),气体摩尔体积的单位( )。
三、实验题
18.自1807年戴维通过电解获得金属钠开始,钠及其化合物在生产、生活和科学研究中的地位越来越重要。
(1)钠的氧化物中,能用于呼吸面具和潜水艇中作供氧剂的是______________(填化学式)。
(2)精选种子有利于提高农作物的产量。某农场工作人员配制1 L一定物质的量浓度的NaCl溶液进行选种,所需玻璃仪器有烧杯、玻璃棒、量筒、______________.
(3)在隔绝空气条件下让钠与FeSO4溶液反应,实验装置如图。向100 mL大试管中先加入40 mL煤油,取一小块金属钠放入大试管后塞上橡皮塞通过长颈漏斗加入FeSO4溶液使煤油的液面至橡胶塞,并夹紧弹簧夹。
①下列叙述不正确的是______________ (填字母)。
A.剩余的钠应放回原试剂瓶中
B.有关钠反应的现象是有气泡生成,钠熔化成小球且在煤油和FeSO4溶液界面处上下跳动,最终完全溶解
C.实验过程中,大试管内和长颈漏斗内的液面都会下降
②钠与FeSO4溶液反应的化学方程式为______________.
(4)侯氏制碱法(先以和水等为原料制取NaHCO3,然后再将NaHCO3制成Na2CO3)是中国传统工业方法,检验某干燥纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成表格内容:
选择的装置(填字母) 实验现象 实验结论
_______________ ______________ 样品中含有NaHCO3
19.实验室常用浓盐酸的质量分数为36.5%,密度为1.20 g/cm3。
(1)此盐酸的物质的量浓度为_____。
(2)需要230 mL3.0 mol·L-1的盐酸,配制时需以上浓盐酸的体积为_____mL。
(3)上述实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒以及_____(两种仪器)。
(4)用浓盐酸配制3.00 mol·L-1稀盐酸,操作步骤的正确顺序是________(填字母代号)。
a.计算需要浓盐酸的体积
b.用量筒量取浓盐酸
c.将烧杯中的溶液注入所需容积的容量瓶中,瓶用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶
d.把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却
e.盖好瓶塞,反复上下颠倒,摇匀
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm处,改用某仪器小心滴加蒸馏水至凹液面与刻度线相平
(5)下列操作使溶液物质的量浓度偏高的是:________。
A.量取浓盐酸时仰视刻度线
B.容量瓶洗净后未经干燥处理
C.未冷却至室温就转移定容
D.将洗涤量筒的洗涤液转移到容量瓶中
E.定容时俯视刻度线
F.摇匀后立即观察,发现溶液未达到刻度线,再加几滴蒸馏水至刻度线
四、计算题
20.碳酸钙与盐酸反应产生标准状况下的CO2气体3.36L,求参加反应的碳酸钙的质量是多少?________________。
21.用能氧化浓盐酸。反应的化学方程式如下:
,请计算回答下列问题:
(1)当15.8 g 反应时,被氧化HCl的物质的量为多少______?
(2)当15.8 g 反应时,产生的在标准状况下的体积为多少______?
(3)当15.8 g 反应时,转移电子的数目为多少______?
参考答案:
1.D
【详解】A.的羟基所含电子数均为9,的氢氧根离子所含电子数均为10,A错误;
B.石墨烯(单层石墨)的物质的量为:,在石墨烯中,每个碳原子被三个六元环公用,1个六元环中含有个碳原子,1个碳原子形成0.5个六元环,0.5mol石墨烯中含有六元环的个数为0.25,B错误;
C.25℃时的溶液中由水电离出的c(H+)=1×10-14÷10-13=0.1mol/L,由水电离出的c()=10-13 mol/L ,的数目为10-13,C错误;
D.标准状况下,甲烷为0.5mol,和氯气混合物在光照条件下反应后,生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳还有HCl,所得混合物的分子数为0.5,D正确;
答案选D。
2.C
【详解】A.1.4g乙烯、丙烯中含有0.1molCH2,即含有0.1molC,选项A错误;
B.淀粉和纤维素的通式是(C6H10O5)n,16.2g混合物含有0.1molC6H10O5,故含有0.6molC,选项B错误;
C.1.5g丙烷的物质的量为0.05mol,一分子乙烷中含有7个共价键,故1.5g乙烷中含有7×0.05×6.02×1023 =7×3.01×1022,选项C正确;
D.标况下,四氯化碳是液态,不是气体,选项D错误;
答案选C。
3.C
【详解】物质的量不能用来表示宏观物质,只能用来表示微观粒子,如:分子、原子、离子、电子、质子、中子等,其单位是mol,故市售食盐不能用“物质的量”计量;
答案选C。
4.C
【详解】①Al2O3熔点高,可作耐火坩埚;
② Na2CO3碱性比较强,不能治疗胃酸过多,治疗胃酸过多应该用NaHCO3;
③KAl(SO4)2·12H2O溶于水电离产生的Al3+能水解生成Al(OH)3胶体,可以吸附水中的杂质,作净水剂 ;
④NaHCO3水溶液呈弱碱性,可用作食用碱;
⑤钠、钾、锶、钡等化合物在灼烧时呈现不同的颜色,可作烟花的焰色;
⑥Na2O不能产生氧气,Na2O2能和二氧化碳以及水反应生成氧气,可作供氧剂;
所以正确的是①③④⑤,故选C。
5.B
【详解】设质量都为mg,则有:,故选B。
6.A
【详解】A. 金属钠的密度大于煤油,并且不和煤油反应,可以保存在煤油中,故A正确;
B. 金属钠和盐溶液的反应实质是先和水反应,不会将金属从其盐中置换出来,故B错误;
C. 钠的熔点低,钠与水反应为放热反应,所以会熔成小球,故C正确;
D. 金属钠在空气中会被氧化为氧化钠,不会自燃,故D错误。
答案选A。
【点睛】钠是一种非常活泼的金属,密度比水小,钠与水反应现象是浮,熔,游,响,红,需注意钠与溶液反应时会优先和溶液中的水反应。
7.B
【详解】A.未明确标准状况,不能用公式V=22.4·n 计算气体的体积,A项错误;
B.在标准状况下,2molH2的体积=22.4L/mol×2mol=44.8L,B项正确;
C.因为CO和N2的摩尔质量相等,所以等质量的CO和N2的物质的量相等,但题目没有明确两气体所处的温度和压强是否相同,所以无法判断等质量的CO和N2的体积是否一定相等。C项错误;
D.未明确标准状况,不能用公式V=22.4·n 计算气体的体积,D项错误;答案选B。
【点睛】利用公式V= 22.4·n计算物质的体积时,一定要明确两点:一是物质的状态必须是“气体”,二是温度和压强必须是“标准状况(即00C和101kPa)”。
8.C
【详解】A.Cl2是黄绿色具有刺激性气味的有毒气体,A不正确;
B.将紫色石蕊试液逐滴滴入新制氯水中,先变红后褪色,可证明新制氯水具有酸性和强氧化性,B不正确;
C.在点燃条件下,纯净的氢气在氯气中剧烈燃烧,并发出苍白色火焰,C正确;
D.向田鼠洞里通入氯气杀灭田鼠,不仅利用了氯气有毒的性质,还利用氯气的密度比空气大,D不正确;
故选C。
9.C
【详解】A.在1 L 0.1 mol/L的碳酸钠溶液中,除了溶质外,还存在大量的水,所以氧原子总数远大于0.3,故A错误;
B.该溶液的体积未知,不能进行相关计算,故B错误;
C.每个中含有10个电子,32 g中所含电子的数目为,故C正确;
D.标准状况下,乙醇为液态,不能用进行计算,故D错误;
故选C。
10.C
【详解】用NaOH固体配制溶液,需要用托盘天平称量氢氧化钠,用烧杯溶解氢氧化钠固体,用容量瓶定容,A是托盘天平、B是烧杯、C是圆底烧瓶、D是容量瓶,不需要用圆底烧瓶,故选C。
11.C
【详解】A.Na2O2中含有两个Na+和一个,所以7.8gNa2O2中的有0.3mol离子,所以离子总数为0.3NA,故A错误;
B.pH=2的盐酸中总浓度为0.01mol/L,没有溶液体积,无法计算H+总数,故B错误;
C.2.3gNa为0.1mol,反应方程式为,Na失去1个电子,所以转移电子数为0.1mol,转移电子数为0.1NA,故C正确;
D.标准情况下才有5.6LH2S有,所含S-H键的数目为0.5NA,故D错误;
故答案选C。
12.C
【详解】A.KMnO4固体受潮,实际量取的KMnO4的质量偏小,所配溶液的浓度偏低,A错误;
B.溶解搅拌时有液体飞溅,少量KMnO4损失,移入容量瓶内KMnO4的量减少,所配溶液的浓度偏低,B错误;
C.定容时俯视容量瓶刻度线,导致所配溶液体积偏小,所配溶液的浓度偏高,C正确;
D.摇匀后液面下降,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,导致溶液的体积偏大,所配溶液的浓度偏低,D错误;
答案选C。
13.C
【详解】A.加入适量的溶液,引入钠离子,A错误;
B.加入足量的溶液,过滤,过量的碳酸根离子仍然在溶液中,B错误;
C.先加入过量的溶液生成碳酸钡沉淀,过滤,再向滤液中加入适量的稀硝酸除去过量的碳酸钾,C正确;
D.先加入过量的溶液,过滤,再向滤液中加入适量的稀盐酸,引入氯离子,D错误;
答案选C。
14.D
【详解】“采蒿蓼之属,晒干烧灰”,说明“石碱”成分来自植物烧成的灰中的成分,“以水淋汁”,该成分易溶于水,久则凝淀如石,亦去垢,能洗去油污,发面,能作为发酵剂,排除KOH、KAl(SO4)2,植物烧成的灰中的成分主要为碳酸盐,所以碳酸钾符合,同时符合久则凝淀如石,而KHCO3久则分解生成粉末状的碳酸钾,故D符合,故答案为D。
15.A
【详解】6mol/L的Mg(NO3)2溶液中NO3-的浓度为:6mol/L×2=12 mol/L,
将a mL稀释至b mL,稀释过程中NO3-的物质的量不变,则稀释后溶液中NO3-的物质的量浓度为: =mol/L,A项正确;
答案选A。
【点睛】掌握稀释前后溶质的物质的量保持不变是解题的突破口,要特别注意粒子之间的关系。
16.(1) ②④③①⑤ ⑤①③④② ②④①③⑤
(2)4:3
(3) 16.8g/mol 80%
(4)
【详解】(1)同温同压下,气体体积比=物质的量之比,结合可知,体积和摩尔质量成反比,①的摩尔质量为44g·mol-1,②的摩尔质量为2g·mol-1,③的摩尔质量为32g·mol-1,④的摩尔质量为16g·mol-1,⑤的摩尔质量为64g·mol-1,故体积由大到小的顺序是②④③①⑤;
根据阿伏加德罗推论,相同条件下,气体密度之比=摩尔质量之比,故密度由大到小顺序是⑤①③④②;
设质量为mg,则①原子的物质的量是,②原子物质的量为m mol,③原子的物质的量,④原子物质的量为,⑤原子物质的量为,因此原子数由大到小的顺序是②④①③⑤;
(2)含相同数目的H原子,则n(NH3)×3=n(CH4)×4,因此有n(NH3):n(CH4)=4:3;
(3)平均摩尔质量=22.4×ρ标=22.4×0.75g·mol-1=16.8g·mol-1,根据平均摩尔质量定义,n(NH3)×17+n(CH4)×16/[n(NH3)+n(CH4]=16.8,n(NH3):n(CH4)=4:1,氨气的体积分数为×100%=80%;
(4)n(Al3+)=mol,n()=mol=mol,VmL溶液中c()=mol·L-1,取出的mL溶液中c()=mol·L-1,稀释过程中n()不变,mol·L-1×mL = c’()×VmL,则c’()= 。
17. 摩尔或mol L/mol(或Lmol-1)
【分析】根据物质的量与气体摩尔体积的概念及定义作答。
【详解】物质的量是一个物理量,单位为摩尔或mol,简称摩;气体摩尔体积是指单位物质的量的气体所占的体积,常用单位为L/mol(或Lmol-1),故答案为摩尔或mol;L/mol(或Lmol-1)。
18.(1)Na2O2
(2)1000 mL容量瓶、胶头滴管
(3) C 2Na+2H2O+FeSO4=Fe(OH)2↓+Na2SO4+H2↑
(4) AB或AC或ACB B中溶液变浑浊或C中固体变蓝或C中固体变蓝,B中溶液变浑浊
【解析】(1)
钠元素可形成Na2O、Na2O2两种氧化物,其中Na2O2能够与人呼吸产生的CO2、H2O发生反应产生O2,因此可帮助人呼吸,因此钠的氧化物中,能用于呼吸面具和潜水艇中作供氧剂的是Na2O2;
(2)
精选种子有利于提高农作物的产量。某农场工作人员配制1 L一定物质的量浓度的NaCl溶液进行选种,所需玻璃仪器有烧杯、玻璃棒、量筒、1000 mL容量瓶、胶头滴管;
(3)
①A.由于钠性质活泼,容易与水及空气中的氧气发生化学反应,所以剩余的钠应放回原试剂瓶中,A正确;
B.Na与H2O发生反应:2Na+2H2O=2NaOH+H2↑,该反应是放热反应,放出是热使熔点低的钠熔化为小球,小球在煤油和FeSO4溶液界面处上下跳动,最终完全溶解,反应放出氢气,因此看到有气泡生成,B正确;
C.该反应中有氢气生成,所以大试管内气体的压强增大,压强大于外界大气压,导致大试管内的溶液下降,把试管内的溶液压入长颈漏斗中,使长颈漏斗中液面逐渐上升,C错误;
故合理选项是C;
②将Na放入FeSO4溶液中,首先Na与H2O反应产生NaOH、H2,反应方程式为:2Na+2H2O=2NaOH+H2↑,然后是NaOH与FeSO4发生复分解反应产生Fe(OH)2沉淀和Na2SO4,反应方程式为:2NaOH+FeSO4=Fe(OH)2↓+Na2SO4,将两个方程式叠加,可得钠与FeSO4溶液反应的总化学方程式为:2Na+2H2O+FeSO4=Fe(OH)2↓+Na2SO4+H2↑;
(4)
NaHCO3不稳定,受热分解产生Na2CO3、H2O、CO2,CO2与澄清石灰水作用产生CaCO3沉淀,使石灰水变浑浊;H2O能够使无水CuSO4由白色粉末变为CuSO4·5H2O蓝色晶体,而Na2CO3稳定,受热不分解,因此检验某干燥纯碱样品中是否混有NaHCO3,可以选择装置A、B检验,实验现象是:B中溶液变浑浊;或使用装置A、C进行检验,现象是C中固体变蓝;或使用A、C、B进行检验,实验现象是C中固体变蓝,B中溶液变浑浊。
19. 12 mol/L 62.5 250mL容量瓶、胶头滴管 abdcfe ACDE
【详解】(1)质量分数为36.5%,密度为1.20 g/cm3的浓盐酸的物质的量浓度c= mol/L=12 mol/L,答案:12 mol/L;
(2)配制230 mL3.0 mol·L-1的盐酸,应选择250mL的容量瓶,设需要浓盐酸的体积为V,稀释前后溶质HCl的物质的量不变,则V×12 mol/L=250 mL ×3.0 mol·L-1,解得V=62.5mL,答案:62.5;
(3)配制一定物质的量浓度溶液步骤为计算、称量、溶解、转移、洗涤、定容、摇匀、装瓶贴签等,用到的玻璃仪器有250mL容量瓶、量筒、胶头滴管、烧杯、玻璃棒,答案:250mL容量瓶、胶头滴管;
(4)配制一定物质的量浓度溶液步骤为计算、称量、溶解、转移、洗涤、定容、摇匀、装瓶贴签等,所以正确的操作步骤为abdcfe,答案:abdcfe;
(5)A.量取浓盐酸时仰视读数,浓盐酸体积偏大,溶质HCl物质的量偏大,根据c=,配制的溶液浓度偏高,A符合题意;
B.定容时需要加入蒸馏水,所以将烧杯中溶液转移到容量瓶之前,容量瓶洗净后未经干燥处理,对溶液浓度无影响,B不符合题意;
C.未冷却至室温就转移定容,冷却后溶液体积偏小,根据c=,配制的溶液浓度偏高,C符合题意;
D.将洗涤量筒的洗涤液转移到容量瓶中,溶质HCl物质的量偏大,根据c=,配制的溶液浓度偏高,D符合题意;
E.定容时俯视刻度线,溶液体积偏小,根据c=,配制的溶液浓度偏高,E符合题意;
F.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线,导致溶液体积偏大,根据c=,配制的溶液浓度偏低,F不符合题意;
答案选ACDE。
【点睛】当所配制溶液体积与所选容量瓶体积不同时,应按所选容量瓶的体积计算。
20.15g
【详解】碳酸钙与盐酸反应的方程式为CaCO3 + 2HCl= CaCl2+H2O+CO2,生成二氧化碳的物质的量n(CO2)=n(CaCO3)==0.15mol,碳酸钙的质量为:0.15mol100g/mol=15g。
21. 0.5mol 5.6L 3.01×1023
【详解】根据反应方程式进行计算如下:解得:V(Cl2)=5.6L,n(HCl)=0.5mol, n(e-)=0.5mol,故N(e-)=n(e-)NA=0.5mol×6.02×1023mol-1=3.01×1023,故答案为:0.5mol;5.6L;3.01×1023。
