第1章第2节元素周期律和元素周期表同步练习 (含答案)2022-2023学年下学期高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章第2节元素周期律和元素周期表同步练习 (含答案)2022-2023学年下学期高一化学鲁科版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 497.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 18:01:18 | ||
图片预览



文档简介
第1章第2节元素周期律和元素周期表同步练习
单选题
1. 下列关于元素周期表的说法中,错误的是 ( )
A. 元素周期表是元素按原子序数大小排列而成的
B. 元素原子的电子层数等于其所在周期的周期序数
C. 层电子数为偶数的所有主族元素的族序数与其层电子数相等
D. 元素周期表是元素周期律的具体表现形式
2. 与元素的最外层电子数无关的是( )
A. 元素在周期表中的排列顺序 B. 主族元素的化学性质
C. 主族元素在周期表中处于哪个族 D. 主族元素的化合价
3. 下列说法中正确的是( )
A. 元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化
B. 元素的最高正化合价与元素原子核外电子排布有关
C. 从,,元素的最高化合价均呈现从价价的变化
D. 电子层数相同的原子核外电子排布,其最外层电子数均从个到个呈现周期性变化
4. 下列对元素周期律和元素周期表的认识正确的是( )
A. 元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化
B. 核外电子排布的周期性变化是元素性质周期性变化的本质
C. 元素周期表中可以把元素分成、、、四个区
D. 元素周期表中最外层电子数的元素一定是金属元素
5. 某元素离子的结构示意图为。下列关于该元素或离子的说法中,正确的是
A. 元素符号是 B. 该元素在周期表中的位置是第三周期、族
C. 在化学反应中易失电子 D. 微粒半径小于
6. 、、、是原子半径依次增大的四种短周期主族元素。已知时,、形成的化合物的水溶液的,的电子层数与最外层电子数相等。下列说法错误的是。( )
A. 、、一定位于同一周期
B. 与形成的化合物中各原子不一定都达到电子稳定结构
C. 、的最高价氧化物对应的水化物之间一定能相互反应
D. 与形成的化合物的稳定性一定强于与形成的化合物的稳定性
7. 短周期元素、、、在周期表中的位置如下表所示,其中元素的单质是制备漂白液的重要原料。下列结论正确的是( )
A. 简单氢化物沸点:
B. 含有非极性共价键
C. 最高价氧化物对应水化物的酸性:
D. 单核离子的半径:
8. 元素周期表隐含着许多信息和规律。以下所涉及的元素均为中学化学中常见的短周期元素,其原子半径及主要化合价列表如下,其中用于呼吸面具或潜水艇中作为氧气来源。
元素代号
原子半径
主要化合价 、、
下列说法正确的是( )
A. 、的最高价氧化物对应水化物的酸性
B. 、、的单质失去电子能力最强的是
C. 与两种元素形成的是离子化合物
D. 、、都在第周期
9. 下表为元素周期表的一部分,其中、、、为短周期元素,的单质常温下为黄绿色气体.下列说法不正确的是( )
A. 、的单质均存在同素异形体
B. 、、的简单氢化物的沸点依次递增
C. 的单质可用于制造半导体材料
D. 工业上电解溶液制可使用阴离子交换膜
10. 元素、、在周期表中的相对位置如图所示:已知元素原子的外围电子排布为,则下列说法正确的是( )
A. 元素原子的价层电子排布为
B. 元素在周期表的第二周期第Ⅵ族
C. 元素有最高正价
D. 元素原子的核外电子排布式为
11. 预计于年发射的中国空间站望远镜运行后将成为太空中最大的望远镜。下列有关叙述错误的是( )
A. 主镜材料为密度小,性能好的金属铍,铍元素在元素周期表中位于第二周期Ⅱ族
B. 望远镜需要避免太阳辐射,制作遮阳帆的聚酰亚胺薄膜属于有机高分子材料
C. 望远镜需要超低温环境,主动冷却器用氦制冷,氦的分子间作用力很弱,沸点极低
D. 望远镜工作的推进剂为和,本身的颜色会随温度升高变为红棕色
12. 铯是制造光电管的主要材料,铯元素的部分信息如图所示。下列关于绝的说法中,不正确的是( )
A. 原子序数为 B. 属于Ⅰ族元素 C. 金属性比钠弱 D. 相对原子质量是
13. 五种短周期元素、、、、的原子序数与其一种常见化合价的关系如图所示,下列关系不正确的是 ( )
A. 元素可能为锂 B. 原子半径大小:
C. 中各原子均达到电子稳定结构 D. 元素的简单气态氢化物的稳定性:
已知,,,,,六种元素在元素周期表中的位置如图,请完成问题。
14. 下列说法正确的是( )
A. 离子半径:
B. 最高价氧化物对应的水化物的碱性:
C. 元素对应的氢化物熔沸点高是因为含有很强的共价键
D. 形成的单质属于共价晶体,其熔点高,硬度大
15. 下列说法不正确的是( )
A. 元素的电负性: B. 元素的第一电离能:
C. 元素原子最高能级的不同轨道都有电子 D. 元素原子最外层只有一种自旋方向的电子
二、填空题
16. 俄国化学家门捷列夫在研究周期表时预言了“类硅”元素锗和“类铝”元素镓等种元素。一种提纯二氧化锗粗品主要含、的工艺如下:
已知:与碱反应生成;与碱反应生成;
极易发生水解反应生成;
位于同主族的下一周期,在周期表中的位置是___________。
“氧化”过程是在碱性条件下将氧化为,则还原产物是 ___________填化学式
工业上与蒸馏操作相关的设备有___________
A. 分馏塔 离心萃取机 冷凝塔 加压过滤机
高纯二氧化锗的含量常采用碘酸钾法进行测定。步骤如下:
称取一定质量的高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成
加入次亚磷酸钠溶液还原为
用的碘酸钾溶液滴入上述溶液中,并先后发生如下反应:;已知以下,次亚磷酸钠与和均不反应。
为准确计算样品中二氧化锗的质量分数,应选用___________作指示剂,当出现___________的实验现象时可证明与已完全反应。
17. 现有短周期主族元素、、、、、,原子最外层电子数是电子层数的倍,是金属元素,与能形成、型化合物,元素形成的氧化物具有两性,是一种新型高效自来水消毒杀菌剂,五种元素的原子半径与原子序数的关系如图所示,按要求回答下列问题:
在元素周期表中的位置是_______;的离子结构示意图为_______.
的电子式为_______,属于_______化合物离子或共价,写出该物质与水反应的离子方程式_______。
、、、简单离子半径由大到小的顺序为_______用离子符号表示。
最高价氧化物对应水化物与元素氧化物反应的化学方程式为_______
下列说法正确且能证明元素金属性大于的是_______填标号。
A.元素单质的熔点比元素单质的熔点低
B.元素的单质能置换出溶液中元素的单质
C.、最高价氧化物对应水化物的碱性:
D. 等物质的量的、元素单质分别与酸反应失去电子数目:
三、实验题
18. 镓及其化合物应用广泛,常用于半导体、合金材料等工业。回答下列问题:
元素与为同主族元素,的原子序数为______________,元素在元素周期表中的位置是___________。
的熔点为,且熔融状态不导电,据此判断,该化合物是___________________填“共价化合物”或“离子化合物”。
已知氢氧化镓难溶于水。如下为氧化镓转化为氢氧化镓的一种方案:将氧化镓溶于稀硫酸,然后加入过量的氨水,即得到氢氧化镓沉淀,过滤、洗涤、干燥即可。请依次写出上述方案涉及的离子方程式________
______________________________________、________________________________________________。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着技术的发展,商用进入快车道。某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
仪器中的试剂是_________________;加热前需先通入一段时间的,原因是 ______________________;装置的作用是_______________________________________________。
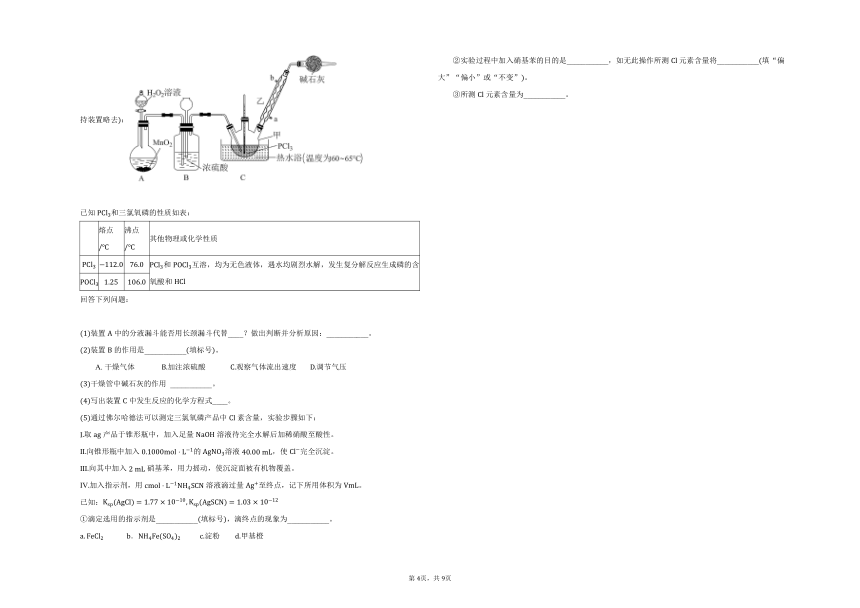
19. 三氯氧磷是一种化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用和为原料可制备三氯氧磷,其制备装置如图所示夹持装置略去:
已知和三氯氧磷的性质如表:
熔点 沸点 其他物理或化学性质
和互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和
回答下列问题:
装置中的分液漏斗能否用长颈漏斗代替____?做出判断并分析原因:___________。
装置的作用是___________填标号。
A. 干燥气体 加注浓硫酸 观察气体流出速度 调节气压
干燥管中碱石灰的作用 ___________。
写出装置中发生反应的化学方程式____。
通过佛尔哈德法可以测定三氯氧磷产品中素含量,实验步骤如下:
Ⅰ取产品于锥形瓶中,加入足量溶液待完全水解后加稀硝酸至酸性。
Ⅱ向锥形瓶中加入的溶液,使完全沉淀。
Ⅲ向其中加入硝基苯,用力摇动,使沉淀面被有机物覆盖。
Ⅳ加入指示剂,用溶液滴过量至终点,记下所用体积为。
已知:
滴定选用的指示剂是___________填标号,滴终点的现象为___________。
. 淀粉 甲基橙
实验过程中加入硝基苯的目的是___________,如无此操作所测元素含量将___________填“偏大”“偏小”或“不变”。
所测元素含量为___________。
答案和解析
1.【答案】
【解析】
【分析】
本题考查元素周期表及应用,为高频考点,把握元素的性质及原子序数的变化、原子结构与位置的关系为解答的关键。
【解答】
元素周期表是元素按原子序数大小排列而成的,把电子层数相同的放在同一行中,称为周期,电子层数等于其所在周期的周期序数,故 A、B正确;
C.层不为最外层时排个电子,也是偶数,此时主族元素所在族的序数与该元素原子的层电子数不相等,故C错误;
D. 随着原子序数的增加,元素原子的最外层电子排布、原子半径、元素的化合价等呈周期性变化,故D正确。
故选C。
2.【答案】
【解析】略
3.【答案】
【解析】
【分析】
本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素的性质及元素周期律为解答的关键,注意周期性的理解,题目难度不大。
【解答】
A.元素的性质呈周期性变化的根本原因是核外电子排布的周期性变化,元素性质体现在原子半径、元素主要化合价、金属性与非金属等,核外电子排布属于结构方面,故A错误;
B.元素的最高正化合价等于元素原子的最外层电子数、除外,元素的最高正化合价与元素原子核外电子排布有关,故B正确;
C.第二周期、没有正价,故C错误;
D.第一周期电子层数相同的原子、的核外电子排布,其最外层电子数分别是和,故D错误。
故选B。
4.【答案】
【解析】解:元素周期律的实质是随着原子序数的递增,元素原子最外层电子排布呈周期性的变化,故A错误;
B.元素周期律的实质是随着原子序数的递增,元素原子最外层电子排布呈周期性的变化,故B正确;
C.元素周期表中,按电子排布,可把周期表中元素分为、、、、五个区,除区外,区的名称来自构造原理最后填入电子的能级的符号,故C错误;
D.元素周期表中最外层电子数的元素可能为,是非金属元素,故D错误;
故选:。
本题考查原子结构与元素周期律,为高频考点,把握元素周期律的实质、元素在周期表的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.
5.【答案】
【解析】【详解】
A.该元素质子数为,则元素符号是,故A错误;
B.该元素为钠,其核电荷数为,核外电子排布是、、,则该元素在周期表中的位置是第三周期、族,故B正确;
C.元素离子的结构示意图为,最外层是个电子,稳定状态,在化学反应中不易失电子,也不易得到电子,故C错误;
D.该微粒为钠离子,根据同电子层结构核多径小,则离子半径大于,故D错误。
综上所述,答案为。
6.【答案】
【解析】由题意可知,、形成的化合物是强酸,则是,是;的电子层数与最外层电子数相等,且原子半径最大,所以是,因此可能是、、。根据以上分析可知,、、一定位于同一周期,即第三周期,项正确;与形成的化合物中各原子不一定都达到电子稳定结构,如等,项正确;如果是,硅酸是弱酸,不能溶解,项错误;不论是、还是,其非金属性均弱于氯元素,所以与形成的化合物的稳定性一定强于与形成的化合物的稳定性,项正确。
7.【答案】
【解析】
【分析】
本题考查元素周期表和元素周期律,掌握元素性质周期性变化的规律和常见化学物质的用途是解题的关键,难度一般。
【解答】
元素的单质是制备漂白液的重要原料,故为元素,根据图中信息可知,为元素;为元素;为元素;
A.常温常压下为液态,为气态,所以沸点:,与组成和结构相似,但中含有氢键,所以沸点:,故A错误;
B.分子含有键,为非极性共价键,故B正确;
C.非金属性:,故最高价氧化物对应水化物的酸性:,故C错误;
D.与核外电子层结构相同,的核电荷数比小,故离子半径:,故D错误。
故选B。
8.【答案】
【解析】
【分析】
本题考查原子结构和元素周期律,侧重考查分析判断能力,把握元素周期律、元素周期表结构及物质结构是解本题关键,知道非金属性强弱、金属性强弱判断方法,题目难度不大。
【解答】
主族元素其最高正化合价与其族序数相等、除外,最低化合价族序数,同一主族元素原子半径随着原子序数增大而增大,同一周期元素原子半径随着原子序数增大而减小,用于呼吸面具或潜水艇中作为氧气来源,为过氧化钠,则为、为元素,根据表中数据知,原子半径最小且位于第族,为元素;为元素、为元素、为元素、为元素。
A.元素的非金属性越强,其最高价氧化物的水合物酸性越强,非金属性,则其最高价氧化物的水合物酸性:,故A正确;
B.、、的单质失电子能力与其金属性成正比,金属性越强,其单质失电子能力越强,金属性,则金属单质失电子能力最强的是即元素,故B错误;
C.、形成的化合物是或,或中只含共价键,为共价化合物,故C错误;
D.、、分别是、、元素,位于第周期、位于第周期、位于第周期,故D错误。
故选A。
9.【答案】
【解析】
【分析】
本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大。
【解答】
的单质常温下为黄绿色气体,则为元素,由元素在周期表中的位置可知,为元素,为元素,为元素,为元素,为元素,据此分析解答;
A.对应的同素异形体有红磷、白磷等,对应的同素异形体有氧气、臭氧等,故A正确;
B.可以形成分子间氢键导致沸点升高,、的相对分子质量增大,沸点升高,故、、的简单氢化物的沸点依次递增,故B正确;
C.和位于同一主族,处于金属与非金属交界处,为重要的半导体材料,故C正确;
D.工业上电解饱和食盐水可制得,因需要将产生的和分开,只允许阳离子通过,故需使用阳离子交换膜,故D错误;
故选D。
10.【答案】
【解析】略
11.【答案】
【解析】略
12.【答案】
【解析】
【分析】本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、表中信息为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
【解答】由图中信息可知,原子序数为,故A正确;
B.一至五周期元素的种类数分别为、、、、,则,即位于第六周期第列,可知属于Ⅰ族,故B正确;
C.同主族从上到下金属性增强,则铯的金属性比钠强,故C错误;
D.图中元素名称下方的数值为元素的相对原子质量,则相对原子质量是,故D正确;
故选C。
13.【答案】
【解析】
【分析】
本题考查了元素的位置、结构和性质的关系,题目难度不大,能根据题意正确判断元素是解本题的关键,要注意把握对应单质和化合物的性质,侧重于考查学生对基础知识的应用能力。
【解答】
的化合价为价,属于第Ⅰ族元素;的化合价为价,属于第族元素;的化合价为价,为第族元素;的化合价为价,属于第族元素;的化合价为价,属于第族元素;已知原子序数:,、同主族,的原子序数小,所以为元素、为元素;的原子序数小于,则为或;的原子序数大于,属于第族,则为元素;原子序数大于,则为元素;
A.由分析可知,元素可能为锂,故A正确;
B.为元素,为元素,同周期原子半径从左到右依次减小,则原子半径大小:,故B正确;
C.为或,中原子不是电子稳定结构,故C错误;
D.元素的非金属性:,则元素气态氢化物的稳定性:,故D正确。
故选:。
14~15.【答案】D 、C
【解析】
【分析】
本题考查元素周期表与元素周期律,识记常见元素在周期表中位置,掌握元素周期律,注意氢键对物质性质的影响。
【解答】
由元素在周期表中位置,可知为元素、为元素、为元素、为元素,处于第四周期族为元素,处于第五周期第族;
A.、离子电子层结构相同,核电荷数越大,原子核对核外电子吸引越强,离子半径越小,故离子半径,故A错误;
B.元素的金属性,故最高价氧化物对应水化物的碱性:,故B错误;
C.分子之间形成氢键,导致其熔沸点比较高,故C错误;
D.锗的单质属于共价晶体,其熔点高,硬度大,故D正确;
【分析】
本题考查元素周期表与元素周期律,熟记常见元素在周期表中位置,注意电子构型对电离能的影响,掌握核外电子排布规律。
【解答】
由元素在周期表中位置,可知为元素、为元素、为元素、为元素,处于第四周期族为元素,处于第五周期第族;
A.同周期主族元素自左而右元素电负性增大,故电负性,故A正确;
B.同周期主族元素随原子序数增大,第一电离能呈增大趋势,其中Ⅱ族、Ⅴ族元素外围电子为全充满或半充满稳定结构,它们第一电离能高于同周期相邻元素,可知第一电离能,故B正确;
C.处于第四周期族,外围电子排布式为,最高能级为,只有个轨道填充电子,另一个为空轨道,故C错误;
D.处于第五周期第族,外围电子排布式为,最外层只填充个电子,最外层只有一种自旋方向的电子,故D正确;
16.【答案】第四周期第Ⅳ族
淀粉溶液 最后半滴碘酸钾溶液滴入后,溶液变蓝色,且半分钟内不褪色
【解析】
【分析】二氧化锗粗品加入氢氧化钠碱浸, 与碱反应生成 , 与碱反应生成 ;然后加入氯酸钠将 氧化为 ,加入盐酸蒸馏促进得到,水解生成得到 ,烘干得到高纯 ;
【小问详解】
位于同主族的下一周期,在周期表中的位置是第四周期第Ⅳ族;
【小问详解】
“氧化”过程是在碱性条件下将 氧化为 ,元素化合价升高,则氯酸钠中氯元素化合价降低发生还原反应得到氯化钠,故还原产物是;
【小问详解】
蒸馏然后冷凝得到馏分,故操作操作的设备为分馏塔和冷凝塔,故选AC;
【小问详解】
由反应可知,反应后会生成碘单质,碘单质能使淀粉溶液变蓝色,故应选用淀粉溶液作指示剂,当出现最后半滴碘酸钾溶液滴入后,溶液变蓝色,且半分钟内不褪色的实验现象时可证明 与 已完全反应。
17.【答案】 第一周期第 Ⅰ族
离子
【解析】
【分析】是金属元素,与能形成、型化合物,则为元素、为元素;原子最外层电子数是电子层数的倍,参考图中原子序数与原子半径关系,可确定为元素, 元素形成的氧化物具有两性,则为元素;是一种新型高效自来水消毒杀菌剂,则为元素。从而得出、、、、、分别为、、、、、。
【小问详解】
由分析可知,为元素,在元素周期表中的位置是第一周期第Ⅰ族;为元素,的离子结构示意图为。答案为:第一周期第Ⅰ族;;
【小问详解】
的化学式为,电子式为,属于离子化合物,与水反应,生成和,离子方程式为。答案为: ;离子;;
【小问详解】
、、、简单离子为、、、,前三者的电子层结构相同,后者多一个电子,、、的核电荷数依次增大,离子半径依次减小,则离子半径由大到小的顺序为。答案为:;
【小问详解】
最高价氧化物对应水化物为,元素的氧化物为,二者反应生成等,化学方程式为。答案为:;
【小问详解】
A.元素单质的熔点比元素单质的熔点低,只能说明晶体中金属键能比晶体小,不能说明二者金属性的强弱,不符合题意;
B.元素的单质加入溶液中,先与水反应,产物再与反应,不能置换出,不符合题意;
C.的金属性大于,则、的碱性关系为,C正确;
D.等物质的量的、元素单质分别与酸反应,失去电子数目比少,并不能表明金属性的强弱,不符合题意;
故选C。答案为:。
【点睛】、等活泼金属与盐、碱溶液反应时,先与水反应,反应产物再与盐或碱反应。
18.【答案】第周期Ⅲ族
共价化合物
浓氨水或浓 溶液
排尽装置中的空气,避免空气与镓反应,使产物不纯
吸收过量的氨气,防止污染环境
【解析】略
19.【答案】【小题】 不能 长颈漏斗不能调节滴液速度
【小题】
【小题】避免空气中的水进入装置导致产物水解
【小题】
【小题】 溶液变红色,且半分钟内不恢复原色 使生成的沉淀被硝基苯覆盖,防止转化为 偏小
【解析】 装置中的分液漏斗用于调节滴液速度,而长颈漏斗不能调节滴液速度,因此装置中的分液漏斗不能用长颈漏斗代替;
装置中所装试剂为浓硫酸,用于干燥氧气,另外通过观察气泡产生的快慢可了解氧气流出速率的大小,装置中的长颈漏斗可以调节装置内气体压强,使装置起到安全瓶的作用,则装置的作用为观察气体流出速度、调节压强、干燥氧气,因此答案选ACD;
遇水剧烈水解,因此干燥管中碱石灰的作用为:避免空气中的水进入装置导致产物水解;
装置中三氯化磷和氧气发生氧化还原反应生成,反应的化学方程式为:;
用溶液滴定过量的银离子至终点,当滴定达到终点时,稍过量一点,加入作指示剂,铁离子与硫氰酸根离子反应使溶液变红,若半分钟内不褪色,则可确定达到滴定终点;
加入少量硝基苯可将生成的氯化银沉淀与溶液隔开,如果不加硝基苯,根据,可知在水溶液中部分氯化银可以转化为,使得实验中生成的偏多,测定结果将偏小;
,则,所测元素含量为。
第1页,共1页
单选题
1. 下列关于元素周期表的说法中,错误的是 ( )
A. 元素周期表是元素按原子序数大小排列而成的
B. 元素原子的电子层数等于其所在周期的周期序数
C. 层电子数为偶数的所有主族元素的族序数与其层电子数相等
D. 元素周期表是元素周期律的具体表现形式
2. 与元素的最外层电子数无关的是( )
A. 元素在周期表中的排列顺序 B. 主族元素的化学性质
C. 主族元素在周期表中处于哪个族 D. 主族元素的化合价
3. 下列说法中正确的是( )
A. 元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化
B. 元素的最高正化合价与元素原子核外电子排布有关
C. 从,,元素的最高化合价均呈现从价价的变化
D. 电子层数相同的原子核外电子排布,其最外层电子数均从个到个呈现周期性变化
4. 下列对元素周期律和元素周期表的认识正确的是( )
A. 元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化
B. 核外电子排布的周期性变化是元素性质周期性变化的本质
C. 元素周期表中可以把元素分成、、、四个区
D. 元素周期表中最外层电子数的元素一定是金属元素
5. 某元素离子的结构示意图为。下列关于该元素或离子的说法中,正确的是
A. 元素符号是 B. 该元素在周期表中的位置是第三周期、族
C. 在化学反应中易失电子 D. 微粒半径小于
6. 、、、是原子半径依次增大的四种短周期主族元素。已知时,、形成的化合物的水溶液的,的电子层数与最外层电子数相等。下列说法错误的是。( )
A. 、、一定位于同一周期
B. 与形成的化合物中各原子不一定都达到电子稳定结构
C. 、的最高价氧化物对应的水化物之间一定能相互反应
D. 与形成的化合物的稳定性一定强于与形成的化合物的稳定性
7. 短周期元素、、、在周期表中的位置如下表所示,其中元素的单质是制备漂白液的重要原料。下列结论正确的是( )
A. 简单氢化物沸点:
B. 含有非极性共价键
C. 最高价氧化物对应水化物的酸性:
D. 单核离子的半径:
8. 元素周期表隐含着许多信息和规律。以下所涉及的元素均为中学化学中常见的短周期元素,其原子半径及主要化合价列表如下,其中用于呼吸面具或潜水艇中作为氧气来源。
元素代号
原子半径
主要化合价 、、
下列说法正确的是( )
A. 、的最高价氧化物对应水化物的酸性
B. 、、的单质失去电子能力最强的是
C. 与两种元素形成的是离子化合物
D. 、、都在第周期
9. 下表为元素周期表的一部分,其中、、、为短周期元素,的单质常温下为黄绿色气体.下列说法不正确的是( )
A. 、的单质均存在同素异形体
B. 、、的简单氢化物的沸点依次递增
C. 的单质可用于制造半导体材料
D. 工业上电解溶液制可使用阴离子交换膜
10. 元素、、在周期表中的相对位置如图所示:已知元素原子的外围电子排布为,则下列说法正确的是( )
A. 元素原子的价层电子排布为
B. 元素在周期表的第二周期第Ⅵ族
C. 元素有最高正价
D. 元素原子的核外电子排布式为
11. 预计于年发射的中国空间站望远镜运行后将成为太空中最大的望远镜。下列有关叙述错误的是( )
A. 主镜材料为密度小,性能好的金属铍,铍元素在元素周期表中位于第二周期Ⅱ族
B. 望远镜需要避免太阳辐射,制作遮阳帆的聚酰亚胺薄膜属于有机高分子材料
C. 望远镜需要超低温环境,主动冷却器用氦制冷,氦的分子间作用力很弱,沸点极低
D. 望远镜工作的推进剂为和,本身的颜色会随温度升高变为红棕色
12. 铯是制造光电管的主要材料,铯元素的部分信息如图所示。下列关于绝的说法中,不正确的是( )
A. 原子序数为 B. 属于Ⅰ族元素 C. 金属性比钠弱 D. 相对原子质量是
13. 五种短周期元素、、、、的原子序数与其一种常见化合价的关系如图所示,下列关系不正确的是 ( )
A. 元素可能为锂 B. 原子半径大小:
C. 中各原子均达到电子稳定结构 D. 元素的简单气态氢化物的稳定性:
已知,,,,,六种元素在元素周期表中的位置如图,请完成问题。
14. 下列说法正确的是( )
A. 离子半径:
B. 最高价氧化物对应的水化物的碱性:
C. 元素对应的氢化物熔沸点高是因为含有很强的共价键
D. 形成的单质属于共价晶体,其熔点高,硬度大
15. 下列说法不正确的是( )
A. 元素的电负性: B. 元素的第一电离能:
C. 元素原子最高能级的不同轨道都有电子 D. 元素原子最外层只有一种自旋方向的电子
二、填空题
16. 俄国化学家门捷列夫在研究周期表时预言了“类硅”元素锗和“类铝”元素镓等种元素。一种提纯二氧化锗粗品主要含、的工艺如下:
已知:与碱反应生成;与碱反应生成;
极易发生水解反应生成;
位于同主族的下一周期,在周期表中的位置是___________。
“氧化”过程是在碱性条件下将氧化为,则还原产物是 ___________填化学式
工业上与蒸馏操作相关的设备有___________
A. 分馏塔 离心萃取机 冷凝塔 加压过滤机
高纯二氧化锗的含量常采用碘酸钾法进行测定。步骤如下:
称取一定质量的高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成
加入次亚磷酸钠溶液还原为
用的碘酸钾溶液滴入上述溶液中,并先后发生如下反应:;已知以下,次亚磷酸钠与和均不反应。
为准确计算样品中二氧化锗的质量分数,应选用___________作指示剂,当出现___________的实验现象时可证明与已完全反应。
17. 现有短周期主族元素、、、、、,原子最外层电子数是电子层数的倍,是金属元素,与能形成、型化合物,元素形成的氧化物具有两性,是一种新型高效自来水消毒杀菌剂,五种元素的原子半径与原子序数的关系如图所示,按要求回答下列问题:
在元素周期表中的位置是_______;的离子结构示意图为_______.
的电子式为_______,属于_______化合物离子或共价,写出该物质与水反应的离子方程式_______。
、、、简单离子半径由大到小的顺序为_______用离子符号表示。
最高价氧化物对应水化物与元素氧化物反应的化学方程式为_______
下列说法正确且能证明元素金属性大于的是_______填标号。
A.元素单质的熔点比元素单质的熔点低
B.元素的单质能置换出溶液中元素的单质
C.、最高价氧化物对应水化物的碱性:
D. 等物质的量的、元素单质分别与酸反应失去电子数目:
三、实验题
18. 镓及其化合物应用广泛,常用于半导体、合金材料等工业。回答下列问题:
元素与为同主族元素,的原子序数为______________,元素在元素周期表中的位置是___________。
的熔点为,且熔融状态不导电,据此判断,该化合物是___________________填“共价化合物”或“离子化合物”。
已知氢氧化镓难溶于水。如下为氧化镓转化为氢氧化镓的一种方案:将氧化镓溶于稀硫酸,然后加入过量的氨水,即得到氢氧化镓沉淀,过滤、洗涤、干燥即可。请依次写出上述方案涉及的离子方程式________
______________________________________、________________________________________________。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着技术的发展,商用进入快车道。某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
仪器中的试剂是_________________;加热前需先通入一段时间的,原因是 ______________________;装置的作用是_______________________________________________。
19. 三氯氧磷是一种化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用和为原料可制备三氯氧磷,其制备装置如图所示夹持装置略去:
已知和三氯氧磷的性质如表:
熔点 沸点 其他物理或化学性质
和互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和
回答下列问题:
装置中的分液漏斗能否用长颈漏斗代替____?做出判断并分析原因:___________。
装置的作用是___________填标号。
A. 干燥气体 加注浓硫酸 观察气体流出速度 调节气压
干燥管中碱石灰的作用 ___________。
写出装置中发生反应的化学方程式____。
通过佛尔哈德法可以测定三氯氧磷产品中素含量,实验步骤如下:
Ⅰ取产品于锥形瓶中,加入足量溶液待完全水解后加稀硝酸至酸性。
Ⅱ向锥形瓶中加入的溶液,使完全沉淀。
Ⅲ向其中加入硝基苯,用力摇动,使沉淀面被有机物覆盖。
Ⅳ加入指示剂,用溶液滴过量至终点,记下所用体积为。
已知:
滴定选用的指示剂是___________填标号,滴终点的现象为___________。
. 淀粉 甲基橙
实验过程中加入硝基苯的目的是___________,如无此操作所测元素含量将___________填“偏大”“偏小”或“不变”。
所测元素含量为___________。
答案和解析
1.【答案】
【解析】
【分析】
本题考查元素周期表及应用,为高频考点,把握元素的性质及原子序数的变化、原子结构与位置的关系为解答的关键。
【解答】
元素周期表是元素按原子序数大小排列而成的,把电子层数相同的放在同一行中,称为周期,电子层数等于其所在周期的周期序数,故 A、B正确;
C.层不为最外层时排个电子,也是偶数,此时主族元素所在族的序数与该元素原子的层电子数不相等,故C错误;
D. 随着原子序数的增加,元素原子的最外层电子排布、原子半径、元素的化合价等呈周期性变化,故D正确。
故选C。
2.【答案】
【解析】略
3.【答案】
【解析】
【分析】
本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素的性质及元素周期律为解答的关键,注意周期性的理解,题目难度不大。
【解答】
A.元素的性质呈周期性变化的根本原因是核外电子排布的周期性变化,元素性质体现在原子半径、元素主要化合价、金属性与非金属等,核外电子排布属于结构方面,故A错误;
B.元素的最高正化合价等于元素原子的最外层电子数、除外,元素的最高正化合价与元素原子核外电子排布有关,故B正确;
C.第二周期、没有正价,故C错误;
D.第一周期电子层数相同的原子、的核外电子排布,其最外层电子数分别是和,故D错误。
故选B。
4.【答案】
【解析】解:元素周期律的实质是随着原子序数的递增,元素原子最外层电子排布呈周期性的变化,故A错误;
B.元素周期律的实质是随着原子序数的递增,元素原子最外层电子排布呈周期性的变化,故B正确;
C.元素周期表中,按电子排布,可把周期表中元素分为、、、、五个区,除区外,区的名称来自构造原理最后填入电子的能级的符号,故C错误;
D.元素周期表中最外层电子数的元素可能为,是非金属元素,故D错误;
故选:。
本题考查原子结构与元素周期律,为高频考点,把握元素周期律的实质、元素在周期表的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.
5.【答案】
【解析】【详解】
A.该元素质子数为,则元素符号是,故A错误;
B.该元素为钠,其核电荷数为,核外电子排布是、、,则该元素在周期表中的位置是第三周期、族,故B正确;
C.元素离子的结构示意图为,最外层是个电子,稳定状态,在化学反应中不易失电子,也不易得到电子,故C错误;
D.该微粒为钠离子,根据同电子层结构核多径小,则离子半径大于,故D错误。
综上所述,答案为。
6.【答案】
【解析】由题意可知,、形成的化合物是强酸,则是,是;的电子层数与最外层电子数相等,且原子半径最大,所以是,因此可能是、、。根据以上分析可知,、、一定位于同一周期,即第三周期,项正确;与形成的化合物中各原子不一定都达到电子稳定结构,如等,项正确;如果是,硅酸是弱酸,不能溶解,项错误;不论是、还是,其非金属性均弱于氯元素,所以与形成的化合物的稳定性一定强于与形成的化合物的稳定性,项正确。
7.【答案】
【解析】
【分析】
本题考查元素周期表和元素周期律,掌握元素性质周期性变化的规律和常见化学物质的用途是解题的关键,难度一般。
【解答】
元素的单质是制备漂白液的重要原料,故为元素,根据图中信息可知,为元素;为元素;为元素;
A.常温常压下为液态,为气态,所以沸点:,与组成和结构相似,但中含有氢键,所以沸点:,故A错误;
B.分子含有键,为非极性共价键,故B正确;
C.非金属性:,故最高价氧化物对应水化物的酸性:,故C错误;
D.与核外电子层结构相同,的核电荷数比小,故离子半径:,故D错误。
故选B。
8.【答案】
【解析】
【分析】
本题考查原子结构和元素周期律,侧重考查分析判断能力,把握元素周期律、元素周期表结构及物质结构是解本题关键,知道非金属性强弱、金属性强弱判断方法,题目难度不大。
【解答】
主族元素其最高正化合价与其族序数相等、除外,最低化合价族序数,同一主族元素原子半径随着原子序数增大而增大,同一周期元素原子半径随着原子序数增大而减小,用于呼吸面具或潜水艇中作为氧气来源,为过氧化钠,则为、为元素,根据表中数据知,原子半径最小且位于第族,为元素;为元素、为元素、为元素、为元素。
A.元素的非金属性越强,其最高价氧化物的水合物酸性越强,非金属性,则其最高价氧化物的水合物酸性:,故A正确;
B.、、的单质失电子能力与其金属性成正比,金属性越强,其单质失电子能力越强,金属性,则金属单质失电子能力最强的是即元素,故B错误;
C.、形成的化合物是或,或中只含共价键,为共价化合物,故C错误;
D.、、分别是、、元素,位于第周期、位于第周期、位于第周期,故D错误。
故选A。
9.【答案】
【解析】
【分析】
本题考查原子结构与元素周期律,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大。
【解答】
的单质常温下为黄绿色气体,则为元素,由元素在周期表中的位置可知,为元素,为元素,为元素,为元素,为元素,据此分析解答;
A.对应的同素异形体有红磷、白磷等,对应的同素异形体有氧气、臭氧等,故A正确;
B.可以形成分子间氢键导致沸点升高,、的相对分子质量增大,沸点升高,故、、的简单氢化物的沸点依次递增,故B正确;
C.和位于同一主族,处于金属与非金属交界处,为重要的半导体材料,故C正确;
D.工业上电解饱和食盐水可制得,因需要将产生的和分开,只允许阳离子通过,故需使用阳离子交换膜,故D错误;
故选D。
10.【答案】
【解析】略
11.【答案】
【解析】略
12.【答案】
【解析】
【分析】本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、表中信息为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
【解答】由图中信息可知,原子序数为,故A正确;
B.一至五周期元素的种类数分别为、、、、,则,即位于第六周期第列,可知属于Ⅰ族,故B正确;
C.同主族从上到下金属性增强,则铯的金属性比钠强,故C错误;
D.图中元素名称下方的数值为元素的相对原子质量,则相对原子质量是,故D正确;
故选C。
13.【答案】
【解析】
【分析】
本题考查了元素的位置、结构和性质的关系,题目难度不大,能根据题意正确判断元素是解本题的关键,要注意把握对应单质和化合物的性质,侧重于考查学生对基础知识的应用能力。
【解答】
的化合价为价,属于第Ⅰ族元素;的化合价为价,属于第族元素;的化合价为价,为第族元素;的化合价为价,属于第族元素;的化合价为价,属于第族元素;已知原子序数:,、同主族,的原子序数小,所以为元素、为元素;的原子序数小于,则为或;的原子序数大于,属于第族,则为元素;原子序数大于,则为元素;
A.由分析可知,元素可能为锂,故A正确;
B.为元素,为元素,同周期原子半径从左到右依次减小,则原子半径大小:,故B正确;
C.为或,中原子不是电子稳定结构,故C错误;
D.元素的非金属性:,则元素气态氢化物的稳定性:,故D正确。
故选:。
14~15.【答案】D 、C
【解析】
【分析】
本题考查元素周期表与元素周期律,识记常见元素在周期表中位置,掌握元素周期律,注意氢键对物质性质的影响。
【解答】
由元素在周期表中位置,可知为元素、为元素、为元素、为元素,处于第四周期族为元素,处于第五周期第族;
A.、离子电子层结构相同,核电荷数越大,原子核对核外电子吸引越强,离子半径越小,故离子半径,故A错误;
B.元素的金属性,故最高价氧化物对应水化物的碱性:,故B错误;
C.分子之间形成氢键,导致其熔沸点比较高,故C错误;
D.锗的单质属于共价晶体,其熔点高,硬度大,故D正确;
【分析】
本题考查元素周期表与元素周期律,熟记常见元素在周期表中位置,注意电子构型对电离能的影响,掌握核外电子排布规律。
【解答】
由元素在周期表中位置,可知为元素、为元素、为元素、为元素,处于第四周期族为元素,处于第五周期第族;
A.同周期主族元素自左而右元素电负性增大,故电负性,故A正确;
B.同周期主族元素随原子序数增大,第一电离能呈增大趋势,其中Ⅱ族、Ⅴ族元素外围电子为全充满或半充满稳定结构,它们第一电离能高于同周期相邻元素,可知第一电离能,故B正确;
C.处于第四周期族,外围电子排布式为,最高能级为,只有个轨道填充电子,另一个为空轨道,故C错误;
D.处于第五周期第族,外围电子排布式为,最外层只填充个电子,最外层只有一种自旋方向的电子,故D正确;
16.【答案】第四周期第Ⅳ族
淀粉溶液 最后半滴碘酸钾溶液滴入后,溶液变蓝色,且半分钟内不褪色
【解析】
【分析】二氧化锗粗品加入氢氧化钠碱浸, 与碱反应生成 , 与碱反应生成 ;然后加入氯酸钠将 氧化为 ,加入盐酸蒸馏促进得到,水解生成得到 ,烘干得到高纯 ;
【小问详解】
位于同主族的下一周期,在周期表中的位置是第四周期第Ⅳ族;
【小问详解】
“氧化”过程是在碱性条件下将 氧化为 ,元素化合价升高,则氯酸钠中氯元素化合价降低发生还原反应得到氯化钠,故还原产物是;
【小问详解】
蒸馏然后冷凝得到馏分,故操作操作的设备为分馏塔和冷凝塔,故选AC;
【小问详解】
由反应可知,反应后会生成碘单质,碘单质能使淀粉溶液变蓝色,故应选用淀粉溶液作指示剂,当出现最后半滴碘酸钾溶液滴入后,溶液变蓝色,且半分钟内不褪色的实验现象时可证明 与 已完全反应。
17.【答案】 第一周期第 Ⅰ族
离子
【解析】
【分析】是金属元素,与能形成、型化合物,则为元素、为元素;原子最外层电子数是电子层数的倍,参考图中原子序数与原子半径关系,可确定为元素, 元素形成的氧化物具有两性,则为元素;是一种新型高效自来水消毒杀菌剂,则为元素。从而得出、、、、、分别为、、、、、。
【小问详解】
由分析可知,为元素,在元素周期表中的位置是第一周期第Ⅰ族;为元素,的离子结构示意图为。答案为:第一周期第Ⅰ族;;
【小问详解】
的化学式为,电子式为,属于离子化合物,与水反应,生成和,离子方程式为。答案为: ;离子;;
【小问详解】
、、、简单离子为、、、,前三者的电子层结构相同,后者多一个电子,、、的核电荷数依次增大,离子半径依次减小,则离子半径由大到小的顺序为。答案为:;
【小问详解】
最高价氧化物对应水化物为,元素的氧化物为,二者反应生成等,化学方程式为。答案为:;
【小问详解】
A.元素单质的熔点比元素单质的熔点低,只能说明晶体中金属键能比晶体小,不能说明二者金属性的强弱,不符合题意;
B.元素的单质加入溶液中,先与水反应,产物再与反应,不能置换出,不符合题意;
C.的金属性大于,则、的碱性关系为,C正确;
D.等物质的量的、元素单质分别与酸反应,失去电子数目比少,并不能表明金属性的强弱,不符合题意;
故选C。答案为:。
【点睛】、等活泼金属与盐、碱溶液反应时,先与水反应,反应产物再与盐或碱反应。
18.【答案】第周期Ⅲ族
共价化合物
浓氨水或浓 溶液
排尽装置中的空气,避免空气与镓反应,使产物不纯
吸收过量的氨气,防止污染环境
【解析】略
19.【答案】【小题】 不能 长颈漏斗不能调节滴液速度
【小题】
【小题】避免空气中的水进入装置导致产物水解
【小题】
【小题】 溶液变红色,且半分钟内不恢复原色 使生成的沉淀被硝基苯覆盖,防止转化为 偏小
【解析】 装置中的分液漏斗用于调节滴液速度,而长颈漏斗不能调节滴液速度,因此装置中的分液漏斗不能用长颈漏斗代替;
装置中所装试剂为浓硫酸,用于干燥氧气,另外通过观察气泡产生的快慢可了解氧气流出速率的大小,装置中的长颈漏斗可以调节装置内气体压强,使装置起到安全瓶的作用,则装置的作用为观察气体流出速度、调节压强、干燥氧气,因此答案选ACD;
遇水剧烈水解,因此干燥管中碱石灰的作用为:避免空气中的水进入装置导致产物水解;
装置中三氯化磷和氧气发生氧化还原反应生成,反应的化学方程式为:;
用溶液滴定过量的银离子至终点,当滴定达到终点时,稍过量一点,加入作指示剂,铁离子与硫氰酸根离子反应使溶液变红,若半分钟内不褪色,则可确定达到滴定终点;
加入少量硝基苯可将生成的氯化银沉淀与溶液隔开,如果不加硝基苯,根据,可知在水溶液中部分氯化银可以转化为,使得实验中生成的偏多,测定结果将偏小;
,则,所测元素含量为。
第1页,共1页
