第1章第3节元素周期表的应用同步练习 (含答案)2022-2023学年下学期高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第1章第3节元素周期表的应用同步练习 (含答案)2022-2023学年下学期高一化学鲁科版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 83.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 18:01:27 | ||
图片预览



文档简介
第1章第3节元素周期表的应用同步练习
单选题
1. 如图为元素周期表中短周期的一部分,下列关于、、的说法正确的是( )
A. 电负性:
B. 离子半径:
C. 分子中各原子的最外层均满足电子稳定结构
D. 第一电离能:
2. 下列关于物质的递变规律的说法中,正确的是( )
A. 第Ⅰ族元素的金属性比第Ⅱ族元素的金属性强
B. 第Ⅵ族元素的氢化物中,稳定性最好的其沸点也最高
C. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D. 第三周期元素的离子半径从左到右逐渐减小
3. 下列各组元素的原子随着原子序数的递增,有关递变规律不正确的是 ( )
A. 原子半径: B. 金属性:
C. 最高正价: D. 非金属性:
4. 下列排列顺序不正确的是 ( )
沸点:氧化性:原子半径:还原性:
结合的能力:酸性:
A. B. C. D.
5. 下列说法正确的是( )
常温下白磷可自燃而氮气须在放电时才与氧气反应,则非金属性:
第族元素铯的两种同位素比多个质子
因为氧化性:稀,所以非金属性:
离子化合物中即可以含有极性共价键又可以含有非极性共价键
、、、的最高价氧化物对应水化物的酸性逐渐增强
从上到下,卤族元素的非金属性逐渐减弱,所以酸性
离子半径:
A. B. C. D.
6. 根据元素周期表和周期律分析下面的推断,其中错误的是
A. 原子半径: B. 酸性:高氯酸硫酸
C. 稳定性:硒化氢硫化氢 D. 碱性:氢氧化锶氢氧化钙
7. 下列叙述正确的是( )
A. 原子半径: B. 最高正化合价:
C. 沸点: D. 碱性:
8. 下列各项比较错误的是
A. 微粒半径:
B. 碱性强弱:
C. 稳定性:
D. 酸性强弱:
9. 下列有关物质性质的比较正确的是( )
第Ⅱ族元素的单质从上到下,失电子能力减弱
元素的最高正化合价在数值上等于它所在的族序数
同周期主族元素的原子半径越小,越难失去电子
元素的非金属性越强,它的气态氢化物水溶液的酸性越强
还原性:
酸性:.
A. B. C. D.
10. 下列结论错误的是
微粒半径:氢化物的稳定性:离子的还原性:氧化性: 酸性: 非金属性: 金属性:
A. 只有 B. C. D.
11. 利用原子结构及元素周期律表相关知识得到的以下结论中正确的是( )
A. 第族元素钫的两种核素:比少个质子
B. 第三周期元素的原子半径:
C. 第族元素从上到下,单质与氢气化合越来越难
D. 碱性:
12. 下列变化规律正确的是( )
A. 、、原子半径从大到小 B. 、、热稳定性从弱到强
C. 、、金属性从强到弱 D. 、、酸性从弱到强
13. 元素周期律为人类推测元素性质提供了依据。根据周期律推测下列结论正确的是( )
A. 原子半径大小: B. 酸性强弱:
C. 碱性强弱: D. 金属性:
14. 下列比较错误的是( )
A. 原子半径: B. 酸性强弱:
C. 氢化物的稳定性: D. 碱性强弱:
15. 下列各组元素性质递变规律不正确的是( )
A. 随原子序数增加,、、的最外层电子数依次增多
B. 、、元素最高正价依次增高
C. 、、原子半径依次增大
D. 、、的金属性依次增强
二、填空题
16. 短周期主族元素、、、、原子序数依次增大,的最高价含氧酸与其气态氢化物能发生化合反应生成,的原子半径是同周期中最小的,的焰色反应火焰呈黄色,的最外层电子数和电子层数相等,和为同一族。
元素在周期表中的位置为_______________。
的化学式为___________,化合物类型为_______________。
元素最高正价与最低负价代数和为____________________。
、、元素原子半径由大到小的顺序为______________________用元素符号回答。
、两种元素的最高价氧化物对应的水化物中,碱性最弱的是__________填化学式。
下列可作为比较和的非金属性强弱的依据是_______填序号。
A.氢化物的稳定性
B.单质与反应的难易程度
C.最高价氧化物的水化物酸性强弱
D. 将的单质通入的钠盐溶液观察是否有逸出
元素和元素形成的化合物是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为______________________________________________。
17. 下表是元素周期表的一部分。根据表中元素,用化学用语填空:
族 周期 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ
上表编号的元素中,属于金属元素的是_______,最高价含氧酸酸性最强的元素是______,非金属性最强的元素是_______,原子半径最小的元素是______,单质可制作芯片的元素是_______,元素的原子结构示意图是_______。
元素的单质的电子式为_______;元素的最简单氢化物的结构式为____________。
元素和元素的最简单氢化物的沸点由高到低的顺序是_____________________;
写出一个化学反应方程式,证明和的单质非金属性强弱____________________;
三、实验题
18. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ将钠、钾、镁、铝各 分别投入到足量的同浓度的盐酸中,试预测实验结果: ________与盐酸反应最剧烈;________与盐酸反应产生的气体最多。
向溶液中通入氯气出现黄色浑浊,可证明的非金属性比强,反应的离子方程式为 ___________________。
将溶液与溶液混合生成,从而验证碱性强于,继而可以验证的金属性强于氮,你认为此设计是否合理?并说明理由:______________________________。
Ⅱ利用如图装置可验证同主族元素非金属性的变化规律。
仪器的名称为________________,干燥管的作用为________________。
若要证明非金属性:,则中加浓盐酸,中加与浓盐酸常温下反应生成氯气,中加淀粉碘化钾混合溶液,观察到中溶液________________填现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________________溶液吸收尾气。
若要证明非金属性:,则在中加盐酸、中加、中加溶液,观察到中溶液____________________填现象,即可证明。但有的同学认为盐酸具有挥发性,可进入中干扰试验,应在两装置间添加装有________________溶液的洗气瓶除去。
19. 在学习元素周期表和元素周期律后,某化学兴趣小组在老师的指导下,设计实验以探究元素性质的递变规律。
Ⅰ为了验证卤族部分元素递变规律,设计如图装置进行实验。
溴元素在元素周期表中的位置________________________;
中通入充分反应后,将中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象是________________________________________。
根据上述实验操作步骤,为确保“非金属性:氯溴碘”的实验结论可靠,你认为做好本实验最关键因素是_______________________________。
下列性质的递变正确,且能作为卤族元素非金属性递变规律判断依据的是_________。填写序号
:、、的熔点逐渐升高 :、、的稳定性逐渐减弱
:、、的酸性逐渐减弱 :、、的还原性逐渐增强
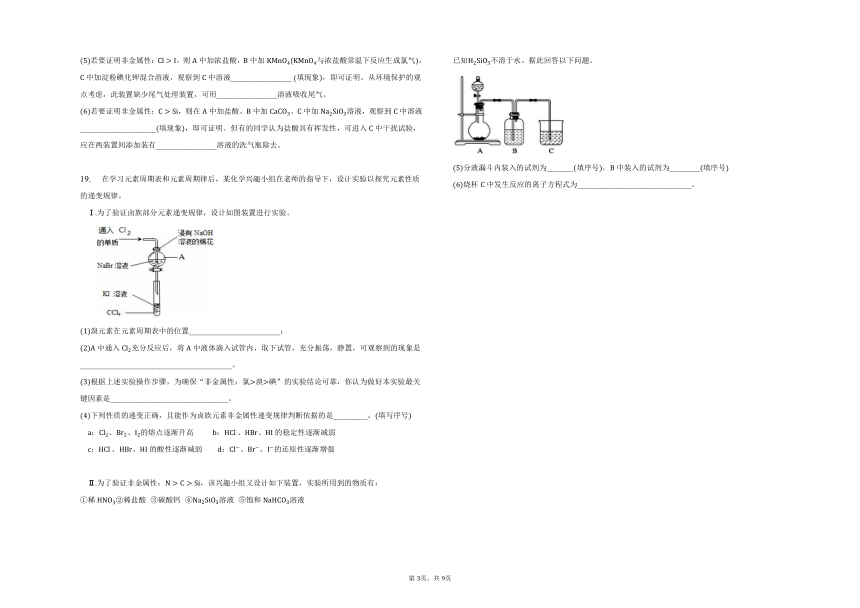
Ⅱ为了验证非金属性:,该兴趣小组又设计如下装置,实验所用到的物质有:
稀稀盐酸 碳酸钙 溶液 饱和溶液
已知不溶于水。据此回答以下问题。
分液漏斗内装入的试剂为_______填序号,中装入的试剂为________填序号
烧杯中发生反应的离子方程式为______________________________。
答案和解析
1.【答案】
【解析】由图示关系可推知:为氦元素,为氟元素,为氯元素,为硫元素。项,元素的电负性关系为,不正确;项,离子半径关系为,不正确;项,的电子式为:,正确;项,元素第一电离能大小关系为,不正确。
2.【答案】
【解析】
【分析】
本题综合考查元素周期表与周期律知识,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累。
【解答】
A.同周期第Ⅰ族元素金属性比第Ⅱ族元素强,但不同周期比较,如Ⅰ、Ⅱ,前者金属性较弱,故A错误;
B.第Ⅵ族元素的氢化物中稳定性最好的是,因分子间存在氢键,其沸点也最高,故B正确;
C.同周期非金属元素最高价氧化物的水化物酸性从左到右依次增强,但低价态氧化物的水化物酸性不一定如此,如的酸性比强,故C错误;
D.第三周期元素离子半径大小顺序为:,故D错误。
故选B。
3.【答案】
【解析】
【分析】
本题考查了元素周期律的相关知识,试题难度较易。
【解答】
A.同周期主族元素从左到右原子半径逐渐减小,故A正确;
B.同主族元素从上到下金属性逐渐增强,故B正确;
C.元素的非金属性很强,难以失去电子,没有正价,元素无最高正价,故C错误;
D.同周期元素从左到右非金属性逐渐增强,故D正确。
4.【答案】
【解析】
【分析】
本题主要考查了元素性质的递变规律,注意把握非金属元素的性质的变化规律,题目难度较小。
【解答】
和结构相似,分子间存在范德华力,相对分子质量越大的沸点高,但水中分子间存在氢键,沸点更高,所以沸点:,故正确;
根据反应,判断氧化性,故错误;
电子层数越多原子半径越大,则半径和大于,电子层数相同时,原子序数越大,半径越小,则半径,所以原子半径:,故正确;
元素的非金属性越强,对应阴离子的还原性越弱,非金属性:,则还原性:,故错误;
酸性越强,酸越易电离出氢离子,对应阴离子越难结合氢离子,酸性,则结合的能力:,故正确;
非金属越强,则其最高价氧化物的水化物的酸性越强,非金属性:,则酸性:,故错误;
所以不正确的有,故A正确。
故选A。
5.【答案】
【解析】
【分析】
本题考查了元素周期表和元素周期律,为高频考点,把握非金属性比较方法、化学键、离子半径比较方法为解答的关键,侧重分析与应用能力的考查,注意把握有关规律,题目难度不大。
【解答】
不能根据单质的稳定性来判断元素的非金属性,、都是第族元素,非金属性:,故错误;
同位素的质子数相同,第族元素铯的两种同位素与的质子数相同,中子数不同,故错误;
不能根据含氧酸的氧化性强弱来判断元素非金属性强弱,酸性:,所以非金属性:,故错误;
离子化合物中一定含有离子键,可能含有共价键,如中含有极性共价键,中含有非极性共价键,故正确;
元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,、、、的非金属性逐渐增强,则最高价氧化物对应水化物的酸性逐渐增强,故正确;
从上到下,卤族元素的非金属性逐渐减弱,最高价含氧酸酸性逐渐减弱无含氧酸,故错误;
核外电子排布相同的离子,核电荷数越大,离子半径越小,则离子半径:,故错误。
故选:。
6.【答案】
【解析】
【分析】
本题主要考查元素周期律的应用,涉及半径比较以及非金属性和金属性强弱判断,掌握元素周期律变化规则是解题关键,难度不大。
【解答】
A. 同周期原子从左到右半径逐渐减小,所以原子半径:,故A正确;
B. 非金属性,所以最高价氧化物对应水化物酸性为高氯酸硫酸,故B正确;
C. 同主族元素从上到下非金属性减弱,最简气态氢化物稳定性减弱,所以稳定性:硒化氢硫化氢,故C错误;
D. 同主族元素从上到下金属性增强,所以最高价氧化物对应水化物碱性增强,所以碱性:氢氧化锶氢氧化钙,故D正确;
故选C。
7.【答案】
【解析】
【分析】
本题考查元素周期律的应用,题目难度不大,明确元素周期律的内容为解答关键,注意掌握元素周期表结构及常见元素化合物性质,试题侧重考查学生的分析能力及知识迁移能力。
【解答】
A.同一周期从左到右,原子半径逐渐减小,电子层越多,原子半径越大,故原子半径:,故A正确;
B.没有正价,故B错误;
C.、、位于Ⅰ族,碱金属元素从上往下,单质的沸点降低,故C错误;
D.金属性:,则最高价氧化物对应水化物的碱性:,故D错误。
8.【答案】
【解析】
【分析】
本题考查元素的性质的递变规律,题目难度不大,注意元素周期律以及元素的性质与元素对应单质、化合物性质的关系。
【解答】
A.、、核外电子排布相同,原子序数越大,半径越小,因此微粒半径:,故A正确;
B.金属性越强,最高价氧化物对应水化物的碱性越强,金属性,最高价氧化物对应水化物的碱性强弱:,故B错误;
C.非金属性越强,气态氢化物越稳定,非金属性,气态氢化物稳定性,故C正确;
D.非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性,最高价氧化物对应水化物的酸性,故D正确。
9.【答案】
【解析】
【分析】
本题考查元素周期表与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
【解答】
同主族元素从上到下,元素的金属性增强,则第Ⅱ族元素的单质从上到下,失电子能力增强,故错误;
主族元素的最高正化合价在数值上等于它所在的主族序数,但、通常无正价,且过渡元素不符合此规律,故错误;
同周期主族元素从左向右原子半径减小、金属性减弱,则同周期主族元素的原子半径越小,越难失去电子,故正确;
非金属性越强,对应氢化物越稳定,但不能比较水溶液的酸性,如的非金属性最强,最稳定,酸为弱酸,故错误;
非金属性,对应阴离子的还原性为,故错误;
非金属性,对应最高价含氧酸的酸性为,故正确;故B正确。
故选B。
10.【答案】
【解析】
【分析】
本题考查原子结构与元素周期律的应用,题目难度中等,明确元素周期律内容为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及综合应用能力。
【解答】
含有个电子层,其离子半径最小,其它三种离子含有个电子层,核电荷数越大离子半径越小,则微粒半径:,故错误;
非金属性,则氢化物的稳定性:,故正确;
非金属性,则离子的还原性:,故错误;
非金属性,则单质的氧化性:,故正确;
非金属性,则最高价氧化物对应水化物的酸性:
碳酸的酸性大于,故正确;
同一主族从上到下非金属性逐渐减弱,则非金属性,同一周期从左向右非金属性逐渐增强,则非金属性:、,所以非金属性,故正确;
根据金属活动性顺序表可知,金属性:,故正确;
故选:。
11.【答案】
【解析】
【分析】
本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
【解析】
A.同种元素的不同核素,质子数相同,则比少个中子,质子数相同,故A错误;
B.同周期主族元素从左向右原子半径减小,则,故B错误;
C.同主族从上到下非金属性减弱,非金属性越强,越易与氢气化合,则第Ⅶ族元素从上到下,单质与氢气化合越来越难,故C正确;
D.同周期主族元素从左向右金属性减弱,金属性为,则碱性:,故D错误;
故选:。
12.【答案】
【解析】
【分析】
本题主要考查的是元素周期律的具体表现,意在考查学生的理解能力和知识应用能力,解题的关键是掌握元素金属性强弱变化的具体表现和元素非金属性强弱变化的具体表现。
【解答】
A.同周期元素原子半径随原子序数递增而减小,同主族元素原子半径随原子序数递增而增大,则原子半径:,故A错误;
B.元素的非金属性:,则氢化物的稳定性:,故B错误;
C.同周期元素,随着原子序数的增大,金属性逐渐减弱,同主族元素,随着原子序数的增大,金属性逐渐增强,则金属性:,故C错误;
D.非金属性:,元素的非金属性越强,元素最高价氧化物对应水化物的酸性越强,故H、、酸性从弱到强,故D正确。
13.【答案】
【解析】
【分析】
本题考查元素周期律,意在考查学生的知识应用能力,熟练掌握元素周期律是解本题关键,比较容易。
【解答】
A.同周期自左向右原子半径逐渐减小,则原子半径大小:,A错误;
B.非金属性越强,最高价含氧酸的酸性越强,则酸性强弱:,B错误;
C.同主族从上到下金属性逐渐增强,最高价氧化物的水化物的碱性越强,碱性强弱:,C正确;
D.同主族从上到下金属性逐渐增强,金属性:,D错误。
14.【答案】
【解析】略
15.【答案】
【解析】
【分析】
本题考查元素周期律,解答这类问题应明确元素性质的递变规律,试题难度不大。
【解答】
A.根据同周期元素性质的递变规律可知,随原子序数增加,、、的最外层电子数依次增多,故A正确;
B.根据同周期元素性质的递变规律可知、、元素最高正价依次增高,故B正确;
C.根据同周期元素性质的递变规律可知、、原子半径依次减小,故C错误;
D.根据同主族元素性质的递变规律可知、、的金属性依次增强,故D正确。
16.【答案】第二周期Ⅶ族分;
分 离子化合物分
分;
分;
分;
分;
分。
【解析】
【分析】
本题考查原子结构和元素周期律的综合应用,熟练掌握同一周期、同一主族元素性质递变规律是解题的关键,难度不大。
【解答】
因为的最高价含氧酸与其气态氢化物能发生化合反应生成,所以为氮元素,的焰色反应火焰呈黄色,所以为钠元素,根据原子序数递增可知为二周期,的原子半径是同周期中最小的,所以为氟元素,和为同一族,所以为氯元素,的最外层电子数和电子层数相等所以为铝原子,由此解答。
为氟元素在周期表中的位置为第二周期Ⅶ族,
故答案为:第二周期Ⅶ族;
为氮元素,的化学式为,化合物类型为离子化合物,
故答案为:;离子化合物;
为氯元素最高正价为,最低负价为,代数和为,
故答案为:;
一般的,电子层数多,原子半径大,电子层数相同时,原子序数越大,原子半径越小,所以三者原子半径由大到小的顺序为,
故答案为:;
元素的金属性越强,元素的最高价氧化物对应的水化物中,碱性越强,所以碱性最弱的是,
故答案为:;
元素无正价,氟气体和水剧烈反应,所以可以通过氢化物的稳定性单质与反应的难易程度判断和的非金属性强弱,
故答案为:;
化合物是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体即,该反应的化学方程式为,
故答案为:。
17.【答案】;;;;;
;
【解析】
【分析】
本题考查学生元素周期表的内容和元素周期律的综合知识,熟练掌握元素周期表的结构和元素周期律是解题的关键,难度不大。
【解答】
由元素在周期表中的位置可知,元素分别是、、、、、、、。
上表编号的元素中,属于金属元素的是;非金属性越强对最高价含氧酸的酸性越强,的非金属性最强,但没有最高价含氧酸,所以最高价含氧酸酸性最强的元素是;非金属性最强的元素是;同周期从左到右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,原子半径最小的元素是,单质可制作芯片的元素是,元素的原子结构示意图是;
故答案为:;;;;;;
元素的单质是,电子式为;元素的最简单氢化物为,结构式为;
故答案为:;;
元素和元素的最简单氢化物分别是、,分子间存在氢键,而分子间无氢键,所以沸点由高到低的顺序是;
根据非金属性强的元素的单质能够解答此类题目的关键在于非金属性弱的元素置换出来,反应:证明比的单质非金属性强;
故答案为:。
18.【答案】钾;铝;;不合理;用碱性强弱比较金属性强弱时,一定要用元素的最高价氧化物的水化物的碱性强弱比较,而不是氮元素的最高价氧化物的水化物;锥形瓶;防止倒吸;变蓝;;有白色沉淀生成;饱和
【解析】解:Ⅰ金属活泼性顺序为:钾钠镁铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成氢气需要得到电子,钾、钠都失去电子,镁失去电子,而铝失去电子,所以生成氢气最多的是金属铝,
故答案为:钾;铝;
氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:,
故答案为:;
将溶液与溶液混合生成,可以说明的碱性大于,但不能说明的金属性大于,因为要验证金属性的强弱,必须通过比较最高价氧化物所对应的水化物的碱性来进行比较,而不是氮元素的最高价氧化物的水化物,
故答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素的最高价氧化物的水化物的碱性强弱比较,而不是氮元素的最高价氧化物的水化物.
Ⅱ仪器为锥形瓶;球形干燥管能够防止倒吸,可以避免中液体进入锥形瓶中,
故答案为:锥形瓶;防止倒吸;
与浓盐酸常温下反应生成氯气,氯气能够将碘离子氧化成碘单质,碘单质遇到淀粉变成蓝色,氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气,
故答案为:变蓝;;
氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在和之间增加装有饱和溶液的洗气瓶,
故答案为:有白色沉淀生成;饱和.
本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法,明确除杂试剂的作用原则:除去杂质,不能引进新的杂质.
19.【答案】第四周期第族;
溶液分层,上层几乎无色,下层呈紫红色;
氯气通入少适量;
;
;;
。
【解析】
【分析】
本题主要考查的是元素性质递变规律的性质探究,意在考查学生的实验分析能力和知识应用能力,解题的关键是掌握元素非金属性强弱的具体表现和理解实验的原理。
【解答】
溴元素在元素周期表中的位置是第四周期第族;
氯气通入到溴化钠溶液中,发生反应,将中液体滴入到试管中,发生反应,碘易溶于四氯化碳溶液,四氯化碳与水互不相溶,故可观察到的现象是溶液分层,上层几乎无色,下层呈紫红色;
如果通入到中的氯气过量,那滴入到试管中的溶液含有氯气,氯气氧化性较强,发生反应,这将无法证明溴与碘的非金属性强弱关系,所以,做好本实验最关键因素是氯气通入少适量;
、 、的熔点逐渐升高,涉及的卤素的物理性质的变化情况,不能作为卤族元素非金属性递变规律的判断依据,故错误;
元素的非金属性越强,氢化物的稳定性越高,则卤素氢化物的稳定性变化情况可以作为卤族元素非金属性递变规律的判断依据,故正确;
元素的非金属性越强,元素最高价氧化物对应水化物的酸性越强,卤素的氢化物的酸性变化情况不能作为卤族元素非金属性递变规律的判断依据,故错误;
元素的非金属性越强,元素简单离子的还原性越弱,则卤素元素的简单离子的还原性变化情况可以作为卤族元素非金属性递变规律的判断依据,故正确;
由实验装置和药品可知,该实验通过元素最高价氧化物对应水化物的酸性探究元素的非金属性,则分液漏斗内装入的试剂为稀;中盛放的是碳酸钙,硝酸与碳酸钙反应生成二氧化碳,由于硝酸具有挥发性,反应生成的二氧化碳中含有挥发出来的硝酸,中装入的试剂为饱和溶液,用于除去挥发出来的;
烧杯中盛放的是溶液,反应的离子方程式为。
第1页,共1页
单选题
1. 如图为元素周期表中短周期的一部分,下列关于、、的说法正确的是( )
A. 电负性:
B. 离子半径:
C. 分子中各原子的最外层均满足电子稳定结构
D. 第一电离能:
2. 下列关于物质的递变规律的说法中,正确的是( )
A. 第Ⅰ族元素的金属性比第Ⅱ族元素的金属性强
B. 第Ⅵ族元素的氢化物中,稳定性最好的其沸点也最高
C. 同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D. 第三周期元素的离子半径从左到右逐渐减小
3. 下列各组元素的原子随着原子序数的递增,有关递变规律不正确的是 ( )
A. 原子半径: B. 金属性:
C. 最高正价: D. 非金属性:
4. 下列排列顺序不正确的是 ( )
沸点:氧化性:原子半径:还原性:
结合的能力:酸性:
A. B. C. D.
5. 下列说法正确的是( )
常温下白磷可自燃而氮气须在放电时才与氧气反应,则非金属性:
第族元素铯的两种同位素比多个质子
因为氧化性:稀,所以非金属性:
离子化合物中即可以含有极性共价键又可以含有非极性共价键
、、、的最高价氧化物对应水化物的酸性逐渐增强
从上到下,卤族元素的非金属性逐渐减弱,所以酸性
离子半径:
A. B. C. D.
6. 根据元素周期表和周期律分析下面的推断,其中错误的是
A. 原子半径: B. 酸性:高氯酸硫酸
C. 稳定性:硒化氢硫化氢 D. 碱性:氢氧化锶氢氧化钙
7. 下列叙述正确的是( )
A. 原子半径: B. 最高正化合价:
C. 沸点: D. 碱性:
8. 下列各项比较错误的是
A. 微粒半径:
B. 碱性强弱:
C. 稳定性:
D. 酸性强弱:
9. 下列有关物质性质的比较正确的是( )
第Ⅱ族元素的单质从上到下,失电子能力减弱
元素的最高正化合价在数值上等于它所在的族序数
同周期主族元素的原子半径越小,越难失去电子
元素的非金属性越强,它的气态氢化物水溶液的酸性越强
还原性:
酸性:.
A. B. C. D.
10. 下列结论错误的是
微粒半径:氢化物的稳定性:离子的还原性:氧化性: 酸性: 非金属性: 金属性:
A. 只有 B. C. D.
11. 利用原子结构及元素周期律表相关知识得到的以下结论中正确的是( )
A. 第族元素钫的两种核素:比少个质子
B. 第三周期元素的原子半径:
C. 第族元素从上到下,单质与氢气化合越来越难
D. 碱性:
12. 下列变化规律正确的是( )
A. 、、原子半径从大到小 B. 、、热稳定性从弱到强
C. 、、金属性从强到弱 D. 、、酸性从弱到强
13. 元素周期律为人类推测元素性质提供了依据。根据周期律推测下列结论正确的是( )
A. 原子半径大小: B. 酸性强弱:
C. 碱性强弱: D. 金属性:
14. 下列比较错误的是( )
A. 原子半径: B. 酸性强弱:
C. 氢化物的稳定性: D. 碱性强弱:
15. 下列各组元素性质递变规律不正确的是( )
A. 随原子序数增加,、、的最外层电子数依次增多
B. 、、元素最高正价依次增高
C. 、、原子半径依次增大
D. 、、的金属性依次增强
二、填空题
16. 短周期主族元素、、、、原子序数依次增大,的最高价含氧酸与其气态氢化物能发生化合反应生成,的原子半径是同周期中最小的,的焰色反应火焰呈黄色,的最外层电子数和电子层数相等,和为同一族。
元素在周期表中的位置为_______________。
的化学式为___________,化合物类型为_______________。
元素最高正价与最低负价代数和为____________________。
、、元素原子半径由大到小的顺序为______________________用元素符号回答。
、两种元素的最高价氧化物对应的水化物中,碱性最弱的是__________填化学式。
下列可作为比较和的非金属性强弱的依据是_______填序号。
A.氢化物的稳定性
B.单质与反应的难易程度
C.最高价氧化物的水化物酸性强弱
D. 将的单质通入的钠盐溶液观察是否有逸出
元素和元素形成的化合物是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为______________________________________________。
17. 下表是元素周期表的一部分。根据表中元素,用化学用语填空:
族 周期 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅶ
上表编号的元素中,属于金属元素的是_______,最高价含氧酸酸性最强的元素是______,非金属性最强的元素是_______,原子半径最小的元素是______,单质可制作芯片的元素是_______,元素的原子结构示意图是_______。
元素的单质的电子式为_______;元素的最简单氢化物的结构式为____________。
元素和元素的最简单氢化物的沸点由高到低的顺序是_____________________;
写出一个化学反应方程式,证明和的单质非金属性强弱____________________;
三、实验题
18. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ将钠、钾、镁、铝各 分别投入到足量的同浓度的盐酸中,试预测实验结果: ________与盐酸反应最剧烈;________与盐酸反应产生的气体最多。
向溶液中通入氯气出现黄色浑浊,可证明的非金属性比强,反应的离子方程式为 ___________________。
将溶液与溶液混合生成,从而验证碱性强于,继而可以验证的金属性强于氮,你认为此设计是否合理?并说明理由:______________________________。
Ⅱ利用如图装置可验证同主族元素非金属性的变化规律。
仪器的名称为________________,干燥管的作用为________________。
若要证明非金属性:,则中加浓盐酸,中加与浓盐酸常温下反应生成氯气,中加淀粉碘化钾混合溶液,观察到中溶液________________填现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________________溶液吸收尾气。
若要证明非金属性:,则在中加盐酸、中加、中加溶液,观察到中溶液____________________填现象,即可证明。但有的同学认为盐酸具有挥发性,可进入中干扰试验,应在两装置间添加装有________________溶液的洗气瓶除去。
19. 在学习元素周期表和元素周期律后,某化学兴趣小组在老师的指导下,设计实验以探究元素性质的递变规律。
Ⅰ为了验证卤族部分元素递变规律,设计如图装置进行实验。
溴元素在元素周期表中的位置________________________;
中通入充分反应后,将中液体滴入试管内,取下试管,充分振荡,静置,可观察到的现象是________________________________________。
根据上述实验操作步骤,为确保“非金属性:氯溴碘”的实验结论可靠,你认为做好本实验最关键因素是_______________________________。
下列性质的递变正确,且能作为卤族元素非金属性递变规律判断依据的是_________。填写序号
:、、的熔点逐渐升高 :、、的稳定性逐渐减弱
:、、的酸性逐渐减弱 :、、的还原性逐渐增强
Ⅱ为了验证非金属性:,该兴趣小组又设计如下装置,实验所用到的物质有:
稀稀盐酸 碳酸钙 溶液 饱和溶液
已知不溶于水。据此回答以下问题。
分液漏斗内装入的试剂为_______填序号,中装入的试剂为________填序号
烧杯中发生反应的离子方程式为______________________________。
答案和解析
1.【答案】
【解析】由图示关系可推知:为氦元素,为氟元素,为氯元素,为硫元素。项,元素的电负性关系为,不正确;项,离子半径关系为,不正确;项,的电子式为:,正确;项,元素第一电离能大小关系为,不正确。
2.【答案】
【解析】
【分析】
本题综合考查元素周期表与周期律知识,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累。
【解答】
A.同周期第Ⅰ族元素金属性比第Ⅱ族元素强,但不同周期比较,如Ⅰ、Ⅱ,前者金属性较弱,故A错误;
B.第Ⅵ族元素的氢化物中稳定性最好的是,因分子间存在氢键,其沸点也最高,故B正确;
C.同周期非金属元素最高价氧化物的水化物酸性从左到右依次增强,但低价态氧化物的水化物酸性不一定如此,如的酸性比强,故C错误;
D.第三周期元素离子半径大小顺序为:,故D错误。
故选B。
3.【答案】
【解析】
【分析】
本题考查了元素周期律的相关知识,试题难度较易。
【解答】
A.同周期主族元素从左到右原子半径逐渐减小,故A正确;
B.同主族元素从上到下金属性逐渐增强,故B正确;
C.元素的非金属性很强,难以失去电子,没有正价,元素无最高正价,故C错误;
D.同周期元素从左到右非金属性逐渐增强,故D正确。
4.【答案】
【解析】
【分析】
本题主要考查了元素性质的递变规律,注意把握非金属元素的性质的变化规律,题目难度较小。
【解答】
和结构相似,分子间存在范德华力,相对分子质量越大的沸点高,但水中分子间存在氢键,沸点更高,所以沸点:,故正确;
根据反应,判断氧化性,故错误;
电子层数越多原子半径越大,则半径和大于,电子层数相同时,原子序数越大,半径越小,则半径,所以原子半径:,故正确;
元素的非金属性越强,对应阴离子的还原性越弱,非金属性:,则还原性:,故错误;
酸性越强,酸越易电离出氢离子,对应阴离子越难结合氢离子,酸性,则结合的能力:,故正确;
非金属越强,则其最高价氧化物的水化物的酸性越强,非金属性:,则酸性:,故错误;
所以不正确的有,故A正确。
故选A。
5.【答案】
【解析】
【分析】
本题考查了元素周期表和元素周期律,为高频考点,把握非金属性比较方法、化学键、离子半径比较方法为解答的关键,侧重分析与应用能力的考查,注意把握有关规律,题目难度不大。
【解答】
不能根据单质的稳定性来判断元素的非金属性,、都是第族元素,非金属性:,故错误;
同位素的质子数相同,第族元素铯的两种同位素与的质子数相同,中子数不同,故错误;
不能根据含氧酸的氧化性强弱来判断元素非金属性强弱,酸性:,所以非金属性:,故错误;
离子化合物中一定含有离子键,可能含有共价键,如中含有极性共价键,中含有非极性共价键,故正确;
元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,、、、的非金属性逐渐增强,则最高价氧化物对应水化物的酸性逐渐增强,故正确;
从上到下,卤族元素的非金属性逐渐减弱,最高价含氧酸酸性逐渐减弱无含氧酸,故错误;
核外电子排布相同的离子,核电荷数越大,离子半径越小,则离子半径:,故错误。
故选:。
6.【答案】
【解析】
【分析】
本题主要考查元素周期律的应用,涉及半径比较以及非金属性和金属性强弱判断,掌握元素周期律变化规则是解题关键,难度不大。
【解答】
A. 同周期原子从左到右半径逐渐减小,所以原子半径:,故A正确;
B. 非金属性,所以最高价氧化物对应水化物酸性为高氯酸硫酸,故B正确;
C. 同主族元素从上到下非金属性减弱,最简气态氢化物稳定性减弱,所以稳定性:硒化氢硫化氢,故C错误;
D. 同主族元素从上到下金属性增强,所以最高价氧化物对应水化物碱性增强,所以碱性:氢氧化锶氢氧化钙,故D正确;
故选C。
7.【答案】
【解析】
【分析】
本题考查元素周期律的应用,题目难度不大,明确元素周期律的内容为解答关键,注意掌握元素周期表结构及常见元素化合物性质,试题侧重考查学生的分析能力及知识迁移能力。
【解答】
A.同一周期从左到右,原子半径逐渐减小,电子层越多,原子半径越大,故原子半径:,故A正确;
B.没有正价,故B错误;
C.、、位于Ⅰ族,碱金属元素从上往下,单质的沸点降低,故C错误;
D.金属性:,则最高价氧化物对应水化物的碱性:,故D错误。
8.【答案】
【解析】
【分析】
本题考查元素的性质的递变规律,题目难度不大,注意元素周期律以及元素的性质与元素对应单质、化合物性质的关系。
【解答】
A.、、核外电子排布相同,原子序数越大,半径越小,因此微粒半径:,故A正确;
B.金属性越强,最高价氧化物对应水化物的碱性越强,金属性,最高价氧化物对应水化物的碱性强弱:,故B错误;
C.非金属性越强,气态氢化物越稳定,非金属性,气态氢化物稳定性,故C正确;
D.非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性,最高价氧化物对应水化物的酸性,故D正确。
9.【答案】
【解析】
【分析】
本题考查元素周期表与元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
【解答】
同主族元素从上到下,元素的金属性增强,则第Ⅱ族元素的单质从上到下,失电子能力增强,故错误;
主族元素的最高正化合价在数值上等于它所在的主族序数,但、通常无正价,且过渡元素不符合此规律,故错误;
同周期主族元素从左向右原子半径减小、金属性减弱,则同周期主族元素的原子半径越小,越难失去电子,故正确;
非金属性越强,对应氢化物越稳定,但不能比较水溶液的酸性,如的非金属性最强,最稳定,酸为弱酸,故错误;
非金属性,对应阴离子的还原性为,故错误;
非金属性,对应最高价含氧酸的酸性为,故正确;故B正确。
故选B。
10.【答案】
【解析】
【分析】
本题考查原子结构与元素周期律的应用,题目难度中等,明确元素周期律内容为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及综合应用能力。
【解答】
含有个电子层,其离子半径最小,其它三种离子含有个电子层,核电荷数越大离子半径越小,则微粒半径:,故错误;
非金属性,则氢化物的稳定性:,故正确;
非金属性,则离子的还原性:,故错误;
非金属性,则单质的氧化性:,故正确;
非金属性,则最高价氧化物对应水化物的酸性:
碳酸的酸性大于,故正确;
同一主族从上到下非金属性逐渐减弱,则非金属性,同一周期从左向右非金属性逐渐增强,则非金属性:、,所以非金属性,故正确;
根据金属活动性顺序表可知,金属性:,故正确;
故选:。
11.【答案】
【解析】
【分析】
本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
【解析】
A.同种元素的不同核素,质子数相同,则比少个中子,质子数相同,故A错误;
B.同周期主族元素从左向右原子半径减小,则,故B错误;
C.同主族从上到下非金属性减弱,非金属性越强,越易与氢气化合,则第Ⅶ族元素从上到下,单质与氢气化合越来越难,故C正确;
D.同周期主族元素从左向右金属性减弱,金属性为,则碱性:,故D错误;
故选:。
12.【答案】
【解析】
【分析】
本题主要考查的是元素周期律的具体表现,意在考查学生的理解能力和知识应用能力,解题的关键是掌握元素金属性强弱变化的具体表现和元素非金属性强弱变化的具体表现。
【解答】
A.同周期元素原子半径随原子序数递增而减小,同主族元素原子半径随原子序数递增而增大,则原子半径:,故A错误;
B.元素的非金属性:,则氢化物的稳定性:,故B错误;
C.同周期元素,随着原子序数的增大,金属性逐渐减弱,同主族元素,随着原子序数的增大,金属性逐渐增强,则金属性:,故C错误;
D.非金属性:,元素的非金属性越强,元素最高价氧化物对应水化物的酸性越强,故H、、酸性从弱到强,故D正确。
13.【答案】
【解析】
【分析】
本题考查元素周期律,意在考查学生的知识应用能力,熟练掌握元素周期律是解本题关键,比较容易。
【解答】
A.同周期自左向右原子半径逐渐减小,则原子半径大小:,A错误;
B.非金属性越强,最高价含氧酸的酸性越强,则酸性强弱:,B错误;
C.同主族从上到下金属性逐渐增强,最高价氧化物的水化物的碱性越强,碱性强弱:,C正确;
D.同主族从上到下金属性逐渐增强,金属性:,D错误。
14.【答案】
【解析】略
15.【答案】
【解析】
【分析】
本题考查元素周期律,解答这类问题应明确元素性质的递变规律,试题难度不大。
【解答】
A.根据同周期元素性质的递变规律可知,随原子序数增加,、、的最外层电子数依次增多,故A正确;
B.根据同周期元素性质的递变规律可知、、元素最高正价依次增高,故B正确;
C.根据同周期元素性质的递变规律可知、、原子半径依次减小,故C错误;
D.根据同主族元素性质的递变规律可知、、的金属性依次增强,故D正确。
16.【答案】第二周期Ⅶ族分;
分 离子化合物分
分;
分;
分;
分;
分。
【解析】
【分析】
本题考查原子结构和元素周期律的综合应用,熟练掌握同一周期、同一主族元素性质递变规律是解题的关键,难度不大。
【解答】
因为的最高价含氧酸与其气态氢化物能发生化合反应生成,所以为氮元素,的焰色反应火焰呈黄色,所以为钠元素,根据原子序数递增可知为二周期,的原子半径是同周期中最小的,所以为氟元素,和为同一族,所以为氯元素,的最外层电子数和电子层数相等所以为铝原子,由此解答。
为氟元素在周期表中的位置为第二周期Ⅶ族,
故答案为:第二周期Ⅶ族;
为氮元素,的化学式为,化合物类型为离子化合物,
故答案为:;离子化合物;
为氯元素最高正价为,最低负价为,代数和为,
故答案为:;
一般的,电子层数多,原子半径大,电子层数相同时,原子序数越大,原子半径越小,所以三者原子半径由大到小的顺序为,
故答案为:;
元素的金属性越强,元素的最高价氧化物对应的水化物中,碱性越强,所以碱性最弱的是,
故答案为:;
元素无正价,氟气体和水剧烈反应,所以可以通过氢化物的稳定性单质与反应的难易程度判断和的非金属性强弱,
故答案为:;
化合物是一种新型无机材料,它可与过量烧碱溶液反应产生使湿润的红色石蕊试纸变蓝的气体即,该反应的化学方程式为,
故答案为:。
17.【答案】;;;;;
;
【解析】
【分析】
本题考查学生元素周期表的内容和元素周期律的综合知识,熟练掌握元素周期表的结构和元素周期律是解题的关键,难度不大。
【解答】
由元素在周期表中的位置可知,元素分别是、、、、、、、。
上表编号的元素中,属于金属元素的是;非金属性越强对最高价含氧酸的酸性越强,的非金属性最强,但没有最高价含氧酸,所以最高价含氧酸酸性最强的元素是;非金属性最强的元素是;同周期从左到右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,原子半径最小的元素是,单质可制作芯片的元素是,元素的原子结构示意图是;
故答案为:;;;;;;
元素的单质是,电子式为;元素的最简单氢化物为,结构式为;
故答案为:;;
元素和元素的最简单氢化物分别是、,分子间存在氢键,而分子间无氢键,所以沸点由高到低的顺序是;
根据非金属性强的元素的单质能够解答此类题目的关键在于非金属性弱的元素置换出来,反应:证明比的单质非金属性强;
故答案为:。
18.【答案】钾;铝;;不合理;用碱性强弱比较金属性强弱时,一定要用元素的最高价氧化物的水化物的碱性强弱比较,而不是氮元素的最高价氧化物的水化物;锥形瓶;防止倒吸;变蓝;;有白色沉淀生成;饱和
【解析】解:Ⅰ金属活泼性顺序为:钾钠镁铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成氢气需要得到电子,钾、钠都失去电子,镁失去电子,而铝失去电子,所以生成氢气最多的是金属铝,
故答案为:钾;铝;
氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:,
故答案为:;
将溶液与溶液混合生成,可以说明的碱性大于,但不能说明的金属性大于,因为要验证金属性的强弱,必须通过比较最高价氧化物所对应的水化物的碱性来进行比较,而不是氮元素的最高价氧化物的水化物,
故答案为:不合理,用碱性强弱比较金属性强弱时,一定要用元素的最高价氧化物的水化物的碱性强弱比较,而不是氮元素的最高价氧化物的水化物.
Ⅱ仪器为锥形瓶;球形干燥管能够防止倒吸,可以避免中液体进入锥形瓶中,
故答案为:锥形瓶;防止倒吸;
与浓盐酸常温下反应生成氯气,氯气能够将碘离子氧化成碘单质,碘单质遇到淀粉变成蓝色,氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气,
故答案为:变蓝;;
氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在和之间增加装有饱和溶液的洗气瓶,
故答案为:有白色沉淀生成;饱和.
本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法,题目难度中等,正确掌握判断金属性、非金属性强弱的方法,明确除杂试剂的作用原则:除去杂质,不能引进新的杂质.
19.【答案】第四周期第族;
溶液分层,上层几乎无色,下层呈紫红色;
氯气通入少适量;
;
;;
。
【解析】
【分析】
本题主要考查的是元素性质递变规律的性质探究,意在考查学生的实验分析能力和知识应用能力,解题的关键是掌握元素非金属性强弱的具体表现和理解实验的原理。
【解答】
溴元素在元素周期表中的位置是第四周期第族;
氯气通入到溴化钠溶液中,发生反应,将中液体滴入到试管中,发生反应,碘易溶于四氯化碳溶液,四氯化碳与水互不相溶,故可观察到的现象是溶液分层,上层几乎无色,下层呈紫红色;
如果通入到中的氯气过量,那滴入到试管中的溶液含有氯气,氯气氧化性较强,发生反应,这将无法证明溴与碘的非金属性强弱关系,所以,做好本实验最关键因素是氯气通入少适量;
、 、的熔点逐渐升高,涉及的卤素的物理性质的变化情况,不能作为卤族元素非金属性递变规律的判断依据,故错误;
元素的非金属性越强,氢化物的稳定性越高,则卤素氢化物的稳定性变化情况可以作为卤族元素非金属性递变规律的判断依据,故正确;
元素的非金属性越强,元素最高价氧化物对应水化物的酸性越强,卤素的氢化物的酸性变化情况不能作为卤族元素非金属性递变规律的判断依据,故错误;
元素的非金属性越强,元素简单离子的还原性越弱,则卤素元素的简单离子的还原性变化情况可以作为卤族元素非金属性递变规律的判断依据,故正确;
由实验装置和药品可知,该实验通过元素最高价氧化物对应水化物的酸性探究元素的非金属性,则分液漏斗内装入的试剂为稀;中盛放的是碳酸钙,硝酸与碳酸钙反应生成二氧化碳,由于硝酸具有挥发性,反应生成的二氧化碳中含有挥发出来的硝酸,中装入的试剂为饱和溶液,用于除去挥发出来的;
烧杯中盛放的是溶液,反应的离子方程式为。
第1页,共1页
