第2章第1节化学键与物质构成同步练习 (含答案)2022-2023学年下学期高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 第2章第1节化学键与物质构成同步练习 (含答案)2022-2023学年下学期高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 182.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 18:01:37 | ||
图片预览



文档简介
第2章第1节化学键与物质构成同步练习
一、单选题
1. 下列关于化学键的叙述中,正确的是( )
A. 氢键是一种特殊的共价键 B. 离子化合物中可能含有共价键
C. 的挥发破坏了共价键 D. 非极性键只能存在双原子单质中
2. 关于化学键的下列叙述中,正确的是( )
化学键只存在于分子之间 化学键只存在于原子或离子之间
化学键是一种静电作用 化学键是原子之间强烈的相互吸引
离子化合物可能含共价键 共价化合物可能含离子键
金属和非金属只能形成离子键 两个非金属和非金属原子间只能形成共价键
A. B. C. D.
3. 下列说法中正确的是
A. 共价化合物中只有共价键,离子化合物中只有离子键
B. 、分子中每个原子最外层均满足电子结构
C. 将某种化合物溶于水,若能导电说明这种化合物是离子化合物
D. 碳链直线型,有极性键和非极性键,碳链也为直线型,也有极性键和非极性键
4. 下列说法正确的是( )
A. 离子键就是阴、阳离子间的静电引力
B. 所有金属元素与所有非金属元素之间都能形成离子键
C. 在水中能电离出和,所以由和构成
D. 某化合物熔融态能导电,则该化合物中一定含有离子键
5. 下列叙述正确的个数是( )
用电子式表示的形成过程为:
两个不同种非金属元素的原子间形成的化学键都是极性键
离子化合物在熔融状态时能够导电
含有非极性键的化合物一定是共价化合物
元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
次氯酸的电子式:
离子化合物中一定含有离子键
A. B. C. D.
6. 下列说法不正确的是( )
A. 化学反应的本质是旧键的断裂和新键的形成
B. 、、、的熔、沸点逐渐升高,原因是分子间作用力逐渐增大
C. 和之间可以形成氢键,这也是氨极易溶于水的原因之一
D. 中含有离子键、极性键、非极性键
7. 下列叙述中,不正确的是( )
A. 溶于水时要破坏离子键 B. 和都是只含有极性键的共价化合物
C. 是含有非极性键的离子化合物 D. 和晶体熔化时要破坏离子键
8. 实验室利用固体和固体反应制氨气,反应方程式为:,下列关于该反应的说法错误的是( )
A. 中存在离子键和极性键
B. 此反应过程中既有离子键、极性键断裂,也有离子键和极性键形成
C. 含“”键,含“”键
D. 像、这样含金属元素的化合物一定属于离子化合物
9. 下列叙述中不正确的是( )
离子化合物中一定含离子键,可能含共价键
含离子键的物质一定是离子化合物
共价化合物中一定含共价键,不可能含离子键
含共价键的化合物一定是共价化合物
、、、既可以通过化合反应又可以通过复分解反应制取
、、 既可以通过化合反应又可以通过置换反应制取
A. B. C. D.
10. 下列叙述正确的个数是( )
用电子式表示的形成过程为:
两个不同种非金属元素的原子间形成的化学键都是极性键
离子化合物在熔融状态时能够导电
含有非极性键的化合物一定是共价化合物
元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
次氯酸的电子式:
离子化合物中一定含有离子键
A. B. C. D.
11. 下列说法正确的是( )
A. 属于共价化合物,溶于水能电离出和,破坏共价键。
B. 是离子化合物,该物质中只含有离子键
C. 和两种分子中,每个原子的最外层都具有电子稳定结构
D. 的热稳定性比强,是由于的分子间作用力较大
12. 短周期元素、、、的原子序数依次增大。、、、分别是由这四种元素中的两种组成的常见化合物,为淡黄色固体,为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示部分生成物已省略。则下列说法中不正确的是( )
A. 沸点:
B. 原子半径:
C. C、两种元素组成的化合物只含有离子键
D. A、、三种元素组成的化合物既可以是离子化合物,又可以是共价化合物
13. 表中物质与其所含化学键类型、所属化合物类型完全对应的一组是( )
选项
物质
化学键类型 共价键 离子键、共价键 离子键 离子键、共价键
化合物类型 共价化合物 离子化合物 离子化合物 共价化合物
A. B. C. D.
14. 下列关于化学键的说法正确的是( )
是一种非常稳定的化合物,这是因为分子间存在氢键
熔化破坏了离子键
、熔点后者高是因为前者克服分子间作用力后者熔化破坏共价键
活泼金属与非金属化合时,一定能形成离子键
离子化合物中可能同时含有离子键和共价键
由非金属元素形成的化合物一定不是离子化合物
单质分子中一定含非极性键
A. B. C. D.
15. 关于共价键与共价化合物的下列叙述中正确的是
原子间以共用电子对形成的物质是共价化合物
共价化合物中一定只含有共价键
共价化合物中一定不含有离子键
含有共价键的化合物一定是共价化合物
离子化合物中可能含有共价键
A. B. C. D.
二、填空题
16. 下列种化学符号:
表示核素的符号共______种。
互为同位素的是______和______。
质量数相等,但不能互为同位素的是______和______。
中子数相等,但质子数不相等的是______和______。
:写出下列物质的电子式: _________2 ________
铵根的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 个质子,个中子,核外有 个电子,该粒子的化学符号是____。
已知断开 键、键、键分别需要吸收的能量为 、、,则由 和 生成 会_____“放出”或“吸收”_____的热量。
现有下列物质: ,只由离子键构成的物质是_____填序号,下同,由离子键和非极性共价键构成的物质是________,属于共价化合物的是_____。
17. 根据要求回答下列问题:
Ⅰ液氨、氨气 乙醇、甲醚 金刚石、 、
上述四组物质中,互为同分异构体的是_____,互为同素异形体的是_____;属于同种物质的是___________填序号。
Ⅱ现有以下五种物质: 干冰 请用相应字母填空:
属于离子晶体是______,属于分子晶体是______,属于原子晶体是_______;
属于共价化合物的是______________;
熔化时只需要破坏共价键的是_____________;
既含有离子键又含有共价键的是__________________。
Ⅲ是一种高效清洁的火箭燃料。已知在、 下,完全燃烧生成氮气和液态水时,放出热量,写出热化学方程式 ___________________________ 。
实验题
18. 氮元素可以形成多种化合物,回答以下问题:
基态氮原子的轨道表示式是______。
、、三种元素电负性从大到小的顺序是______。
肼分子可视为分子中的一个氢原子被氨基取代形成的另一种氮的氢化物。
分子的空间构型是______;分子中氮原子轨道的杂化类型是______。
肼可用作火箭燃料,燃烧时发生的反应是: 。若该反应中有键断裂,则形成的键有______。
肼能与硫酸反应生成。晶体类型与硫酸铵相同,则的晶体内不存在______填标号
离子键 共价键 配位键 范德华力
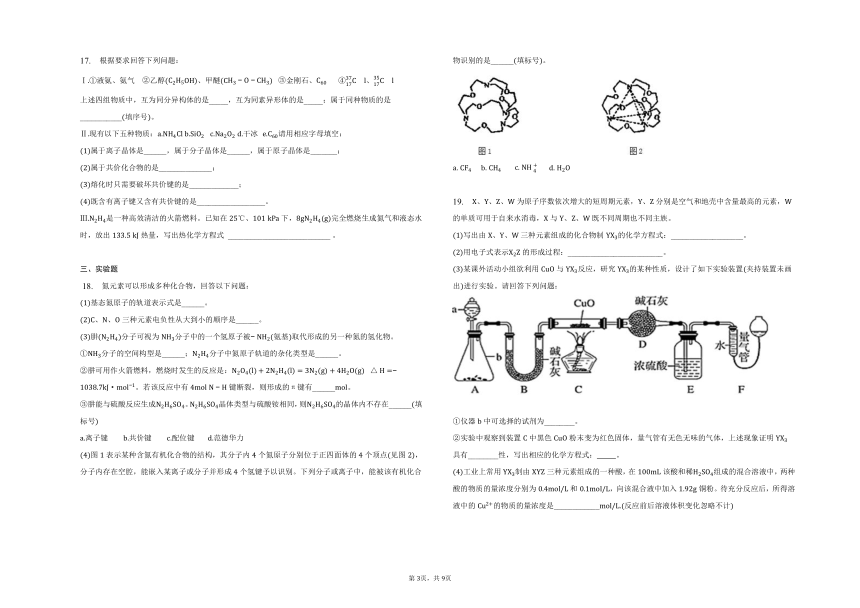
图表示某种含氮有机化合物的结构,其分子内个氮原子分别位于正四面体的个顶点见图,分子内存在空腔,能嵌入某离子或分子并形成个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是______填标号。
19. 、、、为原子序数依次增大的短周期元素,、分别是空气和地壳中含量最高的元素,的单质可用于自来水消毒,与、、既不同周期也不同主族。
写出由、、三种元素组成的化合物制的化学方程式:___________________。
用电子式表示的形成过程:_________________________。
某课外活动小组欲利用与反应,研究的某种性质,设计了如下实验装置夹持装置未画出进行实验。请回答下列问题:
仪器中可选择的试剂为________。
实验中观察到装置中黑色粉末变为红色固体,量气管有无色无味的气体,上述现象证明具有________性,写出相应的化学方程式: 。
工业上常用制由三种元素组成的一种酸,在该酸和稀组成的混合溶液中,两种酸的物质的量浓度分别为和,向该混合液中加入铜粉。待充分反应后,所得溶液中的的物质的量浓度是____________反应前后溶液体积变化忽略不计
答案和解析
1.【答案】
【解析】
【分析】本题考查了化学键的判断、化合物类型的判断、氢键,根据离子键、共价键和离子化合物的概念来分析解答即可,题目难度不大。
【解答】氢键属于分子间作用力,不是共价键,故A错误;
B.离子化合物一定含有离子键,可能含有共价键,如过氧化钠中既含离子键又含共价键,故B正确;
C.的挥发破坏了分子间作用力,共价键没有被破坏,故C错误;
D.同种非金属原子间形成非极性键,化合物中也可能含有非极性键,如过氧化氢中含有非极性键,故D错误;
故选:。
2.【答案】
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及特例,题目难度不大。
【解答】
分子之间的作用力不属于化学键,故错误;
化学键为原子或离子之间强烈的相互作用,化学键只存在于原子或离子之间,故正确;
化学键是含静电吸引和排斥作用,是一种静电作用,故正确;
化学键是原子之间强烈的相互吸引、排斥作用,是一种静电作用,故错误;
离子化合物可能含共价键,如中含离子键、共价键,故正确;
共价化合物中一定不含离子键,含离子键的一定为离子化合物,故错误;
金属和非金属可能形成共价键,如氯化铝为共价化合物,故错误;
两个非金属和非金属原子间只能以共用电子对结合,只能形成共价键,故正确;
故选B。
3.【答案】
【解析】
【分析】
本题考查化学键概念与分类,需能正确区分不同物质中化学键类型,题目难度不大。
【解答】
A.只含共价键的化合物叫做共价化合物,由阳离子和阴离子组成的化合物叫做离子化合物,共价化合物中只有共价键,离子化合物中肯定有离子键,可能有共价键,如氯化铵,故A错误;
B.、分子中每个原子共用电子对,每个原子的最外层均满足电子结构,故B正确;
C.由阳离子和阴离子组成的化合物叫做离子化合物,溶于水可以导电的化合物,可以是离子化合物,也可以是共价化合物,例如氯化氢为共价化合物,其水溶液可以导电,故C错误;
D.碳链直线型,碳氢原子之间形成极性键和碳碳原子之间形成非极性键,符合饱和烃通式,属于烷烃,碳链为锯齿型,也有极性键和非极性键,故D错误。
4.【答案】
【解析】
【分析】
本题主要考查化学键的判断,注意结合离子键和共价键的特点进行分析解答,题目难度一般。
【解答】
A.离子键是阴、阳离子间的静电作用,包括静电引力和静电斥力,故A错误;
B.一般是活泼的金属元素和活泼的非金属元素之间能形成离子键,比如就不属于离子化合物,不存在离子键,故B错误;
C.是共价化合物,由原子和原子构成,故C错误;
D.某化合物熔融态能导电,则该化合物中一定含有离子键,故D正确。
故选D。
5.【答案】
【解析】
【分析】
本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大,侧重于考查学生对基础知识的应用能力。
【解答】
氯化镁是由个镁原子和个氯原子通过离子键形成的,正确的形成过程为,故错误;
两种不同非金属元素原子间形成的化学键都是极性共价键,如,故正确;
离子化合物在熔融状态下可电离出阴阳离子,能导电,故正确;
含有非极性键的化合物不一定是共价化合物,如,故错误;
过渡元素在第Ⅱ与第Ⅲ之间,故错误;
次氯酸为共价化合物,原子最外层个电子,原子最外层个电子,原子最外层个电子,则其电子式为:,故错误;
离子化合物中一定含有离子键,可能含有共价键,故正确,故C正确。
6.【答案】
【解析】
【分析】
本题考查化学键、氢键、极性键,明确不同键的形成及化学反应的实质是解答的关键,试题基础性强,主要是考查学生对化学键、氢键概念以及氢键对物质影响的熟悉,特别是灵活运用这些基础知识解决实际问题的能力,有利于调动学生的学习兴趣。
【解答】
A.因化学反应中一定有物质的变化,则化学反应实质是旧键断裂、新键形成,故A正确;
B.结构相同的分子中,物质的熔沸点与其相对分子质量成正比,所以随着电子层数的增加,卤化物分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高,故B正确;
C.氨气与水分子间存在氢键,使得氨气在水中溶解度特大,与氢键有关,故C正确;
D.中含有离子键、极性键、不含有非极性键,故D错误。
故选D。
7.【答案】
【解析】
【分析】
本题考查了离子键、共价键和离子化合物、共价化合物的关系,难度不大,注意共价键化合物一定不含离子键,离子化合物可能含有共价键。
【解答】
A.是共价化合物,溶于水时发生电离要破坏共价键,故A错误;
B.和分别含有键和键,都属于只含有极性键的共价化合物,故B正确;
C.中与存在离子键,中含有非极性共价键:键,故C正确;
D.和都属于离子化合物,熔化时要破坏离子键,故D正确。
故选A。
8.【答案】
【解析】
【分析】
本题考查化学键相关知识点,需能正确判断化学键的类型、掌握离子化合物的定义,题目难度不大。
【解答】
A.铵根离子和氯离子之间存在离子键、铵根离子中原子和原子之间存在极性键,故A正确;
B.此反应过程中既有铵根离子和氯离子之间的离子键、原子和原子之间的极性键断裂,也有钙离子和氯离子之间的离子键和水中原子和原子之间极性键形成,故B正确;
C.氢氧化钙中氧原子与氢原子之间形成共价键,则含“”极性键;氨气分子中氮原子与氢原子形成共价键,含“”极性键,故C正确;
D.含金属元素的化合物不一定属于离子化合物,如属于共价化合物,故D错误。
故选D。
9.【答案】
【解析】
【分析】
本题考查化学键,为高频考点,把握有关化学键的形成及判断的一般规律等为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度一般。
【解答】
离子化合物一定含离子键,也可能含极性键或非极性键,如中含离子键和极性键,过氧化钠中含离子键和非极性键,故正确;
含离子键的物质一定是离子化合物,故正确;
共价化合物一定含共价键,一定不含离子键,含离子键的一定为离子化合物,故正确;
含共价键的化合物可能是离子化合物,如铵盐为离子化合物,故错误;
既可以通过铁与氯化铁发生化合反应,又可以通过氢氧化亚铁与盐酸发生复分解反应制取;既可以通过铁与氯气发生化合反应又可以通过氢氧化铁与盐酸发生复分解反应制取;既可以通过铁与碘发生化合反应又可以通过氢氧化亚铁与氢碘酸发生复分解反应制取;既可以通过氢氧化亚铁、氧气和水发生化合反应又可以通过氯化铁与氢氧化钠发生复分解反应制取,故正确;
既可以通过铁与氯化铁发生化合反应又可以通过铁与盐酸发生置换反应制取、可以通过铁与氯气发生化合反应但不可以通过置换反应制取,故错误;
故选:。
10.【答案】
【解析】
【分析】
本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大,侧重于考查学生对基础知识的应用能力。
【解答】
氯化镁是由个镁原子和个氯原子通过离子键形成的,正确的形成过程为,故错误;
两种不同非金属元素原子间形成的化学键都是极性共价键,如,故正确;
离子化合物在熔融状态下可电离出阴阳离子,能导电,故正确;
含有非极性键的化合物不一定是共价化合物,如,故错误;
过渡元素在第Ⅱ与第Ⅲ之间,金属与非金属的分界线附近常属于半导体,故错误;
次氯酸为共价化合物,原子最外层个电子,原子最外层个电子,原子最外层个电子,则其电子式为:,故错误;
离子化合物中一定含有离子键,可能含有共价键,故正确。
故选C。
11.【答案】
【解析】
【分析】
本题主要考查的是化学键,意在考查学生的识记能力和知识应用能力,解题的关键是掌握化学键及相关概念和理解化学键与物质性质的关系。
【解答】
A.只含有共价键,属于共价化合物,溶于水能电离出和,破坏共价键,故A正确;
B.是离子化合物,既含有离子键钠离子与氢氧根离子间,又含有共价键氧原子和氢原子间,故B错误;
C.中每个原子的最外层都具有电子稳定结构,但中原子没有达到电子稳定结构,故C错误;
D.的热稳定性比强,是由于中氢氧共价键比氢硫共价键强,故D错误。
12.【答案】
【解析】
【分析】
本题考查无机物的推断及元素周期表及元素周期律,为高频考点,把握元素化合物知识、图中转化关系来推断物质及元素为解答的关键,侧重分析推断能力的考查,注意、乙为物质推断的突破口,题目难度不大。
【解答】
、、、是由这四种元素中的两种组成常见的化合物,为淡黄色固体,为,乙为红棕色气体,乙为,为常见液体,甲为单质,结合图中转化可知,则为,甲为,为,为,由短周期元素、、、原子序数依次增加可知,为,为,为,为,以此来解答;
A.由于氢键的作用,使、在同主族氢化物中的沸点反常,但常温下水为液体,则沸点高低顺序为,故A正确;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:,故B正确;
C.与形成的化合物过氧化钠中含有离子键和共价键,故C错误;
D.、、可以形成、,属于离子化合物,属于共价化合物,故D正确。
故选C。
13.【答案】
【解析】
【分析】
本题考查化学键、化合物的类型,明确元素之间的成键原因、化学键与化合物的关系是解答本题的关键,难度不大。
【解答】
A.中只含共价键,碳原子和氧原子之间存在共价键,属于共价化合物,故A正确;
B.中只含离子键,镁离子与氯离子中存在离子键,属于离子化合物,故B错误;
C.中只含共价键,氢原子和氯原子之间存在共价键,属于共价化合物,故C错误;
D.中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,属于离子化合物,故D错误;
故选:。
14.【答案】
【解析】
【分析】
本题考查了化学键与物质的关系,明确物质的构成微粒及微粒间的作用力是解答本题关键,采用举例法来分析解答,注意:氢键不属于化学键,为易错点。
【解答】
是一种非常稳定的化合物,与其化学键有关,与氢键无关,故错误;
氯化钠属于离子化合物,熔化发生电离,所以离子键发生了破坏,故正确;
、熔点后者高是因为前者克服分子间作用力,后者熔化破坏共价键,分子间作用力较化学键小,故正确;
活泼金属与非金属化合时,不一定能形成离子键,如氯化铝中只含共价键,故错误;
离子化合物中可能同时含有离子键和共价键,如,故正确;
由非金属元素形成的化合物可能是离子化合物,如氯化铵,故错误;
单质分子中不一定含非极性键,如稀有气体,故错误;所以D正确。
故选D。
15.【答案】
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度一般。
【解答】
原子间以共用电子对形成的物质不一定是化合物,还可能是单质如,所以不一定是共价化合物,故错误;
共价化合物中一定不含离子键,一定只含有共价键,故正确;
共价化合物中一定不含离子键,含离子键的为离子化合物,故正确;
含有共价键的化合物可能为离子化合物,如含离子键、共价键,故错误;
离子化合物中可能含有共价键,如含离子键、共价键,故正确。
故选D。
16.【答案】
;
;
;
;
;;
放出;
;;
【解析】
【分析】
本题为综合题,考查了化学用语的使用,涉及元素符号的书写、电子式的书写,化学键及化合物类型判断,阿伏加德罗常数的有个计算,题目难度不大,掌握基础是解题关键。
【解答】
每一种符号表示一种核素,表示核素的符号共种。
互为同位素的是、。
C、的质量数均为,但质子数不同,不互为同位素。
C、的中子数均为,但质子数不同。
:氨气分子内氮原子与个氢原子分别共用对电子,电子式为;中与两个均共用两对电子,电子式为。
铵根物质的量为,含有中子数为:,个数为,核外电子数为:,某微粒含有一个电子核,核中有个质子,个中子,则质量数为,核外有个电子,为氯离子,该粒子的化学符号:
在反应中,断裂键,键共吸收的能量为:,生成,共形成键,放出的能量为:,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:。
,存在共价键,是非金属单质;,钠离子与过氧根之间存在离子键,两个氧原子内部存在共价键,为离子化合物;,钠离子与氢氧根离子之间存在离子键,氧原子与氢原子之间存在共价键,为离子化合物;,存在,共价键,为共价化合物;,存在钙离子与氯离子离子键,为离子化合物;,铵根离子与硝酸根离子存在离子键,铵根离子内部、硝酸根离子内部存在共价键,为离子化合物;,存在共价键,为共价化合物;
所以只由离子键构成的物质是,由离子键和非极性共价键构成的物质是,属于共价化合物的是。
17.【答案】Ⅰ ; ;
Ⅱ;;
Ⅲ
【解析】
【分析】
本题考查了物质的组成、结构与分类,整体难度较小,掌握基础知识是解答本题的关键。
【解答】
Ⅰ乙醇和甲醚分子式相同、结构不同,互为同分异构体;
金刚石与是由碳元素组成的不同单质,互为同素异形体;
液氨与氨气都是由分子构成的,属于同种物质,
故答案为: ; ; 。
Ⅱ与中均含有离子键,均属于离子化合物;干冰和均是由分子构成的,均属于分子晶体;是原子晶体,
故答案为:;; 。
和干冰中均只含有共价键,均属于共价化合物,
故答案为:。
是原子间以极性共价键形成的原子晶体,熔化时只需要破坏共价键,
故答案为:。
和均由阴阳离子构成,铵根离子、过氧根离子中均存在共价键,故和中既含有离子键又含有共价键,
故答案为:。
Ⅲ在、 下,即完全燃烧生成氮气和液态水时,放出热量,则完全燃烧生成氮气和液态水时,放出热量,热化学方程式为 ,
故答案为: 。
18.【答案】
三角锥形;
【解析】
【分析】
本题考查物质的结构与性质相关知识点,涉及核外电子排布图、空间构型的判断、晶体中存在的化学键等知识点,分子空间构型是考试热点,要注重基础知识的积累,难度中等。
【解答】
氮元素核外有个电子,则根据洪特规则和保利不相容原理,氮原子的轨道表示式为
故答案为:;
、、属于同一周期元素且原子序数依次增大,同一周期元素从左到右电负性增大,
故答案为:;
分子中氮原子含有个共价键和一个孤电子对,中心原子价层电子对数,为四面体结构,氮原子连有三个氢原子,所以空间构型是三角锥形;分子中氮原子的价层电子对,原子轨道的杂化类型是,
故答案为:三角锥形;;
若该反应中有 键断裂,则有参加反应,生成氮气,形成的键有,
故答案为:;
硫酸铵是离子化合物,硫酸铵中存在离子键、共价键以及配位键,晶体类型与硫酸铵相同,所以的晶体内存在离子键、共价键以及配位键,不含范德华力,
故答案为:;
注意氢键的形成条件及成键元素、、、,本题中嵌入某微粒分别与个原子形成个氢键,由成键元素及数目可知为,
故答案为:。
19.【答案】;
;
氧化钙或氢氧化钠固体或碱石灰;还原;;
。
【解析】
【分析】
本题主要考查元素周期表的推断,氨气的制备,氨气与氧化物反应的实验探究等。、、、为原子序数依次增大的短周期元素,、分别是空气和地壳中含量最高的元素,可推断为,为,的单质可用于自来水消毒,可推断为,则为。
【解答】
由,,三种元素组成的化合物是氯化铵,氯化铵与氢氧化钙在加热条件下可制备氨气,方程式为;
是水,用电子式表示其形成过程为;
欲探究与的反应,需要先制备氨气,分液漏斗中加浓氨水,锥形瓶中可以是氧化钙固体,氢氧化钠固体或者碱石灰,遇浓氨水放热制备氨气;中黑色粉末变红,证明氧化铜被还原为单质铜,说明氨气具有还原性,反应方程式为 ;
铜的物质的量为,根据铜与硝酸根和氢离子的离子方程式
,
氢离子少量,铜离子的物质的量需根据氢离子的物质的量来计算,根据关系式 ,氢离子为,故铜离子的物质的量为,溶液体积是毫升,故所得溶液中的的物质的量浓度是。
第1页,共1页
一、单选题
1. 下列关于化学键的叙述中,正确的是( )
A. 氢键是一种特殊的共价键 B. 离子化合物中可能含有共价键
C. 的挥发破坏了共价键 D. 非极性键只能存在双原子单质中
2. 关于化学键的下列叙述中,正确的是( )
化学键只存在于分子之间 化学键只存在于原子或离子之间
化学键是一种静电作用 化学键是原子之间强烈的相互吸引
离子化合物可能含共价键 共价化合物可能含离子键
金属和非金属只能形成离子键 两个非金属和非金属原子间只能形成共价键
A. B. C. D.
3. 下列说法中正确的是
A. 共价化合物中只有共价键,离子化合物中只有离子键
B. 、分子中每个原子最外层均满足电子结构
C. 将某种化合物溶于水,若能导电说明这种化合物是离子化合物
D. 碳链直线型,有极性键和非极性键,碳链也为直线型,也有极性键和非极性键
4. 下列说法正确的是( )
A. 离子键就是阴、阳离子间的静电引力
B. 所有金属元素与所有非金属元素之间都能形成离子键
C. 在水中能电离出和,所以由和构成
D. 某化合物熔融态能导电,则该化合物中一定含有离子键
5. 下列叙述正确的个数是( )
用电子式表示的形成过程为:
两个不同种非金属元素的原子间形成的化学键都是极性键
离子化合物在熔融状态时能够导电
含有非极性键的化合物一定是共价化合物
元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
次氯酸的电子式:
离子化合物中一定含有离子键
A. B. C. D.
6. 下列说法不正确的是( )
A. 化学反应的本质是旧键的断裂和新键的形成
B. 、、、的熔、沸点逐渐升高,原因是分子间作用力逐渐增大
C. 和之间可以形成氢键,这也是氨极易溶于水的原因之一
D. 中含有离子键、极性键、非极性键
7. 下列叙述中,不正确的是( )
A. 溶于水时要破坏离子键 B. 和都是只含有极性键的共价化合物
C. 是含有非极性键的离子化合物 D. 和晶体熔化时要破坏离子键
8. 实验室利用固体和固体反应制氨气,反应方程式为:,下列关于该反应的说法错误的是( )
A. 中存在离子键和极性键
B. 此反应过程中既有离子键、极性键断裂,也有离子键和极性键形成
C. 含“”键,含“”键
D. 像、这样含金属元素的化合物一定属于离子化合物
9. 下列叙述中不正确的是( )
离子化合物中一定含离子键,可能含共价键
含离子键的物质一定是离子化合物
共价化合物中一定含共价键,不可能含离子键
含共价键的化合物一定是共价化合物
、、、既可以通过化合反应又可以通过复分解反应制取
、、 既可以通过化合反应又可以通过置换反应制取
A. B. C. D.
10. 下列叙述正确的个数是( )
用电子式表示的形成过程为:
两个不同种非金属元素的原子间形成的化学键都是极性键
离子化合物在熔融状态时能够导电
含有非极性键的化合物一定是共价化合物
元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
次氯酸的电子式:
离子化合物中一定含有离子键
A. B. C. D.
11. 下列说法正确的是( )
A. 属于共价化合物,溶于水能电离出和,破坏共价键。
B. 是离子化合物,该物质中只含有离子键
C. 和两种分子中,每个原子的最外层都具有电子稳定结构
D. 的热稳定性比强,是由于的分子间作用力较大
12. 短周期元素、、、的原子序数依次增大。、、、分别是由这四种元素中的两种组成的常见化合物,为淡黄色固体,为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示部分生成物已省略。则下列说法中不正确的是( )
A. 沸点:
B. 原子半径:
C. C、两种元素组成的化合物只含有离子键
D. A、、三种元素组成的化合物既可以是离子化合物,又可以是共价化合物
13. 表中物质与其所含化学键类型、所属化合物类型完全对应的一组是( )
选项
物质
化学键类型 共价键 离子键、共价键 离子键 离子键、共价键
化合物类型 共价化合物 离子化合物 离子化合物 共价化合物
A. B. C. D.
14. 下列关于化学键的说法正确的是( )
是一种非常稳定的化合物,这是因为分子间存在氢键
熔化破坏了离子键
、熔点后者高是因为前者克服分子间作用力后者熔化破坏共价键
活泼金属与非金属化合时,一定能形成离子键
离子化合物中可能同时含有离子键和共价键
由非金属元素形成的化合物一定不是离子化合物
单质分子中一定含非极性键
A. B. C. D.
15. 关于共价键与共价化合物的下列叙述中正确的是
原子间以共用电子对形成的物质是共价化合物
共价化合物中一定只含有共价键
共价化合物中一定不含有离子键
含有共价键的化合物一定是共价化合物
离子化合物中可能含有共价键
A. B. C. D.
二、填空题
16. 下列种化学符号:
表示核素的符号共______种。
互为同位素的是______和______。
质量数相等,但不能互为同位素的是______和______。
中子数相等,但质子数不相等的是______和______。
:写出下列物质的电子式: _________2 ________
铵根的中子数是___,核外电子数是____,某微粒含有一个原子核,核中有 个质子,个中子,核外有 个电子,该粒子的化学符号是____。
已知断开 键、键、键分别需要吸收的能量为 、、,则由 和 生成 会_____“放出”或“吸收”_____的热量。
现有下列物质: ,只由离子键构成的物质是_____填序号,下同,由离子键和非极性共价键构成的物质是________,属于共价化合物的是_____。
17. 根据要求回答下列问题:
Ⅰ液氨、氨气 乙醇、甲醚 金刚石、 、
上述四组物质中,互为同分异构体的是_____,互为同素异形体的是_____;属于同种物质的是___________填序号。
Ⅱ现有以下五种物质: 干冰 请用相应字母填空:
属于离子晶体是______,属于分子晶体是______,属于原子晶体是_______;
属于共价化合物的是______________;
熔化时只需要破坏共价键的是_____________;
既含有离子键又含有共价键的是__________________。
Ⅲ是一种高效清洁的火箭燃料。已知在、 下,完全燃烧生成氮气和液态水时,放出热量,写出热化学方程式 ___________________________ 。
实验题
18. 氮元素可以形成多种化合物,回答以下问题:
基态氮原子的轨道表示式是______。
、、三种元素电负性从大到小的顺序是______。
肼分子可视为分子中的一个氢原子被氨基取代形成的另一种氮的氢化物。
分子的空间构型是______;分子中氮原子轨道的杂化类型是______。
肼可用作火箭燃料,燃烧时发生的反应是: 。若该反应中有键断裂,则形成的键有______。
肼能与硫酸反应生成。晶体类型与硫酸铵相同,则的晶体内不存在______填标号
离子键 共价键 配位键 范德华力
图表示某种含氮有机化合物的结构,其分子内个氮原子分别位于正四面体的个顶点见图,分子内存在空腔,能嵌入某离子或分子并形成个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是______填标号。
19. 、、、为原子序数依次增大的短周期元素,、分别是空气和地壳中含量最高的元素,的单质可用于自来水消毒,与、、既不同周期也不同主族。
写出由、、三种元素组成的化合物制的化学方程式:___________________。
用电子式表示的形成过程:_________________________。
某课外活动小组欲利用与反应,研究的某种性质,设计了如下实验装置夹持装置未画出进行实验。请回答下列问题:
仪器中可选择的试剂为________。
实验中观察到装置中黑色粉末变为红色固体,量气管有无色无味的气体,上述现象证明具有________性,写出相应的化学方程式: 。
工业上常用制由三种元素组成的一种酸,在该酸和稀组成的混合溶液中,两种酸的物质的量浓度分别为和,向该混合液中加入铜粉。待充分反应后,所得溶液中的的物质的量浓度是____________反应前后溶液体积变化忽略不计
答案和解析
1.【答案】
【解析】
【分析】本题考查了化学键的判断、化合物类型的判断、氢键,根据离子键、共价键和离子化合物的概念来分析解答即可,题目难度不大。
【解答】氢键属于分子间作用力,不是共价键,故A错误;
B.离子化合物一定含有离子键,可能含有共价键,如过氧化钠中既含离子键又含共价键,故B正确;
C.的挥发破坏了分子间作用力,共价键没有被破坏,故C错误;
D.同种非金属原子间形成非极性键,化合物中也可能含有非极性键,如过氧化氢中含有非极性键,故D错误;
故选:。
2.【答案】
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及特例,题目难度不大。
【解答】
分子之间的作用力不属于化学键,故错误;
化学键为原子或离子之间强烈的相互作用,化学键只存在于原子或离子之间,故正确;
化学键是含静电吸引和排斥作用,是一种静电作用,故正确;
化学键是原子之间强烈的相互吸引、排斥作用,是一种静电作用,故错误;
离子化合物可能含共价键,如中含离子键、共价键,故正确;
共价化合物中一定不含离子键,含离子键的一定为离子化合物,故错误;
金属和非金属可能形成共价键,如氯化铝为共价化合物,故错误;
两个非金属和非金属原子间只能以共用电子对结合,只能形成共价键,故正确;
故选B。
3.【答案】
【解析】
【分析】
本题考查化学键概念与分类,需能正确区分不同物质中化学键类型,题目难度不大。
【解答】
A.只含共价键的化合物叫做共价化合物,由阳离子和阴离子组成的化合物叫做离子化合物,共价化合物中只有共价键,离子化合物中肯定有离子键,可能有共价键,如氯化铵,故A错误;
B.、分子中每个原子共用电子对,每个原子的最外层均满足电子结构,故B正确;
C.由阳离子和阴离子组成的化合物叫做离子化合物,溶于水可以导电的化合物,可以是离子化合物,也可以是共价化合物,例如氯化氢为共价化合物,其水溶液可以导电,故C错误;
D.碳链直线型,碳氢原子之间形成极性键和碳碳原子之间形成非极性键,符合饱和烃通式,属于烷烃,碳链为锯齿型,也有极性键和非极性键,故D错误。
4.【答案】
【解析】
【分析】
本题主要考查化学键的判断,注意结合离子键和共价键的特点进行分析解答,题目难度一般。
【解答】
A.离子键是阴、阳离子间的静电作用,包括静电引力和静电斥力,故A错误;
B.一般是活泼的金属元素和活泼的非金属元素之间能形成离子键,比如就不属于离子化合物,不存在离子键,故B错误;
C.是共价化合物,由原子和原子构成,故C错误;
D.某化合物熔融态能导电,则该化合物中一定含有离子键,故D正确。
故选D。
5.【答案】
【解析】
【分析】
本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大,侧重于考查学生对基础知识的应用能力。
【解答】
氯化镁是由个镁原子和个氯原子通过离子键形成的,正确的形成过程为,故错误;
两种不同非金属元素原子间形成的化学键都是极性共价键,如,故正确;
离子化合物在熔融状态下可电离出阴阳离子,能导电,故正确;
含有非极性键的化合物不一定是共价化合物,如,故错误;
过渡元素在第Ⅱ与第Ⅲ之间,故错误;
次氯酸为共价化合物,原子最外层个电子,原子最外层个电子,原子最外层个电子,则其电子式为:,故错误;
离子化合物中一定含有离子键,可能含有共价键,故正确,故C正确。
6.【答案】
【解析】
【分析】
本题考查化学键、氢键、极性键,明确不同键的形成及化学反应的实质是解答的关键,试题基础性强,主要是考查学生对化学键、氢键概念以及氢键对物质影响的熟悉,特别是灵活运用这些基础知识解决实际问题的能力,有利于调动学生的学习兴趣。
【解答】
A.因化学反应中一定有物质的变化,则化学反应实质是旧键断裂、新键形成,故A正确;
B.结构相同的分子中,物质的熔沸点与其相对分子质量成正比,所以随着电子层数的增加,卤化物分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高,故B正确;
C.氨气与水分子间存在氢键,使得氨气在水中溶解度特大,与氢键有关,故C正确;
D.中含有离子键、极性键、不含有非极性键,故D错误。
故选D。
7.【答案】
【解析】
【分析】
本题考查了离子键、共价键和离子化合物、共价化合物的关系,难度不大,注意共价键化合物一定不含离子键,离子化合物可能含有共价键。
【解答】
A.是共价化合物,溶于水时发生电离要破坏共价键,故A错误;
B.和分别含有键和键,都属于只含有极性键的共价化合物,故B正确;
C.中与存在离子键,中含有非极性共价键:键,故C正确;
D.和都属于离子化合物,熔化时要破坏离子键,故D正确。
故选A。
8.【答案】
【解析】
【分析】
本题考查化学键相关知识点,需能正确判断化学键的类型、掌握离子化合物的定义,题目难度不大。
【解答】
A.铵根离子和氯离子之间存在离子键、铵根离子中原子和原子之间存在极性键,故A正确;
B.此反应过程中既有铵根离子和氯离子之间的离子键、原子和原子之间的极性键断裂,也有钙离子和氯离子之间的离子键和水中原子和原子之间极性键形成,故B正确;
C.氢氧化钙中氧原子与氢原子之间形成共价键,则含“”极性键;氨气分子中氮原子与氢原子形成共价键,含“”极性键,故C正确;
D.含金属元素的化合物不一定属于离子化合物,如属于共价化合物,故D错误。
故选D。
9.【答案】
【解析】
【分析】
本题考查化学键,为高频考点,把握有关化学键的形成及判断的一般规律等为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度一般。
【解答】
离子化合物一定含离子键,也可能含极性键或非极性键,如中含离子键和极性键,过氧化钠中含离子键和非极性键,故正确;
含离子键的物质一定是离子化合物,故正确;
共价化合物一定含共价键,一定不含离子键,含离子键的一定为离子化合物,故正确;
含共价键的化合物可能是离子化合物,如铵盐为离子化合物,故错误;
既可以通过铁与氯化铁发生化合反应,又可以通过氢氧化亚铁与盐酸发生复分解反应制取;既可以通过铁与氯气发生化合反应又可以通过氢氧化铁与盐酸发生复分解反应制取;既可以通过铁与碘发生化合反应又可以通过氢氧化亚铁与氢碘酸发生复分解反应制取;既可以通过氢氧化亚铁、氧气和水发生化合反应又可以通过氯化铁与氢氧化钠发生复分解反应制取,故正确;
既可以通过铁与氯化铁发生化合反应又可以通过铁与盐酸发生置换反应制取、可以通过铁与氯气发生化合反应但不可以通过置换反应制取,故错误;
故选:。
10.【答案】
【解析】
【分析】
本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大,侧重于考查学生对基础知识的应用能力。
【解答】
氯化镁是由个镁原子和个氯原子通过离子键形成的,正确的形成过程为,故错误;
两种不同非金属元素原子间形成的化学键都是极性共价键,如,故正确;
离子化合物在熔融状态下可电离出阴阳离子,能导电,故正确;
含有非极性键的化合物不一定是共价化合物,如,故错误;
过渡元素在第Ⅱ与第Ⅲ之间,金属与非金属的分界线附近常属于半导体,故错误;
次氯酸为共价化合物,原子最外层个电子,原子最外层个电子,原子最外层个电子,则其电子式为:,故错误;
离子化合物中一定含有离子键,可能含有共价键,故正确。
故选C。
11.【答案】
【解析】
【分析】
本题主要考查的是化学键,意在考查学生的识记能力和知识应用能力,解题的关键是掌握化学键及相关概念和理解化学键与物质性质的关系。
【解答】
A.只含有共价键,属于共价化合物,溶于水能电离出和,破坏共价键,故A正确;
B.是离子化合物,既含有离子键钠离子与氢氧根离子间,又含有共价键氧原子和氢原子间,故B错误;
C.中每个原子的最外层都具有电子稳定结构,但中原子没有达到电子稳定结构,故C错误;
D.的热稳定性比强,是由于中氢氧共价键比氢硫共价键强,故D错误。
12.【答案】
【解析】
【分析】
本题考查无机物的推断及元素周期表及元素周期律,为高频考点,把握元素化合物知识、图中转化关系来推断物质及元素为解答的关键,侧重分析推断能力的考查,注意、乙为物质推断的突破口,题目难度不大。
【解答】
、、、是由这四种元素中的两种组成常见的化合物,为淡黄色固体,为,乙为红棕色气体,乙为,为常见液体,甲为单质,结合图中转化可知,则为,甲为,为,为,由短周期元素、、、原子序数依次增加可知,为,为,为,为,以此来解答;
A.由于氢键的作用,使、在同主族氢化物中的沸点反常,但常温下水为液体,则沸点高低顺序为,故A正确;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:,故B正确;
C.与形成的化合物过氧化钠中含有离子键和共价键,故C错误;
D.、、可以形成、,属于离子化合物,属于共价化合物,故D正确。
故选C。
13.【答案】
【解析】
【分析】
本题考查化学键、化合物的类型,明确元素之间的成键原因、化学键与化合物的关系是解答本题的关键,难度不大。
【解答】
A.中只含共价键,碳原子和氧原子之间存在共价键,属于共价化合物,故A正确;
B.中只含离子键,镁离子与氯离子中存在离子键,属于离子化合物,故B错误;
C.中只含共价键,氢原子和氯原子之间存在共价键,属于共价化合物,故C错误;
D.中钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在共价键,属于离子化合物,故D错误;
故选:。
14.【答案】
【解析】
【分析】
本题考查了化学键与物质的关系,明确物质的构成微粒及微粒间的作用力是解答本题关键,采用举例法来分析解答,注意:氢键不属于化学键,为易错点。
【解答】
是一种非常稳定的化合物,与其化学键有关,与氢键无关,故错误;
氯化钠属于离子化合物,熔化发生电离,所以离子键发生了破坏,故正确;
、熔点后者高是因为前者克服分子间作用力,后者熔化破坏共价键,分子间作用力较化学键小,故正确;
活泼金属与非金属化合时,不一定能形成离子键,如氯化铝中只含共价键,故错误;
离子化合物中可能同时含有离子键和共价键,如,故正确;
由非金属元素形成的化合物可能是离子化合物,如氯化铵,故错误;
单质分子中不一定含非极性键,如稀有气体,故错误;所以D正确。
故选D。
15.【答案】
【解析】
【分析】
本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度一般。
【解答】
原子间以共用电子对形成的物质不一定是化合物,还可能是单质如,所以不一定是共价化合物,故错误;
共价化合物中一定不含离子键,一定只含有共价键,故正确;
共价化合物中一定不含离子键,含离子键的为离子化合物,故正确;
含有共价键的化合物可能为离子化合物,如含离子键、共价键,故错误;
离子化合物中可能含有共价键,如含离子键、共价键,故正确。
故选D。
16.【答案】
;
;
;
;
;;
放出;
;;
【解析】
【分析】
本题为综合题,考查了化学用语的使用,涉及元素符号的书写、电子式的书写,化学键及化合物类型判断,阿伏加德罗常数的有个计算,题目难度不大,掌握基础是解题关键。
【解答】
每一种符号表示一种核素,表示核素的符号共种。
互为同位素的是、。
C、的质量数均为,但质子数不同,不互为同位素。
C、的中子数均为,但质子数不同。
:氨气分子内氮原子与个氢原子分别共用对电子,电子式为;中与两个均共用两对电子,电子式为。
铵根物质的量为,含有中子数为:,个数为,核外电子数为:,某微粒含有一个电子核,核中有个质子,个中子,则质量数为,核外有个电子,为氯离子,该粒子的化学符号:
在反应中,断裂键,键共吸收的能量为:,生成,共形成键,放出的能量为:,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:。
,存在共价键,是非金属单质;,钠离子与过氧根之间存在离子键,两个氧原子内部存在共价键,为离子化合物;,钠离子与氢氧根离子之间存在离子键,氧原子与氢原子之间存在共价键,为离子化合物;,存在,共价键,为共价化合物;,存在钙离子与氯离子离子键,为离子化合物;,铵根离子与硝酸根离子存在离子键,铵根离子内部、硝酸根离子内部存在共价键,为离子化合物;,存在共价键,为共价化合物;
所以只由离子键构成的物质是,由离子键和非极性共价键构成的物质是,属于共价化合物的是。
17.【答案】Ⅰ ; ;
Ⅱ;;
Ⅲ
【解析】
【分析】
本题考查了物质的组成、结构与分类,整体难度较小,掌握基础知识是解答本题的关键。
【解答】
Ⅰ乙醇和甲醚分子式相同、结构不同,互为同分异构体;
金刚石与是由碳元素组成的不同单质,互为同素异形体;
液氨与氨气都是由分子构成的,属于同种物质,
故答案为: ; ; 。
Ⅱ与中均含有离子键,均属于离子化合物;干冰和均是由分子构成的,均属于分子晶体;是原子晶体,
故答案为:;; 。
和干冰中均只含有共价键,均属于共价化合物,
故答案为:。
是原子间以极性共价键形成的原子晶体,熔化时只需要破坏共价键,
故答案为:。
和均由阴阳离子构成,铵根离子、过氧根离子中均存在共价键,故和中既含有离子键又含有共价键,
故答案为:。
Ⅲ在、 下,即完全燃烧生成氮气和液态水时,放出热量,则完全燃烧生成氮气和液态水时,放出热量,热化学方程式为 ,
故答案为: 。
18.【答案】
三角锥形;
【解析】
【分析】
本题考查物质的结构与性质相关知识点,涉及核外电子排布图、空间构型的判断、晶体中存在的化学键等知识点,分子空间构型是考试热点,要注重基础知识的积累,难度中等。
【解答】
氮元素核外有个电子,则根据洪特规则和保利不相容原理,氮原子的轨道表示式为
故答案为:;
、、属于同一周期元素且原子序数依次增大,同一周期元素从左到右电负性增大,
故答案为:;
分子中氮原子含有个共价键和一个孤电子对,中心原子价层电子对数,为四面体结构,氮原子连有三个氢原子,所以空间构型是三角锥形;分子中氮原子的价层电子对,原子轨道的杂化类型是,
故答案为:三角锥形;;
若该反应中有 键断裂,则有参加反应,生成氮气,形成的键有,
故答案为:;
硫酸铵是离子化合物,硫酸铵中存在离子键、共价键以及配位键,晶体类型与硫酸铵相同,所以的晶体内存在离子键、共价键以及配位键,不含范德华力,
故答案为:;
注意氢键的形成条件及成键元素、、、,本题中嵌入某微粒分别与个原子形成个氢键,由成键元素及数目可知为,
故答案为:。
19.【答案】;
;
氧化钙或氢氧化钠固体或碱石灰;还原;;
。
【解析】
【分析】
本题主要考查元素周期表的推断,氨气的制备,氨气与氧化物反应的实验探究等。、、、为原子序数依次增大的短周期元素,、分别是空气和地壳中含量最高的元素,可推断为,为,的单质可用于自来水消毒,可推断为,则为。
【解答】
由,,三种元素组成的化合物是氯化铵,氯化铵与氢氧化钙在加热条件下可制备氨气,方程式为;
是水,用电子式表示其形成过程为;
欲探究与的反应,需要先制备氨气,分液漏斗中加浓氨水,锥形瓶中可以是氧化钙固体,氢氧化钠固体或者碱石灰,遇浓氨水放热制备氨气;中黑色粉末变红,证明氧化铜被还原为单质铜,说明氨气具有还原性,反应方程式为 ;
铜的物质的量为,根据铜与硝酸根和氢离子的离子方程式
,
氢离子少量,铜离子的物质的量需根据氢离子的物质的量来计算,根据关系式 ,氢离子为,故铜离子的物质的量为,溶液体积是毫升,故所得溶液中的的物质的量浓度是。
第1页,共1页
