第2章微粒间相互作用与物质性质单元练习(含答案)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章微粒间相互作用与物质性质单元练习(含答案)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 344.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 18:32:32 | ||
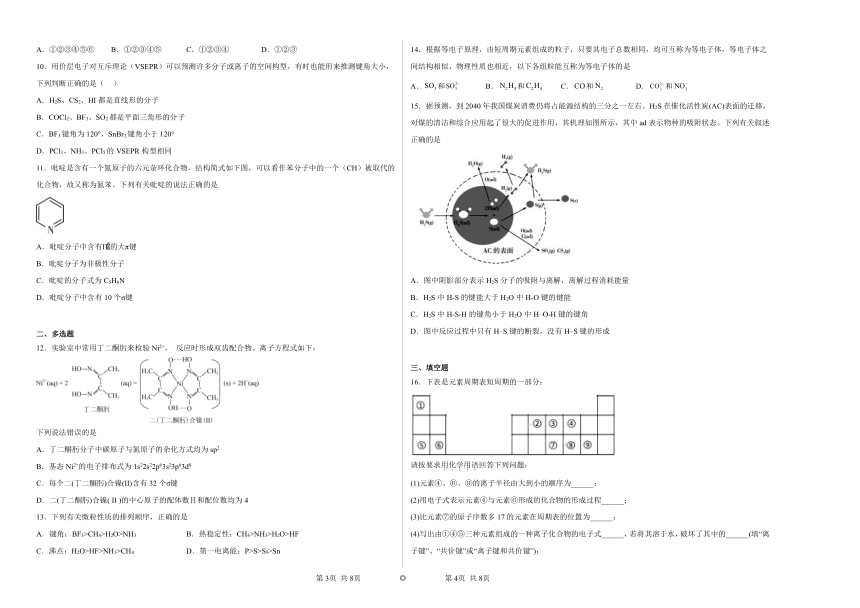
图片预览




文档简介
第2章微粒间相互作用与物质性质单元练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列叙述中正确的是
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线形分子
2.第ⅤA族元素的原子R与Cl原子结合形成RCl3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法不正确的是
A.每个原子都达到8电子稳定结构
B.键角(Cl-R-Cl)有90°、120°、180°三种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.分子中5个R-Cl键键能不相同
3.已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,下列各组粒子结构不相似的是( )
A.BCl3和PH3 B.NH和CH4 C.NO和CO D.CO2和N2O
4.NA代表阿伏加德罗常数的值。下列叙述正确的是
A.NO2和N2O4组成的4.6 g混合气体所含氧原子数为0.3NA
B.124 g P4(正四面体)中P-P键数目为4NA
C.常温常压下,1.8 g D2O含有的质子数、电子数、中子数均为NA
D.标准状况下,2.24 L乙烯中含有的π键数目为 0.1NA
5.下列说法中不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,2个π键
6.随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列关于说法中不正确的是
A.f在元素周期表的位置是第3周期ⅢA族。
B.d、e常见离子的半径大小:r(O2-)>r(Na+)
C.g、h的最高价氧化物对应的水化物的酸性强弱是:HClO4>H2SO4
D.x2d2的结构式:
7.根据杂化轨道理论和价层电子对互斥模型,对下列分子或者离子的判断完全正确的是
选项 化学式 中心原子杂化方式 价层电子对互斥模型 分子或离子的立体构型
A sp2 正四面体形 三角锥形
B H2O sp2 四面体形 V形
C NH3 sp3 三角锥形 平面三角形
D CH4 sp3 正四面体形 正四面体形
A.A B.B C.C D.D
8.甲烷分子(CH4)失去一个H+,形成甲基阴离子(),在这个过程中,下列描述不合理的是
A.碳原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
9.下列现象与氢键有关的是
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
10.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
A.H2S、CS2、HI都是直线形的分子
B.COCl2、BF3、SO2都是平面三角形的分子
C.BF3键角为120°,SnBr2键角小于120°
D.PCl3、NH3、PCl5的VSEPR构型相同
11.吡啶是含有一个氮原子的六元杂环化合物,结构简式如下图,可以看作苯分子中的一个(CH)被取代的化合物,故又称为氮苯。下列有关吡啶的说法正确的是
A.吡啶分子中含有Π的大π键
B.吡啶分子为非极性分子
C.吡啶的分子式为C5H6N
D.吡啶分子中含有10个σ键
二、多选题
12.实验室中常用丁二酮肟来检验Ni2+, 反应时形成双齿配合物。离子方程式如下:
下列说法错误的是
A.丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2
B.基态Ni2+的电子排布式为1s22s22p63s23p63d8
C.每个二(丁二酮肟)合镍(II)含有32个σ键
D.二(丁二酮肟)合镍( II )的中心原子的配体数目和配位数均为4
13.下列有关微粒性质的排列顺序,正确的是
A.键角:BF3>CH4>H2O>NH3 B.热稳定性:CH4>NH3>H2O>HF
C.沸点:H2O>HF>NH3>CH4 D.第一电离能:P>S>Si>Sn
14.根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体,等电子体之间结构相似、物理性质也相近,以下各组粒能互称为等电子体的是
A.和 B.和 C.和 D.和
15.据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性炭(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述正确的是
A.图中阴影部分表示H2S分子的吸附与离解,离解过程消耗能量
B.H2S中H-S的键能大于H2O中H-O键的键能
C.H2S中H-S-H的键角小于H2O中H–O-H键的键角
D.图中反应过程中只有H–S键的断裂,没有H–S键的形成
三、填空题
16.下表是元素周期表短周期的一部分:
请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为______;
(2)用电子式表示元素④与元素⑥形成的化合物的形成过程______;
(3)比元素⑦的原子序数多17的元素在周期表的位置为______;
(4)写出由①④⑤三种元素组成的一种离子化合物的电子式______,若将其溶于水,破坏了其中的______(填“离子键”、“共价键”或“离子键和共价键”);
17.配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是______。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______。
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于______(填字母代号)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:______;能使该反应发生的可能原因是______。
II.已知:在溶液中为橙色,在溶液中为黄色
(1)下列反应曾用于检测司机是否酒后驾驶:2+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①基态Cr原子外围电子排布图为______;配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是______(填元素符号)。
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为______。
(2)有下列实验:
①呈天蓝色的离子的化学式为______,溶剂X可以是______(填名称),继续添加氨水,沉淀溶解的离子方程式为______。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是______。
③下列有关化学实验的“操作→现象→解释”均正确的是______。
选项 操作 现象 解释
A 向某溶液中滴加KSCN溶液 产生红色沉淀 Fe3++3SCN-=Fe(SCN)3↓
B 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 产生0.2mol沉淀 已知Cr3+的配位数为6,则CrCl3·6H2O的化学式可表示为[Cr(H2O)5Cl]Cl2·H2O
C 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH 溶液先橙色加深,后变为黄色 溶液中存在+H2O 2+2H+
D 向AgCl悬浊液中滴加氨水 沉淀溶解 AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl-
四、元素或物质推断题
18.X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
元素 相关信息
X X的基态原子核外3个能级上有电子,且每个能级上的电子数相等
Y 原子最外层电子数是次外层的三倍
Z 单质及其化合物的焰色反应为黄色
W W为前四周期中未成对电子数最多的元素
(1)X位于元素周期表中的位置______。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于______晶体。
(2)XY2的电子式是______;分子空间构型为______。
(3)Z2Y2中含有的化学键类型有______;阴、阳离子的个数比为______。
五、结构与性质
19.研究表明,利用FeCl2、NH4H2PO4、Li2CO3和苯胺( )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
(1)Fe2+基态核外电子排布式为________。
(2) N、P、O三种元素的电负性由大到小的顺序为________。
(3) CO32-中心原子轨道的杂化类型为________;与CO32-互为等电子体的一种分子为________(填化学式)。
(4) 1mol苯胺分子中含有σ键的数目为________;苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是________________________________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.NH3、CO是极性分子,CO2是非极性分子,A错误;
B.CH4、CCl4均含有极性键,但它们的空间结构对称且无孤电子对,为非极性分子,B正确;
C.元素的非金属性越强,气态氢化物的稳定性越强,F、Cl、Br、I的非金属性依次减弱,HF、HCl、HBr、HI的稳定性依次减弱,C错误;
D.CS2、C2H2是直线形分子,H2O是V形分子,D错误;
故选B。
【点睛】判断分子极性的一般方法:①双原子分子:同核的是非极性分子,异核的是极性分子;②多原子分子:空间结构对称且无孤电子对的是非极性分子,空间结构不对称或含有孤电子对的是极性分子。
2.A
【详解】A.第ⅤA族元素的R原子最外层有5个电子,形成5个共用电子对,所以RCl5中R的最外层电子数为10,不满足8电子稳定结构,故A错误;
B.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl)有90°、120、180°几种,故B正确;
C.RCl5RCl3+Cl2↑,RCl3中R采用sp3杂化,有一个孤电子对,为三角锥形结构,故C正确;
D.键长越短,键能越大,分子中5个R-Cl键的键长不同,所以键能不同,故D正确;
故选A。
3.A
【详解】A.BCl3和PH3中,前者的价电子数为24,后者的价电子数为8,二者的结构不相似,A符合题意;
B.NH和CH4都由5个原子构成,价电子数都为10,二者结构相似,B不符合题意;
C.NO和CO都由4个原子构成,价电子数都为24,二者的结构相似,C不符合题意;
D.CO2和N2O都由3个原子构成,价电子数都为16,二者的结构相似,D不符合题意;
故选A。
4.D
【详解】A.NO2和N2O4的最简式相同,都是NO2,4.6 g NO2的物质的量为0.1mol,所含氧原子数为0.2NA,故A错误;
B.P4分子中含有6个P-P键,124 g P4分子的物质的量为1mol,则1mol P4分子中含有P-P键数目为6NA,故B错误;
C.D2O含有的质子数为10、电子数为10、中子数10,1.8 g D2O的物质的量为0.9mol,则0.9mol D2O含有的质子数、电子数、中子数均为0.9NA,故C错误;
D.乙烯分子的结构简式为CH2=CH2,双键中含有1个δ键和1个π键,标准状况下,2.24 L乙烯的物质的量为1mol,则1mol乙烯中含有的π键数目为 0.1NA,故D正确;
故选D。
5.C
【详解】A. σ键是头碰头的重叠,π键是肩并肩的重叠,σ键比π键重叠程度大,σ键比π键稳定,故A正确;
B. 两个原子间只能形成1个σ键,两个原子之间形成双键时,含有一个σ键和一个π键,两个原子之间形成三键时,含有一个σ键和2个π键,故B正确;
C. 单原子分子中没有共价键,如稀有气体分子中不存在σ键,故C错误;
D. 两个原子之间形成三键时,含有一个σ键和2个π键,N2分子中含有一个三键,即有一个σ键,2个π键,故D正确。
故选C。
6.D
【分析】8种元素为短周期元素,在同一周期中,从左向右原子半径逐渐变小,同一主族,从上到下原子半径逐渐变大,主族元素最高正化合价一般等于族序数,最低负价=8-主族族序数,从图中的化合价、原子半径的大小及原子序数可知,x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此进行解答;
【详解】A. f为Al元素,在元素周期表的位置是第3周期ⅢA族,A正确;
B. d是O元素,e是Na元素,电子层结构相同的离子,核电荷数大者离子半径小,d、e简单离子的半径大小:r(O2-)>r(Na+),B正确;
C. 非金属性越强,最高价氧化物对应的水化物的酸性越强, g是S元素,h是Cl元素,g、h的最高价氧化物对应的水化物的酸性强弱是:HClO4>H2SO4,C正确;
D. x2d2的为过氧化氢,属于共价化合物,结构式:H-O-O-H,D不正确;
答案选D。
7.D
【详解】A.的中心S原子的价层电子对数为4,发生sp3杂化,A不正确;
B.H2O的中心O原子的价层电子对数为4,发生sp3杂化,B不正确;
C.NH3的中心N原子价层电子对数为4,由于孤对电子的排斥作用,分子呈三角锥形,C不正确;
D.CH4的中心C原子的价层电子对数为4,发生sp3杂化,所以价层电子对互斥模型、分子或离子的立体构型都呈正四面体形,D正确;
故选D。
8.A
【详解】A.甲烷分子(CH4)失去一个H+,形成甲基阴离子(),两微粒中C原子的价层电子数都是为4,碳原子杂化方式均为sp3杂化,故A错误;
B.甲烷为正四面体型结构,为三角锥形结构,微粒形状发生变化,故B正确;
C.甲烷稳定,带负电荷不稳定,故C正确;
D.甲烷为正四面体型结构,为三角锥形结构,碳原子含有孤对电子,其键角比甲烷中键角小,故D正确;
故答案为A。
9.B
【详解】①NH3的熔、沸点比VA族其他元素氢化物的高是因为氨气存在分子间氢键,故①符合题意;②小分子的醇、羧酸与水形成分子间氢键,因此小分子的醇、羧酸可以和水以任意比互溶,故②符合题意;③冰中水与周围四个水分子以分子间氢键形成四面体结构,中间有空隙,因此冰的密度比液态水的密度小,故③符合题意;④尿素[CO(NH2)2]存在分子间氢键,因此尿素的熔、沸点比醋酸的高,故④符合题意;⑤邻羟基苯甲酸存在分子内氢键,对羟基苯甲酸存在分子间氢键,因此邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤符合题意;⑥水分子高温下也很稳定主要是氧氢键稳定,难断裂,故⑥不符合题意;因此①②③④⑤都与氢键有关,故B符合题意。
综上所述,答案为B。
10.C
【详解】A. 中心原子S原子采取sp 杂化,电子对构型为正四面体形,分子构型为V形,H—S—H键角为92.1°,即H2S为V型分子,CS2、HI都是直线形的分子,故A错误;
B.SO2中,且含有2个孤电子对,所以SO2为V形结构;BF3中,所以BF3是键角为120°的平面三角形结构,COCl2中,为平面三角形分子,故B错误;
C.由B可知BF3键角为120°,SnBr2中,且含有一个孤电子对,为V形结构,孤对电子与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以SnBr2键角小于120°,故C正确;
D.NH3、PCl3中,且含有一个孤电子对,所以PCl3、NH3为三角锥形结构;PCl5中,且不含孤对电子,为三角双锥结构,故D错误。
答案选C
11.A
【详解】A.吡啶分子与苯分子是等电子体,其结构相似,苯分子中含有Π的大π键,故吡啶分子中也含有Π的大π键,A说法正确;
B.吡啶分子的正负电荷的重心不能重合,故其为极性分子,B不正确;
C.吡啶可以看作苯分子中的一个(CH)被N取代的化合物,故其的分子式为C5H5N,C不正确;
D.吡啶分子中C-C、C-H、C-N均为σ键,共含有11个σ键,D不正确。
本题选A。
12.AD
【详解】A.由丁二酮肟分子结构可知,分子中有的碳原子形成1个双键和2个单键,碳原子的杂化方式为sp2杂化,还有的碳原子全部是单键,碳原子的杂化方式为sp3杂化,选项A错误;
B.镍元素的核电荷数为28,失去2个电子形成镍离子,则基态Ni2+的电子排布式为1s22s22p63s23p63d8,选项B正确;
C.由二(丁二酮肟)合镍(II)的结构可知,配合物中含有4个配位键、4个双键和24个单键,共32个σ键,选项C正确;
D.由二(丁二酮肟)合镍(II)的结构可知,配合物的中心原子为镍离子,配位数为4,配位体为二个丁二酮肟,选项D错误;
答案选AD。
13.CD
【详解】A.BF3、CH4、H2O、NH3的键角分别为120°、109°28′、104.5°、107°18′,所以键角大小顺序为:BF3>CH4>NH3>H2O,A不正确;
B.因为非金属性F>O>N>C,所以热稳定性:HF>H2O>NH3>CH4,B不正确;
C.因为NH3、H2O、HF分子间都能形成氢键,水中氢键比氟化氢多,常温下,氨气为气体,所以沸点:H2O>HF>NH3>CH4,C正确;
D.因为非金属性S>P>Si>Sn,但P的3p轨道半充满,电子的能量低,第一电离能反常,所以第一电离能:P>S>Si>Sn,D正确;
故选CD。
14.CD
【详解】A.三氧化硫和亚硫酸根的原子个数相同,电子总数一定不同,不能互称为等电子体,故A错误;
B.肼和乙烯的的原子个数相同,电子总数一定不同,不能互称为等电子体,故A错误;
C.一氧化碳和氮气的原子个数相同,电子总数都为14,能互称为等电子体,故C正确;
D.碳酸根和硝酸根的原子个数相同,电子总数都为32,能互称为等电子体,故D正确;
故选CD。
15.AC
【详解】A.图中阴影部分H2S(g)→H2S(ad)为H2S在催化剂表面的吸附,H2S(ad)→2H(ad)+S(ad)表示H2S的离解,离解过程有化学键的断裂,消耗能量,故A正确;
B.S原子的半径大于O原子,所以H-S键的键长大于H-O键,H-S的键能较弱,故B错误;
C.H2S和H2O中均含有两对孤电子对,分子空间构型为V形,但在水分子中由于O元素的电负性大于S,成键电子对更靠近O原子,排斥作用更大,键角更大,故C正确;
D.据图可知阴影部分出现H(ad)、S(ad),有H-S键的断裂,部分S(g)与H2(g)生成H2S(g),存在H-S键的形成,故D错误;
综上所述答案为AC。
16. Cl >O2 >Mg2+ 第四周期第IVA族 离子键
【分析】根据各元素在元素周期表中的位置,①为H元素;②为与第二周期第ⅡA族,为C元素;同理③为N元素;④为O元素;⑤位于第三周期第IA族,为Na元素;同理⑥为Mg元素;⑦为P元素;⑧为S元素;⑨为Cl元素。
【详解】(1)由于离子核外电子层数越多,离子半径越大,当离子核外电子层数相同时,核电荷数越大,离子半径越小;Cl 核外有3个电子层,O2 、Mg2+核外都有2个电子层,所以Cl 的半径最大,O2 半径次之,Mg2+的离子半径最小,故元素④、⑥、⑨的离子半径由大到小的顺序为Cl >O2 >Mg2+,故填Cl >O2 >Mg2+;
(2)Mg原子失去电子形成Mg2+,O原子获得电子形成O2 ,Mg2+与O2 通过静电作用形成离子键,用电子式表示为,故填;
(3)元素⑦是P元素,它的原子序数是15,比该元素的原子序数大17的元素是32,其核外电子排布是2、8、18、4,所以该元素位于第四周期第IVA族,故填第四周期第IVA族;
(4)①④⑤三种元素分别是H、O、Na,三种元素形成的离子化合物是NaOH,其电子式是;NaOH是离子化合物,含有离子键、共价键,当其溶于水电离产生OH 、Na+,所以断裂的是离子键,故填、离子键。
17. Fe(SCN)2+ FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl C Fe(SCN)3+3F =FeF3+3SCN Fe3+结合F 的能力大于结合SCN 的能力 O H2O与CH3CH2OH分子间能形成氢键 [Cu(H2O)4]2+ 乙醇 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- NH3>H2O BC
【详解】I.(1)①Fe3+与SCN 以个数比1:1配合物离子,离子带2个单位正电荷,该配合物离子为Fe(SCN)2+,故填Fe(SCN)2+;
②若Fe3+与SCN 以个数比1:5配合,该配离子为[Fe(SCN)5]2 ,则FeCl3与KSCN在水溶液中发生反应的化学方程式为FeCl3+5KSCN═K2[Fe(SCN)5]+3KCl,故填FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl;
(3)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,因平衡正向移动,血红色离子的浓度增加,故填C;
(4)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色溶液,表示该反应的离子方程式为Fe(SCN)3+3F =FeF3+3SCN ;能使该反应发生的可能原因是Fe3+结合F 的能力大于结合SCN 的能力,故填Fe(SCN)3+3F =FeF3+3SCN 、Fe3+结合F 的能力大于结合SCN 的能力;
II.(1)①Cr位于周期表第四周期ⅥB族,原子核外电子排布为1s22s22p63s23p63d54s1,外围电子排布图为:;配合物[Cr(H2O)6]3+中Cr3+为中心离子,H2O为配体,O原子提供孤对电子,与Cr3+形成配位键,形成配位键的原子是:O,故填、O;
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为H2O与CH3CH2OH分子间能形成氢键,故填H2O与CH3CH2OH分子间能形成氢键;
(2)①呈天蓝色的离子的化学式为[Cu(H2O)4]2+;加入X的作用是降低溶剂的极性,减小Cu(NH3)4SO4 H2O的溶解度,试剂X可以是乙醇;继续添加氨水,沉淀溶解的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故填[Cu(H2O)4]2+、乙醇、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
②天蓝色的离子[Cu(H2O)4]2+最终转换成了深蓝色的[Cu(NH3)4]2+,说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是:NH3>H2O,故填NH3>H2O;
③A.KSCN溶液与Fe3+溶液作用的方程式为:Fe3++3SCN- Fe(SCN)3,该反应时可逆反应,故A错误;
B.氯化铬(CrCl3 6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铬(CrCl3 6H2O)化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3 6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2 H2O,故B正确;
C.在反应(橙色)+H2O2(黄色)+2H+中,向K2Cr2O7溶液中滴加3滴浓H2SO4,氢离子浓度增大,平衡逆向移动,则溶液橙色加深或溶液颜色加深,加入NaOH,氢离子浓度减小,平衡正向移动,则溶液由橙色变为黄色,故C正确;
D.Ag+与氨气分子结合生成二氨合银离子,导致银离子浓度减小,促使AgCl (s) Ag+(aq)+Cl-(aq)正向移动,沉淀溶解,故D错误;
故填BC。
18. 第二周期第IVA族 原子 直线形 离子键、非极性键(或共价键) 1∶2
【分析】根据洪特规则和泡利原理,X元素的基态电子排布为,为C元素;Y元素的次外层电子数为2,最外层电子数为6,为O元素;Z元素的单质及其化合物的焰色反应为黄色,为Na元素;根据题意,W元素的价电子排布为,为Mn元素。
【详解】(1)X为C元素,原子核外有2个电子层,最外层电子数为6,位于周期表第二周期ⅣA族,其对应的单质中金刚石的熔点高、硬度大,为原子晶体,故填第二周期ⅣA、原子;
(2)C和O位于周期表相同周期,同周期元素从左到右元素的电负性逐渐增强,则电负性较强的为O,XY2为CO2,为共价化合物,电子式为,分子中含有2个C=C键,其中有2个σ键,分子构型是直线形;故填、直线形;
(3)Z2Y2为Na2O2,为离子化合物,含有,含有离子键和非极性键,阴、阳离子的个数比为1:2,故填离子键、非极性键(或共价键)、1:2。
19. [Ar]3d6或1s22s22p63s23p63d6 O>N>P sp2 SO3 14mol 苯胺分子间可形成氢键
【详解】(1)铁是26号元素,其基态电子排布式为:1s22s22p63s23p63d64s2,失去2个电子变成亚铁离子Fe2+,Fe2+基态核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6;
(2)同周期从左到右、同主族从下到上,电负性逐渐增大,根据元素在元素周期表中的位置,可知N、P、O三种元素的电负性由大到小的顺序为:O>N>P;
(3)CO32-中心原子碳原子孤对电子对数==0,杂化轨道数目=3+0=3,碳原子采取sp2杂化;CO32-的原子数为4,价电子数为24,等电子体是指具有相同原子数和相同价电子数的分子或原子团,根据等电子体的定义可知,与CO32-互为等电子体的分子有SO3、BF3等,答案为:sp2;SO3;
(4)苯胺( )中C-C键、C-H键、C-N键、N-H键均是或含有σ键,1 mol苯胺分子中含有σ键的数目共计为14mol;苯胺为分子晶体,由分子构成,苯胺与甲苯的相对分子质量相近,但苯胺的沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是苯胺分子之间存在氢键,答案为:14mol;苯胺分子间可形成氢键。
【点睛】氢键存在于分子之间而不是分子内,强度大于分子间作用力,弱于化学键。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列叙述中正确的是
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线形分子
2.第ⅤA族元素的原子R与Cl原子结合形成RCl3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法不正确的是
A.每个原子都达到8电子稳定结构
B.键角(Cl-R-Cl)有90°、120°、180°三种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.分子中5个R-Cl键键能不相同
3.已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,下列各组粒子结构不相似的是( )
A.BCl3和PH3 B.NH和CH4 C.NO和CO D.CO2和N2O
4.NA代表阿伏加德罗常数的值。下列叙述正确的是
A.NO2和N2O4组成的4.6 g混合气体所含氧原子数为0.3NA
B.124 g P4(正四面体)中P-P键数目为4NA
C.常温常压下,1.8 g D2O含有的质子数、电子数、中子数均为NA
D.标准状况下,2.24 L乙烯中含有的π键数目为 0.1NA
5.下列说法中不正确的是( )
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,2个π键
6.随原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列关于说法中不正确的是
A.f在元素周期表的位置是第3周期ⅢA族。
B.d、e常见离子的半径大小:r(O2-)>r(Na+)
C.g、h的最高价氧化物对应的水化物的酸性强弱是:HClO4>H2SO4
D.x2d2的结构式:
7.根据杂化轨道理论和价层电子对互斥模型,对下列分子或者离子的判断完全正确的是
选项 化学式 中心原子杂化方式 价层电子对互斥模型 分子或离子的立体构型
A sp2 正四面体形 三角锥形
B H2O sp2 四面体形 V形
C NH3 sp3 三角锥形 平面三角形
D CH4 sp3 正四面体形 正四面体形
A.A B.B C.C D.D
8.甲烷分子(CH4)失去一个H+,形成甲基阴离子(),在这个过程中,下列描述不合理的是
A.碳原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
9.下列现象与氢键有关的是
①NH3的熔、沸点比VA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素(CO(NH2)2)的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
10.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
A.H2S、CS2、HI都是直线形的分子
B.COCl2、BF3、SO2都是平面三角形的分子
C.BF3键角为120°,SnBr2键角小于120°
D.PCl3、NH3、PCl5的VSEPR构型相同
11.吡啶是含有一个氮原子的六元杂环化合物,结构简式如下图,可以看作苯分子中的一个(CH)被取代的化合物,故又称为氮苯。下列有关吡啶的说法正确的是
A.吡啶分子中含有Π的大π键
B.吡啶分子为非极性分子
C.吡啶的分子式为C5H6N
D.吡啶分子中含有10个σ键
二、多选题
12.实验室中常用丁二酮肟来检验Ni2+, 反应时形成双齿配合物。离子方程式如下:
下列说法错误的是
A.丁二酮肟分子中碳原子与氮原子的杂化方式均为sp2
B.基态Ni2+的电子排布式为1s22s22p63s23p63d8
C.每个二(丁二酮肟)合镍(II)含有32个σ键
D.二(丁二酮肟)合镍( II )的中心原子的配体数目和配位数均为4
13.下列有关微粒性质的排列顺序,正确的是
A.键角:BF3>CH4>H2O>NH3 B.热稳定性:CH4>NH3>H2O>HF
C.沸点:H2O>HF>NH3>CH4 D.第一电离能:P>S>Si>Sn
14.根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体,等电子体之间结构相似、物理性质也相近,以下各组粒能互称为等电子体的是
A.和 B.和 C.和 D.和
15.据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性炭(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述正确的是
A.图中阴影部分表示H2S分子的吸附与离解,离解过程消耗能量
B.H2S中H-S的键能大于H2O中H-O键的键能
C.H2S中H-S-H的键角小于H2O中H–O-H键的键角
D.图中反应过程中只有H–S键的断裂,没有H–S键的形成
三、填空题
16.下表是元素周期表短周期的一部分:
请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为______;
(2)用电子式表示元素④与元素⑥形成的化合物的形成过程______;
(3)比元素⑦的原子序数多17的元素在周期表的位置为______;
(4)写出由①④⑤三种元素组成的一种离子化合物的电子式______,若将其溶于水,破坏了其中的______(填“离子键”、“共价键”或“离子键和共价键”);
17.配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:
I.向黄色的FeCl3溶液中加入无色的KSCN溶液,溶液变成血红色。该反应在有的教材中用方程式FeCl3+3KSCN=Fe(SCN)3+3KCl表示。
(1)经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。请按要求填空:
①若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色。该离子的离子符号是______。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为______。
(2)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,这是由于______(填字母代号)。
A.与Fe3+配合的SCN-数目增多 B.血红色离子的数目增多 C.血红色离子的浓度增加
(3)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色,表示该反应的离子方程式为:______;能使该反应发生的可能原因是______。
II.已知:在溶液中为橙色,在溶液中为黄色
(1)下列反应曾用于检测司机是否酒后驾驶:2+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
①基态Cr原子外围电子排布图为______;配合物[Cr(H2O)6]3+中与Cr3+形成配位键的原子是______(填元素符号)。
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为______。
(2)有下列实验:
①呈天蓝色的离子的化学式为______,溶剂X可以是______(填名称),继续添加氨水,沉淀溶解的离子方程式为______。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是______。
③下列有关化学实验的“操作→现象→解释”均正确的是______。
选项 操作 现象 解释
A 向某溶液中滴加KSCN溶液 产生红色沉淀 Fe3++3SCN-=Fe(SCN)3↓
B 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 产生0.2mol沉淀 已知Cr3+的配位数为6,则CrCl3·6H2O的化学式可表示为[Cr(H2O)5Cl]Cl2·H2O
C 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH 溶液先橙色加深,后变为黄色 溶液中存在+H2O 2+2H+
D 向AgCl悬浊液中滴加氨水 沉淀溶解 AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl-
四、元素或物质推断题
18.X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
元素 相关信息
X X的基态原子核外3个能级上有电子,且每个能级上的电子数相等
Y 原子最外层电子数是次外层的三倍
Z 单质及其化合物的焰色反应为黄色
W W为前四周期中未成对电子数最多的元素
(1)X位于元素周期表中的位置______。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于______晶体。
(2)XY2的电子式是______;分子空间构型为______。
(3)Z2Y2中含有的化学键类型有______;阴、阳离子的个数比为______。
五、结构与性质
19.研究表明,利用FeCl2、NH4H2PO4、Li2CO3和苯胺( )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。
(1)Fe2+基态核外电子排布式为________。
(2) N、P、O三种元素的电负性由大到小的顺序为________。
(3) CO32-中心原子轨道的杂化类型为________;与CO32-互为等电子体的一种分子为________(填化学式)。
(4) 1mol苯胺分子中含有σ键的数目为________;苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是________________________________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.NH3、CO是极性分子,CO2是非极性分子,A错误;
B.CH4、CCl4均含有极性键,但它们的空间结构对称且无孤电子对,为非极性分子,B正确;
C.元素的非金属性越强,气态氢化物的稳定性越强,F、Cl、Br、I的非金属性依次减弱,HF、HCl、HBr、HI的稳定性依次减弱,C错误;
D.CS2、C2H2是直线形分子,H2O是V形分子,D错误;
故选B。
【点睛】判断分子极性的一般方法:①双原子分子:同核的是非极性分子,异核的是极性分子;②多原子分子:空间结构对称且无孤电子对的是非极性分子,空间结构不对称或含有孤电子对的是极性分子。
2.A
【详解】A.第ⅤA族元素的R原子最外层有5个电子,形成5个共用电子对,所以RCl5中R的最外层电子数为10,不满足8电子稳定结构,故A错误;
B.上下两个顶点与中心R原子形成的键角为180°,中间为平面三角形,构成三角形的键角为120°,顶点与平面形成的键角为90°,所以键角(Cl-R-Cl)有90°、120、180°几种,故B正确;
C.RCl5RCl3+Cl2↑,RCl3中R采用sp3杂化,有一个孤电子对,为三角锥形结构,故C正确;
D.键长越短,键能越大,分子中5个R-Cl键的键长不同,所以键能不同,故D正确;
故选A。
3.A
【详解】A.BCl3和PH3中,前者的价电子数为24,后者的价电子数为8,二者的结构不相似,A符合题意;
B.NH和CH4都由5个原子构成,价电子数都为10,二者结构相似,B不符合题意;
C.NO和CO都由4个原子构成,价电子数都为24,二者的结构相似,C不符合题意;
D.CO2和N2O都由3个原子构成,价电子数都为16,二者的结构相似,D不符合题意;
故选A。
4.D
【详解】A.NO2和N2O4的最简式相同,都是NO2,4.6 g NO2的物质的量为0.1mol,所含氧原子数为0.2NA,故A错误;
B.P4分子中含有6个P-P键,124 g P4分子的物质的量为1mol,则1mol P4分子中含有P-P键数目为6NA,故B错误;
C.D2O含有的质子数为10、电子数为10、中子数10,1.8 g D2O的物质的量为0.9mol,则0.9mol D2O含有的质子数、电子数、中子数均为0.9NA,故C错误;
D.乙烯分子的结构简式为CH2=CH2,双键中含有1个δ键和1个π键,标准状况下,2.24 L乙烯的物质的量为1mol,则1mol乙烯中含有的π键数目为 0.1NA,故D正确;
故选D。
5.C
【详解】A. σ键是头碰头的重叠,π键是肩并肩的重叠,σ键比π键重叠程度大,σ键比π键稳定,故A正确;
B. 两个原子间只能形成1个σ键,两个原子之间形成双键时,含有一个σ键和一个π键,两个原子之间形成三键时,含有一个σ键和2个π键,故B正确;
C. 单原子分子中没有共价键,如稀有气体分子中不存在σ键,故C错误;
D. 两个原子之间形成三键时,含有一个σ键和2个π键,N2分子中含有一个三键,即有一个σ键,2个π键,故D正确。
故选C。
6.D
【分析】8种元素为短周期元素,在同一周期中,从左向右原子半径逐渐变小,同一主族,从上到下原子半径逐渐变大,主族元素最高正化合价一般等于族序数,最低负价=8-主族族序数,从图中的化合价、原子半径的大小及原子序数可知,x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,据此进行解答;
【详解】A. f为Al元素,在元素周期表的位置是第3周期ⅢA族,A正确;
B. d是O元素,e是Na元素,电子层结构相同的离子,核电荷数大者离子半径小,d、e简单离子的半径大小:r(O2-)>r(Na+),B正确;
C. 非金属性越强,最高价氧化物对应的水化物的酸性越强, g是S元素,h是Cl元素,g、h的最高价氧化物对应的水化物的酸性强弱是:HClO4>H2SO4,C正确;
D. x2d2的为过氧化氢,属于共价化合物,结构式:H-O-O-H,D不正确;
答案选D。
7.D
【详解】A.的中心S原子的价层电子对数为4,发生sp3杂化,A不正确;
B.H2O的中心O原子的价层电子对数为4,发生sp3杂化,B不正确;
C.NH3的中心N原子价层电子对数为4,由于孤对电子的排斥作用,分子呈三角锥形,C不正确;
D.CH4的中心C原子的价层电子对数为4,发生sp3杂化,所以价层电子对互斥模型、分子或离子的立体构型都呈正四面体形,D正确;
故选D。
8.A
【详解】A.甲烷分子(CH4)失去一个H+,形成甲基阴离子(),两微粒中C原子的价层电子数都是为4,碳原子杂化方式均为sp3杂化,故A错误;
B.甲烷为正四面体型结构,为三角锥形结构,微粒形状发生变化,故B正确;
C.甲烷稳定,带负电荷不稳定,故C正确;
D.甲烷为正四面体型结构,为三角锥形结构,碳原子含有孤对电子,其键角比甲烷中键角小,故D正确;
故答案为A。
9.B
【详解】①NH3的熔、沸点比VA族其他元素氢化物的高是因为氨气存在分子间氢键,故①符合题意;②小分子的醇、羧酸与水形成分子间氢键,因此小分子的醇、羧酸可以和水以任意比互溶,故②符合题意;③冰中水与周围四个水分子以分子间氢键形成四面体结构,中间有空隙,因此冰的密度比液态水的密度小,故③符合题意;④尿素[CO(NH2)2]存在分子间氢键,因此尿素的熔、沸点比醋酸的高,故④符合题意;⑤邻羟基苯甲酸存在分子内氢键,对羟基苯甲酸存在分子间氢键,因此邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤符合题意;⑥水分子高温下也很稳定主要是氧氢键稳定,难断裂,故⑥不符合题意;因此①②③④⑤都与氢键有关,故B符合题意。
综上所述,答案为B。
10.C
【详解】A. 中心原子S原子采取sp 杂化,电子对构型为正四面体形,分子构型为V形,H—S—H键角为92.1°,即H2S为V型分子,CS2、HI都是直线形的分子,故A错误;
B.SO2中,且含有2个孤电子对,所以SO2为V形结构;BF3中,所以BF3是键角为120°的平面三角形结构,COCl2中,为平面三角形分子,故B错误;
C.由B可知BF3键角为120°,SnBr2中,且含有一个孤电子对,为V形结构,孤对电子与成键电子对之间的排斥力大于成键电子对之间的排斥力,所以SnBr2键角小于120°,故C正确;
D.NH3、PCl3中,且含有一个孤电子对,所以PCl3、NH3为三角锥形结构;PCl5中,且不含孤对电子,为三角双锥结构,故D错误。
答案选C
11.A
【详解】A.吡啶分子与苯分子是等电子体,其结构相似,苯分子中含有Π的大π键,故吡啶分子中也含有Π的大π键,A说法正确;
B.吡啶分子的正负电荷的重心不能重合,故其为极性分子,B不正确;
C.吡啶可以看作苯分子中的一个(CH)被N取代的化合物,故其的分子式为C5H5N,C不正确;
D.吡啶分子中C-C、C-H、C-N均为σ键,共含有11个σ键,D不正确。
本题选A。
12.AD
【详解】A.由丁二酮肟分子结构可知,分子中有的碳原子形成1个双键和2个单键,碳原子的杂化方式为sp2杂化,还有的碳原子全部是单键,碳原子的杂化方式为sp3杂化,选项A错误;
B.镍元素的核电荷数为28,失去2个电子形成镍离子,则基态Ni2+的电子排布式为1s22s22p63s23p63d8,选项B正确;
C.由二(丁二酮肟)合镍(II)的结构可知,配合物中含有4个配位键、4个双键和24个单键,共32个σ键,选项C正确;
D.由二(丁二酮肟)合镍(II)的结构可知,配合物的中心原子为镍离子,配位数为4,配位体为二个丁二酮肟,选项D错误;
答案选AD。
13.CD
【详解】A.BF3、CH4、H2O、NH3的键角分别为120°、109°28′、104.5°、107°18′,所以键角大小顺序为:BF3>CH4>NH3>H2O,A不正确;
B.因为非金属性F>O>N>C,所以热稳定性:HF>H2O>NH3>CH4,B不正确;
C.因为NH3、H2O、HF分子间都能形成氢键,水中氢键比氟化氢多,常温下,氨气为气体,所以沸点:H2O>HF>NH3>CH4,C正确;
D.因为非金属性S>P>Si>Sn,但P的3p轨道半充满,电子的能量低,第一电离能反常,所以第一电离能:P>S>Si>Sn,D正确;
故选CD。
14.CD
【详解】A.三氧化硫和亚硫酸根的原子个数相同,电子总数一定不同,不能互称为等电子体,故A错误;
B.肼和乙烯的的原子个数相同,电子总数一定不同,不能互称为等电子体,故A错误;
C.一氧化碳和氮气的原子个数相同,电子总数都为14,能互称为等电子体,故C正确;
D.碳酸根和硝酸根的原子个数相同,电子总数都为32,能互称为等电子体,故D正确;
故选CD。
15.AC
【详解】A.图中阴影部分H2S(g)→H2S(ad)为H2S在催化剂表面的吸附,H2S(ad)→2H(ad)+S(ad)表示H2S的离解,离解过程有化学键的断裂,消耗能量,故A正确;
B.S原子的半径大于O原子,所以H-S键的键长大于H-O键,H-S的键能较弱,故B错误;
C.H2S和H2O中均含有两对孤电子对,分子空间构型为V形,但在水分子中由于O元素的电负性大于S,成键电子对更靠近O原子,排斥作用更大,键角更大,故C正确;
D.据图可知阴影部分出现H(ad)、S(ad),有H-S键的断裂,部分S(g)与H2(g)生成H2S(g),存在H-S键的形成,故D错误;
综上所述答案为AC。
16. Cl >O2 >Mg2+ 第四周期第IVA族 离子键
【分析】根据各元素在元素周期表中的位置,①为H元素;②为与第二周期第ⅡA族,为C元素;同理③为N元素;④为O元素;⑤位于第三周期第IA族,为Na元素;同理⑥为Mg元素;⑦为P元素;⑧为S元素;⑨为Cl元素。
【详解】(1)由于离子核外电子层数越多,离子半径越大,当离子核外电子层数相同时,核电荷数越大,离子半径越小;Cl 核外有3个电子层,O2 、Mg2+核外都有2个电子层,所以Cl 的半径最大,O2 半径次之,Mg2+的离子半径最小,故元素④、⑥、⑨的离子半径由大到小的顺序为Cl >O2 >Mg2+,故填Cl >O2 >Mg2+;
(2)Mg原子失去电子形成Mg2+,O原子获得电子形成O2 ,Mg2+与O2 通过静电作用形成离子键,用电子式表示为,故填;
(3)元素⑦是P元素,它的原子序数是15,比该元素的原子序数大17的元素是32,其核外电子排布是2、8、18、4,所以该元素位于第四周期第IVA族,故填第四周期第IVA族;
(4)①④⑤三种元素分别是H、O、Na,三种元素形成的离子化合物是NaOH,其电子式是;NaOH是离子化合物,含有离子键、共价键,当其溶于水电离产生OH 、Na+,所以断裂的是离子键,故填、离子键。
17. Fe(SCN)2+ FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl C Fe(SCN)3+3F =FeF3+3SCN Fe3+结合F 的能力大于结合SCN 的能力 O H2O与CH3CH2OH分子间能形成氢键 [Cu(H2O)4]2+ 乙醇 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- NH3>H2O BC
【详解】I.(1)①Fe3+与SCN 以个数比1:1配合物离子,离子带2个单位正电荷,该配合物离子为Fe(SCN)2+,故填Fe(SCN)2+;
②若Fe3+与SCN 以个数比1:5配合,该配离子为[Fe(SCN)5]2 ,则FeCl3与KSCN在水溶液中发生反应的化学方程式为FeCl3+5KSCN═K2[Fe(SCN)5]+3KCl,故填FeCl3+5KSCN=K2[Fe(SCN)5]+3KCl;
(3)向上述血红色溶液中继续加入浓KSCN溶液,溶液血红色加深,因平衡正向移动,血红色离子的浓度增加,故填C;
(4)向上述血红色溶液中加入NaF溶液振荡,只观察到血红色溶液迅速褪成无色溶液,表示该反应的离子方程式为Fe(SCN)3+3F =FeF3+3SCN ;能使该反应发生的可能原因是Fe3+结合F 的能力大于结合SCN 的能力,故填Fe(SCN)3+3F =FeF3+3SCN 、Fe3+结合F 的能力大于结合SCN 的能力;
II.(1)①Cr位于周期表第四周期ⅥB族,原子核外电子排布为1s22s22p63s23p63d54s1,外围电子排布图为:;配合物[Cr(H2O)6]3+中Cr3+为中心离子,H2O为配体,O原子提供孤对电子,与Cr3+形成配位键,形成配位键的原子是:O,故填、O;
②CH3CH2OH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为H2O与CH3CH2OH分子间能形成氢键,故填H2O与CH3CH2OH分子间能形成氢键;
(2)①呈天蓝色的离子的化学式为[Cu(H2O)4]2+;加入X的作用是降低溶剂的极性,减小Cu(NH3)4SO4 H2O的溶解度,试剂X可以是乙醇;继续添加氨水,沉淀溶解的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故填[Cu(H2O)4]2+、乙醇、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
②天蓝色的离子[Cu(H2O)4]2+最终转换成了深蓝色的[Cu(NH3)4]2+,说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是:NH3>H2O,故填NH3>H2O;
③A.KSCN溶液与Fe3+溶液作用的方程式为:Fe3++3SCN- Fe(SCN)3,该反应时可逆反应,故A错误;
B.氯化铬(CrCl3 6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铬(CrCl3 6H2O)化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3 6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2 H2O,故B正确;
C.在反应(橙色)+H2O2(黄色)+2H+中,向K2Cr2O7溶液中滴加3滴浓H2SO4,氢离子浓度增大,平衡逆向移动,则溶液橙色加深或溶液颜色加深,加入NaOH,氢离子浓度减小,平衡正向移动,则溶液由橙色变为黄色,故C正确;
D.Ag+与氨气分子结合生成二氨合银离子,导致银离子浓度减小,促使AgCl (s) Ag+(aq)+Cl-(aq)正向移动,沉淀溶解,故D错误;
故填BC。
18. 第二周期第IVA族 原子 直线形 离子键、非极性键(或共价键) 1∶2
【分析】根据洪特规则和泡利原理,X元素的基态电子排布为,为C元素;Y元素的次外层电子数为2,最外层电子数为6,为O元素;Z元素的单质及其化合物的焰色反应为黄色,为Na元素;根据题意,W元素的价电子排布为,为Mn元素。
【详解】(1)X为C元素,原子核外有2个电子层,最外层电子数为6,位于周期表第二周期ⅣA族,其对应的单质中金刚石的熔点高、硬度大,为原子晶体,故填第二周期ⅣA、原子;
(2)C和O位于周期表相同周期,同周期元素从左到右元素的电负性逐渐增强,则电负性较强的为O,XY2为CO2,为共价化合物,电子式为,分子中含有2个C=C键,其中有2个σ键,分子构型是直线形;故填、直线形;
(3)Z2Y2为Na2O2,为离子化合物,含有,含有离子键和非极性键,阴、阳离子的个数比为1:2,故填离子键、非极性键(或共价键)、1:2。
19. [Ar]3d6或1s22s22p63s23p63d6 O>N>P sp2 SO3 14mol 苯胺分子间可形成氢键
【详解】(1)铁是26号元素,其基态电子排布式为:1s22s22p63s23p63d64s2,失去2个电子变成亚铁离子Fe2+,Fe2+基态核外电子排布式为[Ar]3d6或1s22s22p63s23p63d6;
(2)同周期从左到右、同主族从下到上,电负性逐渐增大,根据元素在元素周期表中的位置,可知N、P、O三种元素的电负性由大到小的顺序为:O>N>P;
(3)CO32-中心原子碳原子孤对电子对数==0,杂化轨道数目=3+0=3,碳原子采取sp2杂化;CO32-的原子数为4,价电子数为24,等电子体是指具有相同原子数和相同价电子数的分子或原子团,根据等电子体的定义可知,与CO32-互为等电子体的分子有SO3、BF3等,答案为:sp2;SO3;
(4)苯胺( )中C-C键、C-H键、C-N键、N-H键均是或含有σ键,1 mol苯胺分子中含有σ键的数目共计为14mol;苯胺为分子晶体,由分子构成,苯胺与甲苯的相对分子质量相近,但苯胺的沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是苯胺分子之间存在氢键,答案为:14mol;苯胺分子间可形成氢键。
【点睛】氢键存在于分子之间而不是分子内,强度大于分子间作用力,弱于化学键。
答案第1页,共2页
答案第1页,共2页
