第3章第1节认识晶体同步练习(含答案)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第3章第1节认识晶体同步练习(含答案)2022-2023学年下学期高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 19:20:25 | ||
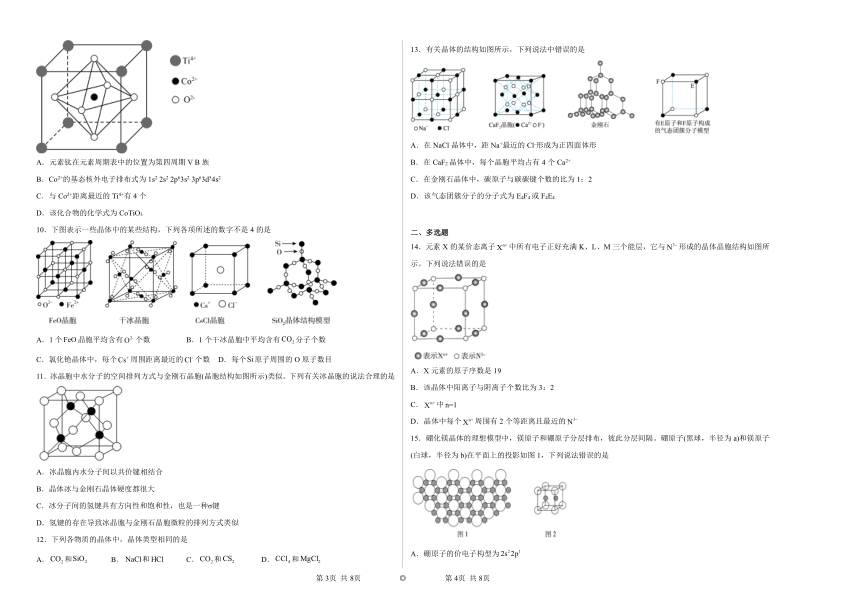
图片预览




文档简介
第3章第1节认识晶体同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.氮化硼是一种超硬、耐磨、耐高温的新型材料。下列各组物质中,晶体类型与氮化硼相同的是
A.金刚石和C60 B.碳化硅和水晶
C.水银和铝 D.硝酸钠和刚玉
2.下列各组物质中,化学键类型与晶体类型均相同的是
A.、 B.、
C.、 D.、
3.对物质的研究可改善我们的生活。下列描述错误的是
A.纳米晶体会有不同于大块晶体的特性,主要原因是晶体的表面积增大
B.用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是相同的
C.超分子具有分子识别与自组装的特征
D.等离子体和离子液体都具有良好的导电性
4.晶体内微粒总是按周期性规律重复排列,反映其结构特点的基本重复单位为晶胞,晶体可视为晶胞经平移无隙并置而成。以下是某些晶体的局部结构,可做为晶胞的是
A. (都在顶点) B. (在顶点和面心)
C. (在顶点和面心) D. (在顶点和体心)
5.2021年4月华人科学家苗建伟教授团队在《Nature》发文称,团队在国际上首次实现了对金属玻璃中所有原子的3D位置的实验测定。金属玻璃就是由金属元素或金属元素为主要成分的熔体通过快速冷却得到的具有非晶态结构的金属固体。以下关于金属玻璃的说法正确的是
A.金属玻璃能自发呈现多面体外形
B.金属玻璃具有固定的熔点
C.鉴别金属玻璃是否为晶体最可靠的科学方法为X射线衍射实验
D.金属玻璃是金属与二氧化硅的混合物
6.晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示,下列有关说法正确的是
A.每个晶胞中含有8个K、6个O、1个1
B.的空间构型为四面体形
C.与K紧邻的O的个数为6个
D.在晶胞结构的另一种表示中,若I处于各顶角位置,O处于棱心位置,则K处于体心位置
7.某化学兴趣小组在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
熔点/℃ 801 712 190 -68 782
沸点/℃ 1465 1418 178 57 1600
根据表中数据分析,属于分子晶体的是
A. B.
C. D.
8.如图是某化合物的晶体结构,镁原子间形成正六棱柱,且棱柱的上、下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为
A. B. C. D.
9.钴的一种化合物的晶胞结构如图所示,下列说法正确的是
A.元素钛在元素周期表中的位置为第四周期V B族
B.Co2+的基态核外电子排布式为1s2 2s2 2p63s2 3p63d54s2
C.与Co2+距离最近的Ti4+有4个
D.该化合物的化学式为CoTiO3
10.下图表示一些晶体中的某些结构,下列各项所述的数字不是4的是
A.1个晶胞平均含有个数 B.1个干冰晶胞中平均含有分子个数
C.氯化铯晶体中,每个周围距离最近的个数 D.每个原子周围的O原子数目
11.冰晶胞中水分子的空间排列方式与金刚石晶胞(晶胞结构如图所示)类似。下列有关冰晶胞的说法合理的是
A.冰晶胞内水分子间以共价键相结合
B.晶体冰与金刚石晶体硬度都很大
C.冰分子间的氢键具有方向性和饱和性,也是一种σ键
D.氢键的存在导致冰晶胞与金刚石晶胞微粒的排列方式类似
12.下列各物质的晶体中,晶体类型相同的是
A.和 B.和 C.和 D.和
13.有关晶体的结构如图所示,下列说法中错误的是
A.在NaCl晶体中,距Na+最近的Cl-形成为正四面体形
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为E4F4或F4E4
二、多选题
14.元素X的某价态离子中所有电子正好充满K、L、M三个能层,它与形成的晶体晶胞结构如图所示。下列说法错误的是
A.X元素的原子序数是19
B.该晶体中阳离子与阴离子个数比为3:2
C.中
D.晶体中每个周围有2个等距离且最近的
15.硼化镁晶体的理想模型中,镁原子和硼原子分层排布,彼此分层间隔。硼原子(黑球,半径为a)和镁原子(白球,半径为b)在平面上的投影如图1,下列说法错误的是
A.硼原子的价电子构型为
B.硼化镁晶体的晶胞结构可用图2表示
C.该晶体的化学式为
D.晶胞边长为
三、填空题
16.回答下列问题
(1)元素铜的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________。
(2)为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。
(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为___________,该功能陶瓷的化学式为___________。
(4)某晶体结构模型如图所示。该晶体的化学式是___________,在晶体中1个原子或1个原子周围距离最近的O原子数目分别为___________个、___________个。
(5)有一种钛原子和碳原子构成的气态团簇分子,其结构如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为___________(填字母)。
A. B. C. D.
17.铁及铁的化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态的最外层电子排布式为:________。
(2)工业上常利用与形成稳定;(六氰合亚铁离子)的特性来处理含的工业废水。在中C原子的杂化方式为_______,写出的电子式:_______。
(3)三氯化铁易溶于水,也易溶于乙醚等有机溶剂。它在300℃以上易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,其结构如图所示。请判断三氯化铁的晶体类型为_______。
(4)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中黑色小球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为_______。
四、元素或物质推断题
18.前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中键和键数目之比为1∶2,D的最高化合价和最低化合价代数和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为_______;基态D原子核外电子占据的能量最高的能级符号为_______。
(2)A元素的各级电离能数据如表:
符号
电离能/() 800.6 2427 3660 25026 32827
分析表中数据可知,相邻两级的电离能中,和之间差异最大,其主要原因是_______。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是_______。
(4)氯元素与A、B、C元素组成的共价分子、、中,中心原子采用杂化、空间结构为三角锥形的是_______(填分子式)。
(5)为热色性固体,且有色温效应.其颜色在低于℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色.在淡黄色→橙黄色→深红色的转化中,破坏的作用力是_______;在常压下,高于130℃分解为相应的单质,这一变化中破坏的作用力是_______.在B、C、D的简单气态氢化物中,属于非极性分子的是_______(填分子式)。
(6)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子).已知:该晶体密度为,代表阿伏加德罗常数的值。
①该晶体的化学式为_______。
②在该晶体中,A与C形成共价键的键长(d)为_______。
19.如图所示是部分短周期主族元素单质熔点的变化图,根据此图回答下列问题:
(1)③号元素在元素周期表中的位置是__________________________________,该元素的一种同素异形体能导电,该同素异形体的名称是__________________________________。
(2)⑤⑥两种元素的最高价氧化物对应的水化物之间相互反应的离子方程式为______________________。
(3)⑦号元素的原子结构示意图为____________________________________________________。
(4)②④两种元素形成的化合物晶体有两种结构,其中一种结构与金刚石相似,具有该结构的晶体属于______________________晶体,若使其熔化,需破坏的是________________________________。
(5)写出⑤和⑧形成的常见化合物的电子式________________________________________________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质,则氮化硼属于共价晶体,熔化时所克服的微粒间的作用力为共价键,然后判断选项中的晶体为原子晶体来解答。
【详解】A.金刚石是共价晶体,C60是分子晶体,故A不选;
B.水晶是SiO2晶体,碳化硅和二氧化硅都是共价晶体,熔化克服共价键,故B选;
C.水银和铝都是金属,故C不选;
D.硝酸钠是离子晶体,刚玉是氧化铝,都属于离子晶体,故D不选;
正确答案是B。
2.C
【详解】A.NaCl中只有离子键,NaOH中有离子键和极性共价键,两者都是离子晶体,A不符合题意;
B.SiO2、SO2中都只有极性共价键,SiO2是共价晶体,SO2是分子晶体,B不符合题意;
C.Na2CO3、KClO3中都含有离子键和极性共价键,二者都是离子晶体,C符合题意;
D.H2O2中含有极性共价键和非极性共价键,Na2O2中含有离子键和非极性共价键,H2O2是分子晶体,Na2O2是离子晶体,D不符合题意;
故选C。
3.B
【详解】A.纳米晶体的表面积更大,因此有不同于大块晶体的特性,A正确;
B.石英玻璃为非晶态SiO2,水晶为晶态SiO2,二者研成粉末摄取的X射线衍射图谱不相同,B错误;
C.分子识别与自组装是超分子的特征,C正确;
D.等离子体和离子液体都具有良好的导电性,D正确;故答案为B。
4.B
【详解】按照题意,晶体可视为晶胞经平移无隙并置而成,是指相邻晶胞之间没有任何间隙,所有晶胞平行排列,取向相同。由此可知,平移后,重合位置的原子相同。
A.不管是左右或上下平移时,大圆表示的原子和小圆表示的原子位置重合,但不是同一种原子,因此该结构不能作为晶胞,A错误;
B.不管是上下平移还是左右平移,各原子都可以与相同的原子重叠,可平移无隙并置得到晶体,因此该结构可以作为晶胞,B正确;
C.上下平移时,位于面心的两个不同的原子位置会重合,因此该结构不能作为晶胞,C错误;
D.该结构平移时会存在空隙,因此不能作为晶胞,D错误;
答案选B。
5.C
【详解】A.金属玻璃属于类似于玻璃态的一种非晶体结构,因此不能自发呈现多面体外形,A错误;
B.非晶体没有固定的熔点,B错误;
C.鉴别晶体与非晶体最可靠的科学方法是进行X射线衍射实验,C正确;
D.金属玻璃由金属元素或金属元素为主要成分的熔体通过快速冷却形成的,与二氧化硅无关,D错误;
故选C。
6.D
【详解】A.K位于晶胞的顶点,O位于晶胞的面心,I位于晶胞的体内,故每个晶胞中含有1个K、3个O、1个I,A错误;
B.中I的价层电子对数为,I采取杂化,则的空间构型为三角锥形,B错误;
C.O位于面心,K位于顶点,与K紧邻的O的个数为12个,C错误;
D.在晶胞结构的另一种表示中,I处于各顶角位置,个数为,O位于棱心位置,每个棱为4个晶胞共有O个数为,K的个数为1,应位于体心位置,D正确;
故选D。
7.B
【分析】由表中氯化物熔、沸点可知,一般情况下,熔、沸点较低的是分子晶体,熔沸点较高的是离子晶体。
【详解】由分析可知,SiCl4、AlCl3的熔沸点都很低,因此形成的晶体是分子晶体。NaCl、MgCl2、CaCl2的熔沸点很高,所以形成的晶体应该是离子晶体,通过离子键结合,故B正确;
故答案选B。
8.A
【详解】利用均摊法计算晶胞的微粒个数可知,镁原子间形成正六棱柱,且棱柱的上、下底面还各有一个镁原子,故一个晶胞中镁原子的个数为;6个硼原子位于棱柱侧面上,故硼原子数为,所以晶胞中镁原子和硼原子的个数比为1∶1,故化学式为,A项正确;
故选A。
9.D
【详解】A.元素钛在元素周期表中的位置为第四周期 IV B族,A错误;
B.Co原子失去最外层的两个电子形成Co2+,故Co2+的基态核外电子排布式为1s22s22p63s23p63d7,B错误;
C.由图可知,与Co2+距离最近的Ti4+有8个,C错误;
D.该晶胞中,Co2+的个数为1,Ti4+的个数为8×=1,O2-的个数为6×=3,则该化合物的化学式为CoTiO3,D正确;
故选D。
10.C
【详解】A.氧化亚铁晶胞中O2-数目×12+1=4,A不符合题意;
B.1个干冰晶胞中平均含有CO2分子个数×8+×6=4,B不符合题意;
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数是8,C符合题意;
D.在二氧化硅晶体结构中,一个硅原子与四个氧原子形成Si-O键,D不符合题意;
故选C。
11.D
【详解】A.冰晶胞内水分子间以氢键相结合,A错误;
B.晶体冰为分子晶体,硬度很小;金刚石为原子晶体,硬度很大,B错误;
C.冰分子间的氢键具有方向性和饱和性,但氢键不属于化学键,不是σ键,C错误;
D.水分子中氧原子和金刚石中碳原子均为sp3杂化,水分子中氧原子与2个氢原子结合后还有2对孤电子对,可以与另外2个水分子中氢原子形成氢键,故每个水分子与相邻4个水分子形成4个氢键,导致冰晶胞与金刚石晶胞微粒的排列方式类似,D正确;
故选D。
12.C
【详解】A. CO2形成的晶体为分子晶体,SiO2形成的晶体为原子晶体,晶体类型不相同,故A错误;
B.NaCl形成的晶体为离子晶体,HCl形成的晶体为分子晶体,晶体类型不相同,故B错误;
C.CO2形成的晶体为分子晶体,CS2形成的晶体为分子晶体,晶体类型相同,故C正确;
D.CCl4形成的晶体为分子晶体,MgCl2形成的晶体为离子晶体,晶体类型不相同,故D错误;
故选C。
13.A
【详解】A.据图可知距Na+最近的Cl-位于棱心和体心,共6个,形成正八面体,A错误;
B.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,B正确;
C.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,C正确;
D.该物质由分子构成,据图可知每个分子含有4个F原子,4个E原子,所以分子式为E4F4或F4E4,D正确;
综上所述答案为A。
14.AB
【详解】A.从“元素X的某价态离子中所有电子正好充满K、L、M三个能层”可知,中共有28个电子,A项错误;
B.图中位于每条棱的中点,一个晶胞拥有X的个数为,位于顶点,一个晶胞拥有的个数为,阳离子与阴离子个数比为3:1,B项错误;
C.该物质的化学式为,故X显价,C项正确;
D.的配位数为2,D项正确;
故选:AB。
15.BC
【详解】A.硼原子的原子序数为5,其价电子排布式为2s22p1,A正确;
B.图2中Mg原子位于晶胞的顶点,原子个数为8×=1,B原子位于晶胞的内部,原子个数为2个,其化学式为MgB2,与图1相符,故图2为晶胞结构,B错误;
C.根据图1可知,1个B原子被3个Mg原子共用,即属于1个Mg原子的B原子为,同理,1个Mg原子被6个B原子共用,即用于一个B原子的Mg原子为,所以晶胞中原子个数比Mg:B=:=1:2,化学式为MgB2,C错误;
D.由图2可知,边长为2个白球圆心的距离,图1中3个连续最近的白球的中心组成一个等边三角形,如图,在等边三角形中作辅助线,如图(a、b、c为白球的球心,d为黑球的球心),ac即为晶胞边长,设晶胞边长为x,ae长度为x,ad长度为(a+b),则cos30°==,解得x=(a+b),D正确;
故选BC。
16.(1)
(2)16
(3) 2
(4) 6 12
(5)A
【详解】(1)由晶胞结构可知白球有8个位于顶点,6个位于面心,个数为,黑球4个在体内,则Cu和Cl的原子个数比为1:1,化学式为,故答案为:;
(2)内部有4个氧原子,其余氧原子位于面心和顶点,则氧原子个数为:,结合化学式可知铜原子个数为O的2倍,含16个,故答案为:16;
(3)黑球有1个在体内、4个在棱上,个数为:,白球1个在体内、8个在顶点,个数为:,则该晶胞种B、N个数均为2,化学式为BN。故答案为:2;BN;
(4)该晶胞中6个O原子位于面心,个数为,Co原子由8个位于顶点,个数为,Ti原子1个在体内,则该晶胞的化学式为:,由晶胞结构可知1个Ti原子周围有6个O原子,1个Co周围有12个O,故答案为:;6;12;
(5)该结构表示团簇分子,含有14个Ti和13个C,化学式为,故答案为:;
17.(1)
(2) sp
(3)分子晶体
(4)1:2
【详解】(1)根据铁原子的电子排布式:,的电子排布式为:;
(2)的结构式中,直线型,所以C原子的杂化方式为sp;电子式为:
(3)根据已知信息,该晶体在300℃以上易升华,在400℃时其蒸气,熔沸点较低,故为分子晶体;
(4)小黑球的周围有四个灰球,而一个灰球的周围有两个黑球,故黑球与灰球的个数比为1:2,氮原子与铁原子的个数比为1:2
18. 或 3p 硼原子失去第3个电子后,达到稳定结构,不易再失去电子(或其他合理说法) B、C、N元素的非金属性依次增强 NCl3 分子间作用力(或范德华力) 化学键(或共价键) CH4 BN
【分析】A、B、C、D、E为原子序数依次增大的前四周期元素,基态B原子核外电子占据3个能级且每个能级上电子数相等,则基态B原子核外电子排布式为,故B为C元素;基态A原子核外电子占据3个轨道,且A的原子序数小于B,则基态A原子核外电子排布式为,故A为B元素;C的双原子单质分子中键和键数目之比为1:2,则C为N元素;基态E原子核外有6个未成对电子,则E处于第四周期,价层电子排布式为,故E为Cr元素;D的最高化合价和最低化合价代数和等于4,D为第ⅥA族元素,且原子序数小于Cr,故D为S元素。.综上分析,A为B元素、B为C元素、C为N元素、D为S元素、E为Cr元素。
【详解】(1)由上述分析可知E为Cr元素,基态E原子的核外电子排布式为或;D为S元素,原子的核外电子排布式为,核外电子占据的能量最高的能级符号为3p,故答案为:;3p;
(2)基态硼原子核外电子排布式为,所以硼原子失去第3个电子后,达到稳定结构,不易再失去电子,因此硼原子相邻两级的电离能中,和之间差异最大,故答案为:硼原子失去第3个电子后,达到稳定结构,不易再失去电子;
(3)B、C、N元素的非金属性依次增强,所以B、C、N元素的最高价氧化物对应的水化物酸性依次增强,故答案为:B、C、N元素的非金属性依次增强;
(4)中硼原子价层电子对数为,且不含孤电子对,采用sp2杂化,空间结构为平面三角形;CCl4分子中碳原子价层电子对数为,且不含孤电子对,采用杂化,空间结构为正四面体形;分子中N原子价层电子对数为,采用杂化,该分子中含有1个孤电子对,所以其空间结构是三角锥形,故答案为:NCl3;
(5)由已知高于130℃时发生分解可知,此过程中破坏的作用力是共价键;在低于该温度时发生颜色变化的过程中,破坏的作用力是分子间作用力(或范德华力)。C、N、S元素的简单气态氢化物中,CH4为正四面体形结构,是非极性分子;NH3为三角锥形结构,分子中正、负电中心不重合,所以是极性分子;硫原子最外层有6个电子,它和两个氢原子形成2个共用电子对后还有2个孤电子对,一共有4对电子在硫原子周围,这4对电子呈四面体形结构,其中两个方向被氢原子占据,还有2个方向被孤电子对占据,所以H2S分子呈V形,正、负电中心不重合,为极性分子,故答案为:分子间作用力(或范德华力);化学键(或共价键);CH4;
(6)①B原子(白色球)占据立方体的8个顶点和6个面心,所以有个;N原子位于晶胞内部,共4个,故该晶体的化学式为BN,故答案为:BN;
②设晶胞边长为a、键长为d,A、C连线处于晶胞体对角线上,且距离为体对角线长度的,则,根据已知条件可得,所以,故答案为:。
19. 第二周期ⅣA族 石墨 共价 共价键
【分析】据图可知①到⑨分别为Be、B、C、N、Na、Al、Si、S、Cl,据此解答。
【详解】(1)③号元素为C,位于周期表第二周期ⅣA族,C的同素异形体石墨能导电,故答案为:第二周期ⅣA族;石墨;
(2)⑤(Na)⑥(Al)两种元素的最高价氧化物对应的水化物为NaOH、Al(OH)3,它们之间相互反应的离子方程式为,故答案为:;
(3)⑦号元素为Si,它的原子结构示意图为 ,故答案为: ;
(4)②(B)④(N)两种元素形成的化合物晶体有两种结构,其中一种结构与金刚石相似,则该结构的晶体属于共价晶体,若使其熔化,需破坏共价键,故答案为:共价;共价键;
(5)⑤(Na)和⑧(S)形成的常见化合物为Na2S,它的电子式为 ,故答案为: 。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.氮化硼是一种超硬、耐磨、耐高温的新型材料。下列各组物质中,晶体类型与氮化硼相同的是
A.金刚石和C60 B.碳化硅和水晶
C.水银和铝 D.硝酸钠和刚玉
2.下列各组物质中,化学键类型与晶体类型均相同的是
A.、 B.、
C.、 D.、
3.对物质的研究可改善我们的生活。下列描述错误的是
A.纳米晶体会有不同于大块晶体的特性,主要原因是晶体的表面积增大
B.用X射线衍射摄取石英玻璃和水晶的粉末得到的图谱是相同的
C.超分子具有分子识别与自组装的特征
D.等离子体和离子液体都具有良好的导电性
4.晶体内微粒总是按周期性规律重复排列,反映其结构特点的基本重复单位为晶胞,晶体可视为晶胞经平移无隙并置而成。以下是某些晶体的局部结构,可做为晶胞的是
A. (都在顶点) B. (在顶点和面心)
C. (在顶点和面心) D. (在顶点和体心)
5.2021年4月华人科学家苗建伟教授团队在《Nature》发文称,团队在国际上首次实现了对金属玻璃中所有原子的3D位置的实验测定。金属玻璃就是由金属元素或金属元素为主要成分的熔体通过快速冷却得到的具有非晶态结构的金属固体。以下关于金属玻璃的说法正确的是
A.金属玻璃能自发呈现多面体外形
B.金属玻璃具有固定的熔点
C.鉴别金属玻璃是否为晶体最可靠的科学方法为X射线衍射实验
D.金属玻璃是金属与二氧化硅的混合物
6.晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示,下列有关说法正确的是
A.每个晶胞中含有8个K、6个O、1个1
B.的空间构型为四面体形
C.与K紧邻的O的个数为6个
D.在晶胞结构的另一种表示中,若I处于各顶角位置,O处于棱心位置,则K处于体心位置
7.某化学兴趣小组在学完分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
熔点/℃ 801 712 190 -68 782
沸点/℃ 1465 1418 178 57 1600
根据表中数据分析,属于分子晶体的是
A. B.
C. D.
8.如图是某化合物的晶体结构,镁原子间形成正六棱柱,且棱柱的上、下底面还各有一个镁原子;6个硼原子位于棱柱侧面上。则该化合物的化学式为
A. B. C. D.
9.钴的一种化合物的晶胞结构如图所示,下列说法正确的是
A.元素钛在元素周期表中的位置为第四周期V B族
B.Co2+的基态核外电子排布式为1s2 2s2 2p63s2 3p63d54s2
C.与Co2+距离最近的Ti4+有4个
D.该化合物的化学式为CoTiO3
10.下图表示一些晶体中的某些结构,下列各项所述的数字不是4的是
A.1个晶胞平均含有个数 B.1个干冰晶胞中平均含有分子个数
C.氯化铯晶体中,每个周围距离最近的个数 D.每个原子周围的O原子数目
11.冰晶胞中水分子的空间排列方式与金刚石晶胞(晶胞结构如图所示)类似。下列有关冰晶胞的说法合理的是
A.冰晶胞内水分子间以共价键相结合
B.晶体冰与金刚石晶体硬度都很大
C.冰分子间的氢键具有方向性和饱和性,也是一种σ键
D.氢键的存在导致冰晶胞与金刚石晶胞微粒的排列方式类似
12.下列各物质的晶体中,晶体类型相同的是
A.和 B.和 C.和 D.和
13.有关晶体的结构如图所示,下列说法中错误的是
A.在NaCl晶体中,距Na+最近的Cl-形成为正四面体形
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为E4F4或F4E4
二、多选题
14.元素X的某价态离子中所有电子正好充满K、L、M三个能层,它与形成的晶体晶胞结构如图所示。下列说法错误的是
A.X元素的原子序数是19
B.该晶体中阳离子与阴离子个数比为3:2
C.中
D.晶体中每个周围有2个等距离且最近的
15.硼化镁晶体的理想模型中,镁原子和硼原子分层排布,彼此分层间隔。硼原子(黑球,半径为a)和镁原子(白球,半径为b)在平面上的投影如图1,下列说法错误的是
A.硼原子的价电子构型为
B.硼化镁晶体的晶胞结构可用图2表示
C.该晶体的化学式为
D.晶胞边长为
三、填空题
16.回答下列问题
(1)元素铜的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是___________。
(2)为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。
(3)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为___________,该功能陶瓷的化学式为___________。
(4)某晶体结构模型如图所示。该晶体的化学式是___________,在晶体中1个原子或1个原子周围距离最近的O原子数目分别为___________个、___________个。
(5)有一种钛原子和碳原子构成的气态团簇分子,其结构如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为___________(填字母)。
A. B. C. D.
17.铁及铁的化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态的最外层电子排布式为:________。
(2)工业上常利用与形成稳定;(六氰合亚铁离子)的特性来处理含的工业废水。在中C原子的杂化方式为_______,写出的电子式:_______。
(3)三氯化铁易溶于水,也易溶于乙醚等有机溶剂。它在300℃以上易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,其结构如图所示。请判断三氯化铁的晶体类型为_______。
(4)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中黑色小球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为_______。
四、元素或物质推断题
18.前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中键和键数目之比为1∶2,D的最高化合价和最低化合价代数和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为_______;基态D原子核外电子占据的能量最高的能级符号为_______。
(2)A元素的各级电离能数据如表:
符号
电离能/() 800.6 2427 3660 25026 32827
分析表中数据可知,相邻两级的电离能中,和之间差异最大,其主要原因是_______。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是_______。
(4)氯元素与A、B、C元素组成的共价分子、、中,中心原子采用杂化、空间结构为三角锥形的是_______(填分子式)。
(5)为热色性固体,且有色温效应.其颜色在低于℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色.在淡黄色→橙黄色→深红色的转化中,破坏的作用力是_______;在常压下,高于130℃分解为相应的单质,这一变化中破坏的作用力是_______.在B、C、D的简单气态氢化物中,属于非极性分子的是_______(填分子式)。
(6)A、C形成立方晶体,晶体结构类似于金刚石,如图所示(白色球代表A原子,黑色球代表C原子).已知:该晶体密度为,代表阿伏加德罗常数的值。
①该晶体的化学式为_______。
②在该晶体中,A与C形成共价键的键长(d)为_______。
19.如图所示是部分短周期主族元素单质熔点的变化图,根据此图回答下列问题:
(1)③号元素在元素周期表中的位置是__________________________________,该元素的一种同素异形体能导电,该同素异形体的名称是__________________________________。
(2)⑤⑥两种元素的最高价氧化物对应的水化物之间相互反应的离子方程式为______________________。
(3)⑦号元素的原子结构示意图为____________________________________________________。
(4)②④两种元素形成的化合物晶体有两种结构,其中一种结构与金刚石相似,具有该结构的晶体属于______________________晶体,若使其熔化,需破坏的是________________________________。
(5)写出⑤和⑧形成的常见化合物的电子式________________________________________________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质,则氮化硼属于共价晶体,熔化时所克服的微粒间的作用力为共价键,然后判断选项中的晶体为原子晶体来解答。
【详解】A.金刚石是共价晶体,C60是分子晶体,故A不选;
B.水晶是SiO2晶体,碳化硅和二氧化硅都是共价晶体,熔化克服共价键,故B选;
C.水银和铝都是金属,故C不选;
D.硝酸钠是离子晶体,刚玉是氧化铝,都属于离子晶体,故D不选;
正确答案是B。
2.C
【详解】A.NaCl中只有离子键,NaOH中有离子键和极性共价键,两者都是离子晶体,A不符合题意;
B.SiO2、SO2中都只有极性共价键,SiO2是共价晶体,SO2是分子晶体,B不符合题意;
C.Na2CO3、KClO3中都含有离子键和极性共价键,二者都是离子晶体,C符合题意;
D.H2O2中含有极性共价键和非极性共价键,Na2O2中含有离子键和非极性共价键,H2O2是分子晶体,Na2O2是离子晶体,D不符合题意;
故选C。
3.B
【详解】A.纳米晶体的表面积更大,因此有不同于大块晶体的特性,A正确;
B.石英玻璃为非晶态SiO2,水晶为晶态SiO2,二者研成粉末摄取的X射线衍射图谱不相同,B错误;
C.分子识别与自组装是超分子的特征,C正确;
D.等离子体和离子液体都具有良好的导电性,D正确;故答案为B。
4.B
【详解】按照题意,晶体可视为晶胞经平移无隙并置而成,是指相邻晶胞之间没有任何间隙,所有晶胞平行排列,取向相同。由此可知,平移后,重合位置的原子相同。
A.不管是左右或上下平移时,大圆表示的原子和小圆表示的原子位置重合,但不是同一种原子,因此该结构不能作为晶胞,A错误;
B.不管是上下平移还是左右平移,各原子都可以与相同的原子重叠,可平移无隙并置得到晶体,因此该结构可以作为晶胞,B正确;
C.上下平移时,位于面心的两个不同的原子位置会重合,因此该结构不能作为晶胞,C错误;
D.该结构平移时会存在空隙,因此不能作为晶胞,D错误;
答案选B。
5.C
【详解】A.金属玻璃属于类似于玻璃态的一种非晶体结构,因此不能自发呈现多面体外形,A错误;
B.非晶体没有固定的熔点,B错误;
C.鉴别晶体与非晶体最可靠的科学方法是进行X射线衍射实验,C正确;
D.金属玻璃由金属元素或金属元素为主要成分的熔体通过快速冷却形成的,与二氧化硅无关,D错误;
故选C。
6.D
【详解】A.K位于晶胞的顶点,O位于晶胞的面心,I位于晶胞的体内,故每个晶胞中含有1个K、3个O、1个I,A错误;
B.中I的价层电子对数为,I采取杂化,则的空间构型为三角锥形,B错误;
C.O位于面心,K位于顶点,与K紧邻的O的个数为12个,C错误;
D.在晶胞结构的另一种表示中,I处于各顶角位置,个数为,O位于棱心位置,每个棱为4个晶胞共有O个数为,K的个数为1,应位于体心位置,D正确;
故选D。
7.B
【分析】由表中氯化物熔、沸点可知,一般情况下,熔、沸点较低的是分子晶体,熔沸点较高的是离子晶体。
【详解】由分析可知,SiCl4、AlCl3的熔沸点都很低,因此形成的晶体是分子晶体。NaCl、MgCl2、CaCl2的熔沸点很高,所以形成的晶体应该是离子晶体,通过离子键结合,故B正确;
故答案选B。
8.A
【详解】利用均摊法计算晶胞的微粒个数可知,镁原子间形成正六棱柱,且棱柱的上、下底面还各有一个镁原子,故一个晶胞中镁原子的个数为;6个硼原子位于棱柱侧面上,故硼原子数为,所以晶胞中镁原子和硼原子的个数比为1∶1,故化学式为,A项正确;
故选A。
9.D
【详解】A.元素钛在元素周期表中的位置为第四周期 IV B族,A错误;
B.Co原子失去最外层的两个电子形成Co2+,故Co2+的基态核外电子排布式为1s22s22p63s23p63d7,B错误;
C.由图可知,与Co2+距离最近的Ti4+有8个,C错误;
D.该晶胞中,Co2+的个数为1,Ti4+的个数为8×=1,O2-的个数为6×=3,则该化合物的化学式为CoTiO3,D正确;
故选D。
10.C
【详解】A.氧化亚铁晶胞中O2-数目×12+1=4,A不符合题意;
B.1个干冰晶胞中平均含有CO2分子个数×8+×6=4,B不符合题意;
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数是8,C符合题意;
D.在二氧化硅晶体结构中,一个硅原子与四个氧原子形成Si-O键,D不符合题意;
故选C。
11.D
【详解】A.冰晶胞内水分子间以氢键相结合,A错误;
B.晶体冰为分子晶体,硬度很小;金刚石为原子晶体,硬度很大,B错误;
C.冰分子间的氢键具有方向性和饱和性,但氢键不属于化学键,不是σ键,C错误;
D.水分子中氧原子和金刚石中碳原子均为sp3杂化,水分子中氧原子与2个氢原子结合后还有2对孤电子对,可以与另外2个水分子中氢原子形成氢键,故每个水分子与相邻4个水分子形成4个氢键,导致冰晶胞与金刚石晶胞微粒的排列方式类似,D正确;
故选D。
12.C
【详解】A. CO2形成的晶体为分子晶体,SiO2形成的晶体为原子晶体,晶体类型不相同,故A错误;
B.NaCl形成的晶体为离子晶体,HCl形成的晶体为分子晶体,晶体类型不相同,故B错误;
C.CO2形成的晶体为分子晶体,CS2形成的晶体为分子晶体,晶体类型相同,故C正确;
D.CCl4形成的晶体为分子晶体,MgCl2形成的晶体为离子晶体,晶体类型不相同,故D错误;
故选C。
13.A
【详解】A.据图可知距Na+最近的Cl-位于棱心和体心,共6个,形成正八面体,A错误;
B.Ca2+位于晶胞的顶点和面心,根据均摊法,个数为=4,B正确;
C.金刚石中每个C原子形成4个共价键,每个共价键被两个碳原子共用,所以每个碳原子具有2个共价键,即碳原子与碳碳键个数的比为1:2,C正确;
D.该物质由分子构成,据图可知每个分子含有4个F原子,4个E原子,所以分子式为E4F4或F4E4,D正确;
综上所述答案为A。
14.AB
【详解】A.从“元素X的某价态离子中所有电子正好充满K、L、M三个能层”可知,中共有28个电子,A项错误;
B.图中位于每条棱的中点,一个晶胞拥有X的个数为,位于顶点,一个晶胞拥有的个数为,阳离子与阴离子个数比为3:1,B项错误;
C.该物质的化学式为,故X显价,C项正确;
D.的配位数为2,D项正确;
故选:AB。
15.BC
【详解】A.硼原子的原子序数为5,其价电子排布式为2s22p1,A正确;
B.图2中Mg原子位于晶胞的顶点,原子个数为8×=1,B原子位于晶胞的内部,原子个数为2个,其化学式为MgB2,与图1相符,故图2为晶胞结构,B错误;
C.根据图1可知,1个B原子被3个Mg原子共用,即属于1个Mg原子的B原子为,同理,1个Mg原子被6个B原子共用,即用于一个B原子的Mg原子为,所以晶胞中原子个数比Mg:B=:=1:2,化学式为MgB2,C错误;
D.由图2可知,边长为2个白球圆心的距离,图1中3个连续最近的白球的中心组成一个等边三角形,如图,在等边三角形中作辅助线,如图(a、b、c为白球的球心,d为黑球的球心),ac即为晶胞边长,设晶胞边长为x,ae长度为x,ad长度为(a+b),则cos30°==,解得x=(a+b),D正确;
故选BC。
16.(1)
(2)16
(3) 2
(4) 6 12
(5)A
【详解】(1)由晶胞结构可知白球有8个位于顶点,6个位于面心,个数为,黑球4个在体内,则Cu和Cl的原子个数比为1:1,化学式为,故答案为:;
(2)内部有4个氧原子,其余氧原子位于面心和顶点,则氧原子个数为:,结合化学式可知铜原子个数为O的2倍,含16个,故答案为:16;
(3)黑球有1个在体内、4个在棱上,个数为:,白球1个在体内、8个在顶点,个数为:,则该晶胞种B、N个数均为2,化学式为BN。故答案为:2;BN;
(4)该晶胞中6个O原子位于面心,个数为,Co原子由8个位于顶点,个数为,Ti原子1个在体内,则该晶胞的化学式为:,由晶胞结构可知1个Ti原子周围有6个O原子,1个Co周围有12个O,故答案为:;6;12;
(5)该结构表示团簇分子,含有14个Ti和13个C,化学式为,故答案为:;
17.(1)
(2) sp
(3)分子晶体
(4)1:2
【详解】(1)根据铁原子的电子排布式:,的电子排布式为:;
(2)的结构式中,直线型,所以C原子的杂化方式为sp;电子式为:
(3)根据已知信息,该晶体在300℃以上易升华,在400℃时其蒸气,熔沸点较低,故为分子晶体;
(4)小黑球的周围有四个灰球,而一个灰球的周围有两个黑球,故黑球与灰球的个数比为1:2,氮原子与铁原子的个数比为1:2
18. 或 3p 硼原子失去第3个电子后,达到稳定结构,不易再失去电子(或其他合理说法) B、C、N元素的非金属性依次增强 NCl3 分子间作用力(或范德华力) 化学键(或共价键) CH4 BN
【分析】A、B、C、D、E为原子序数依次增大的前四周期元素,基态B原子核外电子占据3个能级且每个能级上电子数相等,则基态B原子核外电子排布式为,故B为C元素;基态A原子核外电子占据3个轨道,且A的原子序数小于B,则基态A原子核外电子排布式为,故A为B元素;C的双原子单质分子中键和键数目之比为1:2,则C为N元素;基态E原子核外有6个未成对电子,则E处于第四周期,价层电子排布式为,故E为Cr元素;D的最高化合价和最低化合价代数和等于4,D为第ⅥA族元素,且原子序数小于Cr,故D为S元素。.综上分析,A为B元素、B为C元素、C为N元素、D为S元素、E为Cr元素。
【详解】(1)由上述分析可知E为Cr元素,基态E原子的核外电子排布式为或;D为S元素,原子的核外电子排布式为,核外电子占据的能量最高的能级符号为3p,故答案为:;3p;
(2)基态硼原子核外电子排布式为,所以硼原子失去第3个电子后,达到稳定结构,不易再失去电子,因此硼原子相邻两级的电离能中,和之间差异最大,故答案为:硼原子失去第3个电子后,达到稳定结构,不易再失去电子;
(3)B、C、N元素的非金属性依次增强,所以B、C、N元素的最高价氧化物对应的水化物酸性依次增强,故答案为:B、C、N元素的非金属性依次增强;
(4)中硼原子价层电子对数为,且不含孤电子对,采用sp2杂化,空间结构为平面三角形;CCl4分子中碳原子价层电子对数为,且不含孤电子对,采用杂化,空间结构为正四面体形;分子中N原子价层电子对数为,采用杂化,该分子中含有1个孤电子对,所以其空间结构是三角锥形,故答案为:NCl3;
(5)由已知高于130℃时发生分解可知,此过程中破坏的作用力是共价键;在低于该温度时发生颜色变化的过程中,破坏的作用力是分子间作用力(或范德华力)。C、N、S元素的简单气态氢化物中,CH4为正四面体形结构,是非极性分子;NH3为三角锥形结构,分子中正、负电中心不重合,所以是极性分子;硫原子最外层有6个电子,它和两个氢原子形成2个共用电子对后还有2个孤电子对,一共有4对电子在硫原子周围,这4对电子呈四面体形结构,其中两个方向被氢原子占据,还有2个方向被孤电子对占据,所以H2S分子呈V形,正、负电中心不重合,为极性分子,故答案为:分子间作用力(或范德华力);化学键(或共价键);CH4;
(6)①B原子(白色球)占据立方体的8个顶点和6个面心,所以有个;N原子位于晶胞内部,共4个,故该晶体的化学式为BN,故答案为:BN;
②设晶胞边长为a、键长为d,A、C连线处于晶胞体对角线上,且距离为体对角线长度的,则,根据已知条件可得,所以,故答案为:。
19. 第二周期ⅣA族 石墨 共价 共价键
【分析】据图可知①到⑨分别为Be、B、C、N、Na、Al、Si、S、Cl,据此解答。
【详解】(1)③号元素为C,位于周期表第二周期ⅣA族,C的同素异形体石墨能导电,故答案为:第二周期ⅣA族;石墨;
(2)⑤(Na)⑥(Al)两种元素的最高价氧化物对应的水化物为NaOH、Al(OH)3,它们之间相互反应的离子方程式为,故答案为:;
(3)⑦号元素为Si,它的原子结构示意图为 ,故答案为: ;
(4)②(B)④(N)两种元素形成的化合物晶体有两种结构,其中一种结构与金刚石相似,则该结构的晶体属于共价晶体,若使其熔化,需破坏共价键,故答案为:共价;共价键;
(5)⑤(Na)和⑧(S)形成的常见化合物为Na2S,它的电子式为 ,故答案为: 。
答案第1页,共2页
答案第1页,共2页
