化学人教版(2019)必修第一册2.2氯及其化合物 课件(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2氯及其化合物 课件(共22张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 77.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 20:41:42 | ||
图片预览



文档简介
(共22张PPT)
高中化学必修第一册
第2节 氯及其化合物
第二章海水中的重要元素——钠和氯
(2)氯气的实验室制法
(3)氯离子的检验
新课导入
自然界中有没有游离态的氯 如果没有,人们是怎样制得氯气的呢?
氯元素在自然界中以_________存在
化合态
NaCl
CaCl2
MgCl2
二 .氯气的实验室制法
二.氯气的实验室制法
氯气由________发现的,
由__________确认的。
此反应是实验室制取氯气的主要方法之一,
药品是______________,
反应原理为
__________________________________。
舍勒
戴维
软锰矿和浓盐酸
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
舍勒
戴维
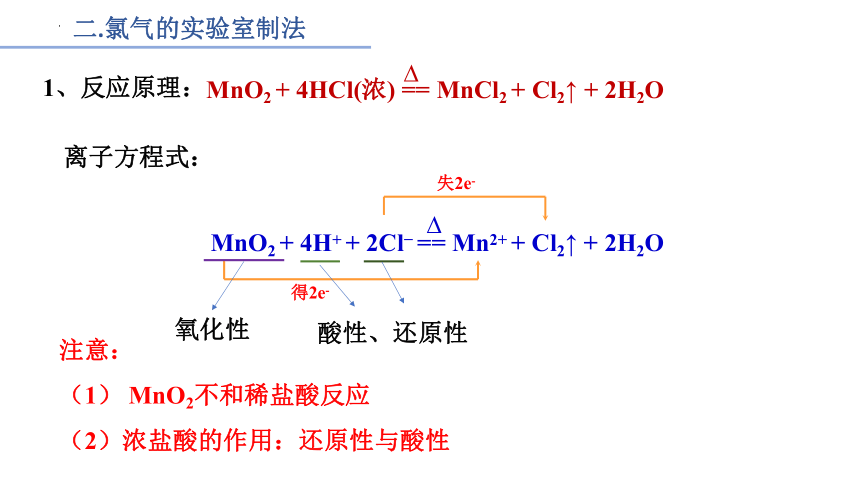
二.氯气的实验室制法
1、反应原理:
MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + 2H2O
离子方程式:
MnO2 + 4H+ + 2Cl == Mn2+ + Cl2↑ + 2H2O
得2e-
失2e-
氧化性
酸性、还原性
注意:
(1) MnO2不和稀盐酸反应
(2)浓盐酸的作用:还原性与酸性
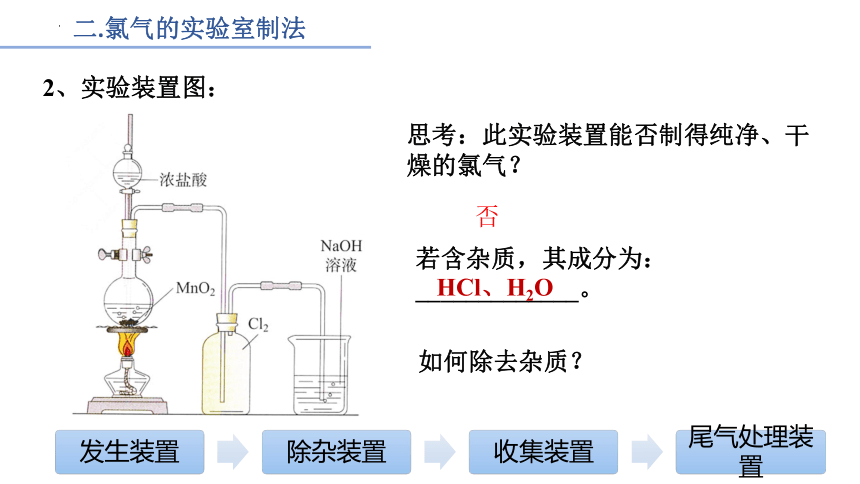
二.氯气的实验室制法
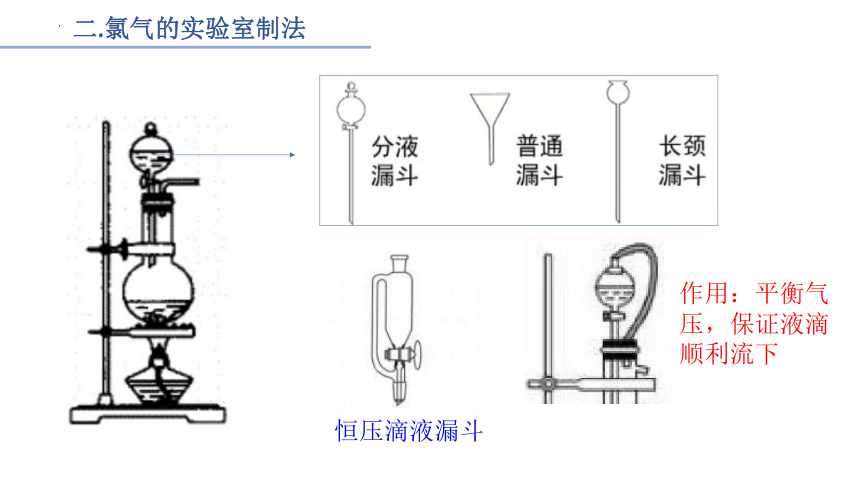
2、实验装置图:
思考:此实验装置能否制得纯净、干燥的氯气?
若含杂质,其成分为:
_____________。
否
HCl、H2O
如何除去杂质?
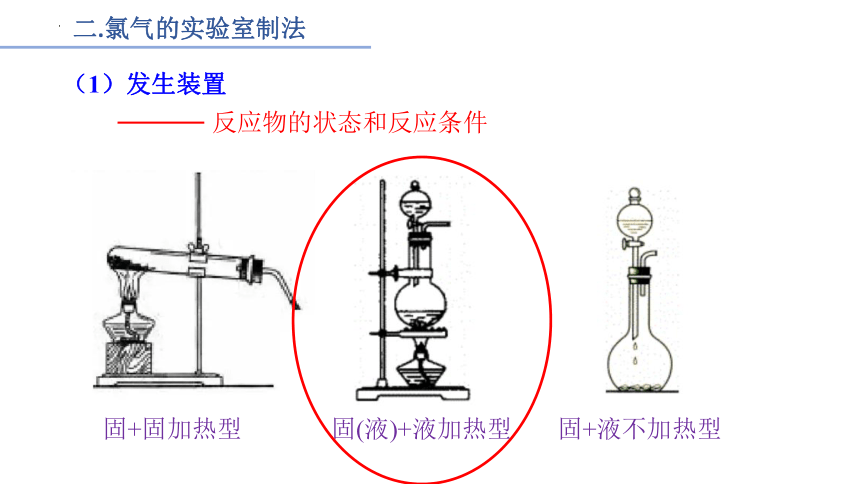
二.氯气的实验室制法
(1)发生装置
反应物的状态和反应条件
固+固加热型
固(液)+液加热型
固+液不加热型
二.氯气的实验室制法
恒压滴液漏斗
作用:平衡气压,保证液滴顺利流下
二.氯气的实验室制法
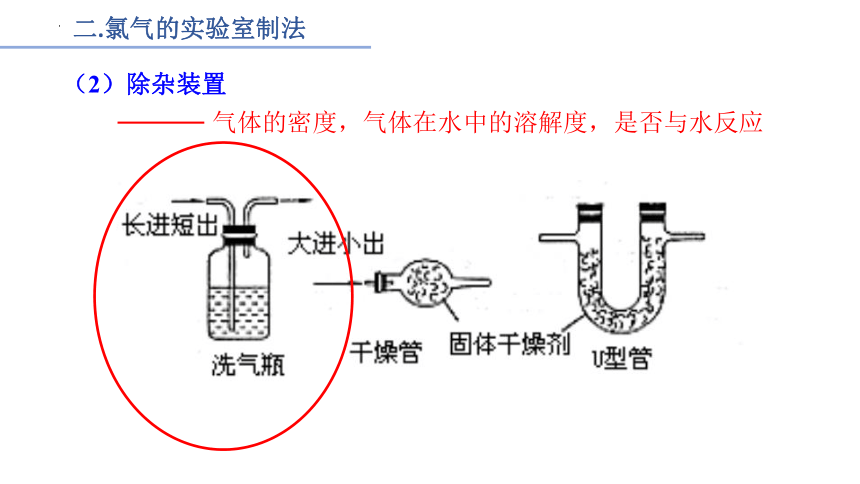
(2)除杂装置
气体的密度,气体在水中的溶解度,是否与水反应
二.氯气的实验室制法
(3)收集装置
气体的性质
向上排空气法
向下排空气法
排饱和食盐水
排水法
二.氯气的实验室制法
(4)尾气处理装置
NaOH溶液
难吸收,可点燃的气体
如:CO
二.氯气的实验室制法
NaOH溶液
目的:防止倒吸
二.氯气的实验室制法
二.氯气的实验室制法
仪器组装顺序:自下而上、从左到右
能否用澄清石灰水代替NaOH?为什么?
如何检验氯气已收集满?
MnO2
浓HCl
饱和食盐水(除HCl)
浓硫酸
(除H2O)
注意导气管的进出方式(长进短出)
不能,Ca(OH)2溶液浓度小,吸收不完全
氯气的验满方法
3.湿润的紫色石蕊试纸先变红后褪色,则收集满
1.观察集气瓶口呈黄绿色,则收集满
2.湿润的淀粉-KI试纸在集气瓶口变蓝,则收集满
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝
二.氯气的实验室制法
二.氯气的实验室制法
二.氯气的实验室制法
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7 +14HCl(浓)= 2KCl+2CrCl3+5Cl2↑+7H2O
KClO3 + 6HCl(浓)= KCl +3Cl2↑+3H2O
NaClO + 2HCl(浓)= NaCl+ Cl2↑ + H2O
Ca(ClO)2 + 4HCl(浓) = CaCl2 +2Cl2↑+2H2O
◆其他制备Cl2方法
三 .氯离子的检验
三.氯离子的检验
【实验2-9】
1、在三支试管中分别加入2-3mL的稀盐酸、氯化钠溶液和碳酸钠溶液,然后各滴几滴AgNO3溶液,观察现象
2、再分别加入少量稀硝酸,观察现象
三.氯离子的检验
加入AgNO3后 加入HNO3 解释或离子方程式
稀盐酸
NaCl溶液 Na2CO3溶液
Ag2CO3 + 2H+ = 2Ag+ + CO2 + H2O
2Ag+ + CO32- =Ag2CO3
Ag+ +Cl– =AgCl
白色沉淀
沉淀不溶解
白色沉淀
沉淀不溶解
白色沉淀
沉淀溶解
三.氯离子的检验
问题1:某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对?
Cl-或CO32-
问题2:检验Cl-时为何加入稀硝酸酸化?
一般先在被检测的溶液中滴入适量稀硝酸,使其酸化,以排除CO32 等的干扰,
三.氯离子的检验
Cl-的检验方法
取少量待测液于试管中,先加入稀硝酸酸化,再加入硝酸银溶液,若白色沉淀生成,说明溶液中含有Cl-。
或者硝酸酸化的硝酸银溶液
Ag++Cl-===AgCl↓
高中化学必修第一册
第2节 氯及其化合物
第二章海水中的重要元素——钠和氯
(2)氯气的实验室制法
(3)氯离子的检验
新课导入
自然界中有没有游离态的氯 如果没有,人们是怎样制得氯气的呢?
氯元素在自然界中以_________存在
化合态
NaCl
CaCl2
MgCl2
二 .氯气的实验室制法
二.氯气的实验室制法
氯气由________发现的,
由__________确认的。
此反应是实验室制取氯气的主要方法之一,
药品是______________,
反应原理为
__________________________________。
舍勒
戴维
软锰矿和浓盐酸
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
舍勒
戴维
二.氯气的实验室制法
1、反应原理:
MnO2 + 4HCl(浓) == MnCl2 + Cl2↑ + 2H2O
离子方程式:
MnO2 + 4H+ + 2Cl == Mn2+ + Cl2↑ + 2H2O
得2e-
失2e-
氧化性
酸性、还原性
注意:
(1) MnO2不和稀盐酸反应
(2)浓盐酸的作用:还原性与酸性
二.氯气的实验室制法
2、实验装置图:
思考:此实验装置能否制得纯净、干燥的氯气?
若含杂质,其成分为:
_____________。
否
HCl、H2O
如何除去杂质?
二.氯气的实验室制法
(1)发生装置
反应物的状态和反应条件
固+固加热型
固(液)+液加热型
固+液不加热型
二.氯气的实验室制法
恒压滴液漏斗
作用:平衡气压,保证液滴顺利流下
二.氯气的实验室制法
(2)除杂装置
气体的密度,气体在水中的溶解度,是否与水反应
二.氯气的实验室制法
(3)收集装置
气体的性质
向上排空气法
向下排空气法
排饱和食盐水
排水法
二.氯气的实验室制法
(4)尾气处理装置
NaOH溶液
难吸收,可点燃的气体
如:CO
二.氯气的实验室制法
NaOH溶液
目的:防止倒吸
二.氯气的实验室制法
二.氯气的实验室制法
仪器组装顺序:自下而上、从左到右
能否用澄清石灰水代替NaOH?为什么?
如何检验氯气已收集满?
MnO2
浓HCl
饱和食盐水(除HCl)
浓硫酸
(除H2O)
注意导气管的进出方式(长进短出)
不能,Ca(OH)2溶液浓度小,吸收不完全
氯气的验满方法
3.湿润的紫色石蕊试纸先变红后褪色,则收集满
1.观察集气瓶口呈黄绿色,则收集满
2.湿润的淀粉-KI试纸在集气瓶口变蓝,则收集满
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝
二.氯气的实验室制法
二.氯气的实验室制法
二.氯气的实验室制法
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7 +14HCl(浓)= 2KCl+2CrCl3+5Cl2↑+7H2O
KClO3 + 6HCl(浓)= KCl +3Cl2↑+3H2O
NaClO + 2HCl(浓)= NaCl+ Cl2↑ + H2O
Ca(ClO)2 + 4HCl(浓) = CaCl2 +2Cl2↑+2H2O
◆其他制备Cl2方法
三 .氯离子的检验
三.氯离子的检验
【实验2-9】
1、在三支试管中分别加入2-3mL的稀盐酸、氯化钠溶液和碳酸钠溶液,然后各滴几滴AgNO3溶液,观察现象
2、再分别加入少量稀硝酸,观察现象
三.氯离子的检验
加入AgNO3后 加入HNO3 解释或离子方程式
稀盐酸
NaCl溶液 Na2CO3溶液
Ag2CO3 + 2H+ = 2Ag+ + CO2 + H2O
2Ag+ + CO32- =Ag2CO3
Ag+ +Cl– =AgCl
白色沉淀
沉淀不溶解
白色沉淀
沉淀不溶解
白色沉淀
沉淀溶解
三.氯离子的检验
问题1:某溶液中加入AgNO3溶液产生白色沉淀,则可确定该溶液中一定有氯离子,这种说法对不对?
Cl-或CO32-
问题2:检验Cl-时为何加入稀硝酸酸化?
一般先在被检测的溶液中滴入适量稀硝酸,使其酸化,以排除CO32 等的干扰,
三.氯离子的检验
Cl-的检验方法
取少量待测液于试管中,先加入稀硝酸酸化,再加入硝酸银溶液,若白色沉淀生成,说明溶液中含有Cl-。
或者硝酸酸化的硝酸银溶液
Ag++Cl-===AgCl↓
