3.2.1分子晶体和共价晶体 课件(共20张PPT) 化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.1分子晶体和共价晶体 课件(共20张PPT) 化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 36.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 21:05:40 | ||
图片预览



文档简介
(共20张PPT)
人教版 选择性必修2
第三章 第二节 第1课时 《分子晶体和共价晶体》
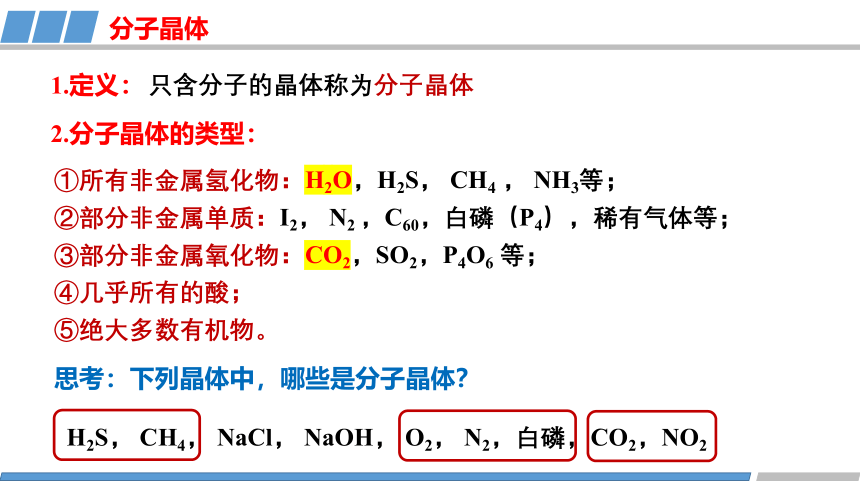
1.定义:
分子晶体
2.分子晶体的类型:
①所有非金属氢化物:H2O,H2S, CH4 , NH3等;
②部分非金属单质:I2, N2 ,C60,白磷(P4),稀有气体等;
③部分非金属氧化物:CO2,SO2,P4O6 等;
④几乎所有的酸;
⑤绝大多数有机物。
H2S, CH4, NaCl, NaOH, O2, N2,白磷,CO2,NO2
思考:下列晶体中,哪些是分子晶体?
只含分子的晶体称为分子晶体
干冰晶体 冰晶体
微粒间 作用力 分子间
分子内
范德华力
共价键
共价键
干冰晶体,易升华
冰晶体,不易升华,密度小于干冰
分子晶体
范德华力、氢键
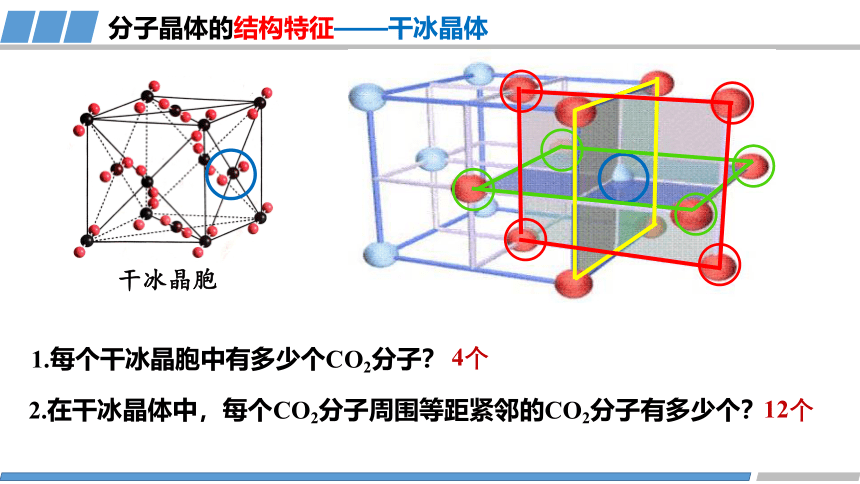
干冰晶胞
12个
1.每个干冰晶胞中有多少个CO2分子?
4个
2.在干冰晶体中,每个CO2分子周围等距紧邻的CO2分子有多少个?
分子晶体的结构特征——干冰晶体
C60晶胞
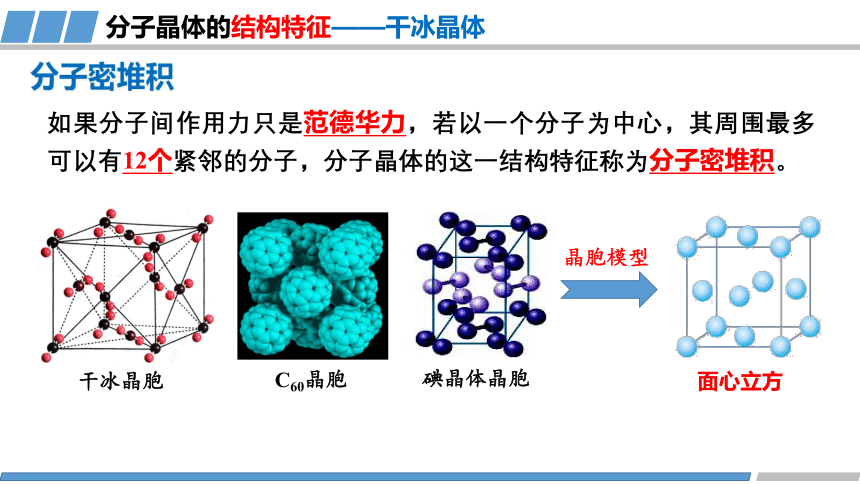
分子密堆积
干冰晶胞
如果分子间作用力只是范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一结构特征称为分子密堆积。
分子晶体的结构特征——干冰晶体
碘晶体晶胞
晶胞模型
面心立方
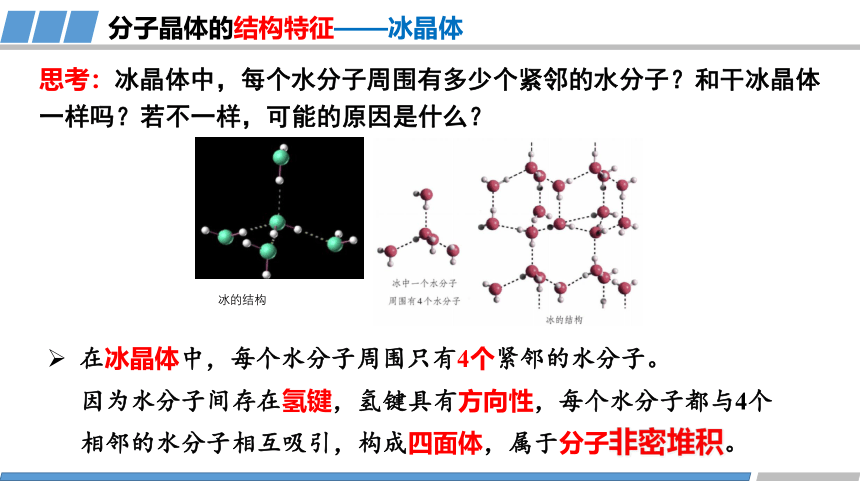
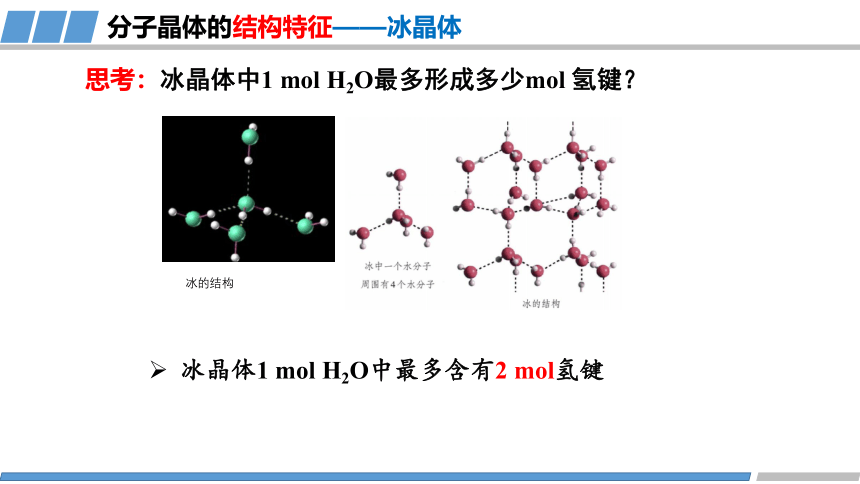
思考:冰晶体中,每个水分子周围有多少个紧邻的水分子?和干冰晶体一样吗?若不一样,可能的原因是什么?
在冰晶体中,每个水分子周围只有4个紧邻的水分子。
分子晶体的结构特征——冰晶体
冰的结构
因为水分子间存在氢键,氢键具有方向性,每个水分子都与4个相邻的水分子相互吸引,构成四面体,属于分子非密堆积。
思考:冰晶体中1 mol H2O最多形成多少mol 氢键?
冰晶体1 mol H2O中最多含有2 mol氢键
1
2
3
4
冰的结构
分子晶体的结构特征——冰晶体
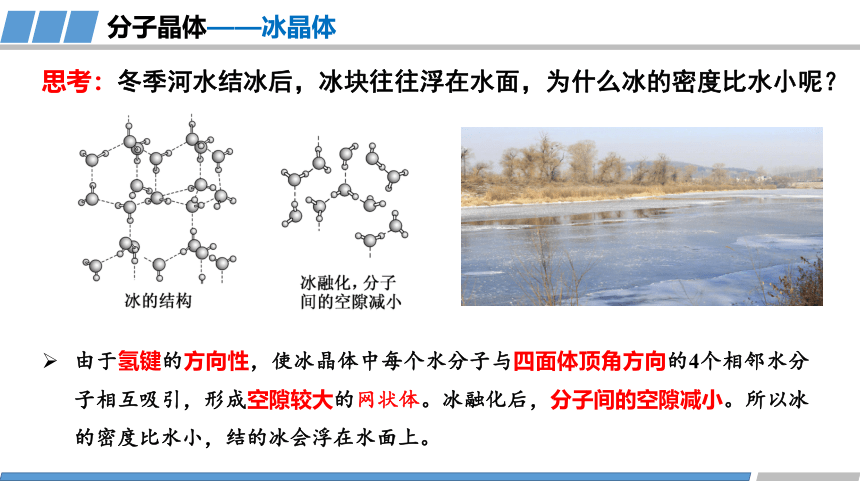
思考:冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
分子晶体——冰晶体
由于氢键的方向性,使冰晶体中每个水分子与四面体顶角方向的4个相邻水分子相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,结的冰会浮在水面上。
P79思考与讨论:硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
-硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,形成分子密堆积。因此,一个硫化氢分子周围有12个紧邻分子。
-而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
分子晶体
微粒间作用力 _________ _______________
微粒堆积方式 _________ _______________
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
范德华力和氢键
分子密堆积
分子非密堆积
分子晶体
思考:请根据表3-2中数据分析:分子晶体的熔点有什么特点?
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
熔点较低
分子晶体熔化时一般只破坏范德华力、氢键,不破坏化学键。范德华力、氢键相对化学键较弱。
分子晶体的物理特性
为什么分子晶体的熔点比较低?
表3-2
思考:溜冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
原因:分子间作用力较弱。
分子晶体(如冰晶体)一般硬度比较小,如何从结构的角度进行解释呢?
说明冰晶体的硬度小
分子晶体的物理特性
构成分子晶体的微粒都是分子,熔融时没有产生自由移动的离子,因此分子晶体一般不导电。
思考:分子晶体(如乙醇)一般都是绝缘体,熔融状态下也不导电。从结构的角度应该如何解释呢?
分子晶体的物理特性
熔沸点低
硬度小
不导电
分子晶体的物理特性
二氧化碳与镁的反应
(2Mg+CO2 2MgO+C)。
1.定义:
原子
共价键
共价晶体
相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体。
2.共价晶体的类型:
(1)某些单质:以C为中心,同主族向下:
硅(Si)锗(Ge)和灰锡(Sn)等
同周期向左:硼(B)
(2)某些非金属化合物:
二氧化硅(SiO2)、金刚砂(SiC)、氮化硅(Si3N4)等
金刚石晶体结构
共价晶体的结构特征——金刚石
金刚石晶胞
碳原子个数与C-C共价键个数之比为 ,1mol金刚石可以形成 个C-C共价键
2NA
6
金刚石晶体中碳原子杂化方式为 ,最小环上有 个碳原子。
sp3杂化
1 :2
SiO2晶体结构
共价晶体的结构特征——SiO2
1mol二氧化硅晶体中含有的“Si-O”键数目为 。
4NA
二氧化硅晶体中硅原子采取 杂化,二氧化硅晶体结构中最小的环为 元环
SiO2晶胞
sp3
12
-结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3500 3000 2700 1710 1410 1211
硬度 10 9.5 9.5 7 6.5 6.0
共价晶体的物理特性
表3-3
P82思考与讨论:怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
晶体类型 分子晶体 共价晶体
概念
组成微粒
作用力
熔沸点
硬度
相邻原子间以共价键相结合而形成空间网状结构
原子
共价键
高
很大
分子晶体和共价晶体
小结
分子间以分子间作用力结合
分子
分子间作用力
低
较小
人教版 选择性必修2
第三章 第二节 第1课时 《分子晶体和共价晶体》
1.定义:
分子晶体
2.分子晶体的类型:
①所有非金属氢化物:H2O,H2S, CH4 , NH3等;
②部分非金属单质:I2, N2 ,C60,白磷(P4),稀有气体等;
③部分非金属氧化物:CO2,SO2,P4O6 等;
④几乎所有的酸;
⑤绝大多数有机物。
H2S, CH4, NaCl, NaOH, O2, N2,白磷,CO2,NO2
思考:下列晶体中,哪些是分子晶体?
只含分子的晶体称为分子晶体
干冰晶体 冰晶体
微粒间 作用力 分子间
分子内
范德华力
共价键
共价键
干冰晶体,易升华
冰晶体,不易升华,密度小于干冰
分子晶体
范德华力、氢键
干冰晶胞
12个
1.每个干冰晶胞中有多少个CO2分子?
4个
2.在干冰晶体中,每个CO2分子周围等距紧邻的CO2分子有多少个?
分子晶体的结构特征——干冰晶体
C60晶胞
分子密堆积
干冰晶胞
如果分子间作用力只是范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子,分子晶体的这一结构特征称为分子密堆积。
分子晶体的结构特征——干冰晶体
碘晶体晶胞
晶胞模型
面心立方
思考:冰晶体中,每个水分子周围有多少个紧邻的水分子?和干冰晶体一样吗?若不一样,可能的原因是什么?
在冰晶体中,每个水分子周围只有4个紧邻的水分子。
分子晶体的结构特征——冰晶体
冰的结构
因为水分子间存在氢键,氢键具有方向性,每个水分子都与4个相邻的水分子相互吸引,构成四面体,属于分子非密堆积。
思考:冰晶体中1 mol H2O最多形成多少mol 氢键?
冰晶体1 mol H2O中最多含有2 mol氢键
1
2
3
4
冰的结构
分子晶体的结构特征——冰晶体
思考:冬季河水结冰后,冰块往往浮在水面,为什么冰的密度比水小呢?
分子晶体——冰晶体
由于氢键的方向性,使冰晶体中每个水分子与四面体顶角方向的4个相邻水分子相互吸引,形成空隙较大的网状体。冰融化后,分子间的空隙减小。所以冰的密度比水小,结的冰会浮在水面上。
P79思考与讨论:硫化氢和水分子结构相似,但硫化氢晶体中,一个硫化氢分子周围有12个紧邻分子,而冰中一个水分子周围只有4个紧邻分子,为什么?
-硫化氢晶体中分子之间只有范德华力,范德华力无饱和性与方向性,形成分子密堆积。因此,一个硫化氢分子周围有12个紧邻分子。
-而冰晶体中水分子间存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键。因此,冰中一个水分子周围只有4个紧邻分子。
分子晶体
微粒间作用力 _________ _______________
微粒堆积方式 _________ _______________
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
范德华力和氢键
分子密堆积
分子非密堆积
分子晶体
思考:请根据表3-2中数据分析:分子晶体的熔点有什么特点?
分子晶体 氧气 氮气 白磷
熔点/℃ -218.3 -210.1 44.2
分子晶体 硫化氢 甲烷 乙酸
熔点/℃ -85.6 -182 16.6
熔点较低
分子晶体熔化时一般只破坏范德华力、氢键,不破坏化学键。范德华力、氢键相对化学键较弱。
分子晶体的物理特性
为什么分子晶体的熔点比较低?
表3-2
思考:溜冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
原因:分子间作用力较弱。
分子晶体(如冰晶体)一般硬度比较小,如何从结构的角度进行解释呢?
说明冰晶体的硬度小
分子晶体的物理特性
构成分子晶体的微粒都是分子,熔融时没有产生自由移动的离子,因此分子晶体一般不导电。
思考:分子晶体(如乙醇)一般都是绝缘体,熔融状态下也不导电。从结构的角度应该如何解释呢?
分子晶体的物理特性
熔沸点低
硬度小
不导电
分子晶体的物理特性
二氧化碳与镁的反应
(2Mg+CO2 2MgO+C)。
1.定义:
原子
共价键
共价晶体
相邻原子间以共价键结合而形成的具有空间立体网状结构的晶体。
2.共价晶体的类型:
(1)某些单质:以C为中心,同主族向下:
硅(Si)锗(Ge)和灰锡(Sn)等
同周期向左:硼(B)
(2)某些非金属化合物:
二氧化硅(SiO2)、金刚砂(SiC)、氮化硅(Si3N4)等
金刚石晶体结构
共价晶体的结构特征——金刚石
金刚石晶胞
碳原子个数与C-C共价键个数之比为 ,1mol金刚石可以形成 个C-C共价键
2NA
6
金刚石晶体中碳原子杂化方式为 ,最小环上有 个碳原子。
sp3杂化
1 :2
SiO2晶体结构
共价晶体的结构特征——SiO2
1mol二氧化硅晶体中含有的“Si-O”键数目为 。
4NA
二氧化硅晶体中硅原子采取 杂化,二氧化硅晶体结构中最小的环为 元环
SiO2晶胞
sp3
12
-结构相似的共价晶体,原子半径越小,键长越短,键能越大,晶体的熔点越高,硬度越大。
共价晶体 金刚石 氮化硼 碳化硅 石英 硅 锗
熔点/℃ >3500 3000 2700 1710 1410 1211
硬度 10 9.5 9.5 7 6.5 6.0
共价晶体的物理特性
表3-3
P82思考与讨论:怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
晶体类型 分子晶体 共价晶体
概念
组成微粒
作用力
熔沸点
硬度
相邻原子间以共价键相结合而形成空间网状结构
原子
共价键
高
很大
分子晶体和共价晶体
小结
分子间以分子间作用力结合
分子
分子间作用力
低
较小
