2.3.2 分子间作用力 课件(共25张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.2 分子间作用力 课件(共25张ppt)化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-19 21:06:52 | ||
图片预览



文档简介
(共25张PPT)
《分子间作用力1》
人教版 选择性必修2
第二章 第三节 第2课时
①创意菜中干冰除了制造烟雾效果外还可以保持低温,为什么?
干冰汽化吸热
②干冰汽化有没有破坏化学键?气化过程中克服了什么作用力?
没有破坏化学键,气化过程中破坏了干冰分子之间的相互作用力
课堂引入
范德华力
研究表明分子之间普遍存在着相互作用力,而荷兰物理学家范德华是最早研究这种作用力的科学家,因而把这种分子间作用力称为范德华力。
J.D.Van der Waals
范德华力
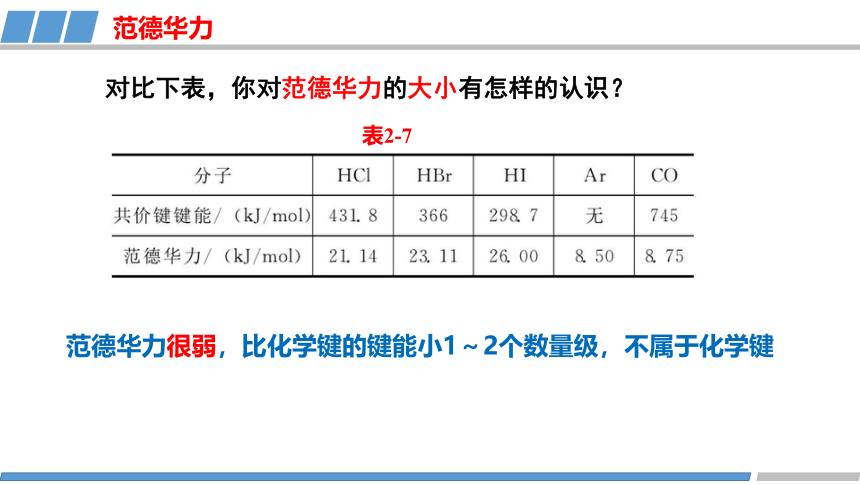
对比下表,你对范德华力的大小有怎样的认识?
范德华力很弱,比化学键的键能小1~2个数量级,不属于化学键
范德华力
表2-7
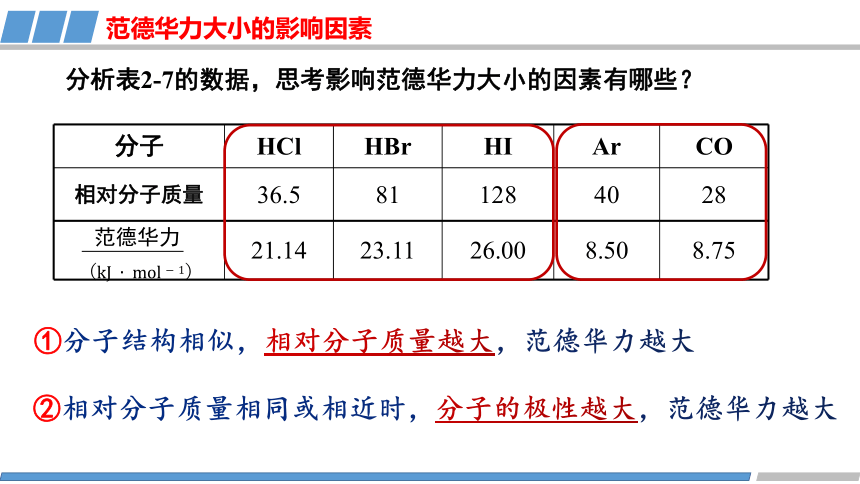
分析表2-7的数据,思考影响范德华力大小的因素有哪些?
范德华力大小的影响因素
②相对分子质量相同或相近时,分子的极性越大,范德华力越大
分子 HCl HBr HI Ar CO
相对分子质量 36.5 81 128 40 28
21.14 23.11 26.00 8.50 8.75
力
①分子结构相似,相对分子质量越大,范德华力越大
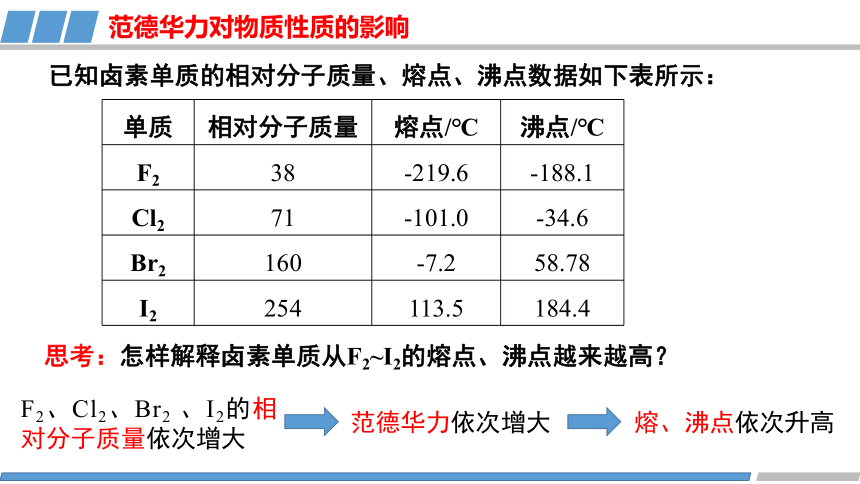
已知卤素单质的相对分子质量、熔点、沸点数据如下表所示:
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101.0 -34.6
Br2 160 -7.2 58.78
I2 254 113.5 184.4
熔、沸点依次升高
范德华力依次增大
F2、Cl2、Br2 、I2的相对分子质量依次增大
思考:怎样解释卤素单质从F2~I2的熔点、沸点越来越高?
范德华力对物质性质的影响
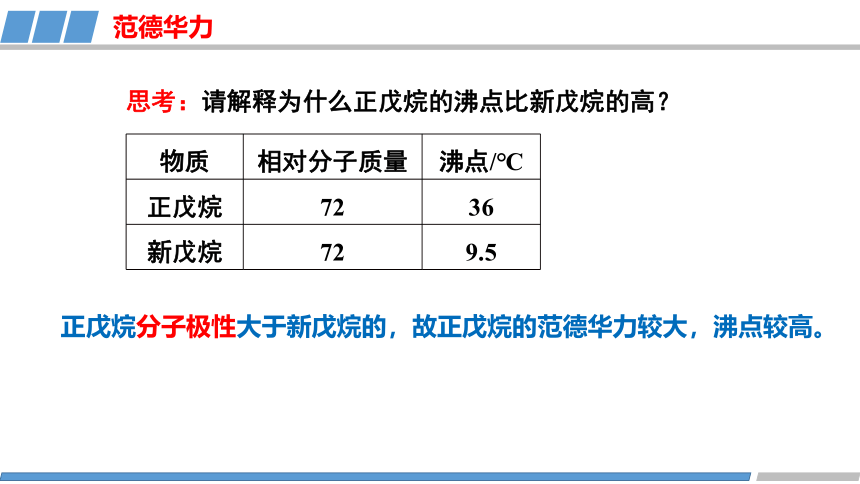
思考:请解释为什么正戊烷的沸点比新戊烷的高?
物质 相对分子质量 沸点/℃
正戊烷 72 36
新戊烷 72 9.5
正戊烷分子极性大于新戊烷的,故正戊烷的范德华力较大,沸点较高。
范德华力
与预测结果相符
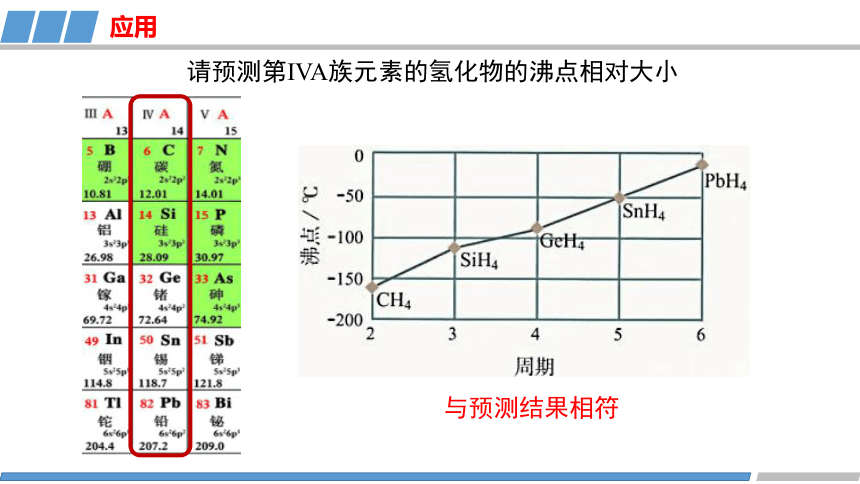
请预测第IVA族元素的氢化物的沸点相对大小
应用
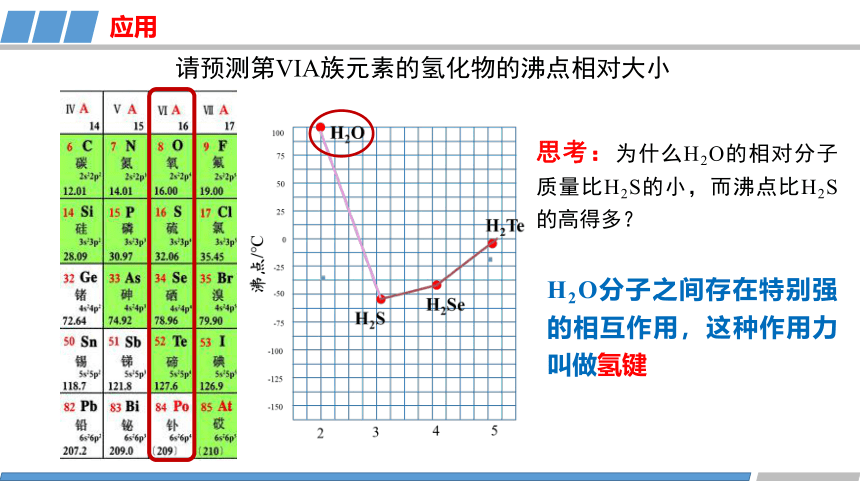
思考:为什么H2O的相对分子质量比H2S的小,而沸点比H2S的高得多?
请预测第VIA族元素的氢化物的沸点相对大小
H2O分子之间存在特别强的相互作用,这种作用力叫做氢键
应用
氢键
水分子间氢键实物模型
氢键的形成原理:
氢键的表示方法:
O — H
O
…
共价键
氢键
通常用“ ”表示氢键,
其中“-”表示共价键,“…”表示形成的氢键
X-H…Y
*氢键键长一般定义为X—H…Y的长度,而不是H…Y的长度
很多官能团都可以与水形成氢键,比如羧基,醛基,羟基,氨基等等
X、Y要求
电负性很大
半径小
有孤对电子
N、O、F
氢键的形成条件:
氢键
X-H…Y
思考:根据氢键的形成原理,你认为最强的氢键是什么?
X—H…Y强弱与X和Y的电负性有关。电负性越大,则氢键越强,
F原子电负性最大,因而F-H…F是最强的氢键
氢键类型 F-H…F O-H…O N-H…N
氢键键能 (kJ mol 1) 28.1 18.8 5.4
氢键
思考:已知F-H…F是最强的氢键,为什么H2O的沸点会高于HF?
氢键具有一定的方向性和饱和性
v,而HF只能形成2个氢键,物质的沸点和氢键强弱、数目有关。
方向性(X-H…Y尽可能在同一条直线上)
氢键
饱和性(一个X-H只能和一个Y原子结合)
对比下表,你对氢键的强度有怎样的认识?
三种作用力的比较
氢键不是化学键,而是特殊的分子间作用力,其键能比化学键弱,比范德华力强。
实验证实,氢键不仅存在于分子之间,也存在于分子内。观察以下两种氢键,比较这两种物质的熔沸点高低。
熔点:2℃
沸点:115℃
熔点:196.5℃
沸点:246.6℃
邻羟基苯甲醛
对羟基苯甲醛
结论:当形成分子内氢键时,物质的熔、沸点将下降。
当形成分子间氢键时,物质的熔、沸点将升高。
氢键
拓展视野
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
DNA双螺旋结构中的氢键
氢键
为什么接近水沸点的水蒸气相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些?
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成“缔合分子”,测定的相对分子质量会大一些。
氢键
总结:范德华力、氢键、共价键的对比
共价键 范德华力 氢键
作用微粒
特征
强度 影响因素
H与N、O、F
原子
有方向性和饱和性
X—H…Y强弱与X和Y的电负性有关
有方向性和饱和性
键长越小,键能越大,共价键越稳定
分子
无方向性和饱和性
①相对分子质量
②分子的极性
共价键>氢键>范德华力
总结
分子间作用力
范德华力
氢键
定义
强度
影响因素
定义
表示方法
特征
物质熔沸点
影响
物质熔沸点等
影响
结构
性质
决定
课堂练习
1.下列物质的变化中,破坏的主要是范德华力的是( )
A. 碘单质的升华
B. NaCl溶于水
C. 将冰加热变为液态
D. NH4Cl受热分解
课堂练习
2.人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘蛛之所以不能从天花板上掉下的主要原因是( )
A.蜘蛛脚的尖端锋利,能抓住天花板B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上
C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
课堂练习
3.共价键、离子键和范德华力是构成物质时粒子间的不同作用力,下列物质中,只含有上述一种作用力的是( )
A.干冰 B.氯化钾
C.氢氧化钠 D.单质碘
4.关于氢键,下列说法正确的是( )
A.氢键比分子间作用力强,所以它属于化学键
B.冰中存在氢键,水中不存在氢键
C.分子间形成的氢键使物质的熔点和沸点升高
D.H2O是一种非常稳定的化合物,这是由于氢键所致
课堂练习
课堂练习
5.在通常条件下,下列各组物质的性质排列正确的是( )
A.热稳定性:HF>H2O>NH3
B.熔点:CO2>KCl>SiO2
C.沸点:乙烷>戊烷>丁烷
D.熔沸点:HI > HBr > HCl >HF
课堂练习正确答案:A C B C A
课堂练习
《分子间作用力1》
人教版 选择性必修2
第二章 第三节 第2课时
①创意菜中干冰除了制造烟雾效果外还可以保持低温,为什么?
干冰汽化吸热
②干冰汽化有没有破坏化学键?气化过程中克服了什么作用力?
没有破坏化学键,气化过程中破坏了干冰分子之间的相互作用力
课堂引入
范德华力
研究表明分子之间普遍存在着相互作用力,而荷兰物理学家范德华是最早研究这种作用力的科学家,因而把这种分子间作用力称为范德华力。
J.D.Van der Waals
范德华力
对比下表,你对范德华力的大小有怎样的认识?
范德华力很弱,比化学键的键能小1~2个数量级,不属于化学键
范德华力
表2-7
分析表2-7的数据,思考影响范德华力大小的因素有哪些?
范德华力大小的影响因素
②相对分子质量相同或相近时,分子的极性越大,范德华力越大
分子 HCl HBr HI Ar CO
相对分子质量 36.5 81 128 40 28
21.14 23.11 26.00 8.50 8.75
力
①分子结构相似,相对分子质量越大,范德华力越大
已知卤素单质的相对分子质量、熔点、沸点数据如下表所示:
单质 相对分子质量 熔点/℃ 沸点/℃
F2 38 -219.6 -188.1
Cl2 71 -101.0 -34.6
Br2 160 -7.2 58.78
I2 254 113.5 184.4
熔、沸点依次升高
范德华力依次增大
F2、Cl2、Br2 、I2的相对分子质量依次增大
思考:怎样解释卤素单质从F2~I2的熔点、沸点越来越高?
范德华力对物质性质的影响
思考:请解释为什么正戊烷的沸点比新戊烷的高?
物质 相对分子质量 沸点/℃
正戊烷 72 36
新戊烷 72 9.5
正戊烷分子极性大于新戊烷的,故正戊烷的范德华力较大,沸点较高。
范德华力
与预测结果相符
请预测第IVA族元素的氢化物的沸点相对大小
应用
思考:为什么H2O的相对分子质量比H2S的小,而沸点比H2S的高得多?
请预测第VIA族元素的氢化物的沸点相对大小
H2O分子之间存在特别强的相互作用,这种作用力叫做氢键
应用
氢键
水分子间氢键实物模型
氢键的形成原理:
氢键的表示方法:
O — H
O
…
共价键
氢键
通常用“ ”表示氢键,
其中“-”表示共价键,“…”表示形成的氢键
X-H…Y
*氢键键长一般定义为X—H…Y的长度,而不是H…Y的长度
很多官能团都可以与水形成氢键,比如羧基,醛基,羟基,氨基等等
X、Y要求
电负性很大
半径小
有孤对电子
N、O、F
氢键的形成条件:
氢键
X-H…Y
思考:根据氢键的形成原理,你认为最强的氢键是什么?
X—H…Y强弱与X和Y的电负性有关。电负性越大,则氢键越强,
F原子电负性最大,因而F-H…F是最强的氢键
氢键类型 F-H…F O-H…O N-H…N
氢键键能 (kJ mol 1) 28.1 18.8 5.4
氢键
思考:已知F-H…F是最强的氢键,为什么H2O的沸点会高于HF?
氢键具有一定的方向性和饱和性
v,而HF只能形成2个氢键,物质的沸点和氢键强弱、数目有关。
方向性(X-H…Y尽可能在同一条直线上)
氢键
饱和性(一个X-H只能和一个Y原子结合)
对比下表,你对氢键的强度有怎样的认识?
三种作用力的比较
氢键不是化学键,而是特殊的分子间作用力,其键能比化学键弱,比范德华力强。
实验证实,氢键不仅存在于分子之间,也存在于分子内。观察以下两种氢键,比较这两种物质的熔沸点高低。
熔点:2℃
沸点:115℃
熔点:196.5℃
沸点:246.6℃
邻羟基苯甲醛
对羟基苯甲醛
结论:当形成分子内氢键时,物质的熔、沸点将下降。
当形成分子间氢键时,物质的熔、沸点将升高。
氢键
拓展视野
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
DNA双螺旋结构中的氢键
氢键
为什么接近水沸点的水蒸气相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些?
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成“缔合分子”,测定的相对分子质量会大一些。
氢键
总结:范德华力、氢键、共价键的对比
共价键 范德华力 氢键
作用微粒
特征
强度 影响因素
H与N、O、F
原子
有方向性和饱和性
X—H…Y强弱与X和Y的电负性有关
有方向性和饱和性
键长越小,键能越大,共价键越稳定
分子
无方向性和饱和性
①相对分子质量
②分子的极性
共价键>氢键>范德华力
总结
分子间作用力
范德华力
氢键
定义
强度
影响因素
定义
表示方法
特征
物质熔沸点
影响
物质熔沸点等
影响
结构
性质
决定
课堂练习
1.下列物质的变化中,破坏的主要是范德华力的是( )
A. 碘单质的升华
B. NaCl溶于水
C. 将冰加热变为液态
D. NH4Cl受热分解
课堂练习
2.人们熟悉的影片《蜘蛛侠》为我们塑造了一个能飞檐走壁、过高楼如履平地的蜘蛛侠,现实中的蜘蛛能在天花板等比较滑的板面上爬行,蜘蛛之所以不能从天花板上掉下的主要原因是( )
A.蜘蛛脚的尖端锋利,能抓住天花板B.蜘蛛的脚上有“胶水”,从而能使蜘蛛粘在天花板上
C.蜘蛛脚上的大量细毛与天花板之间的范德华力这一“黏力”使蜘蛛不致坠落
D.蜘蛛有特异功能,能抓住任何物体
课堂练习
3.共价键、离子键和范德华力是构成物质时粒子间的不同作用力,下列物质中,只含有上述一种作用力的是( )
A.干冰 B.氯化钾
C.氢氧化钠 D.单质碘
4.关于氢键,下列说法正确的是( )
A.氢键比分子间作用力强,所以它属于化学键
B.冰中存在氢键,水中不存在氢键
C.分子间形成的氢键使物质的熔点和沸点升高
D.H2O是一种非常稳定的化合物,这是由于氢键所致
课堂练习
课堂练习
5.在通常条件下,下列各组物质的性质排列正确的是( )
A.热稳定性:HF>H2O>NH3
B.熔点:CO2>KCl>SiO2
C.沸点:乙烷>戊烷>丁烷
D.熔沸点:HI > HBr > HCl >HF
课堂练习正确答案:A C B C A
课堂练习
