第八单元金属和金属材料检测题(含答案)---2022-2023学年九年级化学人教版下册
文档属性
| 名称 | 第八单元金属和金属材料检测题(含答案)---2022-2023学年九年级化学人教版下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 128.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 00:00:00 | ||
图片预览



文档简介
第八单元《金属和金属材料》检测题
一、单选题
1.分类是化学常用的科学方法。下列分类正确的是( )
选项 物质(或变化) 归类
A 木炭燃烧、高温下碳与二氧化碳反应 放热反应
B 水、氧化铜、氢氧化钙 氧化物
C 黄铜、焊锡、生铁 常见合金
D 铁生锈、燃气燃烧、光合作用 氧化反应
A.A B.B C.C D.D
2.下表列出了除去物质中所含少量杂质的方法,其中错误的是( )
选项 物质 杂质 除杂方法
A CO2 CO 点燃
B Cu Fe粉 用磁铁吸引
C CaO CaCO3 高温
D Cu Zn 加入足量的稀盐酸,过滤
A.A B.B C.C D.D
3.在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量(g)与所加溶液质量的关系如图示。下列说法不正确的是
A.b点固体能完全溶于足量稀硫酸
B.d点对应溶液含两种溶质
C.M的值为56.0
D.a、c点对应溶液中FeSO4质量比为1∶8
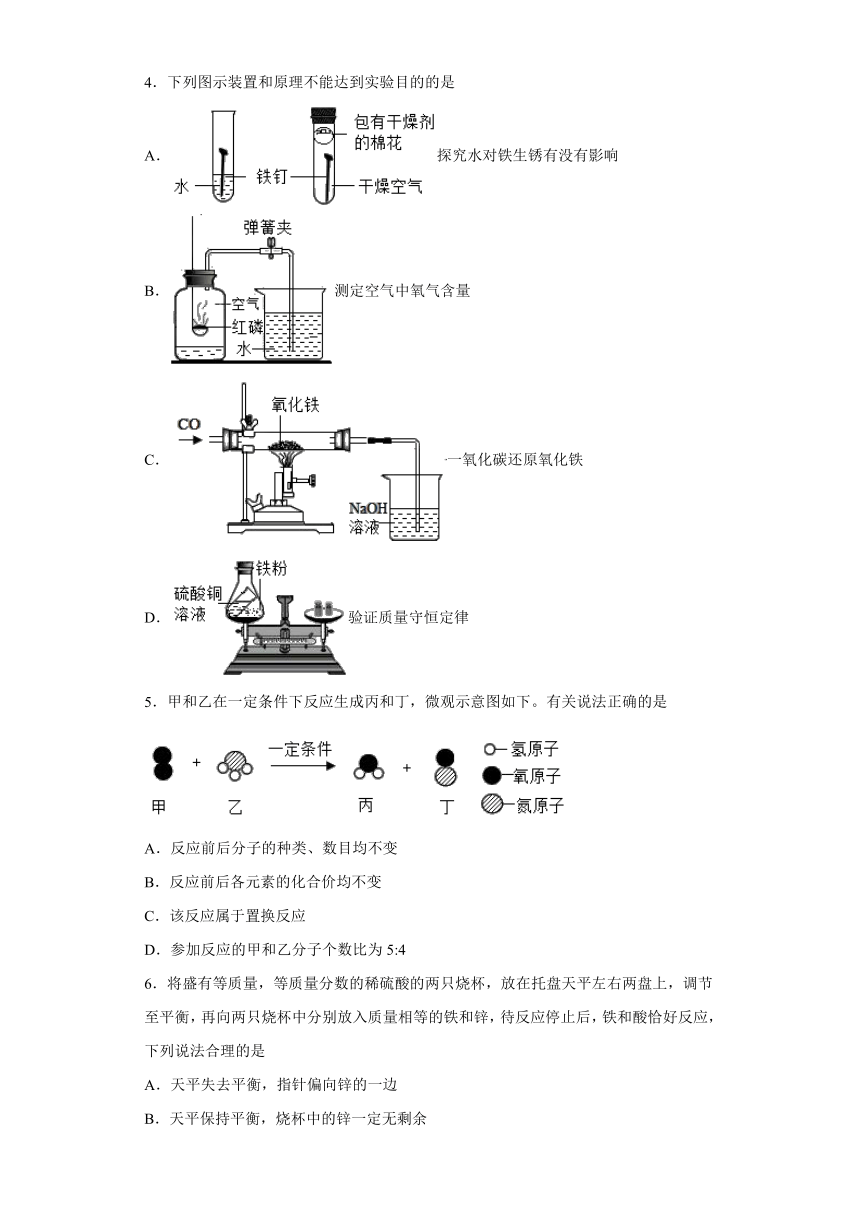
4.下列图示装置和原理不能达到实验目的的是
A.探究水对铁生锈有没有影响
B.测定空气中氧气含量
C.一氧化碳还原氧化铁
D.验证质量守恒定律
5.甲和乙在一定条件下反应生成丙和丁,微观示意图如下。有关说法正确的是
A.反应前后分子的种类、数目均不变
B.反应前后各元素的化合价均不变
C.该反应属于置换反应
D.参加反应的甲和乙分子个数比为5:4
6.将盛有等质量,等质量分数的稀硫酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铁和锌,待反应停止后,铁和酸恰好反应,下列说法合理的是
A.天平失去平衡,指针偏向锌的一边
B.天平保持平衡,烧杯中的锌一定无剩余
C.放锌的一边产生的氢气一定比放铁的一边产生的氢气多
D.天平失去平衡,指针偏向放铁的一边
7.将一根铁棒放在硫酸铜溶液中一段时间。反应前后溶液中存在的离子种类如图所示。其中 表示不同离子。则下列说法正确的是( )
A. 表示铁离子 B. 表示铜离子
C.反应后溶液质量减小 D.反应后铁棒质量减小
8.下列反应属于复分解反应的是
A.S+O2SO2 B.2H2O2H2↑+O2↑
C.C+2CuOCO2+2Cu D.Al(OH)3+3HCl=AlCl3+3H2O
9.物质的性质决定用途。下列用途中主要由物质的化学性质决定的是
A.用石墨作电极
B.用一氧化碳冶炼金属
C.用干冰人工降雨
D.用铜丝作导线
10.下列现象和事实,可用金属活动性作出合理解释的是
①相同几何外形的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的活动性强。
②金属铝比金属锌更耐腐蚀,说明锌比铝的金属活动性强。
③尽管金属的种类很多,但在自然界中,仅有少数金属 (银、铂、金) 以单质形式存在。
④用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放。
A.①②③ B.①②④ C.①③④ D.①②③④
11.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下(一种小球代表一种元素的原子),则下列说法中,正确的是
A.该反应属于置换反应 B.图中的反应物都是化合物
C.反应前后各元素的化合价均发生了改变 D.该反应不符合质量守恒定律
12.氮气及其化合物的转化过程如图所示。下列分析合理的是
A.反应I为置换反应
B.催化剂a表面发生了分子分裂为原子、原子再组合为分子的过程
C.反应II只生成NO
D.反应过程中原子和分子的种类和性质保持不变
二、填空题
13.钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛,
Ⅰ、铁的应用:
(1)下列铁制品的利用与金属导热性有关的是______(填字母,下同)。
A.铁钳 B.铁锅 C.刀具
(2)“纳米a-Fe粉“可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的______和______。
Ⅱ、铁的冶炼:
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来,请回答下列问题:
(3)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______。
(4)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能______。
Ⅲ、实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:
②NaOH溶液可以吸收二氧化碳,反应方程式为: :
③常温下,Ca(OH)2微溶于水,于是他设计了如图1的实验装置,结合装置回容下列问题:
(5)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择图2中的______(填装置编号):
(6)图中装置C、D的作用分别是______、______。
(7)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的______(填试剂名称),反应的化学方程式为______。
(8)该装置设计有一个明显缺陷,你认为是______。
14.金属在生产生活中有着广泛的应用。
(1)据有关报道,每年因锈蚀而报废的铁制品约占年产量的20%~40%,铁生锈是因为铁与空气中的_______________等物质发生化学反应的过程。
(2)同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序,实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝。
Ⅰ小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中;
②把铜丝插入装有稀盐酸的试管中;
③把铜丝插入装有AgNO3溶液的试管中;
观察到①中的实验现象是__________,③中的化学方程式是____________;
Ⅱ后来,小明只选用了上述药品中的三种,通过两步实验,也达到了实验目的,他选用的三种药品是____________________________(写出一种药品组合即可)。
15.化学与生活、生产息息相关,请运用化学知识回答以下问题。
(1)消防队员用高压水枪灭火,此措施所依据的灭火原理是___________;
(2)氢气球在空气中遇明火发生爆炸,所发生的化学反应是____________;
(3)赤铁矿石冶炼铁的原理(用化学方程式表示)___________;
(4)实验室中向含有FeCl2和CuCl2的混合溶液中,加入过量的某种物质后过滤,可得到纯净的FeCl2溶液。该反应的化学方程式:__________;
(5)工业上常用接触法制硫酸(H2SO4),所使用的原料是硫铁矿(主要含FeS)。在高温下,将硫铁矿的粉末与氧气充分反应生成三氧化二铁和二氧化硫,再经过一系列转化可生成硫酸。试写出硫铁矿与氧气反应的化学方程式 ________。
三、实验题
16.进行如下实验,研究物质的性质。
(1)能产生气泡的是_______(填序号)。
(2)能证明Fe的金属活动性比Cu强的现象是_______。
(3)有一只试管中的溶液不与Fe反应,原因是_______。
四、计算题
17.现有工业废液含硫酸铜1.6kg,可通过加入适量铁粉来回收铜,求理论上至少需要铁粉的质量是____ (化学反应原理:Fe+CuSO4=Cu+FeSO4)
18.在锥形瓶中加入80.0g质量分数为10%的硫酸铜溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净后在天平上称得质量为56.0g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起放在天平上称量,记录所称得质量m1.将上述铁钉浸到硫酸铜溶液中,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为m2。
(1)m1_____m2(填“>”或“=”或“<”)。
(2)锥形瓶的质量为_____(用含m1或m2的代数式表示)。
(3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。_______
试卷第2页,共6页
参考答案:
1.C
2.A
3.A
4.C
5.D
6.A
7.C
8.D
9.B
10.C
11.A
12.B
13.(1)B
(2) 氧气 水
(3)3CO+Fe2O32Fe+3CO2
(4)提供热量维持高温条件
(5)丁
(6) 检验二氧化碳是否除尽 干燥气体
(7) 澄清石灰水 Ca(OH)2+CO2=CaCO3↓+H2O
(8)缺少尾气处理装置
14. 水和氧气(或H2O和O2) 铁丝表面有气泡产生,溶液由无色变为浅绿色 Cu + 2AgNO3 =2Ag+Cu(NO3)2 Fe、Cu(NO3)2、Ag(或Fe(NO3)2、Cu、AgNO3)
15. 降低温度至着火点以下 2H2+O22H2O 3CO+Fe2O32Fe+3CO2 Fe+CuCl2=FeCl2+Cu 4FeS+7O22Fe2O3+4SO2
16. A 铁丝表面产生红色固体,溶液由蓝色变为浅绿色 铁的金属活动性比锌弱
17.0.56kg
18.(1)根据质量守恒得:反应过程中反应体系没有物质脱离或进入锥形瓶,因此m1=m2。故填:=
(2)锥形瓶的质量为:m1﹣(56.0g+80.0g)=m1﹣136g,或m2﹣(56.0g+80.0g)=m2﹣136g,故填:m1﹣136g(或m2﹣136g)
(3)设反应的铁的质量为x,生成铜质量为y。
x=2.8g,y=3.2g,
若硫酸铜反应完全,此时所得溶液的质量:80.0g+2.8g﹣3.2g=79.6g,
答:若硫酸铜反应完全,此时所得溶液的质量是79.6g。故填:79.6g
一、单选题
1.分类是化学常用的科学方法。下列分类正确的是( )
选项 物质(或变化) 归类
A 木炭燃烧、高温下碳与二氧化碳反应 放热反应
B 水、氧化铜、氢氧化钙 氧化物
C 黄铜、焊锡、生铁 常见合金
D 铁生锈、燃气燃烧、光合作用 氧化反应
A.A B.B C.C D.D
2.下表列出了除去物质中所含少量杂质的方法,其中错误的是( )
选项 物质 杂质 除杂方法
A CO2 CO 点燃
B Cu Fe粉 用磁铁吸引
C CaO CaCO3 高温
D Cu Zn 加入足量的稀盐酸,过滤
A.A B.B C.C D.D
3.在64.0g铁粉中先后加稀硫酸和CuSO4溶液,固体质量(g)与所加溶液质量的关系如图示。下列说法不正确的是
A.b点固体能完全溶于足量稀硫酸
B.d点对应溶液含两种溶质
C.M的值为56.0
D.a、c点对应溶液中FeSO4质量比为1∶8
4.下列图示装置和原理不能达到实验目的的是
A.探究水对铁生锈有没有影响
B.测定空气中氧气含量
C.一氧化碳还原氧化铁
D.验证质量守恒定律
5.甲和乙在一定条件下反应生成丙和丁,微观示意图如下。有关说法正确的是
A.反应前后分子的种类、数目均不变
B.反应前后各元素的化合价均不变
C.该反应属于置换反应
D.参加反应的甲和乙分子个数比为5:4
6.将盛有等质量,等质量分数的稀硫酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铁和锌,待反应停止后,铁和酸恰好反应,下列说法合理的是
A.天平失去平衡,指针偏向锌的一边
B.天平保持平衡,烧杯中的锌一定无剩余
C.放锌的一边产生的氢气一定比放铁的一边产生的氢气多
D.天平失去平衡,指针偏向放铁的一边
7.将一根铁棒放在硫酸铜溶液中一段时间。反应前后溶液中存在的离子种类如图所示。其中 表示不同离子。则下列说法正确的是( )
A. 表示铁离子 B. 表示铜离子
C.反应后溶液质量减小 D.反应后铁棒质量减小
8.下列反应属于复分解反应的是
A.S+O2SO2 B.2H2O2H2↑+O2↑
C.C+2CuOCO2+2Cu D.Al(OH)3+3HCl=AlCl3+3H2O
9.物质的性质决定用途。下列用途中主要由物质的化学性质决定的是
A.用石墨作电极
B.用一氧化碳冶炼金属
C.用干冰人工降雨
D.用铜丝作导线
10.下列现象和事实,可用金属活动性作出合理解释的是
①相同几何外形的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的活动性强。
②金属铝比金属锌更耐腐蚀,说明锌比铝的金属活动性强。
③尽管金属的种类很多,但在自然界中,仅有少数金属 (银、铂、金) 以单质形式存在。
④用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放。
A.①②③ B.①②④ C.①③④ D.①②③④
11.已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如下(一种小球代表一种元素的原子),则下列说法中,正确的是
A.该反应属于置换反应 B.图中的反应物都是化合物
C.反应前后各元素的化合价均发生了改变 D.该反应不符合质量守恒定律
12.氮气及其化合物的转化过程如图所示。下列分析合理的是
A.反应I为置换反应
B.催化剂a表面发生了分子分裂为原子、原子再组合为分子的过程
C.反应II只生成NO
D.反应过程中原子和分子的种类和性质保持不变
二、填空题
13.钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛,
Ⅰ、铁的应用:
(1)下列铁制品的利用与金属导热性有关的是______(填字母,下同)。
A.铁钳 B.铁锅 C.刀具
(2)“纳米a-Fe粉“可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的______和______。
Ⅱ、铁的冶炼:
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来,请回答下列问题:
(3)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______。
(4)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能______。
Ⅲ、实验探究炼铁原理
某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。
通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:
②NaOH溶液可以吸收二氧化碳,反应方程式为: :
③常温下,Ca(OH)2微溶于水,于是他设计了如图1的实验装置,结合装置回容下列问题:
(5)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择图2中的______(填装置编号):
(6)图中装置C、D的作用分别是______、______。
(7)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的______(填试剂名称),反应的化学方程式为______。
(8)该装置设计有一个明显缺陷,你认为是______。
14.金属在生产生活中有着广泛的应用。
(1)据有关报道,每年因锈蚀而报废的铁制品约占年产量的20%~40%,铁生锈是因为铁与空气中的_______________等物质发生化学反应的过程。
(2)同学们通过实验来验证Cu、Fe、Ag三种金属的活动性顺序,实验室提供的药品有:Cu(NO3)2溶液、AgNO3溶液、Fe(NO3)2溶液、稀盐酸、铜丝、铁丝、银丝。
Ⅰ小华同学设计并完成了如下实验:
①把铁丝插入装有稀盐酸的试管中;
②把铜丝插入装有稀盐酸的试管中;
③把铜丝插入装有AgNO3溶液的试管中;
观察到①中的实验现象是__________,③中的化学方程式是____________;
Ⅱ后来,小明只选用了上述药品中的三种,通过两步实验,也达到了实验目的,他选用的三种药品是____________________________(写出一种药品组合即可)。
15.化学与生活、生产息息相关,请运用化学知识回答以下问题。
(1)消防队员用高压水枪灭火,此措施所依据的灭火原理是___________;
(2)氢气球在空气中遇明火发生爆炸,所发生的化学反应是____________;
(3)赤铁矿石冶炼铁的原理(用化学方程式表示)___________;
(4)实验室中向含有FeCl2和CuCl2的混合溶液中,加入过量的某种物质后过滤,可得到纯净的FeCl2溶液。该反应的化学方程式:__________;
(5)工业上常用接触法制硫酸(H2SO4),所使用的原料是硫铁矿(主要含FeS)。在高温下,将硫铁矿的粉末与氧气充分反应生成三氧化二铁和二氧化硫,再经过一系列转化可生成硫酸。试写出硫铁矿与氧气反应的化学方程式 ________。
三、实验题
16.进行如下实验,研究物质的性质。
(1)能产生气泡的是_______(填序号)。
(2)能证明Fe的金属活动性比Cu强的现象是_______。
(3)有一只试管中的溶液不与Fe反应,原因是_______。
四、计算题
17.现有工业废液含硫酸铜1.6kg,可通过加入适量铁粉来回收铜,求理论上至少需要铁粉的质量是____ (化学反应原理:Fe+CuSO4=Cu+FeSO4)
18.在锥形瓶中加入80.0g质量分数为10%的硫酸铜溶液,塞好橡胶塞。将几根铁钉用砂纸打磨干净后在天平上称得质量为56.0g,再将盛有硫酸铜溶液的锥形瓶和铁钉一起放在天平上称量,记录所称得质量m1.将上述铁钉浸到硫酸铜溶液中,待反应一段时间后溶液颜色改变时,将盛有硫酸铜溶液和锥形瓶放在天平上称量,记录所称的质量为m2。
(1)m1_____m2(填“>”或“=”或“<”)。
(2)锥形瓶的质量为_____(用含m1或m2的代数式表示)。
(3)若硫酸铜反应完全,求此时所得溶液的质量(写出计算结果)。_______
试卷第2页,共6页
参考答案:
1.C
2.A
3.A
4.C
5.D
6.A
7.C
8.D
9.B
10.C
11.A
12.B
13.(1)B
(2) 氧气 水
(3)3CO+Fe2O32Fe+3CO2
(4)提供热量维持高温条件
(5)丁
(6) 检验二氧化碳是否除尽 干燥气体
(7) 澄清石灰水 Ca(OH)2+CO2=CaCO3↓+H2O
(8)缺少尾气处理装置
14. 水和氧气(或H2O和O2) 铁丝表面有气泡产生,溶液由无色变为浅绿色 Cu + 2AgNO3 =2Ag+Cu(NO3)2 Fe、Cu(NO3)2、Ag(或Fe(NO3)2、Cu、AgNO3)
15. 降低温度至着火点以下 2H2+O22H2O 3CO+Fe2O32Fe+3CO2 Fe+CuCl2=FeCl2+Cu 4FeS+7O22Fe2O3+4SO2
16. A 铁丝表面产生红色固体,溶液由蓝色变为浅绿色 铁的金属活动性比锌弱
17.0.56kg
18.(1)根据质量守恒得:反应过程中反应体系没有物质脱离或进入锥形瓶,因此m1=m2。故填:=
(2)锥形瓶的质量为:m1﹣(56.0g+80.0g)=m1﹣136g,或m2﹣(56.0g+80.0g)=m2﹣136g,故填:m1﹣136g(或m2﹣136g)
(3)设反应的铁的质量为x,生成铜质量为y。
x=2.8g,y=3.2g,
若硫酸铜反应完全,此时所得溶液的质量:80.0g+2.8g﹣3.2g=79.6g,
答:若硫酸铜反应完全,此时所得溶液的质量是79.6g。故填:79.6g
同课章节目录
