专题2第二单元溶液组成的定量研究课时作业一上学期高一化学苏教版(2019)必修第一册(含解析)
文档属性
| 名称 | 专题2第二单元溶液组成的定量研究课时作业一上学期高一化学苏教版(2019)必修第一册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 463.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 00:00:00 | ||
图片预览




文档简介
专题2第二单元溶液组成的定量研究课时作业一2022-2023学年上学期高一化学苏教版(2019)必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.实验测得、的混合溶液中,,为0.5mol/L。则为
A.1.00mol/L B.1.25mol/L C.1.75mol/L D.2.05mol/L
2.现有一瓶溶液,下列溶液中的与该溶液中的相等的是
A.溶液 B.溶液
C.溶液 D.溶液
3.1mol/L H2SO4 的含义是
A.1L 水中溶解 1mol H2SO4
B.1L 溶 液 中 含 有 1molH+
C.将 98g H2SO4 溶于 1L 水中配成溶液
D.1L H2SO4 溶液中含有 2molH+
4.下列关于“100mL 0.1 mol L 1溶液”的说法正确的是
A.该溶液与0.1 mol L 1溶液中的相等
B.若取该溶液10mL,其中
C.该溶液中含有的微粒主要有:、、、
D.若取该溶液10mL,恰好能与10mL 0.1 mol L 1溶液完全反应
5.下列对1 mol L-1的Na2SO4溶液的叙述中正确的是
A.溶液中含有1mol Na2SO4
B.它是由1mol Na2SO4溶于1L水形成的溶液
C.1L该溶液含有142g Na2SO4
D.从1L该溶液中取出500mL以后,剩余溶液的浓度为0.5
6.下列判断正确的是
A.1LH2SO4溶液中含有98gH2SO4,则该溶液中溶质的物质的量浓度为98g·L-1
B.1LH2O中溶解了0.5molNaCl,则该溶液中溶质的物质的量浓度为0.5mol·L-1
C.从1L1mol·L-1蔗糖溶液中取出100mL,剩余溶液浓度仍为1mol·L-1
D.0.5mol·L-1NaOH溶液中,含有0.5molNa+
7.下列说法中错误的是
A.从1 L 的NaCl溶液中取出10 mL,其浓度仍是
B.制成0.5 L 的盐酸,需要氯化氢气体112 L
C.0.5 L 溶液中,和总数为
D.10 g 98%硫酸(密度为)与10 mL 硫酸的浓度是不同的
8.现有质量分数为20%,物质的量浓度为的稀蒸发掉一定量的水,使之质量分数变为40%,此时该的物质的量浓度为,则和的数值关系是
A. B. C. D.无法确定
9.下列各溶液中氯离子的物质的量浓度最大的是
A.,的溶液 B.,的溶液
C.,的溶液 D.,的溶液
10.把2.0 mol L 1 溶液和1.0 mol L 1 溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余。此时溶液中的物质的量浓度为
A.3.0 mol L 1 B.2.5 mol L 1 C.2.0 mol L 1 D.1.0 mol L 1
11.下列有关溶液的说法错误的是
A.将质量分数为40%(密度为 1.43 g·cm 3)的 NaOH溶液与水等体积混合,得到质量分数大于20%的溶液
B.要配制480 mL 0.25 mol·L 1的 NaOH溶液,应称量4.8 g NaOH
C.配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配溶液浓度偏高
D.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏高
12.在标准状况下,充满气体的烧瓶做喷泉实验,结束后假设液体充满烧瓶,液体没有溢出,则所得溶液溶质的物质的量浓度为
A. B. C. D.
13.NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,NA个H2O分子所占体积为22.4L
B.1 mol H2O中含有3 mol电子
C.常温常压下,14g由N2与CO组成的混合气体中含有的原子数为NA
D.0.5 mol·L-1的MgCl2溶液中含有氯离子的数目为NA
14.下列关于100 mL 0.1 mol/LNa2SO4溶液的说法中,正确的是
A.分散质粒子直径大于1 nm
B.所含硫酸钠的物质的量是0.1 mol
C.取出50 mL该溶液,所含溶质物质的量为0.005 mol
D.与0.1 mol/L溶液恰好完全反应
15.某化学兴趣小组甲同学为了测定和的混合溶液中的物质的量浓度,将其分成两等份,分别进行了如下实验:
实验Ⅰ.
实验Ⅱ.
则原混合溶液中的物质的量浓度为
A. B. C. D.
二、填空题
16.物质的量浓度
(1)定义:_______。符号为_______。
(2)定义式及单位:_______,单位_______。
(3)意义:1 mol/L NaCl溶液表示_______。
(4)注意:物质的量浓度定义式中的体积V表示的是_______,溶液的体积_______溶剂的体积。
17.“84消毒液”能有效杀灭甲型病毒,某同学购买了一瓶“威露士”牌“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如下信息:
84消毒液 有效成分NaClO 规格1 000 mL 质量分数25% 密度1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为_________________。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=_________________mol·L-1。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8 g·cm-3)的浓硫酸配制100 mL物质的量浓度为0.8 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要用量筒量取_________________mL上述浓硫酸进行配制。
②稀释后的稀硫酸溶液中c(H+)为_________________。
18.计算完成下列各题,并将答案填写在空格处。
(1)相同质量的SO2、SO3的物质的量之比为____;氧原子的个数之比为____。
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是____;A的相对原子质量是____;ACl2的化学式是____。
(3)将117gNaCl溶于水配制成1L溶液。
①该溶液中Cl-的物质的量浓度为____。
②配制1mol L-1的NaCl溶液500mL,需该溶液的体积为____L。
③向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为____,通入HCl气体的体积(标准状况下)为____。
三、实验题
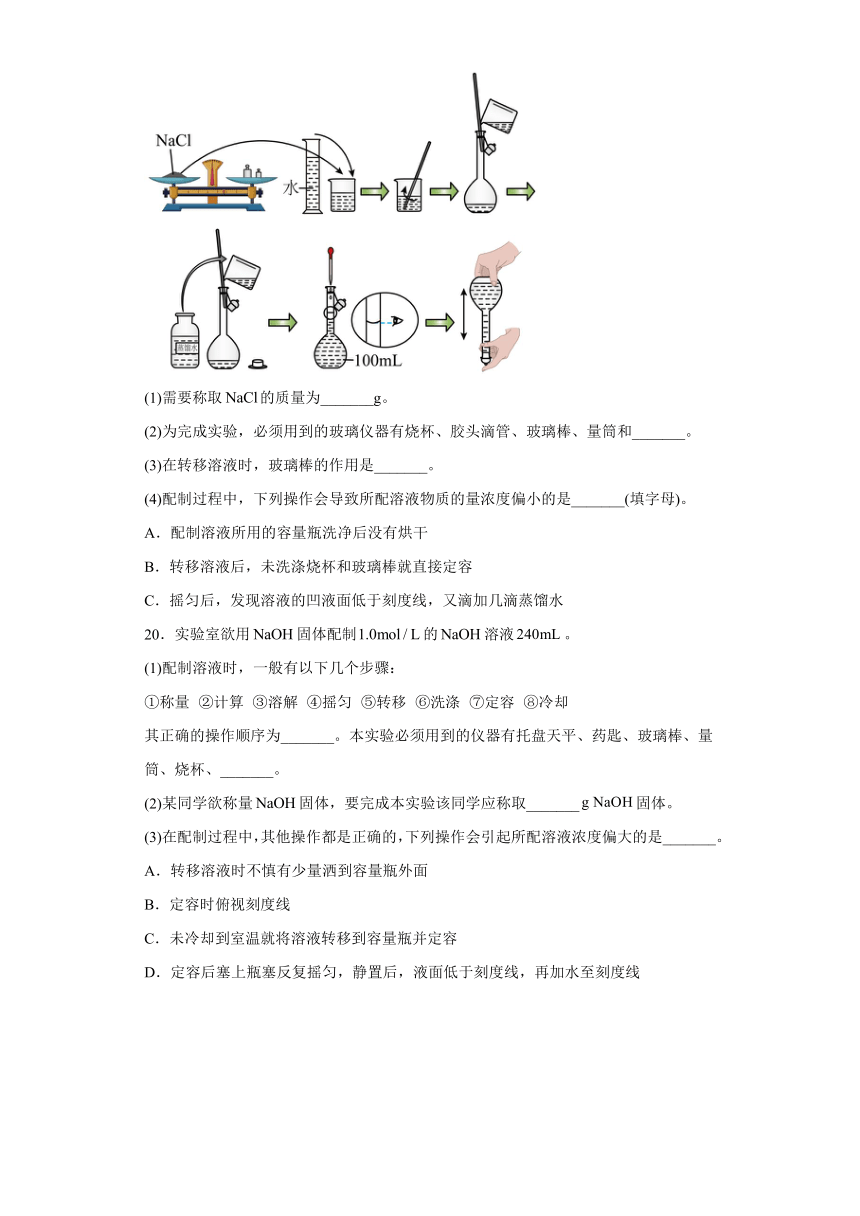
19.实验小组同学需要配制溶液。方法如下:
(1)需要称取的质量为_______g。
(2)为完成实验,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和_______。
(3)在转移溶液时,玻璃棒的作用是_______。
(4)配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是_______(填字母)。
A.配制溶液所用的容量瓶洗净后没有烘干
B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
C.摇匀后,发现溶液的凹液面低于刻度线,又滴加几滴蒸馏水
20.实验室欲用固体配制的溶液。
(1)配制溶液时,一般有以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为_______。本实验必须用到的仪器有托盘天平、药匙、玻璃棒、量筒、烧杯、_______。
(2)某同学欲称量固体,要完成本实验该同学应称取_______固体。
(3)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏大的是_______。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
参考答案:
1.B
【详解】、的混合溶液中,为0.5mol/L ,则的溶液中==0.75mol/L。设混合溶液体积为1L,由可知,==0.5mol/L,则的溶液中==0.5mol/L。则混合溶液中为0.75mol/L+0.5mol/L=1.25mol/L,故选B。
2.B
【分析】250mL的溶液中物质的量浓度是。
【详解】A.250的NaCl溶液中,A不符合题意;
B.25溶液中,B符合题意;
C.75mL的MgCl2溶液中,C不符合题意;
D.125 mL的溶液中,D不符合题意;
故答案为:B。
3.D
【详解】A.1mol/L H2SO4溶液表示1L溶液中含有1molH2SO4,不是指溶剂的体积,故A错误;
B.1L 1mol/L H2SO4溶液中含有H+的物质的量为1L×2mol/L=2mol,故B错误;
C.98g H2SO4溶的物质的量为98g H2SO4溶的物质的量为1mol,溶于1L水中配成溶液的体积不等于1L,无法计算浓度,故C错误;
D.1L 1mol/L H2SO4溶液中含有H+的物质的量为1L×2mol/L=2mol,故D正确;
故选D。
4.D
【详解】A.100mL 0.1 mol L 1溶液中,0.1 mol L 1溶液中的,两者的不相等,故A错误;
B.若取该溶液10mL,离子浓度不变,因此,故B错误;
C.氯化钡全部电离,因此该溶液中含有的微粒主要有:、、,故C错误;
D.若取该溶液10mL,与10mL 0.1 mol L 1溶液,两者的,因此两者恰好完全反应,故D正确。
综上所述,答案为D。
5.C
【详解】A.由于溶液体积未知,则不能确定溶质的物质的量,A错误;
B.1mol Na2SO4溶于1L水,溶液的体积不等于1L,B错误;
C.1L溶液中含有:,C正确;
D.从1L该溶液中取出500mL以后,溶液的均一性,故剩余溶液的浓度仍为1 ,D错误;
故本题选C。
6.C
【详解】A.1LH2SO4溶液中含有98gH2SO4,溶质H2SO4的物质的量,则该溶液中溶质的物质的量浓度为,A错误;
B.1LH2O中溶解了0.5molNaCl,溶液体积大于1L,则该溶液中溶质的物质的量浓度小于0.5mol·L-1,B错误;
C.溶液是均一稳定的分散系,从1L1mol·L-1蔗糖溶液中取出100mL,剩余溶液浓度仍为1mol·L-1,C正确;
D.溶液的体积未知,无法计算,D错误;
故答案为:C。
7.D
【详解】A. 溶液具有均一性,从1L1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L,A正确;
B.制成0.5L10mol/L的盐酸,需要氯化氢气体的物质的量为0.5L×10mol/L=5mol,标况下的体积为5mol×22.4L/mol=112L,B正确;
C. 0.5L2mol/L的BaCl2溶液中,钡离子和氯离子总数为3 ×0.5L×2mol/L×6.02×1023=3×6.02×1023,C正确;
D. 10g98%硫酸(密度为1.84g/cm3)的物质的量浓度为,与10mL18.4mol/L硫酸的浓度是相同的,D不正确;
故选D。
8.B
【详解】溶液中溶质的质量分数由20%变为40%,则蒸发掉原溶液质量一半的水,设质量分数为20%的的密度为,蒸发后密度为,根据物质的量浓度与溶液密度、质量分数的关系有:,,,得,的浓度越大密度越大,,则得到,故B符合题意。
综上所述,答案为B。
9.D
【详解】氯离子浓度大小与溶液体积无关,的溶液、的溶液、的溶液和的溶液中,Cl-的物质的量浓度分别为、、、,则氯离子的物质的量浓度最大的是,的溶液;
故答案选D。
10.B
【详解】假设溶液的体积都为1L,则铜离子物质的量为2mol,铁离子物质的量为2mol,先是铁和铁离子反应Fe+2Fe3+=3 Fe2+,则生成亚铁离子为3mol,再是铁和铜离子反应Cu2++Fe=Cu+Fe2+,生成亚铁离子为2mol,因此亚铁离子共5mol,溶液体积为2L,则亚铁离子物质的量浓度为,故B符合题意。
综上所述,答案为B。
11.B
【详解】A.将质量分数为40%(密度为 1.43 g·cm 3)的 NaOH溶液与水等体积混合,由于水的密度小与氢氧化钠溶液,则等体积水的质量小于氢氧化钠溶液,故所得混合溶液中溶质的质量分数大于20%,A正确;
B.要配制480mL 0.25 mol·L 1的 NaOH溶液,因为容量瓶的规格有限,所以应配制500 mL 0.25 mol·L 1的 NaOH溶液,再从中取480 mL溶液,因此需要称量氢氧化钠的质量为:0.25mol/L×0.5L×40g/mol=5.0g,B错误;
C.配制一定物质的量浓度的溶液,定容时俯视刻度线,导致加入溶液的体积较小,最终配制得到溶液体积偏小,则所配溶液浓度偏高,C正确;
D.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,由于热胀冷缩,导致最终冷却后配制的溶液体积偏小,溶液浓度偏高,D正确;
故选B。
12.B
【详解】假设烧瓶的体积是VL,则物质的量为: ,结束后液体充满烧瓶,故溶液体积为VL,根据浓度公式:,故本题选B。
13.C
【详解】A. 标准状况下,水不是气体,不能计算其体积,故A错误;
B. 1个水分子中含有10个电子,则1 mol H2O中含有10mol电子,故B错误;
C. N2与CO的摩尔质量均为28g/mol,14g由N2与CO组成的混合气体的物质的量为0.5mol,N2与CO均为双原子分子,则含有的原子数为0.5mol2 NA mol-1 =NA,故C正确;
D. 缺少溶液体积,无法计算氯离子的数目,故D错误;
故选C。
14.C
【详解】A.溶液的分散质粒子直径小于1nm,A错误;
B.所含硫酸钠的物质的量是0.1L×0.1mol/L=0.01 mol,B错误;
C.取出50 mL该溶液,所含溶质物质的量为0.05L×0.1mol/L=0.005 mol,C正确;
D.由于未知Ba(OH)2溶液的体积,故无法计算Ba(OH)2的物质的量,D错误;
故答案为:C。
15.A
【详解】实验Ⅰ生成硫酸钡0.015mol,则氯化钡为0.015mol;实验Ⅱ生成氯化银0.04mol,根据氯元素守恒可知,氯化钾为0.04mol-0.015mol×2=0.01mol;原混合溶液中的物质的量浓度为0.01mol÷0.25L=0.04mol/L;
故选A。
16.(1) 单位体积溶液里所含溶质B的物质的量 cB
(2) cB= mol/L(或mol·L-1)
(3)1 L NaCl溶液中含有1 mol NaCl
(4) 溶液的体积 不等于
【解析】(1)
物质的量浓度是表示溶液浓度的一种方法,其定义:单位体积溶液里所含溶质B的物质的量。符号为cB,c表示物质的量浓度,B表示溶质。答案为:单位体积溶液里所含溶质B的物质的量;cB;
(2)
依据物质的量浓度的定义,表达式中,分子为溶质B的物质的量,分母为溶液的体积,则定义式及单位:cB=,单位:mol/L(或mol·L-1)。答案为:cB=;mol/L(或mol·L-1);
(3)
1 mol/L NaCl溶液中,溶质为1mol,溶液为1L,即表示:1 L NaCl溶液中含有1 mol NaCl。答案为:1 L NaCl溶液中含有1 mol NaCl;
(4)
物质的量浓度定义式中的体积V表示的是溶液的体积,溶液的体积不等于溶剂的体积,也不等于溶质体积与溶剂体积之和。答案为:溶液的体积;不等于。
17.(1)4 mol·L-1
(2)0.04
(3) 4.4 1.6 mol·L-1
【解析】(1)
c(NaClO)==4 mol·L-1;
(2)
c(Na+)==0.04 mol·L-1;
(3)
①根据稀释前后硫酸的物质的量不变有:×V(H2SO4)=0.8 mol·L-1×100 mL,V(H2SO4)=4.4 mL;②H2SO4=2H++,c(H+)=2c(H2SO4)=2×0.8 mol·L-1=1.6 mol·L-1。
18.(1) 5:4 5:6
(2) 95g/mol 24 MgCl2
(3) 2mol/L 0.25 1mol/L 22.4L
【解析】(1)
相同质量的SO2、SO3的物质的量之比为,氧原子的个数之比为(5×2):(4×3)=5:6;
(2)
19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的物质的量为0.2mol,摩尔质量是19g÷0.2mol=95g/mol,A的相对原子质量是95-35.5×2=24,则A为镁元素,ACl2的化学式是MgCl2;
(3)
将117gNaCl溶于水配制成1L溶液,NaCl的物质的量为117g÷58.5g/mol=2mol,溶液的浓度为2mol/L;
①由化学式体现的关系可知,该溶液中Cl-的物质的量浓度为2mol/L。
②配制1mol L-1的NaCl溶液500mL,需该溶液的体积为1mol L-1×0.5L÷2mol/L =0.25L。
③向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol L-1(假设溶液体积不变),氯离子的物质的量为3mol L-1×1L =3mol,则根据质量守恒,通入氯化氢的物质的量为3mol -2mol/L×1L =1mol,氯化氢溶于水电离出氢离子,故溶液中H+的物质的量浓度为1mol÷1L=1.0mol/L,通入HCl气体的体积(标准状况下)为1mol×22.4L/mol=22.4L。
19.(1)11.7
(2)500mL容量瓶
(3)引流
(4)BC
【分析】配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等;
【详解】(1)需要称取的质量为m=c V M=0.4mol/L×0.5L×58.5g/mol=11.7g;
(2)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和500mL容量瓶,所以缺少的玻璃仪器:500mL容量瓶;
(3)在转移溶液时,玻璃棒的作用是引流;
(4)A.配制溶液所用的容量瓶洗净后没有烘干,溶质的物质的量不变,溶液体积也不变,则浓度不变,故A不符合题意;
B.转移溶液时未洗涤烧杯和玻璃棒,会导致溶质损失,则浓度偏小,故B符合题意;
C.摇匀后静置,发现液面低于刻度线是正常的,再补加蒸馏水至刻度线,则溶液体积偏多,浓度偏小,故C符合题意;
故答案为:BC。
20.(1) ②①③⑧⑤⑥⑦④ 容量瓶、胶头滴管
(2)10.0
(3)BC
【详解】(1)配制的溶液的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、摇动、定容、摇匀,所以正确操作顺序为②①③⑧⑤⑥⑦④;配制240mL溶液需选用250mL容量瓶进行定容,实验操作中,在烧杯中溶解固体,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2~3次,并将洗涤液移入250mL的容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所有本实验必须用到的仪器除了天平、药匙、玻璃棒、烧杯还需要250mL容量瓶、胶头滴管。
(2)需要称量的固体的质量。
(3)根据分析操作过程中引起相关参数的影响判断对溶液浓度的影响。
A.转移溶液时不慎有少量洒到容量瓶外面,则实际转移到容量瓶内的的物质的量减少,溶液的浓度偏低;
B.定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高;
C.液体具有热胀冷缩的性质,溶解放出大量的热,未冷却到室温就将溶液转移到容量瓶并定容,待溶液冷却至室温时会导致溶液体积偏小,溶液浓度偏高;
D.定容后塞上瓶塞反复倒转摇匀后液面下降,一部分溶液附着在瓶塞或者容量瓶刻度线以上的瓶壁上,若再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:BC。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.实验测得、的混合溶液中,,为0.5mol/L。则为
A.1.00mol/L B.1.25mol/L C.1.75mol/L D.2.05mol/L
2.现有一瓶溶液,下列溶液中的与该溶液中的相等的是
A.溶液 B.溶液
C.溶液 D.溶液
3.1mol/L H2SO4 的含义是
A.1L 水中溶解 1mol H2SO4
B.1L 溶 液 中 含 有 1molH+
C.将 98g H2SO4 溶于 1L 水中配成溶液
D.1L H2SO4 溶液中含有 2molH+
4.下列关于“100mL 0.1 mol L 1溶液”的说法正确的是
A.该溶液与0.1 mol L 1溶液中的相等
B.若取该溶液10mL,其中
C.该溶液中含有的微粒主要有:、、、
D.若取该溶液10mL,恰好能与10mL 0.1 mol L 1溶液完全反应
5.下列对1 mol L-1的Na2SO4溶液的叙述中正确的是
A.溶液中含有1mol Na2SO4
B.它是由1mol Na2SO4溶于1L水形成的溶液
C.1L该溶液含有142g Na2SO4
D.从1L该溶液中取出500mL以后,剩余溶液的浓度为0.5
6.下列判断正确的是
A.1LH2SO4溶液中含有98gH2SO4,则该溶液中溶质的物质的量浓度为98g·L-1
B.1LH2O中溶解了0.5molNaCl,则该溶液中溶质的物质的量浓度为0.5mol·L-1
C.从1L1mol·L-1蔗糖溶液中取出100mL,剩余溶液浓度仍为1mol·L-1
D.0.5mol·L-1NaOH溶液中,含有0.5molNa+
7.下列说法中错误的是
A.从1 L 的NaCl溶液中取出10 mL,其浓度仍是
B.制成0.5 L 的盐酸,需要氯化氢气体112 L
C.0.5 L 溶液中,和总数为
D.10 g 98%硫酸(密度为)与10 mL 硫酸的浓度是不同的
8.现有质量分数为20%,物质的量浓度为的稀蒸发掉一定量的水,使之质量分数变为40%,此时该的物质的量浓度为,则和的数值关系是
A. B. C. D.无法确定
9.下列各溶液中氯离子的物质的量浓度最大的是
A.,的溶液 B.,的溶液
C.,的溶液 D.,的溶液
10.把2.0 mol L 1 溶液和1.0 mol L 1 溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余。此时溶液中的物质的量浓度为
A.3.0 mol L 1 B.2.5 mol L 1 C.2.0 mol L 1 D.1.0 mol L 1
11.下列有关溶液的说法错误的是
A.将质量分数为40%(密度为 1.43 g·cm 3)的 NaOH溶液与水等体积混合,得到质量分数大于20%的溶液
B.要配制480 mL 0.25 mol·L 1的 NaOH溶液,应称量4.8 g NaOH
C.配制一定物质的量浓度的溶液,定容时俯视刻度线导致所配溶液浓度偏高
D.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏高
12.在标准状况下,充满气体的烧瓶做喷泉实验,结束后假设液体充满烧瓶,液体没有溢出,则所得溶液溶质的物质的量浓度为
A. B. C. D.
13.NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,NA个H2O分子所占体积为22.4L
B.1 mol H2O中含有3 mol电子
C.常温常压下,14g由N2与CO组成的混合气体中含有的原子数为NA
D.0.5 mol·L-1的MgCl2溶液中含有氯离子的数目为NA
14.下列关于100 mL 0.1 mol/LNa2SO4溶液的说法中,正确的是
A.分散质粒子直径大于1 nm
B.所含硫酸钠的物质的量是0.1 mol
C.取出50 mL该溶液,所含溶质物质的量为0.005 mol
D.与0.1 mol/L溶液恰好完全反应
15.某化学兴趣小组甲同学为了测定和的混合溶液中的物质的量浓度,将其分成两等份,分别进行了如下实验:
实验Ⅰ.
实验Ⅱ.
则原混合溶液中的物质的量浓度为
A. B. C. D.
二、填空题
16.物质的量浓度
(1)定义:_______。符号为_______。
(2)定义式及单位:_______,单位_______。
(3)意义:1 mol/L NaCl溶液表示_______。
(4)注意:物质的量浓度定义式中的体积V表示的是_______,溶液的体积_______溶剂的体积。
17.“84消毒液”能有效杀灭甲型病毒,某同学购买了一瓶“威露士”牌“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如下信息:
84消毒液 有效成分NaClO 规格1 000 mL 质量分数25% 密度1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为_________________。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=_________________mol·L-1。
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.8 g·cm-3)的浓硫酸配制100 mL物质的量浓度为0.8 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需要用量筒量取_________________mL上述浓硫酸进行配制。
②稀释后的稀硫酸溶液中c(H+)为_________________。
18.计算完成下列各题,并将答案填写在空格处。
(1)相同质量的SO2、SO3的物质的量之比为____;氧原子的个数之比为____。
(2)19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的摩尔质量是____;A的相对原子质量是____;ACl2的化学式是____。
(3)将117gNaCl溶于水配制成1L溶液。
①该溶液中Cl-的物质的量浓度为____。
②配制1mol L-1的NaCl溶液500mL,需该溶液的体积为____L。
③向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol L-1(假设溶液体积不变),则溶液中H+的物质的量浓度为____,通入HCl气体的体积(标准状况下)为____。
三、实验题
19.实验小组同学需要配制溶液。方法如下:
(1)需要称取的质量为_______g。
(2)为完成实验,必须用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和_______。
(3)在转移溶液时,玻璃棒的作用是_______。
(4)配制过程中,下列操作会导致所配溶液物质的量浓度偏小的是_______(填字母)。
A.配制溶液所用的容量瓶洗净后没有烘干
B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
C.摇匀后,发现溶液的凹液面低于刻度线,又滴加几滴蒸馏水
20.实验室欲用固体配制的溶液。
(1)配制溶液时,一般有以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为_______。本实验必须用到的仪器有托盘天平、药匙、玻璃棒、量筒、烧杯、_______。
(2)某同学欲称量固体,要完成本实验该同学应称取_______固体。
(3)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏大的是_______。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
参考答案:
1.B
【详解】、的混合溶液中,为0.5mol/L ,则的溶液中==0.75mol/L。设混合溶液体积为1L,由可知,==0.5mol/L,则的溶液中==0.5mol/L。则混合溶液中为0.75mol/L+0.5mol/L=1.25mol/L,故选B。
2.B
【分析】250mL的溶液中物质的量浓度是。
【详解】A.250的NaCl溶液中,A不符合题意;
B.25溶液中,B符合题意;
C.75mL的MgCl2溶液中,C不符合题意;
D.125 mL的溶液中,D不符合题意;
故答案为:B。
3.D
【详解】A.1mol/L H2SO4溶液表示1L溶液中含有1molH2SO4,不是指溶剂的体积,故A错误;
B.1L 1mol/L H2SO4溶液中含有H+的物质的量为1L×2mol/L=2mol,故B错误;
C.98g H2SO4溶的物质的量为98g H2SO4溶的物质的量为1mol,溶于1L水中配成溶液的体积不等于1L,无法计算浓度,故C错误;
D.1L 1mol/L H2SO4溶液中含有H+的物质的量为1L×2mol/L=2mol,故D正确;
故选D。
4.D
【详解】A.100mL 0.1 mol L 1溶液中,0.1 mol L 1溶液中的,两者的不相等,故A错误;
B.若取该溶液10mL,离子浓度不变,因此,故B错误;
C.氯化钡全部电离,因此该溶液中含有的微粒主要有:、、,故C错误;
D.若取该溶液10mL,与10mL 0.1 mol L 1溶液,两者的,因此两者恰好完全反应,故D正确。
综上所述,答案为D。
5.C
【详解】A.由于溶液体积未知,则不能确定溶质的物质的量,A错误;
B.1mol Na2SO4溶于1L水,溶液的体积不等于1L,B错误;
C.1L溶液中含有:,C正确;
D.从1L该溶液中取出500mL以后,溶液的均一性,故剩余溶液的浓度仍为1 ,D错误;
故本题选C。
6.C
【详解】A.1LH2SO4溶液中含有98gH2SO4,溶质H2SO4的物质的量,则该溶液中溶质的物质的量浓度为,A错误;
B.1LH2O中溶解了0.5molNaCl,溶液体积大于1L,则该溶液中溶质的物质的量浓度小于0.5mol·L-1,B错误;
C.溶液是均一稳定的分散系,从1L1mol·L-1蔗糖溶液中取出100mL,剩余溶液浓度仍为1mol·L-1,C正确;
D.溶液的体积未知,无法计算,D错误;
故答案为:C。
7.D
【详解】A. 溶液具有均一性,从1L1mol/L的氯化钠溶液中取出10mL,其浓度仍是1mol/L,A正确;
B.制成0.5L10mol/L的盐酸,需要氯化氢气体的物质的量为0.5L×10mol/L=5mol,标况下的体积为5mol×22.4L/mol=112L,B正确;
C. 0.5L2mol/L的BaCl2溶液中,钡离子和氯离子总数为3 ×0.5L×2mol/L×6.02×1023=3×6.02×1023,C正确;
D. 10g98%硫酸(密度为1.84g/cm3)的物质的量浓度为,与10mL18.4mol/L硫酸的浓度是相同的,D不正确;
故选D。
8.B
【详解】溶液中溶质的质量分数由20%变为40%,则蒸发掉原溶液质量一半的水,设质量分数为20%的的密度为,蒸发后密度为,根据物质的量浓度与溶液密度、质量分数的关系有:,,,得,的浓度越大密度越大,,则得到,故B符合题意。
综上所述,答案为B。
9.D
【详解】氯离子浓度大小与溶液体积无关,的溶液、的溶液、的溶液和的溶液中,Cl-的物质的量浓度分别为、、、,则氯离子的物质的量浓度最大的是,的溶液;
故答案选D。
10.B
【详解】假设溶液的体积都为1L,则铜离子物质的量为2mol,铁离子物质的量为2mol,先是铁和铁离子反应Fe+2Fe3+=3 Fe2+,则生成亚铁离子为3mol,再是铁和铜离子反应Cu2++Fe=Cu+Fe2+,生成亚铁离子为2mol,因此亚铁离子共5mol,溶液体积为2L,则亚铁离子物质的量浓度为,故B符合题意。
综上所述,答案为B。
11.B
【详解】A.将质量分数为40%(密度为 1.43 g·cm 3)的 NaOH溶液与水等体积混合,由于水的密度小与氢氧化钠溶液,则等体积水的质量小于氢氧化钠溶液,故所得混合溶液中溶质的质量分数大于20%,A正确;
B.要配制480mL 0.25 mol·L 1的 NaOH溶液,因为容量瓶的规格有限,所以应配制500 mL 0.25 mol·L 1的 NaOH溶液,再从中取480 mL溶液,因此需要称量氢氧化钠的质量为:0.25mol/L×0.5L×40g/mol=5.0g,B错误;
C.配制一定物质的量浓度的溶液,定容时俯视刻度线,导致加入溶液的体积较小,最终配制得到溶液体积偏小,则所配溶液浓度偏高,C正确;
D.配制NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,由于热胀冷缩,导致最终冷却后配制的溶液体积偏小,溶液浓度偏高,D正确;
故选B。
12.B
【详解】假设烧瓶的体积是VL,则物质的量为: ,结束后液体充满烧瓶,故溶液体积为VL,根据浓度公式:,故本题选B。
13.C
【详解】A. 标准状况下,水不是气体,不能计算其体积,故A错误;
B. 1个水分子中含有10个电子,则1 mol H2O中含有10mol电子,故B错误;
C. N2与CO的摩尔质量均为28g/mol,14g由N2与CO组成的混合气体的物质的量为0.5mol,N2与CO均为双原子分子,则含有的原子数为0.5mol2 NA mol-1 =NA,故C正确;
D. 缺少溶液体积,无法计算氯离子的数目,故D错误;
故选C。
14.C
【详解】A.溶液的分散质粒子直径小于1nm,A错误;
B.所含硫酸钠的物质的量是0.1L×0.1mol/L=0.01 mol,B错误;
C.取出50 mL该溶液,所含溶质物质的量为0.05L×0.1mol/L=0.005 mol,C正确;
D.由于未知Ba(OH)2溶液的体积,故无法计算Ba(OH)2的物质的量,D错误;
故答案为:C。
15.A
【详解】实验Ⅰ生成硫酸钡0.015mol,则氯化钡为0.015mol;实验Ⅱ生成氯化银0.04mol,根据氯元素守恒可知,氯化钾为0.04mol-0.015mol×2=0.01mol;原混合溶液中的物质的量浓度为0.01mol÷0.25L=0.04mol/L;
故选A。
16.(1) 单位体积溶液里所含溶质B的物质的量 cB
(2) cB= mol/L(或mol·L-1)
(3)1 L NaCl溶液中含有1 mol NaCl
(4) 溶液的体积 不等于
【解析】(1)
物质的量浓度是表示溶液浓度的一种方法,其定义:单位体积溶液里所含溶质B的物质的量。符号为cB,c表示物质的量浓度,B表示溶质。答案为:单位体积溶液里所含溶质B的物质的量;cB;
(2)
依据物质的量浓度的定义,表达式中,分子为溶质B的物质的量,分母为溶液的体积,则定义式及单位:cB=,单位:mol/L(或mol·L-1)。答案为:cB=;mol/L(或mol·L-1);
(3)
1 mol/L NaCl溶液中,溶质为1mol,溶液为1L,即表示:1 L NaCl溶液中含有1 mol NaCl。答案为:1 L NaCl溶液中含有1 mol NaCl;
(4)
物质的量浓度定义式中的体积V表示的是溶液的体积,溶液的体积不等于溶剂的体积,也不等于溶质体积与溶剂体积之和。答案为:溶液的体积;不等于。
17.(1)4 mol·L-1
(2)0.04
(3) 4.4 1.6 mol·L-1
【解析】(1)
c(NaClO)==4 mol·L-1;
(2)
c(Na+)==0.04 mol·L-1;
(3)
①根据稀释前后硫酸的物质的量不变有:×V(H2SO4)=0.8 mol·L-1×100 mL,V(H2SO4)=4.4 mL;②H2SO4=2H++,c(H+)=2c(H2SO4)=2×0.8 mol·L-1=1.6 mol·L-1。
18.(1) 5:4 5:6
(2) 95g/mol 24 MgCl2
(3) 2mol/L 0.25 1mol/L 22.4L
【解析】(1)
相同质量的SO2、SO3的物质的量之比为,氧原子的个数之比为(5×2):(4×3)=5:6;
(2)
19g某二价金属氯化物(ACl2)中含有0.4molCl-,则ACl2的物质的量为0.2mol,摩尔质量是19g÷0.2mol=95g/mol,A的相对原子质量是95-35.5×2=24,则A为镁元素,ACl2的化学式是MgCl2;
(3)
将117gNaCl溶于水配制成1L溶液,NaCl的物质的量为117g÷58.5g/mol=2mol,溶液的浓度为2mol/L;
①由化学式体现的关系可知,该溶液中Cl-的物质的量浓度为2mol/L。
②配制1mol L-1的NaCl溶液500mL,需该溶液的体积为1mol L-1×0.5L÷2mol/L =0.25L。
③向该溶液中再通入一定量的HCl气体后,溶液中Cl-的物质的量浓度为3mol L-1(假设溶液体积不变),氯离子的物质的量为3mol L-1×1L =3mol,则根据质量守恒,通入氯化氢的物质的量为3mol -2mol/L×1L =1mol,氯化氢溶于水电离出氢离子,故溶液中H+的物质的量浓度为1mol÷1L=1.0mol/L,通入HCl气体的体积(标准状况下)为1mol×22.4L/mol=22.4L。
19.(1)11.7
(2)500mL容量瓶
(3)引流
(4)BC
【分析】配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等;
【详解】(1)需要称取的质量为m=c V M=0.4mol/L×0.5L×58.5g/mol=11.7g;
(2)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,玻璃仪器有烧杯、胶头滴管、玻璃棒、量筒和500mL容量瓶,所以缺少的玻璃仪器:500mL容量瓶;
(3)在转移溶液时,玻璃棒的作用是引流;
(4)A.配制溶液所用的容量瓶洗净后没有烘干,溶质的物质的量不变,溶液体积也不变,则浓度不变,故A不符合题意;
B.转移溶液时未洗涤烧杯和玻璃棒,会导致溶质损失,则浓度偏小,故B符合题意;
C.摇匀后静置,发现液面低于刻度线是正常的,再补加蒸馏水至刻度线,则溶液体积偏多,浓度偏小,故C符合题意;
故答案为:BC。
20.(1) ②①③⑧⑤⑥⑦④ 容量瓶、胶头滴管
(2)10.0
(3)BC
【详解】(1)配制的溶液的操作步骤为:计算、称量、溶解、冷却、转移、洗涤、摇动、定容、摇匀,所以正确操作顺序为②①③⑧⑤⑥⑦④;配制240mL溶液需选用250mL容量瓶进行定容,实验操作中,在烧杯中溶解固体,并用玻璃棒搅拌,加速溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2~3次,并将洗涤液移入250mL的容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所有本实验必须用到的仪器除了天平、药匙、玻璃棒、烧杯还需要250mL容量瓶、胶头滴管。
(2)需要称量的固体的质量。
(3)根据分析操作过程中引起相关参数的影响判断对溶液浓度的影响。
A.转移溶液时不慎有少量洒到容量瓶外面,则实际转移到容量瓶内的的物质的量减少,溶液的浓度偏低;
B.定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏高;
C.液体具有热胀冷缩的性质,溶解放出大量的热,未冷却到室温就将溶液转移到容量瓶并定容,待溶液冷却至室温时会导致溶液体积偏小,溶液浓度偏高;
D.定容后塞上瓶塞反复倒转摇匀后液面下降,一部分溶液附着在瓶塞或者容量瓶刻度线以上的瓶壁上,若再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:BC。
