专题4分子空间结构与物质性质单元测试下学期高二化学苏教版(2019)选择性必修2(含解析)
文档属性
| 名称 | 专题4分子空间结构与物质性质单元测试下学期高二化学苏教版(2019)选择性必修2(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 816.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 13:53:34 | ||
图片预览




文档简介
专题4《分子空间结构与物质性质》单元检测题
一、单选题(共13题)
1.物质W常用作食品添加剂,其组成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,元素N的单质在常温下为气体。下列说法正确的是
A.W中Y原子的杂化方式为
B.常温下N的单质与NaOH溶液反应,其中一种产物的水溶液呈碱性,有漂白性
C.Z的氢化物的沸点一定大于Y的所有氢化物的沸点
D.化合物W受热易分解,发生氧化还原反应
2.亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解:3K4[Fe(CN)6]12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
A.Fe2+的最高能层电子排布为3d6
B.配合物K4[Fe(CN)6]中配位数是6
C.N2分子是非极性分子
D.已知Fe3C晶胞中每个碳原子被6个铁原子包围,则铁的配位数是2
3.元素周期表中前四周期元素A、B、C、D原子序数依次增大。A的基态原子价层电子排布式为;B的基态原子2p能级有3个未成对电子:C的基态原子核外未成对电子数最多;的3d轨道电子处于半充满状态。下列说法正确的是
A.离子常作为配合物中的配体,中σ键与π键的数目之比2∶1
B.与D同周期且同族的元素最外层电子数相等
C.元素C位于周期表的第四周期ⅠB族,属于ds区元素
D.元素C能形成多种配合物,其中的中心离子的配位数为4
4.Fe3+的配位化合物较稳定且应用广泛。Fe3+可与H2O、SCN-、F-等配体形成使溶液呈浅紫色的[Fe(H2O)6]3+、红色的[Fe(SCN)6]3-、无色的[FeF6]3-配离子。某同学按如下步骤完成实验:
已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。下列说法不正确的是
A.Fe第四电离能(I4)大于其第三电离能(I3)
B.Ⅰ中溶液呈黄色可能是由Fe3+水解产物的颜色造成
C.可用NaF和KSCN溶液检验FeCl3溶液中是否含有Co2+
D.[Fe(H2O)6]3+中H-O-H的键角与H2O分子中H-O-H的键角相等
5.甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应为HCHO+O2H2O+CO2。下列有关叙述正确的是
A.HCHO分子中σ键和π键的数目之比为2∶1 B.16O原子中的中子数为16
C.CO2的空间构型为直线形 D.H2O与D2O互为同素异形体
6.下列有关硝酸的说法正确的是
A.NO的空间构型为三角锥形
B.浓硝酸保存在棕色带橡胶塞的试剂瓶中
C.用蘸有浓氨水的玻璃棒靠近浓硝酸有白烟产生
D.常温下用铁制容器运输浓硝酸是因为铁与浓硝酸不反应
7.物质M的组成为CoCl3 4NH3,以强碱处理并没有NH3放出;向1molM中加入足量AgNO3溶液生成1mol白色沉淀。下列说法不正确的是
A.该配合物的配体是Cl-和NH3 B.该配合物可表示为[Co(NH3)4Cl2]Cl
C.M中的配离子可能是平面正方形 D.该配合物中心离子的电荷数为3,配位数为6
8.下列说法正确的是
A.H2O分子间存在氢键,所以H2O比H2S稳定
B.He、CO2和CH4分子中都存在共价键
C.PCl5中各原子的最外层均达到8电子稳定结构
D.NaHCO3受热分解生成Na2CO3、CO2和H2O的过程中,既破坏离子键,也破坏共价键
9.肼(H2N~NH2)是一种高能燃料,共价键的键能与热化学方程式信息如下表:
共价键 N-H N-N O=O N≡N O-H
键能/(kJ·mol-1) 391 161 498 946 463
则关于反应N2H4(g) +O2 (g)=N2(g) +2H2O(g)说法正确的是
A.该反应是吸热反应 B.N2H4(1)比 N2H4(g)能量高
C.反应物总能量大于生成物总能量 D.H2O空间结构是直线型
10.“”表示不同卤素之间靠共用电子对形成的卤素互化物(非金属性:),其化学性质和卤素单质相似。下列说法正确的是
A.与水反应可生成和,则参加反应转移电子数为
B.某温度,液态电离:,则不是一个常数
C.与反应生成和
D.与卤素单质一样都是非极性分子
11.下列粒子不属于等电子体的是
A.CH4和NH3 B.N2和CO
C.HCl和H2O D.NH2-和H3O+
12.有机反应过程中,随反应条件不同,成键的碳原子可以形成碳正离子()、碳负离子()、甲基()等微粒。下列说法不正确的是
A.中含有7mol电子
B.中所有的原子不都在一个平面内
C.的空间构型为平面三角形
D.键角:
13.利用可以合成化工原料分子的结构式为,每个分子内含有的键、键数目为
A.4个键 B.2个键、2个键 C.2个键、1个键 D.3个o键、1个键
二、非选择题(共10题)
14.已知N、P同属于元素周期表的第ⅤA族元素。呈三角锥形,N原子位于锥顶,3个H原子位于锥底,间的夹角是107°。
(1)分子的空间结构为,它是一种_______(填“极性”成“非极性”)分子。
(2)分子与分子的结构_______(填“相似”或“不相似”),为_______(填“极性”或“非极性”)键,为_______(填“极性”或“非极性”)分子。
(3)是一种淡黄色油状液体,下列对的有关描述不正确的是_______(填标号)。
a.该分子呈平面三角形b.该分子中的化学键为极性键c.该分子为极性分子
15.研究物质的组成、结构有利于更好的理解物质的性质。
⑴图3是As4S4分子的结构,该分子中含非极性共价键的数目是_____;基态As原子的外围电子排布式是______。
⑵图1是某种晶体的晶胞,该晶体的化学式是______。
⑶图1对应物质与图3对应物质熔点较高的是______,原因是______。
⑷NaCl的熔点为801.3℃,MgO的熔点高达2800℃。MgO熔点高的原因是______。
⑸图3所示是硼酸晶体的层状结构,层内H3BO3分子通过氢键相连。H3BO3分子B原子的轨道杂化方式是______,1 mol H3BO3晶体中含有的氢键数目是_____。
⑹金刚石、晶体硅、金刚砂(SiC)的晶体类型相同,它们的熔点由高到低的顺序是_____。
16.硅材料在生活中占有重要地位。请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为___________,分子中氮原子的杂化轨道类型是___________。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是___________。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
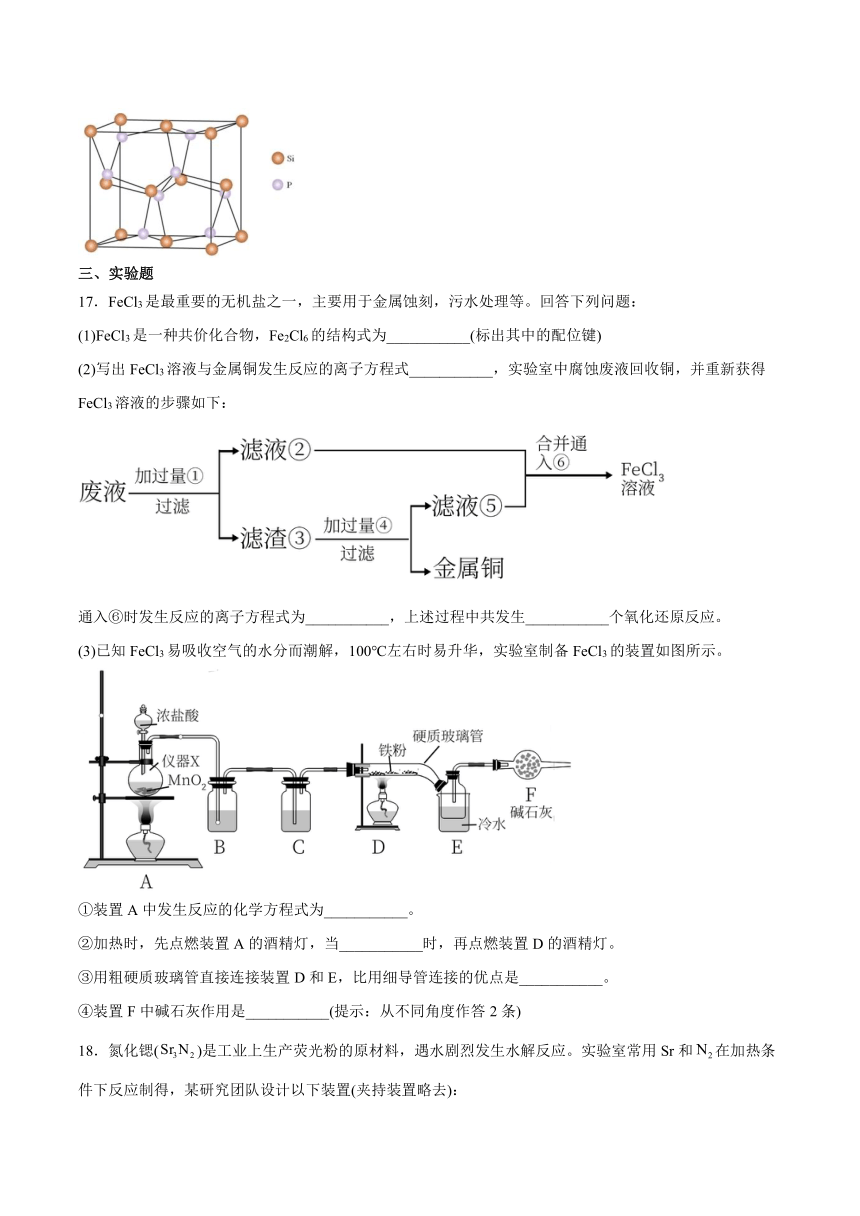
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________,该化合物的化学式为___________。
三、实验题
17.FeCl3是最重要的无机盐之一,主要用于金属蚀刻,污水处理等。回答下列问题:
(1)FeCl3是一种共价化合物,Fe2Cl6的结构式为___________(标出其中的配位键)
(2)写出FeCl3溶液与金属铜发生反应的离子方程式___________,实验室中腐蚀废液回收铜,并重新获得FeCl3溶液的步骤如下:
通入⑥时发生反应的离子方程式为___________,上述过程中共发生___________个氧化还原反应。
(3)已知FeCl3易吸收空气的水分而潮解,100℃左右时易升华,实验室制备FeCl3的装置如图所示。
①装置A中发生反应的化学方程式为___________。
②加热时,先点燃装置A的酒精灯,当___________时,再点燃装置D的酒精灯。
③用粗硬质玻璃管直接连接装置D和E,比用细导管连接的优点是___________。
④装置F中碱石灰作用是___________(提示:从不同角度作答2条)
18.氮化锶()是工业上生产荧光粉的原材料,遇水剧烈发生水解反应。实验室常用Sr和在加热条件下反应制得,某研究团队设计以下装置(夹持装置略去):
已知:锶与镁、钙同主族,锶能与水、、、等快速发生反应。回答下列问题:
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先_______,然后稍稍用力转动即可把玻璃管插入橡皮管中。
(2)A装置中发生反应的化学方程式为_______。
(3)按气流从左到右的方向,装置连接的合理顺序为_______→hi→_______(填小写字母;装置可重复使用),连接顺序中装置E的作用是_______、_______。
(4)工业生产中欲使Sr反应完全,当吸收氮的作用减缓时将温度提高到700~750℃,分析可能的原因是_______(写出一条即可)
(5)中美科学家合作发现钙和锶在上吸附很强,同主族的Be与Mg不具备该性能。钙和锶可以均匀地覆盖在表面上形成。上可吸附至少92个氢分子(如图)。
有关说法正确的是_______(填标号)。
A.吸附相同数目氢分子时,储氢质量分数比高
B.中碳原子杂化方式为
C.储氢是与发生加成反应
D.它们之间的相互作用机制可能与金属原子未占据的d轨道有关
四、计算题
19.蓝色的无水在吸水后会变成粉红色的水合物,该水合物受热后又变成无水,所以无水,常用作吸湿剂和空气湿度指示剂。现有无水,吸水后变成,试回答下列问题:
(1)水合物中x=______。
(2)若该水合物为配合物,其中的配位数为6,经测定得出该配合物内界和外界含有的个数之比为1:1,则该配合物的化学式可表示为______。
20.铁、钴、镍的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
钴的一种化合物晶胞结构如下图所示。
①已知a点的原子坐标参数为(0,0,0),b点为(,,0),c点为(1,,),则d点的原子坐标参数为___________。
②已知该晶体的密度为ρ g·cm-3,则晶胞参数a=___________nm(用含ρ、NA的代数式表示)。
21.A、B、C、D、E、F均为前四周期的元素。在所有前四周期的基态原子中A的未成对电子最多;B的基态原子的L电子层的p能级上有一个空轨道;C的简单氧化物与其最高价氧化物的水化物能反应生成盐;D的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子;F的基态原子有 4个未成对电子。根据信息回答下列问题:
(1)A的价层电子排布式为___________。
(2)B、C、D的第一电离能由小到大的顺序为_______ (填元素符号)。
(3)ED3分子的VSEPR模型为____________。
(4)D、E的简单氢化物分子键角较大的是____,原因为_________。
(5)F3+比F2+更稳定的原因是_______________。
22.(Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是__________。
(3)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ mol-1①,
2X(s)+O2(g)=X2O3(s)△H=-1675.7kJ mol-1 ②
X的单质和FeO反应的热化学方程式是_________。
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________;
(2)Y元素原子的价层电子的轨道表示式为__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_____________。
23.已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,其中元素A的L电子层电子数为0;B元素基态原子的最外层有2个未成对电子;D元素原子的价层电子排布式为nsnnp2n;E元素原子有5个未成对电子;F3+的3d轨道为半充满状态。
(1)B2A2分子中,σ键和π键的个数比为____;BA的键角____BA的键角(填“>”“=”或“<”)。
(2)C2的电子式为____,CA3的价层电子对互斥模型名称为____。
(3)A2D2的结构式为____,是____分子(填“极性”或“非极性”),D元素的杂化类型是____。
(4)固体A2D的结构模型中,每个A2D最多与相邻的____个A2D相连接,这主要是由氢键的____决定的。
(5)气态E2+再失去一个电子比气态F2+再失去一个电子更难的原因是____。
参考答案:
1.B 2.A 3.B 4.D 5.C 6.C 7.C 8.D 9.C 10.C 11.C 12.A 13.D
14. 非极性 相似 极性 极性 a
15. 2 4s24p3 SiO2 SiO2 SiO2是原子晶体,其熔点高于分子晶体As4S4高 都是离子晶体,因MgO所带的电荷多,离子半径之和小,晶格能大,熔点高 sp2 3×6.02×1023 金刚石>金刚砂>晶体硅
16.(1) 四面体 sp3
(2)AB
(3) 共价晶体 SiP2
17.(1)
(2) 2Fe3++Cu=2Fe2++Cu2+ 2Fe2++Cl2=2Fe3++2Cl- 4
(3) MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 装置E开始出现黄绿色气体(或黄绿色气体充满装置D的硬质玻璃管) 防止堵塞 防止空气中水蒸气进入,导致FeCl3潮解;吸收多余的Cl2,防止污染
18.(1)将橡皮管和玻璃管湿润
(2)
(3) acbde fghi 除去C中生成的水蒸气和未反应的氨气 根据长颈漏斗中液面变化,控制气体流速
(4)温度升高,化学反应速率加快;温度升高使化学平衡正向移动
(5)AD
19. 6
20. (,1,)
21.(1)3d54s1
(2)C(3)平面三角形
(4) H2O H2O、H2S中心原子的杂化轨道类型和孤电子对数均相同,但H2O中O的电负性更大,O周围的电子云密度更高,斥力更大
(5)Fe3+的电子排布为[Ar]3d5,3d轨道为半充满状态,比Fe2+的电子排布[Ar]3d6更稳定
22. 二;; ⅤA 弱 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O Al(S)+FeO(S)=Al2O3(S)+ Fe(S)△H=-429.5kJ/mol 1s22s22p63s23p63d104s24p3 三角锥形 As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
23.(1) 3:2 ﹥
(2) 四面体
(3) H—O—O—H 极性 sp3
(4) 4 方向性
(5)Mn2+的价层电子排布为3d5,3d轨道为半充满,比较稳定;Fe2+的价层电子排布为3d6,再失去一个电子即可达到3d轨道半充满的稳定状态
一、单选题(共13题)
1.物质W常用作食品添加剂,其组成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,元素N的单质在常温下为气体。下列说法正确的是
A.W中Y原子的杂化方式为
B.常温下N的单质与NaOH溶液反应,其中一种产物的水溶液呈碱性,有漂白性
C.Z的氢化物的沸点一定大于Y的所有氢化物的沸点
D.化合物W受热易分解,发生氧化还原反应
2.亚铁氰化钾属于欧盟批准使用的食品添加剂,受热易分解:3K4[Fe(CN)6]12KCN+Fe3C+2(CN)2↑+N2↑+C,下列关于该反应说法错误的是
A.Fe2+的最高能层电子排布为3d6
B.配合物K4[Fe(CN)6]中配位数是6
C.N2分子是非极性分子
D.已知Fe3C晶胞中每个碳原子被6个铁原子包围,则铁的配位数是2
3.元素周期表中前四周期元素A、B、C、D原子序数依次增大。A的基态原子价层电子排布式为;B的基态原子2p能级有3个未成对电子:C的基态原子核外未成对电子数最多;的3d轨道电子处于半充满状态。下列说法正确的是
A.离子常作为配合物中的配体,中σ键与π键的数目之比2∶1
B.与D同周期且同族的元素最外层电子数相等
C.元素C位于周期表的第四周期ⅠB族,属于ds区元素
D.元素C能形成多种配合物,其中的中心离子的配位数为4
4.Fe3+的配位化合物较稳定且应用广泛。Fe3+可与H2O、SCN-、F-等配体形成使溶液呈浅紫色的[Fe(H2O)6]3+、红色的[Fe(SCN)6]3-、无色的[FeF6]3-配离子。某同学按如下步骤完成实验:
已知:向Co2+的溶液中加入KSCN溶液生成蓝色的[Co(SCN)4]2-配离子;Co2+不能与F-形成配离子。下列说法不正确的是
A.Fe第四电离能(I4)大于其第三电离能(I3)
B.Ⅰ中溶液呈黄色可能是由Fe3+水解产物的颜色造成
C.可用NaF和KSCN溶液检验FeCl3溶液中是否含有Co2+
D.[Fe(H2O)6]3+中H-O-H的键角与H2O分子中H-O-H的键角相等
5.甲醛是家庭装修常见的污染物。一种催化氧化甲醛的反应为HCHO+O2H2O+CO2。下列有关叙述正确的是
A.HCHO分子中σ键和π键的数目之比为2∶1 B.16O原子中的中子数为16
C.CO2的空间构型为直线形 D.H2O与D2O互为同素异形体
6.下列有关硝酸的说法正确的是
A.NO的空间构型为三角锥形
B.浓硝酸保存在棕色带橡胶塞的试剂瓶中
C.用蘸有浓氨水的玻璃棒靠近浓硝酸有白烟产生
D.常温下用铁制容器运输浓硝酸是因为铁与浓硝酸不反应
7.物质M的组成为CoCl3 4NH3,以强碱处理并没有NH3放出;向1molM中加入足量AgNO3溶液生成1mol白色沉淀。下列说法不正确的是
A.该配合物的配体是Cl-和NH3 B.该配合物可表示为[Co(NH3)4Cl2]Cl
C.M中的配离子可能是平面正方形 D.该配合物中心离子的电荷数为3,配位数为6
8.下列说法正确的是
A.H2O分子间存在氢键,所以H2O比H2S稳定
B.He、CO2和CH4分子中都存在共价键
C.PCl5中各原子的最外层均达到8电子稳定结构
D.NaHCO3受热分解生成Na2CO3、CO2和H2O的过程中,既破坏离子键,也破坏共价键
9.肼(H2N~NH2)是一种高能燃料,共价键的键能与热化学方程式信息如下表:
共价键 N-H N-N O=O N≡N O-H
键能/(kJ·mol-1) 391 161 498 946 463
则关于反应N2H4(g) +O2 (g)=N2(g) +2H2O(g)说法正确的是
A.该反应是吸热反应 B.N2H4(1)比 N2H4(g)能量高
C.反应物总能量大于生成物总能量 D.H2O空间结构是直线型
10.“”表示不同卤素之间靠共用电子对形成的卤素互化物(非金属性:),其化学性质和卤素单质相似。下列说法正确的是
A.与水反应可生成和,则参加反应转移电子数为
B.某温度,液态电离:,则不是一个常数
C.与反应生成和
D.与卤素单质一样都是非极性分子
11.下列粒子不属于等电子体的是
A.CH4和NH3 B.N2和CO
C.HCl和H2O D.NH2-和H3O+
12.有机反应过程中,随反应条件不同,成键的碳原子可以形成碳正离子()、碳负离子()、甲基()等微粒。下列说法不正确的是
A.中含有7mol电子
B.中所有的原子不都在一个平面内
C.的空间构型为平面三角形
D.键角:
13.利用可以合成化工原料分子的结构式为,每个分子内含有的键、键数目为
A.4个键 B.2个键、2个键 C.2个键、1个键 D.3个o键、1个键
二、非选择题(共10题)
14.已知N、P同属于元素周期表的第ⅤA族元素。呈三角锥形,N原子位于锥顶,3个H原子位于锥底,间的夹角是107°。
(1)分子的空间结构为,它是一种_______(填“极性”成“非极性”)分子。
(2)分子与分子的结构_______(填“相似”或“不相似”),为_______(填“极性”或“非极性”)键,为_______(填“极性”或“非极性”)分子。
(3)是一种淡黄色油状液体,下列对的有关描述不正确的是_______(填标号)。
a.该分子呈平面三角形b.该分子中的化学键为极性键c.该分子为极性分子
15.研究物质的组成、结构有利于更好的理解物质的性质。
⑴图3是As4S4分子的结构,该分子中含非极性共价键的数目是_____;基态As原子的外围电子排布式是______。
⑵图1是某种晶体的晶胞,该晶体的化学式是______。
⑶图1对应物质与图3对应物质熔点较高的是______,原因是______。
⑷NaCl的熔点为801.3℃,MgO的熔点高达2800℃。MgO熔点高的原因是______。
⑸图3所示是硼酸晶体的层状结构,层内H3BO3分子通过氢键相连。H3BO3分子B原子的轨道杂化方式是______,1 mol H3BO3晶体中含有的氢键数目是_____。
⑹金刚石、晶体硅、金刚砂(SiC)的晶体类型相同,它们的熔点由高到低的顺序是_____。
16.硅材料在生活中占有重要地位。请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为___________,分子中氮原子的杂化轨道类型是___________。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①[Ne]3s23p2、②[Ne]3s23p1、③[Ne]3s23p14s1,有关这些微粒的叙述,正确的是___________。
A.微粒半径:③>①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________,该化合物的化学式为___________。
三、实验题
17.FeCl3是最重要的无机盐之一,主要用于金属蚀刻,污水处理等。回答下列问题:
(1)FeCl3是一种共价化合物,Fe2Cl6的结构式为___________(标出其中的配位键)
(2)写出FeCl3溶液与金属铜发生反应的离子方程式___________,实验室中腐蚀废液回收铜,并重新获得FeCl3溶液的步骤如下:
通入⑥时发生反应的离子方程式为___________,上述过程中共发生___________个氧化还原反应。
(3)已知FeCl3易吸收空气的水分而潮解,100℃左右时易升华,实验室制备FeCl3的装置如图所示。
①装置A中发生反应的化学方程式为___________。
②加热时,先点燃装置A的酒精灯,当___________时,再点燃装置D的酒精灯。
③用粗硬质玻璃管直接连接装置D和E,比用细导管连接的优点是___________。
④装置F中碱石灰作用是___________(提示:从不同角度作答2条)
18.氮化锶()是工业上生产荧光粉的原材料,遇水剧烈发生水解反应。实验室常用Sr和在加热条件下反应制得,某研究团队设计以下装置(夹持装置略去):
已知:锶与镁、钙同主族,锶能与水、、、等快速发生反应。回答下列问题:
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先_______,然后稍稍用力转动即可把玻璃管插入橡皮管中。
(2)A装置中发生反应的化学方程式为_______。
(3)按气流从左到右的方向,装置连接的合理顺序为_______→hi→_______(填小写字母;装置可重复使用),连接顺序中装置E的作用是_______、_______。
(4)工业生产中欲使Sr反应完全,当吸收氮的作用减缓时将温度提高到700~750℃,分析可能的原因是_______(写出一条即可)
(5)中美科学家合作发现钙和锶在上吸附很强,同主族的Be与Mg不具备该性能。钙和锶可以均匀地覆盖在表面上形成。上可吸附至少92个氢分子(如图)。
有关说法正确的是_______(填标号)。
A.吸附相同数目氢分子时,储氢质量分数比高
B.中碳原子杂化方式为
C.储氢是与发生加成反应
D.它们之间的相互作用机制可能与金属原子未占据的d轨道有关
四、计算题
19.蓝色的无水在吸水后会变成粉红色的水合物,该水合物受热后又变成无水,所以无水,常用作吸湿剂和空气湿度指示剂。现有无水,吸水后变成,试回答下列问题:
(1)水合物中x=______。
(2)若该水合物为配合物,其中的配位数为6,经测定得出该配合物内界和外界含有的个数之比为1:1,则该配合物的化学式可表示为______。
20.铁、钴、镍的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
钴的一种化合物晶胞结构如下图所示。
①已知a点的原子坐标参数为(0,0,0),b点为(,,0),c点为(1,,),则d点的原子坐标参数为___________。
②已知该晶体的密度为ρ g·cm-3,则晶胞参数a=___________nm(用含ρ、NA的代数式表示)。
21.A、B、C、D、E、F均为前四周期的元素。在所有前四周期的基态原子中A的未成对电子最多;B的基态原子的L电子层的p能级上有一个空轨道;C的简单氧化物与其最高价氧化物的水化物能反应生成盐;D的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子;F的基态原子有 4个未成对电子。根据信息回答下列问题:
(1)A的价层电子排布式为___________。
(2)B、C、D的第一电离能由小到大的顺序为_______ (填元素符号)。
(3)ED3分子的VSEPR模型为____________。
(4)D、E的简单氢化物分子键角较大的是____,原因为_________。
(5)F3+比F2+更稳定的原因是_______________。
22.(Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”)。
(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是__________。
(3)Fe(s)+O2(g)=FeO(s)△H=-272.0kJ mol-1①,
2X(s)+O2(g)=X2O3(s)△H=-1675.7kJ mol-1 ②
X的单质和FeO反应的热化学方程式是_________。
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________;
(2)Y元素原子的价层电子的轨道表示式为__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_____________。
23.已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,其中元素A的L电子层电子数为0;B元素基态原子的最外层有2个未成对电子;D元素原子的价层电子排布式为nsnnp2n;E元素原子有5个未成对电子;F3+的3d轨道为半充满状态。
(1)B2A2分子中,σ键和π键的个数比为____;BA的键角____BA的键角(填“>”“=”或“<”)。
(2)C2的电子式为____,CA3的价层电子对互斥模型名称为____。
(3)A2D2的结构式为____,是____分子(填“极性”或“非极性”),D元素的杂化类型是____。
(4)固体A2D的结构模型中,每个A2D最多与相邻的____个A2D相连接,这主要是由氢键的____决定的。
(5)气态E2+再失去一个电子比气态F2+再失去一个电子更难的原因是____。
参考答案:
1.B 2.A 3.B 4.D 5.C 6.C 7.C 8.D 9.C 10.C 11.C 12.A 13.D
14. 非极性 相似 极性 极性 a
15. 2 4s24p3 SiO2 SiO2 SiO2是原子晶体,其熔点高于分子晶体As4S4高 都是离子晶体,因MgO所带的电荷多,离子半径之和小,晶格能大,熔点高 sp2 3×6.02×1023 金刚石>金刚砂>晶体硅
16.(1) 四面体 sp3
(2)AB
(3) 共价晶体 SiP2
17.(1)
(2) 2Fe3++Cu=2Fe2++Cu2+ 2Fe2++Cl2=2Fe3++2Cl- 4
(3) MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 装置E开始出现黄绿色气体(或黄绿色气体充满装置D的硬质玻璃管) 防止堵塞 防止空气中水蒸气进入,导致FeCl3潮解;吸收多余的Cl2,防止污染
18.(1)将橡皮管和玻璃管湿润
(2)
(3) acbde fghi 除去C中生成的水蒸气和未反应的氨气 根据长颈漏斗中液面变化,控制气体流速
(4)温度升高,化学反应速率加快;温度升高使化学平衡正向移动
(5)AD
19. 6
20. (,1,)
21.(1)3d54s1
(2)C
(4) H2O H2O、H2S中心原子的杂化轨道类型和孤电子对数均相同,但H2O中O的电负性更大,O周围的电子云密度更高,斥力更大
(5)Fe3+的电子排布为[Ar]3d5,3d轨道为半充满状态,比Fe2+的电子排布[Ar]3d6更稳定
22. 二;; ⅤA 弱 2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O Al(S)+FeO(S)=Al2O3(S)+ Fe(S)△H=-429.5kJ/mol 1s22s22p63s23p63d104s24p3 三角锥形 As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
23.(1) 3:2 ﹥
(2) 四面体
(3) H—O—O—H 极性 sp3
(4) 4 方向性
(5)Mn2+的价层电子排布为3d5,3d轨道为半充满,比较稳定;Fe2+的价层电子排布为3d6,再失去一个电子即可达到3d轨道半充满的稳定状态
