专题2化学反应速率与化学平衡练习题 高二上学期化学苏教版(2019)选择性必修1(含解析)
文档属性
| 名称 | 专题2化学反应速率与化学平衡练习题 高二上学期化学苏教版(2019)选择性必修1(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 18:17:49 | ||
图片预览


文档简介
专题2《化学反应速率与化学平衡》练习题
一、单选题
1.和都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和,对此反应,下列说法中错误的是
A.改变压强不可以改变反应速率
B.使用催化剂能同时增大正、逆反应的速率
C.缩小体积能增大反应速率
D.升高温度能增大吸热方向的反应速率
2.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)。反应达到平衡时,c(H2)=2 mol/L,c(HI)=4 mol/L,则此温度下反应①的平衡常数是
A.36 B.32 C.16 D.24
3.某温度下,在体积为2L的刚性容器中加入1mol环戊烯(
)和2molI2发生可逆反应(g)+I2(g) (g)+2HI(g) △H>0,实验测定容器内压强随时间变化关系如图所示。下列说法错误的是
A.0~2min内,环戊烯的平均反应速率为0.15mol·L-1·min-1
B.环戊烯的平衡转化率为75%
C.有利于提高环戊烯平衡转化率的条件是高温低压
D.该反应平衡常数为5.4mol·L-1
4.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应: A+3B 2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是
①原混合气体的体积为1.2VL②原混合气体的体积为1.1VL③反应达到平衡时气体A消耗掉0.05VL④反应达平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
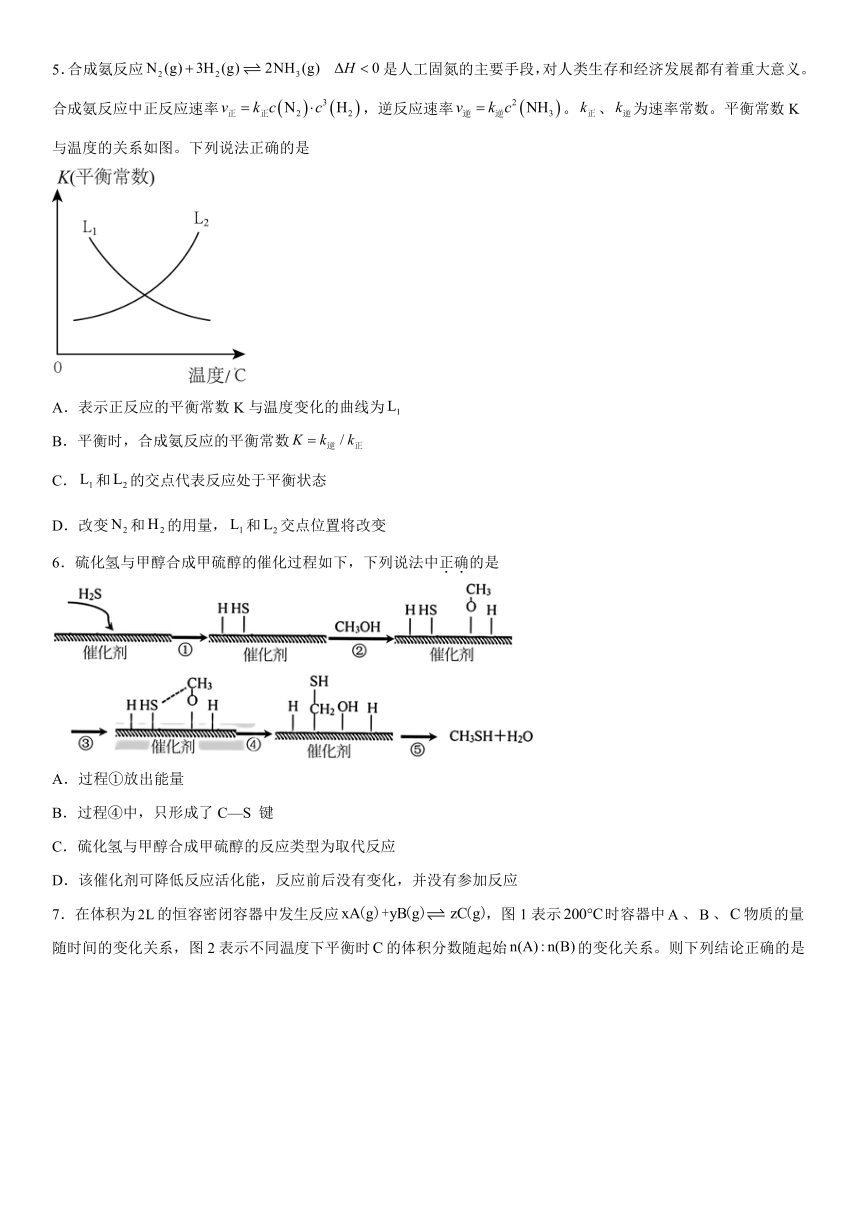
5.合成氨反应是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率,逆反应速率。、为速率常数。平衡常数K与温度的关系如图。下列说法正确的是
A.表示正反应的平衡常数K与温度变化的曲线为
B.平衡时,合成氨反应的平衡常数
C.和的交点代表反应处于平衡状态
D.改变和的用量,和交点位置将改变
6.硫化氢与甲醇合成甲硫醇的催化过程如下,下列说法中正确的是
A.过程①放出能量
B.过程④中,只形成了C—S 键
C.硫化氢与甲醇合成甲硫醇的反应类型为取代反应
D.该催化剂可降低反应活化能,反应前后没有变化,并没有参加反应
7.在体积为的恒容密闭容器中发生反应,图1表示时容器中、、物质的量随时间的变化关系,图2表示不同温度下平衡时的体积分数随起始的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率
B.由图2可知反应,正反应吸热且
C.若在图1所示的平衡状态下再向体系中充入和,此时
D.时,向空容器中充入和,达到平衡时的体积分数小于0.5
8.在容积固定的2 L密闭容器中发生反应:CO(g)+2H2(g)CH3OH(g) △H=a kJ·mol-1,若充入2 mol CO(g)和4 mol H2(g),在不同温度、不同时段下H2的转化率如下表:(已知a1≠a2)
15分钟 30分钟 45分钟 1小时
T1 45% 75% 85% 85%
T2 40% 60% a1 a2
下列说法中错误的是A.T1℃下,45分钟该反应达到平衡状态
B.根据数据判断:T1C.T2℃下,在前30分钟内用CO表示的化学反应速率为1.20 mol/(L·h)
D.该反应的△H>0
9.在一定条件下,反应2A(g)+2B(g)3C(g)+D(g),达到平衡状态的标志是:
A.单位时间内生成2nmolA,同时生成nmolD B.容器内压强不随时间而变化
C.单位时间内生成nmolB,同时消耗1.5nmolC D.容器内混合气体密度不随时间而变化
10.在下列反应CO+H2O CO2+H2中,加入C18O后,则18O存在于
A.只存在于CO和CO2中 B.存在于CO、H2O、CO2中
C.只存在于CO中 D.存在于CO、H2O、CO2、H2中
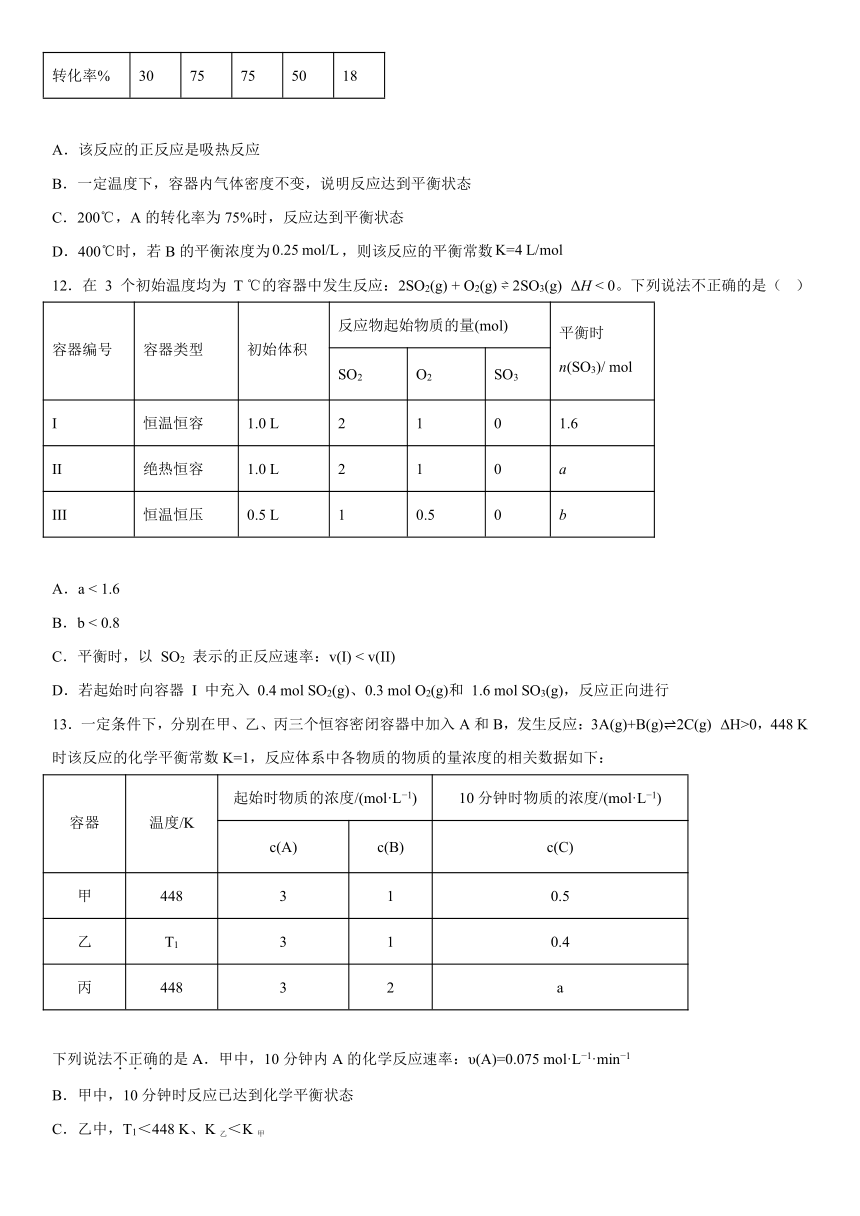
11.在容积不变的密闭容器中加入一定量的A和B,发生反应:,在相同时间内,测得不同温度下A的转化率如下表所示。下列说法正确的是
温度/℃ 100 200 300 400 500
转化率% 30 75 75 50 18
A.该反应的正反应是吸热反应
B.一定温度下,容器内气体密度不变,说明反应达到平衡状态
C.200℃,A的转化率为75%时,反应达到平衡状态
D.400℃时,若B的平衡浓度为,则该反应的平衡常数
12.在 3 个初始温度均为 T ℃的容器中发生反应:2SO2(g) + O2(g) 2SO3(g) ΔH < 0。下列说法不正确的是( )
容器编号 容器类型 初始体积 反应物起始物质的量(mol) 平衡时 n(SO3)/ mol
SO2 O2 SO3
I 恒温恒容 1.0 L 2 1 0 1.6
II 绝热恒容 1.0 L 2 1 0 a
III 恒温恒压 0.5 L 1 0.5 0 b
A.a < 1.6
B.b < 0.8
C.平衡时,以 SO2 表示的正反应速率:v(I) < v(II)
D.若起始时向容器 I 中充入 0.4 mol SO2(g)、0.3 mol O2(g)和 1.6 mol SO3(g),反应正向进行
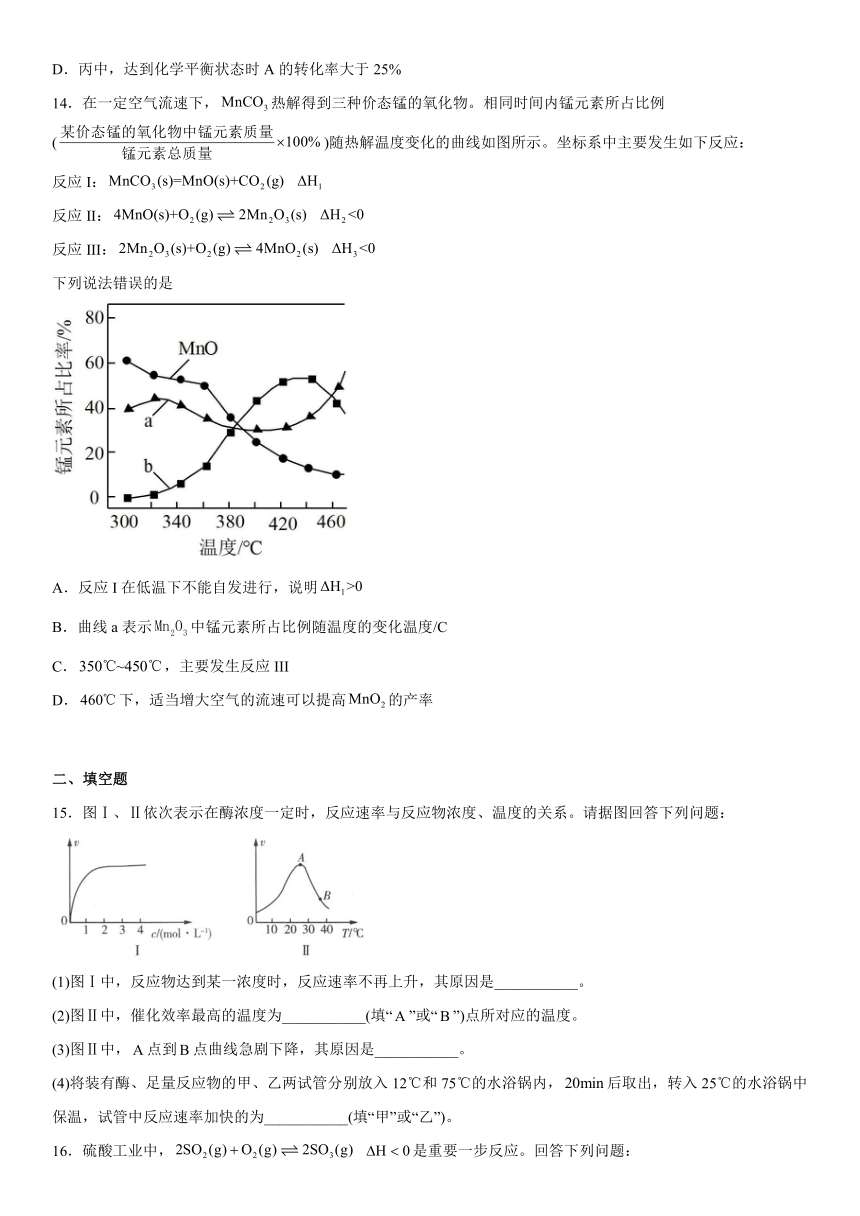
13.一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入A和B,发生反应:3A(g)+B(g) 2C(g) H>0,448 K时该反应的化学平衡常数K=1,反应体系中各物质的物质的量浓度的相关数据如下:
容器 温度/K 起始时物质的浓度/(mol·L 1) 10分钟时物质的浓度/(mol·L 1)
c(A) c(B) c(C)
甲 448 3 1 0.5
乙 T1 3 1 0.4
丙 448 3 2 a
下列说法不正确的是A.甲中,10分钟内A的化学反应速率:υ(A)=0.075 mol·L 1·min 1
B.甲中,10分钟时反应已达到化学平衡状态
C.乙中,T1<448 K、K乙<K甲
D.丙中,达到化学平衡状态时A的转化率大于25%
14.在一定空气流速下,热解得到三种价态锰的氧化物。相同时间内锰元素所占比例()随热解温度变化的曲线如图所示。坐标系中主要发生如下反应:
反应I:
反应II:
反应III:
下列说法错误的是
A.反应I在低温下不能自发进行,说明
B.曲线a表示中锰元素所占比例随温度的变化温度/C
C.,主要发生反应III
D.下,适当增大空气的流速可以提高的产率
二、填空题
15.图Ⅰ、Ⅱ依次表示在酶浓度一定时,反应速率与反应物浓度、温度的关系。请据图回答下列问题:
(1)图Ⅰ中,反应物达到某一浓度时,反应速率不再上升,其原因是___________。
(2)图Ⅱ中,催化效率最高的温度为___________(填“”或“”)点所对应的温度。
(3)图Ⅱ中,点到点曲线急剧下降,其原因是___________。
(4)将装有酶、足量反应物的甲、乙两试管分别放入12℃和75℃的水浴锅内,后取出,转入25℃的水浴锅中保温,试管中反应速率加快的为___________(填“甲”或“乙”)。
16.硫酸工业中, 是重要一步反应。回答下列问题:
(1)某温度下,若的平衡常数,则在同一温度下,反应的平衡常数K=___________。
(2)在恒温下,向恒容密闭容器中加入和发生反应,时反应达到平衡。测得内,平衡后的转化率α1=___________。其他条件不变,反应若在恒压条件下进行,平衡时的转化率α2___________(填“>”“=”或“<”)α1,平衡常数___________(填“增大”“不变”或“减小”,若要使平衡常数减小,可采取的措施是___________。
(3)一定条件下,在恒温恒容的密闭容器中按一定比例充入和,平衡时的体积分数随的变化如图所示。则A、B、C三状态中,的转化率最大的是___________点,当达到平衡状态的体积分数可能是D、E、F三点中的___________点。
17.在一密闭容器中发生反应N2+3H2=2NH3 ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是___________(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻___________;t3时刻___________;t4时刻___________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是___________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线______。
18.已知反应4CO(g)+2NO2(g)=N2(g)+4CO2(g)在不同条件下的化学反应速率如下:
①v(CO)=1.5mol·L-1·min-1
②v(NO2)=0.7mol·L-1·min-1
③v(N2)=0.4mol·L-1·min-1
④v(CO2)=1.1mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
则上述5种情况的反应速率由大到小的顺序为_____(用序号表示)。
19.下列说法中能说明2HI(g) H2(g)+I2(g)已达平衡状态的是_______。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③c(HI)=c(I2)
④反应速率:v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(I2)∶c(H2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
20.硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化: 。回答下列问题:
(1)当、和起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,平衡转化率随温度的变化如图所示。反应在5.0 MPa,550℃时的______,判断的依据是______。影响的因素有______。
(2)将组成(物质的量分数)为、和的气体通入反应器,在温度、压强条件下进行反应。平衡时,若转化率为,则压强为______,平衡常数______(以分压表示,分压=总压×物质的量分数)。
(3)研究表明,催化氧化的反应速率方程为:,式中:为反应速率常数,随温度升高而增大;为平衡转化率,为某时刻转化率,为常数。在时,将一系列温度下的、值代入上述速率方程,得到曲线,如图所示。
曲线上最大值所对应温度称为该下反应的最适宜温度。时,逐渐提高;后,逐渐下降。原因是______。
21.气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及周边反应是新型科研热点。回答下列问题:
(1)恒容密闭容器中,在Ni作催化剂条件下,NH3分解反应如下:2NH3(g) N2(g)+3H2(g),不同温度下,NH3分解率随时间变化如图所示,T1___________T2;v正=k正·c2(NH3),v逆=k逆·c(N2)·c3(H2),NH3的初始浓度为c1,T1时NH3分解反应平衡时___________;曲线①②中,k正 k逆值最大的曲线为___________。
(2)NH2COONH4是尿素生成过程的中间产物,在密闭容器中,发生分解反应NH2COONH4(s) 2NH3(g)+CO2(g)。
T/K 298 303 308 313 318
-lgK 3.638 3.150 2.717 2.294 1.877
表中为不同温度时测得的化学平衡常数K取负对数值,据此推断该分解反应的△H___________0(填“>”或“<”);若298K时,从反应开始至反应达平衡状态时用时tmin,测得平衡时,容器内压强为pMPa,则用分压表示的NH3的生成速率v(NH3)___________。
22.一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的气体物质的量为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是
A.断开3molH-H键的同时断开2molN-H键 B.c(N2) : c(H2): c(NH3) =1:3:2
C.混合气体的平均相对分子质量不变 D.容器内密度不变
(2)N2的转化率α1%=_______,若相同条件下,此反应在容积可变的容器中进行,保持压强不变,达到平衡,则N2的转化率α2%_______α1%(填“>”、“<”或“=”)
(3)该温度下,反应的化学平衡常数K=_______,若此时再加入0.6molN2和0.4mol NH3,则平衡_______(填“向左移动”、“向右移动”或“不移动”)
23.I.在一定温度下的2L密闭容器中,发生反应:,达到平衡时,各物质平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c(Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
(1)若在恒温恒容条件下进行反应,可判断该反应达到化学平衡状态的是_______
A.单位时间内生成nmolX的同时生成2nmolZ
B.密闭容器中密度不再改变的状态
C.用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态
D.反应容器中Y的物质的量分数不再改变的状态
E.密闭容器中压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(2)a、b应满足的关系是_______。
(3)a的取值范围是_______。
Ⅱ.恒温、恒压下,在一个可变容积的容器中发生发应:。
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,若开始时放入xmolA,2molB和1molC,到达平衡后,C的物质的量是3amol,则x=_______mol,平衡时,B的物质的量_______(填序号)
①大于2mol ②等于2 mol ③小于2 mol ④可能大于、等于或小于2mol
(2)若开始时放入6molA和6molB,到达平衡后再加入3molC,待再次到达平衡后,C的物质的量分数是_______。
24.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______mol·L-1·min-1(用含t1的代数式表示);
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________(用图中a、b、c、d表示),理由是___________
(3)在该温度下,反应的标准平衡常数Kθ=____。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g) Kθ=,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
参考答案:
1.A
【详解】A. 改变压强,如果改变容器的容积,能改变物质的浓度,则可以改变反应速率,A错误;
B. 使用催化剂可同时增大正、逆反应的速率,B正确;
C. 缩小体积相当于增大压强,能增大反应速率,C正确;
D. 升高温度,吸热方向、放热方向的反应速率均增大,只是吸热方向的速率增大的程度更大,D正确;
故选A。
2.B
【详解】反应达到平衡时,c(H2)=2mol·L-1,说明消耗HI浓度为4mol·L-1,则生成HI总物质的量浓度为(4+4)mol·L-1=8mol·L-1,即c(NH3)=8mol/l,根据化学平衡常数的定义,①的反应平衡常数K=c(NH3)×c(HI)=8×4=32,故选项B正确。
3.D
【详解】A.根据图中信息可知,容器内起始总压为,2min时总压为,平衡时总压为,恒温恒容,压强之比等于物质的量之比(),即,,列“三段式”如下:
列方程:,则,,A项正确;
B.平衡时,,,列“三段式”如下:
,则,环戊烯的平衡转化率为,B项正确;
C.该反应为吸热反应,且生成物中气体的系数之和大于反应物中气体系数之和,升高温度,减小压强有利于提高环戊烯平衡转化率,C项正确;
D.该反应平衡常数,D项错误;
故选D。
4.A
【详解】设起始A和B的体积分别为a、b
a-0.05V+b-0.15V+10%V=V,a+b=1.1V。原混合气体的体积为1.1VL,反应到平衡消耗气体A体积为0.05VL,消耗B的体积为0.15VL,故选A。
5.A
【详解】A.工业合成氨为放热反应,升温平衡逆向移动,K减小,即表示正反应的平衡常数K与温度变化的曲线为,A项正确;
B.合成氨反应的平衡常数,平衡时,因此,B项错误;
C.和的交点代表反应的正逆反应的平衡常数相等,并不代表此时为平衡状态,C项错误;
D.K只随温度改变而改变,不受反应物量的影响,因此两曲线交点位置不变,D项错误;
本题答案为A。
6.C
【详解】A.根据图示,过程①S-H断裂,断开化学键吸收能量,故A错误;
B.根据图示,过程④中-SH与-CH3结合,氢原子与氧原子结合,形成了O-H键和C-S键,故B错误;
C.由图示可知,硫化氢与甲醇合成甲硫醇的反应过程中,-SH取代了甲醇中的-OH,反应类型为取代反应,故C正确;
D.催化剂可降低反应活化能,加快反应速率,但反应前后没有变化,在中间过程参加了反应,故D错误;
故答案选:C。
7.D
【分析】图甲可知,时平衡时,A的物质的量变化量为,B的物质的量变化量为0.4 mol -0.2 mol =,C的物质的量变化量为0.2mol,各物质变化的物质的量之比等于化学计量数之比,所以反应方程式为:2A(g)+B(g)C(g)。可计算平衡常数K==25。
【详解】A.由图甲可知,时5min达到平衡,平衡时B的物质的量变化量为,故 ,选项A错误;
B.在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比:,即a=2。由图乙可知,:一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即,选项B错误;
C.恒温恒容条件下,再向体系中充入0.2 mol B和0.2 mol C,由于B和C的化学计量数相等,所以Qc=K,平衡不移动,故,选项C错误;
D.由图Ⅰ可知,时平衡时,A、B、C的物质的量变化量分别为、、,物质的量之比等于化学计量数之比,故x:y::::1:1,平衡时A 的体积分数为,时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时,A 的体积分数小于,选项D正确。
答案选D。
8.B
【分析】根据平衡的定义,当物质的浓度保持不变时达到的状态即为平衡状态进行判断平衡点,根据转换率可表示单位时间内转换的快慢可以判断反应速率。根据速率公式进行计算速率。
【详解】A.T1℃下,45分钟到1小时氢气的转化率不变,故可判断达到平衡,故A正确;B.根据a1≠a2判断T2时达到平衡的时间在45分钟后,T2比T1的反应慢,故温度低,B不正确;
C.T2℃下,在前30分钟内氢气的转化率为60%,则转换了的氢气的物质的量为:4 mol ×60%=2.4mol,则转换的一氧化碳根据方程式计算得:1.2mol,根据速率公式得:,故C正确;
D.根据温度T2到T1的转化率降低,说明平衡相对向逆移,而温度降低,故逆反应为放热,正反应时吸热反应,故D正确;
故选答案B。
【点睛】注意反应是吸热还是放热,根据温度对平衡的影响进行判断,升高温度平衡向吸热方向移动。
9.A
【详解】A.单位时间内生成2nmolA,同时生成nmolD,反应进行的方向相反,且物质的量的变化量之比等于化学计量数之比,达到了化学平衡状态,A符合题意;
B.因为反应前后气体的分子数相等,压强始终保持不变,所以当容器内压强不随时间而变化时,不能确定反应达平衡状态,B不符合题意;
C.单位时间内生成nmolB,同时消耗1.5nmolC,反应进行的方向相同,不一定达平衡状态,C不符合题意;
D.容器内混合气体的质量、容器的体积始终不变,密度始终不变,所以当密度不随时间而变化,反应不一定达平衡状态,D不符合题意;
故选A。
10.B
【详解】由于反应CO+H2O CO2+H2为可逆反应,正反应、逆反应同时进行,则含有O元素的物质中均含有18O,故选B。
11.D
【详解】A.温度升高,化学反应速率加快,在相同时间内,反应物的转化率应增大,但由表中数据可知,从300℃升至400℃、500℃时,A的转化率反而降低,说明温度升高,该平衡向逆反应方向移动,该反应的正反应为放热反应,A项错误;
B.在容积不变的容器下,气体体积不变,反应物总质量与生成物总质量相等,故不论反应是否达到平衡状态,容器内气体密度均不变,B项错误;
C.该反应的正反应是放热反应,若200℃已达到平衡状态,则A的转化率大于300℃时A的转化率,但表中数据显示这两个温度时A的转化率相等,说明200℃时,反应没有达到平衡状态,C项错误;
D.400℃时,反应达到平衡,A的平衡转化率为50%,根据反应可知,平衡时,B的平衡浓度为,则该反应的平衡常数,D项正确;
答案选D。
12.B
【详解】A.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则平衡向逆反应方向移动,三氧化硫的物质的量减小,则a <1.6,故A正确;
B.该反应为气体体积减小的反应,恒温恒压与恒温恒容相比,相当于增大压强,则平衡向正反应方向移动,三氧化硫的物质的量增大,则b>0.8,故B错误;
C.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则化学反应速率增大,则平衡时,以SO2表示的正反应速率:v(I) < v(II),故C正确;
D.若起始时向容器I中充入0.4 mol SO2(g)、0.3 molO2(g)和1.6 molSO3(g),等效为起始时向容器 I 中充入SO2(g)为(0.4 +1.6)mol=2.0mol 、O2(g) 为(0.3+0.8) mol=1.1mol,与I相比,相当于增大氧气的浓度,增大反应物浓度,平衡向正反应方向移动,故D正确;
故选B。
13.B
【详解】A.甲中,10分钟时C的物质的浓度为0.5mol·L 1,则A的浓度减小0.75mol·L 1,10分钟内A的化学反应速率:υ(A)= 0.75mol·L 1÷10min=0.075 mol·L 1·min 1,故A正确;
B.甲中,10分钟时C的物质的浓度为0.5mol·L 1,则A的浓度减小0.75mol·L 1,B的浓度减小0.25mol·L 1,10分钟时,c(A)= 2.25mol·L 1、c(A)= 0.75mol·L 1,Q=,反应没有达到化学平衡状态,故B错误;
C.3A(g)+B(g) 2C(g)正反应吸热,升高温度,反应速率加快、平衡常数增大,若T1>448 K,10分钟时C物质的浓度应该大于0.5 mol·L 1,所以乙中,T1<448 K、K乙<K甲,故C正确;
D.甲中,10分钟时C的物质的浓度为0.5mol·L 1,则A的浓度减小0.75mol·L 1,B的浓度减小0.25mol·L 1,10分钟时,c(A)= 2.25mol·L 1、c(A)= 0.75mol·L 1,Q=,达到化学平衡状态时,A的浓度减小大于0.75mol·L 1,则甲中A的转化率大于25%,丙与甲相比,增大B的浓度,A的平衡转化率大于甲,所以丙中,达到化学平衡状态时A的转化率大于25%,故D正确;
选B。
14.D
【详解】A.由反应I可知该反应ΔS>0,根据吉布斯自由能公式ΔG=ΔH-TΔS,故该I在低温下不能自发进行,则,A正确;
B.温度越高,反应越快,根据反应个反应,可以发现二氧化锰是反应III的产物,故温度升高时,相同时间内,二氧化锰会越来越多,即b代表二氧化锰,a代表,B正确;
C.由图可知时,二氧化锰一直增大,故此时发生的主要反应为反应III,C正确;
D.由图可知450℃时二氧化锰的含量较大,此时适当增大空气的流速可以提高的产率,但是温度较低时,二氧化锰含量较低,增大空气的流速不利于提高的产率,D错误;
故选D。
15. 酶的浓度一定 A 温度过高,酶的活性下降 甲
【详解】(1)由图Ⅰ分析,反应物浓度增大到一定限度,反应速率不再上升,说明决定化学反应速率的主要因素是酶的浓度,故答案为:酶的浓度一定;
(2)由图Ⅱ分析,点的反应速率最快,催化效率最高,故答案为:A;
(3)点到点曲线急剧下降是由于温度升高,酶的活性急速下降,故答案为:温度过高,酶的活性下降;
(4)由图Ⅱ可知,0~25℃范围内,温度越高,反应速率越快,所以甲试管转入25℃的水浴中加热时反应速率加快;乙试管在75℃的水浴中加热时,酶已经失活,故乙中无催化反应发生,故答案为:甲。
16.(1)
(2) 75% > 不变 升高温度
(3) A D
【分析】的平衡常数K=,的平衡常数K=,据此分析解答;根据v==,结合化学平衡的影响因素分析解答;若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,结合图象分析解答。
【详解】(1)某温度下,若的平衡常数,即K==100;则在同一温度下,反应的平衡常数K===,故答案为:;
(2)测得10min内,则△n()=7.5×10-3mol L-1 min-1×10min×2L=0.15mol,由方程式可知,反应的的物质的量为0.15mol,则的转化率为×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,转化率增大,即转化率α2>α1;
平衡常数只受温度影响,温度不变,平衡常数不变;正反应是放热反应,若要使平衡常数减小,可以升高温度,平衡逆向移动,平衡常数减小,故答案为:75%;>;不变;升高温度;
(3)若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,的转化率越大,因此的转化率最大的是A点;根据图象,的比值越大,平衡时的体积分数越大,当达到平衡状态的体积分数应该大于C,可能是D、E、F三点中的D点,故答案为:A;D。
17. ACDF C E B A
【详解】(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。
(2)t1时,v正、v逆同时增大,且v逆增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线为 。
18.③①②⑤④
【详解】将②③④⑤均转化为用表示的化学反应速率,则
②;
③;
④;
⑤;
故反应速率由大到小的顺序为。
19.②⑥⑨
【分析】当可逆反应达到平衡状态时,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,据此解答。
【详解】①单位时间内生成nmol H2的同时生成nmol HI,速率之比不等于物质的量之比,故错误;
②一个H-H键断裂的同时有两个H-I键断裂,由于一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,反应达到平衡状态,故正确;
③未知起始投入量,c(HI)=c()不能说明反应达平衡状态,故错误;
④反应速率v(H2)=v(I2)=v(HI),未体现正与逆的关系,故错误;
⑤c(HI):c(H2):c(I2)=2:1:1,浓度比与化学计量数比相等并不能证明反应达平衡,故错误;
⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故正确;
⑦前后气体系数和相同,容器压强始终不变,故错误;
⑧反应前后气体总质量不变,总物质的量也不变,相对分子质量一直不变,故错误;
⑨温度和体积一定时,混合气体颜色不再变化,说明c(I2)不再发生变化,反应达到平衡状态,正确;
⑩温度和压强一定时,由于反应前后体积和气体的质量始终不变,则混合气体的密度始终不变,即密度不再变化不能说明反应达到平衡状态,错误;
故答案为:②⑥⑨。
20. 0.975 该反应气体分子数减少,增大压强,提高 ,所以 温度、压强和反应物的起始浓度(组成) 升高温度,增大使逐渐提高,但降低使逐渐下降。时,增大对的提高大于引起的降低;后,增大对的提高小于引起的降低。
【详解】(1)由题给反应式知,该反应为气体分子数减少的反应,其他条件一定时,增大压强,平衡转化率增大,故,结合题图(b)知5.0 MPa、550℃时对应的平衡转化率为0.975。影响平衡转化率的因素有:温度、压强、反应物的起始浓度等。
(2)设通入的、和共100 mol,利用三段式法进行计算:
平衡时气体的总物质的量为,则,,,因,,代入计算得。
(3)升高温度,反应速率常数增大,反应速率,提高但降低使反应速率逐渐下降。时,增大对的提高大于引起的降低后,增大对的提高小于引起的降低。
21.(1) > 0.12(c1)2 ①
(2) > MPa/min
【详解】(1)图象是NH3分解率和时间的关系,先达到平衡,说明温度高,即T1>T2,当反应达到平衡,v正=v逆,v正=k正·c2(NH3)= v逆=k逆·c(N2)·c3(H2),推出=K,达到平衡时,NH3的分解率为40%,此时消耗c(NH3)=0.4c1mol·L-1,c(N2)=0.2c1moL·L-1,达到平衡时,c(NH3)=0.6c1mol·L-1,c(N2)=0.2c1mol·L-1,c(H2)=0.6c1mol·L-1,K==0.12(c1)2,即0.12(c1)2,k正-k逆最大,说明反应向正反应方向进行程度增大,根据图象,温度升高NH3的分解率增大,即温度越高,向正反应方向进行程度越大,k正-k逆最大的曲线为①;故答案为>;0.12(c1)2;①;
(2)根据表中数据温度越高,K越大,说明该分解反应为吸热反应,即△H>0;反应速率是单位时间内物质的变化量,尿素为固体,氨气和二氧化碳的物质的量之比为2∶1,即氨气的物质的量分数为,用分压表示的氨气的生成速率为MPa·min-1=MPa/min;故答案为>;MPa/min。
22.(1)C
(2) 50%, >
(3) L2/mol2 不移动
【分析】题中发生反应N2+3H22NH3,根据题中信息进行分析。
(1)
A.断开3molH-H键应断开6molN-H键,A错误;
B.各物质的浓度成比例关系,不能说明达到平衡状态,B错误;
C.平均相对分子质量可表示为,体系中质量守恒m恒定,当不变时,不变,反应前后气体系数发生变化,故不变说明达到平衡状态,C正确;
D.密度,m恒定,V恒定,故密度为定值,故密度不变不能说明达到平衡状态,D错误;
故选C。
(2)
由题得:0.4-x+1.2-3x+2x=1.6×=1.2 x=0.2mol
N2的转化率;
反应正向进行,压强减小,要求压强不变相当于加压,平衡正移,N2的转化率增大,故α2%>α1%。
(3)
,将(2)中数值转化成物质的量浓度,代入可得K=L2/mol2;再加入0.6molN2和0.4mol NH3,则N2为0.8mol,H2为0.6mol,NH3为0.8mol,转化成浓度,代入平衡常数公式,可得K’=L2/mol2,故平衡不移动。
23. AD 2 ④
【详解】I.(1)A.单位时间内生成nmolX,指的是逆反应速率,生成2nmolZ,指正反应速率,且1∶2的变化量能够说明正反应速率等于逆反应速率,故可作为反应达平衡的标志;
B.根据,气体的总质量不变,容器体积不变,故密度为定值,故密度不变不可作为反应达平衡的标志;
C.无论反应平衡还是没有平衡,速率比都等于系数比,故用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态不一定是平衡状态;
D.当反应达到平衡状态时,各组分的物质的量均不发生改变,总物质的量也不再变化,即各组分的物质的量分数不再变化,故反应容器中的物质的量分数不再改变的状态是化学平衡状态;
E.由方程式可知,该反应是一个等体积变化,压强始终不改变,故压强不再改变的状态不一定是化学平衡状态;
F.根据可知,m不变,n也不变,则混合气体的平均相对分子质量始终不变,故不可作为反应达平衡的标志;
故选AD;
(2)由方程式可知,反应物X、Y变化量为1:1,设变化量为x,则有:,推出:mol,故答案为:;
(3)利用极限确定a的取值范围:若从正反应开始到达平衡,则a值最大,所以:,即,故;若从逆反应开始到达平衡,则a值最小,所以:,即,故;故答案为:;
Ⅱ.(1)恒温、恒压下到达平衡后,C的物质的量为3amol,说明和(2)所达到的平衡是相同的平衡,满足A.B起始量分为3mol、3mol,依据三段式列式判断;假设反应正向进行依据等效平衡:,x=2,B的物质的量=3- 3a,当3a>1,,B的物质的量小于2;当3a=1,B的物质的量等于2;当3a<1,B的物质的量大于2;故选④,所以答案为:2,④;
(2)若开始时放入6molA和6molB,到达平衡后再加入3molC,根据等效平衡的原理此时和(1)中的开始时放入1molA和1molB是等效平衡,待再次到达平衡后,达到的平衡与(1)是相同的,所以C的物质的量分数可以根据(1)计算得到即C的物质的量分数,故答案为:;
24.(1)
(2) b 容器容积迅速缩小至原来的一半时,N2分压变为原来的2倍;其他条件不变时,容器容积减小,压强增大,平衡向气体体积减小的方向移动,即该平衡逆向移动,所以N2分压先变为原来的2倍,后逐渐减小
(3)0.48
【详解】(1)密闭容器中0.1mol NH3总压为200kPa,则如图t1时H2的分压为120kPa,则H2的物质的量n(H2)=,则用H2的浓度变化表示的反应速率v(H2)=;
(2)t2时刻容器体积迅速缩小到原来的一半,则N2的分压迅速增大到原来的2倍,则cd错误;压强增大,化学平衡向气体总体积减小的方向移动,即化学平衡逆向移动,导致N2的分压应比原来2倍小,则b正确,a错误,故合理选项是b;
(3)在该温度下,达到平衡时,p(N2)=40kPa=0.4pθ、p(H2)=120kPa=1.2pθ、p(NH3)=120kPa=1.2pθ,则Kθ=。
一、单选题
1.和都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和,对此反应,下列说法中错误的是
A.改变压强不可以改变反应速率
B.使用催化剂能同时增大正、逆反应的速率
C.缩小体积能增大反应速率
D.升高温度能增大吸热方向的反应速率
2.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)。反应达到平衡时,c(H2)=2 mol/L,c(HI)=4 mol/L,则此温度下反应①的平衡常数是
A.36 B.32 C.16 D.24
3.某温度下,在体积为2L的刚性容器中加入1mol环戊烯(
)和2molI2发生可逆反应(g)+I2(g) (g)+2HI(g) △H>0,实验测定容器内压强随时间变化关系如图所示。下列说法错误的是
A.0~2min内,环戊烯的平均反应速率为0.15mol·L-1·min-1
B.环戊烯的平衡转化率为75%
C.有利于提高环戊烯平衡转化率的条件是高温低压
D.该反应平衡常数为5.4mol·L-1
4.某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应: A+3B 2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是
①原混合气体的体积为1.2VL②原混合气体的体积为1.1VL③反应达到平衡时气体A消耗掉0.05VL④反应达平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
5.合成氨反应是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率,逆反应速率。、为速率常数。平衡常数K与温度的关系如图。下列说法正确的是
A.表示正反应的平衡常数K与温度变化的曲线为
B.平衡时,合成氨反应的平衡常数
C.和的交点代表反应处于平衡状态
D.改变和的用量,和交点位置将改变
6.硫化氢与甲醇合成甲硫醇的催化过程如下,下列说法中正确的是
A.过程①放出能量
B.过程④中,只形成了C—S 键
C.硫化氢与甲醇合成甲硫醇的反应类型为取代反应
D.该催化剂可降低反应活化能,反应前后没有变化,并没有参加反应
7.在体积为的恒容密闭容器中发生反应,图1表示时容器中、、物质的量随时间的变化关系,图2表示不同温度下平衡时的体积分数随起始的变化关系。则下列结论正确的是
A.200℃时,反应从开始到平衡的平均速率
B.由图2可知反应,正反应吸热且
C.若在图1所示的平衡状态下再向体系中充入和,此时
D.时,向空容器中充入和,达到平衡时的体积分数小于0.5
8.在容积固定的2 L密闭容器中发生反应:CO(g)+2H2(g)CH3OH(g) △H=a kJ·mol-1,若充入2 mol CO(g)和4 mol H2(g),在不同温度、不同时段下H2的转化率如下表:(已知a1≠a2)
15分钟 30分钟 45分钟 1小时
T1 45% 75% 85% 85%
T2 40% 60% a1 a2
下列说法中错误的是A.T1℃下,45分钟该反应达到平衡状态
B.根据数据判断:T1
D.该反应的△H>0
9.在一定条件下,反应2A(g)+2B(g)3C(g)+D(g),达到平衡状态的标志是:
A.单位时间内生成2nmolA,同时生成nmolD B.容器内压强不随时间而变化
C.单位时间内生成nmolB,同时消耗1.5nmolC D.容器内混合气体密度不随时间而变化
10.在下列反应CO+H2O CO2+H2中,加入C18O后,则18O存在于
A.只存在于CO和CO2中 B.存在于CO、H2O、CO2中
C.只存在于CO中 D.存在于CO、H2O、CO2、H2中
11.在容积不变的密闭容器中加入一定量的A和B,发生反应:,在相同时间内,测得不同温度下A的转化率如下表所示。下列说法正确的是
温度/℃ 100 200 300 400 500
转化率% 30 75 75 50 18
A.该反应的正反应是吸热反应
B.一定温度下,容器内气体密度不变,说明反应达到平衡状态
C.200℃,A的转化率为75%时,反应达到平衡状态
D.400℃时,若B的平衡浓度为,则该反应的平衡常数
12.在 3 个初始温度均为 T ℃的容器中发生反应:2SO2(g) + O2(g) 2SO3(g) ΔH < 0。下列说法不正确的是( )
容器编号 容器类型 初始体积 反应物起始物质的量(mol) 平衡时 n(SO3)/ mol
SO2 O2 SO3
I 恒温恒容 1.0 L 2 1 0 1.6
II 绝热恒容 1.0 L 2 1 0 a
III 恒温恒压 0.5 L 1 0.5 0 b
A.a < 1.6
B.b < 0.8
C.平衡时,以 SO2 表示的正反应速率:v(I) < v(II)
D.若起始时向容器 I 中充入 0.4 mol SO2(g)、0.3 mol O2(g)和 1.6 mol SO3(g),反应正向进行
13.一定条件下,分别在甲、乙、丙三个恒容密闭容器中加入A和B,发生反应:3A(g)+B(g) 2C(g) H>0,448 K时该反应的化学平衡常数K=1,反应体系中各物质的物质的量浓度的相关数据如下:
容器 温度/K 起始时物质的浓度/(mol·L 1) 10分钟时物质的浓度/(mol·L 1)
c(A) c(B) c(C)
甲 448 3 1 0.5
乙 T1 3 1 0.4
丙 448 3 2 a
下列说法不正确的是A.甲中,10分钟内A的化学反应速率:υ(A)=0.075 mol·L 1·min 1
B.甲中,10分钟时反应已达到化学平衡状态
C.乙中,T1<448 K、K乙<K甲
D.丙中,达到化学平衡状态时A的转化率大于25%
14.在一定空气流速下,热解得到三种价态锰的氧化物。相同时间内锰元素所占比例()随热解温度变化的曲线如图所示。坐标系中主要发生如下反应:
反应I:
反应II:
反应III:
下列说法错误的是
A.反应I在低温下不能自发进行,说明
B.曲线a表示中锰元素所占比例随温度的变化温度/C
C.,主要发生反应III
D.下,适当增大空气的流速可以提高的产率
二、填空题
15.图Ⅰ、Ⅱ依次表示在酶浓度一定时,反应速率与反应物浓度、温度的关系。请据图回答下列问题:
(1)图Ⅰ中,反应物达到某一浓度时,反应速率不再上升,其原因是___________。
(2)图Ⅱ中,催化效率最高的温度为___________(填“”或“”)点所对应的温度。
(3)图Ⅱ中,点到点曲线急剧下降,其原因是___________。
(4)将装有酶、足量反应物的甲、乙两试管分别放入12℃和75℃的水浴锅内,后取出,转入25℃的水浴锅中保温,试管中反应速率加快的为___________(填“甲”或“乙”)。
16.硫酸工业中, 是重要一步反应。回答下列问题:
(1)某温度下,若的平衡常数,则在同一温度下,反应的平衡常数K=___________。
(2)在恒温下,向恒容密闭容器中加入和发生反应,时反应达到平衡。测得内,平衡后的转化率α1=___________。其他条件不变,反应若在恒压条件下进行,平衡时的转化率α2___________(填“>”“=”或“<”)α1,平衡常数___________(填“增大”“不变”或“减小”,若要使平衡常数减小,可采取的措施是___________。
(3)一定条件下,在恒温恒容的密闭容器中按一定比例充入和,平衡时的体积分数随的变化如图所示。则A、B、C三状态中,的转化率最大的是___________点,当达到平衡状态的体积分数可能是D、E、F三点中的___________点。
17.在一密闭容器中发生反应N2+3H2=2NH3 ΔH<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。
回答下列问题:
(1)处于平衡状态的时间段是___________(填字母,下同)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2)判断t1、t3、t4时刻分别改变的一个条件。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻___________;t3时刻___________;t4时刻___________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是___________。
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线______。
18.已知反应4CO(g)+2NO2(g)=N2(g)+4CO2(g)在不同条件下的化学反应速率如下:
①v(CO)=1.5mol·L-1·min-1
②v(NO2)=0.7mol·L-1·min-1
③v(N2)=0.4mol·L-1·min-1
④v(CO2)=1.1mol·L-1·min-1
⑤v(NO2)=0.01 mol·L-1·s-1
则上述5种情况的反应速率由大到小的顺序为_____(用序号表示)。
19.下列说法中能说明2HI(g) H2(g)+I2(g)已达平衡状态的是_______。
①单位时间内生成n mol H2的同时生成n mol HI
②一个H-H键断裂的同时有两个H-I键断裂
③c(HI)=c(I2)
④反应速率:v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(I2)∶c(H2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
20.硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化: 。回答下列问题:
(1)当、和起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,平衡转化率随温度的变化如图所示。反应在5.0 MPa,550℃时的______,判断的依据是______。影响的因素有______。
(2)将组成(物质的量分数)为、和的气体通入反应器,在温度、压强条件下进行反应。平衡时,若转化率为,则压强为______,平衡常数______(以分压表示,分压=总压×物质的量分数)。
(3)研究表明,催化氧化的反应速率方程为:,式中:为反应速率常数,随温度升高而增大;为平衡转化率,为某时刻转化率,为常数。在时,将一系列温度下的、值代入上述速率方程,得到曲线,如图所示。
曲线上最大值所对应温度称为该下反应的最适宜温度。时,逐渐提高;后,逐渐下降。原因是______。
21.气态含氮化合物是把双刃剑,既是固氮的主要途径,也是大气污染物。气态含氮化合物及周边反应是新型科研热点。回答下列问题:
(1)恒容密闭容器中,在Ni作催化剂条件下,NH3分解反应如下:2NH3(g) N2(g)+3H2(g),不同温度下,NH3分解率随时间变化如图所示,T1___________T2;v正=k正·c2(NH3),v逆=k逆·c(N2)·c3(H2),NH3的初始浓度为c1,T1时NH3分解反应平衡时___________;曲线①②中,k正 k逆值最大的曲线为___________。
(2)NH2COONH4是尿素生成过程的中间产物,在密闭容器中,发生分解反应NH2COONH4(s) 2NH3(g)+CO2(g)。
T/K 298 303 308 313 318
-lgK 3.638 3.150 2.717 2.294 1.877
表中为不同温度时测得的化学平衡常数K取负对数值,据此推断该分解反应的△H___________0(填“>”或“<”);若298K时,从反应开始至反应达平衡状态时用时tmin,测得平衡时,容器内压强为pMPa,则用分压表示的NH3的生成速率v(NH3)___________。
22.一定条件下,在容积为0.1L的密闭容器中,通入0.4molN2和1.2molH2,进行反应,2s后达到平衡,此时容器内的气体物质的量为起始时的3/4,试回答:
(1)能判断该反应达到平衡状态的依据是
A.断开3molH-H键的同时断开2molN-H键 B.c(N2) : c(H2): c(NH3) =1:3:2
C.混合气体的平均相对分子质量不变 D.容器内密度不变
(2)N2的转化率α1%=_______,若相同条件下,此反应在容积可变的容器中进行,保持压强不变,达到平衡,则N2的转化率α2%_______α1%(填“>”、“<”或“=”)
(3)该温度下,反应的化学平衡常数K=_______,若此时再加入0.6molN2和0.4mol NH3,则平衡_______(填“向左移动”、“向右移动”或“不移动”)
23.I.在一定温度下的2L密闭容器中,发生反应:,达到平衡时,各物质平衡浓度为:c(X)=0.8mol/L;c(Y)=0.1mol/L;c(Z)=1.6mol/L。若用a、b、c分别表示X、Y、Z的起始的物质的量,回答下列问题:
(1)若在恒温恒容条件下进行反应,可判断该反应达到化学平衡状态的是_______
A.单位时间内生成nmolX的同时生成2nmolZ
B.密闭容器中密度不再改变的状态
C.用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态
D.反应容器中Y的物质的量分数不再改变的状态
E.密闭容器中压强不再改变的状态
F.混合气体的平均相对分子质量不再改变的状态
(2)a、b应满足的关系是_______。
(3)a的取值范围是_______。
Ⅱ.恒温、恒压下,在一个可变容积的容器中发生发应:。
(1)若开始时放入1molA和1molB,到达平衡后,生成amolC,若开始时放入xmolA,2molB和1molC,到达平衡后,C的物质的量是3amol,则x=_______mol,平衡时,B的物质的量_______(填序号)
①大于2mol ②等于2 mol ③小于2 mol ④可能大于、等于或小于2mol
(2)若开始时放入6molA和6molB,到达平衡后再加入3molC,待再次到达平衡后,C的物质的量分数是_______。
24.氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol NH3通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
(1)若保持容器容积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______mol·L-1·min-1(用含t1的代数式表示);
(2)t2时将容器容积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是___________(用图中a、b、c、d表示),理由是___________
(3)在该温度下,反应的标准平衡常数Kθ=____。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g) gG(g)+hH(g) Kθ=,其中pθ=100kPa,pG、pH、pD、pE为各组分的平衡分压]。
参考答案:
1.A
【详解】A. 改变压强,如果改变容器的容积,能改变物质的浓度,则可以改变反应速率,A错误;
B. 使用催化剂可同时增大正、逆反应的速率,B正确;
C. 缩小体积相当于增大压强,能增大反应速率,C正确;
D. 升高温度,吸热方向、放热方向的反应速率均增大,只是吸热方向的速率增大的程度更大,D正确;
故选A。
2.B
【详解】反应达到平衡时,c(H2)=2mol·L-1,说明消耗HI浓度为4mol·L-1,则生成HI总物质的量浓度为(4+4)mol·L-1=8mol·L-1,即c(NH3)=8mol/l,根据化学平衡常数的定义,①的反应平衡常数K=c(NH3)×c(HI)=8×4=32,故选项B正确。
3.D
【详解】A.根据图中信息可知,容器内起始总压为,2min时总压为,平衡时总压为,恒温恒容,压强之比等于物质的量之比(),即,,列“三段式”如下:
列方程:,则,,A项正确;
B.平衡时,,,列“三段式”如下:
,则,环戊烯的平衡转化率为,B项正确;
C.该反应为吸热反应,且生成物中气体的系数之和大于反应物中气体系数之和,升高温度,减小压强有利于提高环戊烯平衡转化率,C项正确;
D.该反应平衡常数,D项错误;
故选D。
4.A
【详解】设起始A和B的体积分别为a、b
a-0.05V+b-0.15V+10%V=V,a+b=1.1V。原混合气体的体积为1.1VL,反应到平衡消耗气体A体积为0.05VL,消耗B的体积为0.15VL,故选A。
5.A
【详解】A.工业合成氨为放热反应,升温平衡逆向移动,K减小,即表示正反应的平衡常数K与温度变化的曲线为,A项正确;
B.合成氨反应的平衡常数,平衡时,因此,B项错误;
C.和的交点代表反应的正逆反应的平衡常数相等,并不代表此时为平衡状态,C项错误;
D.K只随温度改变而改变,不受反应物量的影响,因此两曲线交点位置不变,D项错误;
本题答案为A。
6.C
【详解】A.根据图示,过程①S-H断裂,断开化学键吸收能量,故A错误;
B.根据图示,过程④中-SH与-CH3结合,氢原子与氧原子结合,形成了O-H键和C-S键,故B错误;
C.由图示可知,硫化氢与甲醇合成甲硫醇的反应过程中,-SH取代了甲醇中的-OH,反应类型为取代反应,故C正确;
D.催化剂可降低反应活化能,加快反应速率,但反应前后没有变化,在中间过程参加了反应,故D错误;
故答案选:C。
7.D
【分析】图甲可知,时平衡时,A的物质的量变化量为,B的物质的量变化量为0.4 mol -0.2 mol =,C的物质的量变化量为0.2mol,各物质变化的物质的量之比等于化学计量数之比,所以反应方程式为:2A(g)+B(g)C(g)。可计算平衡常数K==25。
【详解】A.由图甲可知,时5min达到平衡,平衡时B的物质的量变化量为,故 ,选项A错误;
B.在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比:,即a=2。由图乙可知,:一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应方向移动,故正反应为吸热反应,即,选项B错误;
C.恒温恒容条件下,再向体系中充入0.2 mol B和0.2 mol C,由于B和C的化学计量数相等,所以Qc=K,平衡不移动,故,选项C错误;
D.由图Ⅰ可知,时平衡时,A、B、C的物质的量变化量分别为、、,物质的量之比等于化学计量数之比,故x:y::::1:1,平衡时A 的体积分数为,时,向容器中充入2 mol A 和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,故达到平衡时,A 的体积分数小于,选项D正确。
答案选D。
8.B
【分析】根据平衡的定义,当物质的浓度保持不变时达到的状态即为平衡状态进行判断平衡点,根据转换率可表示单位时间内转换的快慢可以判断反应速率。根据速率公式进行计算速率。
【详解】A.T1℃下,45分钟到1小时氢气的转化率不变,故可判断达到平衡,故A正确;B.根据a1≠a2判断T2时达到平衡的时间在45分钟后,T2比T1的反应慢,故温度低,B不正确;
C.T2℃下,在前30分钟内氢气的转化率为60%,则转换了的氢气的物质的量为:4 mol ×60%=2.4mol,则转换的一氧化碳根据方程式计算得:1.2mol,根据速率公式得:,故C正确;
D.根据温度T2到T1的转化率降低,说明平衡相对向逆移,而温度降低,故逆反应为放热,正反应时吸热反应,故D正确;
故选答案B。
【点睛】注意反应是吸热还是放热,根据温度对平衡的影响进行判断,升高温度平衡向吸热方向移动。
9.A
【详解】A.单位时间内生成2nmolA,同时生成nmolD,反应进行的方向相反,且物质的量的变化量之比等于化学计量数之比,达到了化学平衡状态,A符合题意;
B.因为反应前后气体的分子数相等,压强始终保持不变,所以当容器内压强不随时间而变化时,不能确定反应达平衡状态,B不符合题意;
C.单位时间内生成nmolB,同时消耗1.5nmolC,反应进行的方向相同,不一定达平衡状态,C不符合题意;
D.容器内混合气体的质量、容器的体积始终不变,密度始终不变,所以当密度不随时间而变化,反应不一定达平衡状态,D不符合题意;
故选A。
10.B
【详解】由于反应CO+H2O CO2+H2为可逆反应,正反应、逆反应同时进行,则含有O元素的物质中均含有18O,故选B。
11.D
【详解】A.温度升高,化学反应速率加快,在相同时间内,反应物的转化率应增大,但由表中数据可知,从300℃升至400℃、500℃时,A的转化率反而降低,说明温度升高,该平衡向逆反应方向移动,该反应的正反应为放热反应,A项错误;
B.在容积不变的容器下,气体体积不变,反应物总质量与生成物总质量相等,故不论反应是否达到平衡状态,容器内气体密度均不变,B项错误;
C.该反应的正反应是放热反应,若200℃已达到平衡状态,则A的转化率大于300℃时A的转化率,但表中数据显示这两个温度时A的转化率相等,说明200℃时,反应没有达到平衡状态,C项错误;
D.400℃时,反应达到平衡,A的平衡转化率为50%,根据反应可知,平衡时,B的平衡浓度为,则该反应的平衡常数,D项正确;
答案选D。
12.B
【详解】A.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则平衡向逆反应方向移动,三氧化硫的物质的量减小,则a <1.6,故A正确;
B.该反应为气体体积减小的反应,恒温恒压与恒温恒容相比,相当于增大压强,则平衡向正反应方向移动,三氧化硫的物质的量增大,则b>0.8,故B错误;
C.该反应为放热反应,绝热恒容与恒温恒容相比,相当于升高温度,则化学反应速率增大,则平衡时,以SO2表示的正反应速率:v(I) < v(II),故C正确;
D.若起始时向容器I中充入0.4 mol SO2(g)、0.3 molO2(g)和1.6 molSO3(g),等效为起始时向容器 I 中充入SO2(g)为(0.4 +1.6)mol=2.0mol 、O2(g) 为(0.3+0.8) mol=1.1mol,与I相比,相当于增大氧气的浓度,增大反应物浓度,平衡向正反应方向移动,故D正确;
故选B。
13.B
【详解】A.甲中,10分钟时C的物质的浓度为0.5mol·L 1,则A的浓度减小0.75mol·L 1,10分钟内A的化学反应速率:υ(A)= 0.75mol·L 1÷10min=0.075 mol·L 1·min 1,故A正确;
B.甲中,10分钟时C的物质的浓度为0.5mol·L 1,则A的浓度减小0.75mol·L 1,B的浓度减小0.25mol·L 1,10分钟时,c(A)= 2.25mol·L 1、c(A)= 0.75mol·L 1,Q=,反应没有达到化学平衡状态,故B错误;
C.3A(g)+B(g) 2C(g)正反应吸热,升高温度,反应速率加快、平衡常数增大,若T1>448 K,10分钟时C物质的浓度应该大于0.5 mol·L 1,所以乙中,T1<448 K、K乙<K甲,故C正确;
D.甲中,10分钟时C的物质的浓度为0.5mol·L 1,则A的浓度减小0.75mol·L 1,B的浓度减小0.25mol·L 1,10分钟时,c(A)= 2.25mol·L 1、c(A)= 0.75mol·L 1,Q=,达到化学平衡状态时,A的浓度减小大于0.75mol·L 1,则甲中A的转化率大于25%,丙与甲相比,增大B的浓度,A的平衡转化率大于甲,所以丙中,达到化学平衡状态时A的转化率大于25%,故D正确;
选B。
14.D
【详解】A.由反应I可知该反应ΔS>0,根据吉布斯自由能公式ΔG=ΔH-TΔS,故该I在低温下不能自发进行,则,A正确;
B.温度越高,反应越快,根据反应个反应,可以发现二氧化锰是反应III的产物,故温度升高时,相同时间内,二氧化锰会越来越多,即b代表二氧化锰,a代表,B正确;
C.由图可知时,二氧化锰一直增大,故此时发生的主要反应为反应III,C正确;
D.由图可知450℃时二氧化锰的含量较大,此时适当增大空气的流速可以提高的产率,但是温度较低时,二氧化锰含量较低,增大空气的流速不利于提高的产率,D错误;
故选D。
15. 酶的浓度一定 A 温度过高,酶的活性下降 甲
【详解】(1)由图Ⅰ分析,反应物浓度增大到一定限度,反应速率不再上升,说明决定化学反应速率的主要因素是酶的浓度,故答案为:酶的浓度一定;
(2)由图Ⅱ分析,点的反应速率最快,催化效率最高,故答案为:A;
(3)点到点曲线急剧下降是由于温度升高,酶的活性急速下降,故答案为:温度过高,酶的活性下降;
(4)由图Ⅱ可知,0~25℃范围内,温度越高,反应速率越快,所以甲试管转入25℃的水浴中加热时反应速率加快;乙试管在75℃的水浴中加热时,酶已经失活,故乙中无催化反应发生,故答案为:甲。
16.(1)
(2) 75% > 不变 升高温度
(3) A D
【分析】的平衡常数K=,的平衡常数K=,据此分析解答;根据v==,结合化学平衡的影响因素分析解答;若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,结合图象分析解答。
【详解】(1)某温度下,若的平衡常数,即K==100;则在同一温度下,反应的平衡常数K===,故答案为:;
(2)测得10min内,则△n()=7.5×10-3mol L-1 min-1×10min×2L=0.15mol,由方程式可知,反应的的物质的量为0.15mol,则的转化率为×100%=75%;
正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,转化率增大,即转化率α2>α1;
平衡常数只受温度影响,温度不变,平衡常数不变;正反应是放热反应,若要使平衡常数减小,可以升高温度,平衡逆向移动,平衡常数减小,故答案为:75%;>;不变;升高温度;
(3)若n(SO2)不变,的比值越小,说明n(O2) 越大,相当于充入氧气,平衡正向移动,的转化率越大,因此的转化率最大的是A点;根据图象,的比值越大,平衡时的体积分数越大,当达到平衡状态的体积分数应该大于C,可能是D、E、F三点中的D点,故答案为:A;D。
17. ACDF C E B A
【详解】(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态。
(2)t1时,v正、v逆同时增大,且v逆增大得更快,平衡向逆反应方向移动,所以t1时改变的条件是升温。t3时,v正、v逆同时增大且增大量相同,平衡不移动,所以t3时改变的条件是加催化剂。t4时,v正、v逆同时减小,但平衡向逆反应方向移动,所以t4时改变的条件是减小压强。
(3)根据图示知,t1~t2、t4~t5时间段内平衡均向逆反应方向移动,NH3的含量均比t0~t1时间段的低,所以t0~t1时间段内NH3的百分含量最高。
(4)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达到平衡,据此可画出反应速率的变化曲线为 。
18.③①②⑤④
【详解】将②③④⑤均转化为用表示的化学反应速率,则
②;
③;
④;
⑤;
故反应速率由大到小的顺序为。
19.②⑥⑨
【分析】当可逆反应达到平衡状态时,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态,据此解答。
【详解】①单位时间内生成nmol H2的同时生成nmol HI,速率之比不等于物质的量之比,故错误;
②一个H-H键断裂的同时有两个H-I键断裂,由于一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,反应达到平衡状态,故正确;
③未知起始投入量,c(HI)=c()不能说明反应达平衡状态,故错误;
④反应速率v(H2)=v(I2)=v(HI),未体现正与逆的关系,故错误;
⑤c(HI):c(H2):c(I2)=2:1:1,浓度比与化学计量数比相等并不能证明反应达平衡,故错误;
⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故正确;
⑦前后气体系数和相同,容器压强始终不变,故错误;
⑧反应前后气体总质量不变,总物质的量也不变,相对分子质量一直不变,故错误;
⑨温度和体积一定时,混合气体颜色不再变化,说明c(I2)不再发生变化,反应达到平衡状态,正确;
⑩温度和压强一定时,由于反应前后体积和气体的质量始终不变,则混合气体的密度始终不变,即密度不再变化不能说明反应达到平衡状态,错误;
故答案为:②⑥⑨。
20. 0.975 该反应气体分子数减少,增大压强,提高 ,所以 温度、压强和反应物的起始浓度(组成) 升高温度,增大使逐渐提高,但降低使逐渐下降。时,增大对的提高大于引起的降低;后,增大对的提高小于引起的降低。
【详解】(1)由题给反应式知,该反应为气体分子数减少的反应,其他条件一定时,增大压强,平衡转化率增大,故,结合题图(b)知5.0 MPa、550℃时对应的平衡转化率为0.975。影响平衡转化率的因素有:温度、压强、反应物的起始浓度等。
(2)设通入的、和共100 mol,利用三段式法进行计算:
平衡时气体的总物质的量为,则,,,因,,代入计算得。
(3)升高温度,反应速率常数增大,反应速率,提高但降低使反应速率逐渐下降。时,增大对的提高大于引起的降低后,增大对的提高小于引起的降低。
21.(1) > 0.12(c1)2 ①
(2) > MPa/min
【详解】(1)图象是NH3分解率和时间的关系,先达到平衡,说明温度高,即T1>T2,当反应达到平衡,v正=v逆,v正=k正·c2(NH3)= v逆=k逆·c(N2)·c3(H2),推出=K,达到平衡时,NH3的分解率为40%,此时消耗c(NH3)=0.4c1mol·L-1,c(N2)=0.2c1moL·L-1,达到平衡时,c(NH3)=0.6c1mol·L-1,c(N2)=0.2c1mol·L-1,c(H2)=0.6c1mol·L-1,K==0.12(c1)2,即0.12(c1)2,k正-k逆最大,说明反应向正反应方向进行程度增大,根据图象,温度升高NH3的分解率增大,即温度越高,向正反应方向进行程度越大,k正-k逆最大的曲线为①;故答案为>;0.12(c1)2;①;
(2)根据表中数据温度越高,K越大,说明该分解反应为吸热反应,即△H>0;反应速率是单位时间内物质的变化量,尿素为固体,氨气和二氧化碳的物质的量之比为2∶1,即氨气的物质的量分数为,用分压表示的氨气的生成速率为MPa·min-1=MPa/min;故答案为>;MPa/min。
22.(1)C
(2) 50%, >
(3) L2/mol2 不移动
【分析】题中发生反应N2+3H22NH3,根据题中信息进行分析。
(1)
A.断开3molH-H键应断开6molN-H键,A错误;
B.各物质的浓度成比例关系,不能说明达到平衡状态,B错误;
C.平均相对分子质量可表示为,体系中质量守恒m恒定,当不变时,不变,反应前后气体系数发生变化,故不变说明达到平衡状态,C正确;
D.密度,m恒定,V恒定,故密度为定值,故密度不变不能说明达到平衡状态,D错误;
故选C。
(2)
由题得:0.4-x+1.2-3x+2x=1.6×=1.2 x=0.2mol
N2的转化率;
反应正向进行,压强减小,要求压强不变相当于加压,平衡正移,N2的转化率增大,故α2%>α1%。
(3)
,将(2)中数值转化成物质的量浓度,代入可得K=L2/mol2;再加入0.6molN2和0.4mol NH3,则N2为0.8mol,H2为0.6mol,NH3为0.8mol,转化成浓度,代入平衡常数公式,可得K’=L2/mol2,故平衡不移动。
23. AD 2 ④
【详解】I.(1)A.单位时间内生成nmolX,指的是逆反应速率,生成2nmolZ,指正反应速率,且1∶2的变化量能够说明正反应速率等于逆反应速率,故可作为反应达平衡的标志;
B.根据,气体的总质量不变,容器体积不变,故密度为定值,故密度不变不可作为反应达平衡的标志;
C.无论反应平衡还是没有平衡,速率比都等于系数比,故用X、Y、Z的物质的量浓度变化表示反应速率的比为1∶1∶2的状态不一定是平衡状态;
D.当反应达到平衡状态时,各组分的物质的量均不发生改变,总物质的量也不再变化,即各组分的物质的量分数不再变化,故反应容器中的物质的量分数不再改变的状态是化学平衡状态;
E.由方程式可知,该反应是一个等体积变化,压强始终不改变,故压强不再改变的状态不一定是化学平衡状态;
F.根据可知,m不变,n也不变,则混合气体的平均相对分子质量始终不变,故不可作为反应达平衡的标志;
故选AD;
(2)由方程式可知,反应物X、Y变化量为1:1,设变化量为x,则有:,推出:mol,故答案为:;
(3)利用极限确定a的取值范围:若从正反应开始到达平衡,则a值最大,所以:,即,故;若从逆反应开始到达平衡,则a值最小,所以:,即,故;故答案为:;
Ⅱ.(1)恒温、恒压下到达平衡后,C的物质的量为3amol,说明和(2)所达到的平衡是相同的平衡,满足A.B起始量分为3mol、3mol,依据三段式列式判断;假设反应正向进行依据等效平衡:,x=2,B的物质的量=3- 3a,当3a>1,,B的物质的量小于2;当3a=1,B的物质的量等于2;当3a<1,B的物质的量大于2;故选④,所以答案为:2,④;
(2)若开始时放入6molA和6molB,到达平衡后再加入3molC,根据等效平衡的原理此时和(1)中的开始时放入1molA和1molB是等效平衡,待再次到达平衡后,达到的平衡与(1)是相同的,所以C的物质的量分数可以根据(1)计算得到即C的物质的量分数,故答案为:;
24.(1)
(2) b 容器容积迅速缩小至原来的一半时,N2分压变为原来的2倍;其他条件不变时,容器容积减小,压强增大,平衡向气体体积减小的方向移动,即该平衡逆向移动,所以N2分压先变为原来的2倍,后逐渐减小
(3)0.48
【详解】(1)密闭容器中0.1mol NH3总压为200kPa,则如图t1时H2的分压为120kPa,则H2的物质的量n(H2)=,则用H2的浓度变化表示的反应速率v(H2)=;
(2)t2时刻容器体积迅速缩小到原来的一半,则N2的分压迅速增大到原来的2倍,则cd错误;压强增大,化学平衡向气体总体积减小的方向移动,即化学平衡逆向移动,导致N2的分压应比原来2倍小,则b正确,a错误,故合理选项是b;
(3)在该温度下,达到平衡时,p(N2)=40kPa=0.4pθ、p(H2)=120kPa=1.2pθ、p(NH3)=120kPa=1.2pθ,则Kθ=。
