人教版高中化学选择性必修二 1.1.1 能层与能级 基态与激发态 原子光谱 教案
文档属性
| 名称 | 人教版高中化学选择性必修二 1.1.1 能层与能级 基态与激发态 原子光谱 教案 |  | |
| 格式 | docx | ||
| 文件大小 | 384.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 19:02:55 | ||
图片预览

文档简介
原子结构与性质
第一节 原子结构
1.1.1 能层与能级 基态与激发态 原子光谱
【教材分析】
本节从介绍原子的诞生,原子结构的发现历程入手,首先介绍能层、能级的概念,在原子的基态与激发态概念的基础上介绍电子的跃迁和光谱分析;然后给出构造原理并根据构造原理书写原子的核外电子排布;根据电子云与原子轨道等概念,进一步介绍核外电子的运动状态,并介绍了泡利原理、洪特规则、能量最低原理。本节内容比较抽象 ,教学过程中应注意培养学生的空间想象能力 、分析推理能力及抽象概括能力 。
【课标要求】
1、了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2、知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
3、知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
【教学重难点】
教学重点:能层与能级 基态与激发态
教学难点:能层与能级
【教学过程】
[创设情境]原子是如何产生的
[讲解]我们所在的宇宙诞生于一次大爆炸。宇宙大爆炸后两小时,诞生了大量的H、少量的He及极少量的Li,然后经过长或短的发展过程,以上元素发生原子核的熔合反应,分期分批的合成了其它元素。“原子”一词源自古希腊语“ATOM”,是不可再分的意思。古希腊哲学家假想原子是世间万物最小的粒子。19世纪初,英国人道尔顿创立了近代原子学说,假设原子是化学元素的最小粒子,每一种元素有一种原子。丹麦科学家玻尔提出了构造原理,即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期律的篇章。5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
[思考交流] 1、结合所学,请以钠原子为例,谈谈你对原子结构的认识。
2、你认为核外电子有什么运动特点和排布规律?
[旧知回顾]
玻尔模型:
电子只能在原子核外具有特定能量的“壳层”中运动。
原子是由原子核和核外电子组成
核外电子是分层排布的;
离核越远的电子,能量越高。
[新课讲授]
[学生活动]请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号
最多可容纳电子数
一、能层
[获取概念]概念:多电子原子核外电子的能量是不同的,核外电子按能量不同分成能层。
[设疑]那么原子核外电子在分层能层遵循什么规律呢?
[讲解]
1、排布规则:电子的能层由内向外排序,其序号、符号以及能容纳的最多电子数:第n层最多可容纳的电子数为2n2。最外层电子数不超过8(K层为最外层时,电子数不超过2)次外层电子数不超过18
倒数第三层电子数不超过32
2、能量规律:原子核外电子总是可能先排布在能量较低的电子层上,然后由内向外依次排布在能量逐渐升高的电子层。即:能层的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
[设疑]能级又是什么呢?
[讲解]多电子原子中,同一能层的电子,能量也可能不同,所以,同一能层的电子,又被分成不同的能级,就好比能层是楼层,能级是楼梯的阶级。
[讲解]
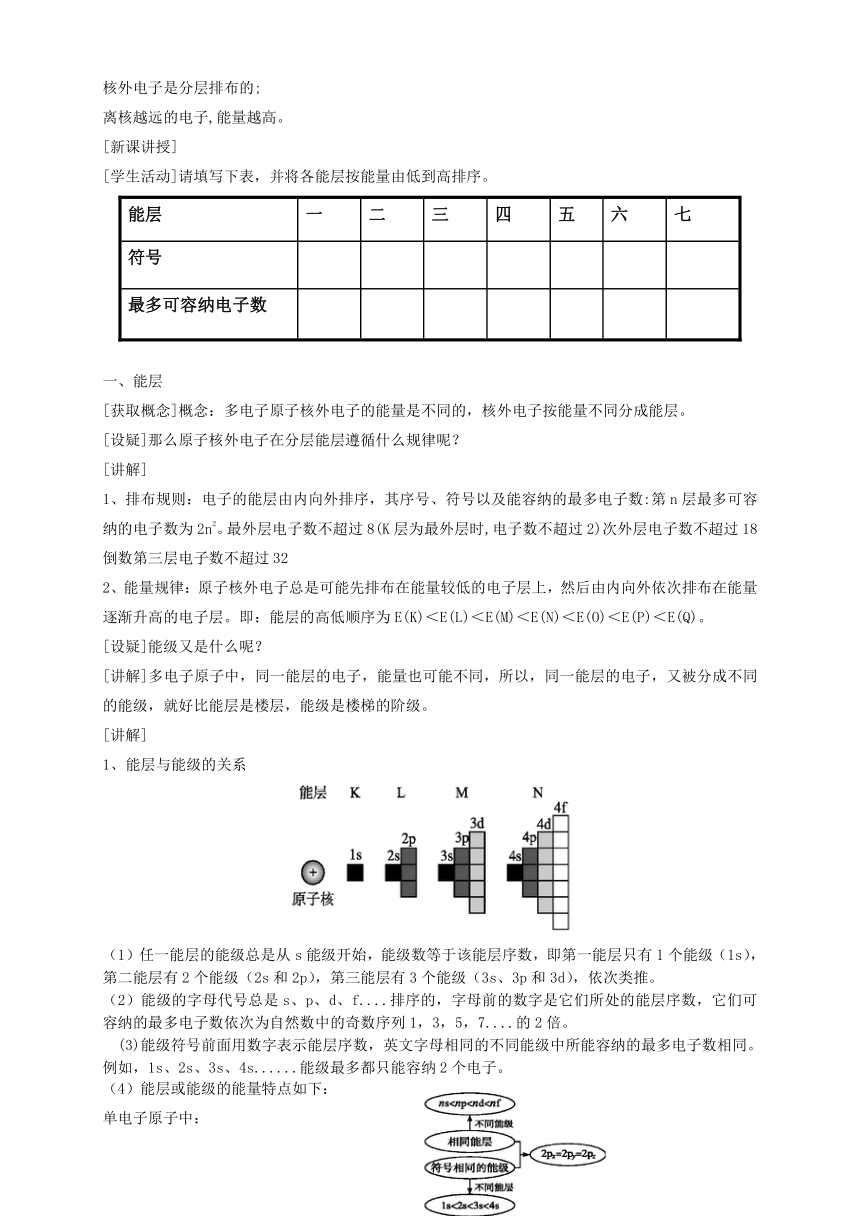
能层与能级的关系
(1)任一能层的能级总是从s能级开始,能级数等于该能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依次类推。
(2)能级的字母代号总是s、p、d、f....排序的,字母前的数字是它们所处的能层序数,它们可容纳的最多电子数依次为自然数中的奇数序列1,3,5,7....的2倍。
(3)能级符号前面用数字表示能层序数,英文字母相同的不同能级中所能容纳的最多电子数相同。例如,1s、2s、3s、4s......能级最多都只能容纳2个电子。
(4)能层或能级的能量特点如下:
单电子原子中:
E(ns) = E(np) = E(nd) = E(nf)
多电子原子中:
E(ns) < E(np) < E(nd) < E(nf)
[思考交流]
请填写下表,归纳各能级最多可容纳的电子数。
能层 K L M N
最多电子数 2 8 18 32
能级
最多电子数
[思考]
1. 以s、p、d、f为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所能容纳的最多电子数是否相同
2.第五能层最多可容纳多少个电子?他们分别容纳在几个能级中?各能级最多容纳多少个电子?
[过渡]观看视频
2.基态与激发态
[板书](1)基态与激发态
[总结]①电子的跃迁是物理变化(未发生电子转移),而原子得失电子时发生的是化学变化。
②一般在能量相近的能级间发生电子跃迁。如1s22s22p2表示基态碳原子,1s22s12p3为激发态碳原子(电子数不变)。
③激发态原子不稳定,易释放能量变为基态原子。
④激发态原子释放能量变为基态原子时,其能量可转化为可见光。光(辐射)是电子跃迁释放能量的重要形式。
[过渡]
生活中,我们看到的许多可见光,都与原子核外电子跃迁释放能量有关。
光谱一词最早是由伟大的物理学家牛顿提出的。不同元素的原子发生跃迁时会吸收或释放出不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱和发射光谱,这些光谱统称为原子光谱。在现代化学中利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。在历史上,有许多种元素都是通过光谱分析来发现的,如在1859年德国科学家本生和基尔霍夫发明了光谱仪,摄取了当时已知元素的光谱图。1861年德国科学家基尔霍夫利用光谱分析的方法发现了铷元素。再如稀有气体氦的原意是“太阳元素”,是1868年分析太阳光谱时发现的,最初人们以为它只存在于太阳,后来才在地球上发现。
[讲解]原子光谱的产生
[获取概念]不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
[展示]原子光谱的分类
发射光谱特征:暗背景,亮线, 线状不连续
吸收光谱特征:亮背景,暗线,线状不连续
[讲解]在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。光谱分析的依据是每一种元素都有自己的特征谱线。
[展示]原子光谱的应用
发现新元素
检验元素
生产生活
[思考]试分析霓虹灯发光的原理。
[解析]处于最低能量状态的原子叫做基态原子。基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。例如,电子可以从ls跃迁到2s、3s....相反,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。光(辐射)是电子跃迁释放能量的重要形式之一。在日常生活中,我们看到的许多可见光,如焰火、霓虹灯光、激光、萤光、LED灯都与原子核外电子跃迁释放能量有关。
[课堂练习]
[课堂小结]本节课掌握能层与能级的概念,基态与激发态,从微观理解原子结构。
第一节 原子结构
1.1.1 能层与能级 基态与激发态 原子光谱
【教材分析】
本节从介绍原子的诞生,原子结构的发现历程入手,首先介绍能层、能级的概念,在原子的基态与激发态概念的基础上介绍电子的跃迁和光谱分析;然后给出构造原理并根据构造原理书写原子的核外电子排布;根据电子云与原子轨道等概念,进一步介绍核外电子的运动状态,并介绍了泡利原理、洪特规则、能量最低原理。本节内容比较抽象 ,教学过程中应注意培养学生的空间想象能力 、分析推理能力及抽象概括能力 。
【课标要求】
1、了解有关核外电子运动模型的历史发展过程,认识核外电子的运动特点。
2、知道电子运动的能量状态具有量子化的特征(能量不连续),电子可以处于不同的能级,在一定条件下会发生激发与跃迁。
3、知道电子的运动状态(空间分布及能量)可通过原子轨道和电子云模型来描述。
【教学重难点】
教学重点:能层与能级 基态与激发态
教学难点:能层与能级
【教学过程】
[创设情境]原子是如何产生的
[讲解]我们所在的宇宙诞生于一次大爆炸。宇宙大爆炸后两小时,诞生了大量的H、少量的He及极少量的Li,然后经过长或短的发展过程,以上元素发生原子核的熔合反应,分期分批的合成了其它元素。“原子”一词源自古希腊语“ATOM”,是不可再分的意思。古希腊哲学家假想原子是世间万物最小的粒子。19世纪初,英国人道尔顿创立了近代原子学说,假设原子是化学元素的最小粒子,每一种元素有一种原子。丹麦科学家玻尔提出了构造原理,即从氢开始,随核电荷数递增,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期律的篇章。5年后,玻尔的“壳层”落实为“能层”与“能级”,厘清了核外电子的可能状态,复杂的原子光谱得以诠释。
[思考交流] 1、结合所学,请以钠原子为例,谈谈你对原子结构的认识。
2、你认为核外电子有什么运动特点和排布规律?
[旧知回顾]
玻尔模型:
电子只能在原子核外具有特定能量的“壳层”中运动。
原子是由原子核和核外电子组成
核外电子是分层排布的;
离核越远的电子,能量越高。
[新课讲授]
[学生活动]请填写下表,并将各能层按能量由低到高排序。
能层 一 二 三 四 五 六 七
符号
最多可容纳电子数
一、能层
[获取概念]概念:多电子原子核外电子的能量是不同的,核外电子按能量不同分成能层。
[设疑]那么原子核外电子在分层能层遵循什么规律呢?
[讲解]
1、排布规则:电子的能层由内向外排序,其序号、符号以及能容纳的最多电子数:第n层最多可容纳的电子数为2n2。最外层电子数不超过8(K层为最外层时,电子数不超过2)次外层电子数不超过18
倒数第三层电子数不超过32
2、能量规律:原子核外电子总是可能先排布在能量较低的电子层上,然后由内向外依次排布在能量逐渐升高的电子层。即:能层的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
[设疑]能级又是什么呢?
[讲解]多电子原子中,同一能层的电子,能量也可能不同,所以,同一能层的电子,又被分成不同的能级,就好比能层是楼层,能级是楼梯的阶级。
[讲解]
能层与能级的关系
(1)任一能层的能级总是从s能级开始,能级数等于该能层序数,即第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第三能层有3个能级(3s、3p和3d),依次类推。
(2)能级的字母代号总是s、p、d、f....排序的,字母前的数字是它们所处的能层序数,它们可容纳的最多电子数依次为自然数中的奇数序列1,3,5,7....的2倍。
(3)能级符号前面用数字表示能层序数,英文字母相同的不同能级中所能容纳的最多电子数相同。例如,1s、2s、3s、4s......能级最多都只能容纳2个电子。
(4)能层或能级的能量特点如下:
单电子原子中:
E(ns) = E(np) = E(nd) = E(nf)
多电子原子中:
E(ns) < E(np) < E(nd) < E(nf)
[思考交流]
请填写下表,归纳各能级最多可容纳的电子数。
能层 K L M N
最多电子数 2 8 18 32
能级
最多电子数
[思考]
1. 以s、p、d、f为符号的能级分别最多可容纳多少个电子?3d、4d、5d能级所能容纳的最多电子数是否相同
2.第五能层最多可容纳多少个电子?他们分别容纳在几个能级中?各能级最多容纳多少个电子?
[过渡]观看视频
2.基态与激发态
[板书](1)基态与激发态
[总结]①电子的跃迁是物理变化(未发生电子转移),而原子得失电子时发生的是化学变化。
②一般在能量相近的能级间发生电子跃迁。如1s22s22p2表示基态碳原子,1s22s12p3为激发态碳原子(电子数不变)。
③激发态原子不稳定,易释放能量变为基态原子。
④激发态原子释放能量变为基态原子时,其能量可转化为可见光。光(辐射)是电子跃迁释放能量的重要形式。
[过渡]
生活中,我们看到的许多可见光,都与原子核外电子跃迁释放能量有关。
光谱一词最早是由伟大的物理学家牛顿提出的。不同元素的原子发生跃迁时会吸收或释放出不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱和发射光谱,这些光谱统称为原子光谱。在现代化学中利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。在历史上,有许多种元素都是通过光谱分析来发现的,如在1859年德国科学家本生和基尔霍夫发明了光谱仪,摄取了当时已知元素的光谱图。1861年德国科学家基尔霍夫利用光谱分析的方法发现了铷元素。再如稀有气体氦的原意是“太阳元素”,是1868年分析太阳光谱时发现的,最初人们以为它只存在于太阳,后来才在地球上发现。
[讲解]原子光谱的产生
[获取概念]不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
[展示]原子光谱的分类
发射光谱特征:暗背景,亮线, 线状不连续
吸收光谱特征:亮背景,暗线,线状不连续
[讲解]在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。光谱分析的依据是每一种元素都有自己的特征谱线。
[展示]原子光谱的应用
发现新元素
检验元素
生产生活
[思考]试分析霓虹灯发光的原理。
[解析]处于最低能量状态的原子叫做基态原子。基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。例如,电子可以从ls跃迁到2s、3s....相反,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。光(辐射)是电子跃迁释放能量的重要形式之一。在日常生活中,我们看到的许多可见光,如焰火、霓虹灯光、激光、萤光、LED灯都与原子核外电子跃迁释放能量有关。
[课堂练习]
[课堂小结]本节课掌握能层与能级的概念,基态与激发态,从微观理解原子结构。
