第2章第3节氧化还原反应同步练习(含答案)2022-2023学年上学期高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第2章第3节氧化还原反应同步练习(含答案)2022-2023学年上学期高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 939.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 20:13:03 | ||
图片预览




文档简介
第2章第3节氧化还原反应同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.黑火药爆炸时的反应为:,该反应的还原剂是
A.C B. C. D.S
2.氧化还原反应与四种基本反应类型关系如图所示,则下列化学反应属于3区域的是
A.
B.2NaHCO3Na2CO3+CO2↑+H2O
C.
D.2Na2O2+2H2O=4NaOH+O2↑
3.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
4.工业上制取的化学反应(未配平):,下列说法正确的是
A.在反应中被还原 B.在反应中失去电子
C.在反应中作氧化剂 D.氧化剂在反应中得到电子
5.下列转化中,需要加入氧化剂才能实现的是
A. B. C. D.
6.工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列说法正确的是
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4在反应中作氧化剂
D.每生成1个ClO2,转移2个电子
7.氧化还原反应与四种基本反应类型的关系如下图所示。下列化学反应属于阴影部分的是
A.
B.
C.
D.
8.氢化钙可用作生氢剂,原理如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
9.下列化学反应中电子转移的表示方法正确的是
A.
B.
C.
D.
10.下列反应中,参加反应的化合物作还原剂的是
A.用锌和稀硫酸反应制取氢气
B.在高温下用氢气还原氧化铜得到单质铜
C.用碳和水蒸气在高温下反应制取氢气
D.用氯气和溴化钠反应生成溴和氯化钠
11.海水是一个巨大的化学资源宝库。下列有关海水综合利用的说法正确的是
A.从海水中可以获得,电解溶液可制备金属钠
B.从海水中提取溴的过程中利用了氧化还原反应原理
C.海水中含有镁元素,只需经过物理变化就可以得到镁单质
D.目前工业上可直接从海水中提取
12.碘在地壳中主要以的形式存在,在海水中主要以的形式存在,几种粒子之间的转化关系如图所示(淀粉遇碘单质变蓝)。
下列说法中不正确的是
A.用淀粉试纸和食醋检验加碘盐时淀粉试纸会变蓝
B.足量能使湿润的、已变蓝的淀粉试纸褪色的原因可能是:
C.由图可知氧化性的强弱顺序为
D.途径II中若生成1,则反应中转移的电子数为10
13.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
14.根据反应:①,②,判断以下各物质的氧化性由强到弱的顺序正确的是
A. B.
C. D.
二、多选题
15.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①T13++2Ag=Tl++2Ag+②Ag++Fe2+=Ag+Fe3+③Fe+2Fe3+=3Fe2+。下列离子氧化性比较顺序正确的是
A.T13+>Fe3+>Ag+ B.Fe3+>Ag+>T13+
C.T13+>Ag+>Fe2+ D.T13+>Ag+>Fe3+
三、填空题
16.亚硝酸钠属有毒物质,是一种食品防腐剂。所以,在肉制品加工中使用防腐剂必须严格控制其使用量,确保食用安全。
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,反应中氧化剂是______,若有0.75mol的还原剂被氧化,则被还原的氧化剂是______mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水,②淀粉碘化钾试纸,③淀粉,④白糖,⑤食醋,⑥白酒。进行实验时,必须选用的物质有______。
(3)若误食亚硝酸盐会导致血红蛋白中亚铁离子转化为铁离子而中毒。服用维生素C可解除亚硝酸盐中毒。下列叙述正确的是______。
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C能把亚铁离子氧化为三价铁离子
D.亚硝酸盐被氧化
17.氧化还原反应在生产和生活中的很多领域都得到了广泛应用。请运用氧化还原反应的知识完成下列题目:
(1)自然界中的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单质硅等。如果需要把某元素由化合态转变为游离态,则该元素_____
A.被氧化 B.被还原 C.有可能被氧化,也有可能被还原 D.由高价变为0价
(2)铀元素在核工业中有重要作用。物质自然界中存在的铀矿石中含有二氧化铀。工业上,可以用钾、钙、镁等金属与二氧化铀反应制得单质铀,若要获得等量的单质铀,钾、钙、镁三种金属中,哪种金属消耗得最多_____,为什么_____。
(3)某危险品仓库中存放有化工原料氰化钠(NaCN)。该物质有剧毒,一旦进入城市排水系统,后果不堪设想。当仓库发生火灾爆炸事故时,工作人员一方面封堵氰化钠泄漏渠道,另一方面对已经泄漏的少量氰化钠做无害化处理。下列物质中,可用于处理泄漏的氰化钠的是_____。
A.铁粉 B.双氧水 C.臭氧 D.氯化钠
四、实验题
18.某化学兴趣小组欲在实验室探究氯气的氧化性并模拟工业制取漂白粉,设计如图装置进行实验:
(1)圆底烧瓶中发生反应的离子方程式为_________。
(2)装置的连接顺序为_________(填接口字母)。
(3)饱和溶液的作用是________,淀粉溶液中的现象为_________。
(4)与石灰乳反应制取漂白粉的化学方程式为________。
19.含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取的化学方程式为_______。
(2)实验室制取干燥时,净化与收集所需装置的接口连接顺序为_______。
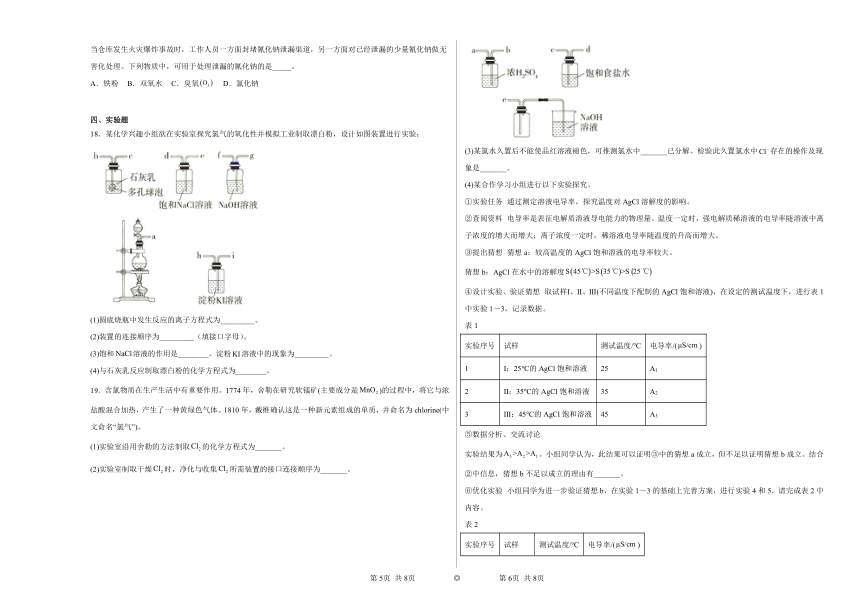
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______已分解。检验此久置氯水中存在的操作及现象是_______。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/()
1 Ⅰ:25℃的AgCl饱和溶液 25 A1
2 Ⅱ:35℃的AgCl饱和溶液 35 A2
3 Ⅲ:45℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论
实验结果为。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有_______。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
实验序号 试样 测试温度/℃ 电导率/()
4 Ⅰ _______ B1
5 _______ _______ B2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】在反应中,S元素由0价降低到-2价,N元素由+5价降低到0价,C元素由0价升高到+4价,则S、KNO3是氧化剂,C是还原剂,故选A。
2.D
【分析】3区域是指属于氧化还原反应,但又不是四大基本反应类型之一,据此分析。
【详解】A.Cl2+2KBr=Br2+2KCl是置换反应,属于四大基本反应类型之一,A不选;
B.2NaHCO3Na2CO3+H2O+CO2↑属于分解反应,也不是氧化还原反应,B不选;
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3是氧化还原反应,但是也属于化合反应,属于四大基本反应类型之一,C不选;
D.NaH+H2O=NaOH+H2↑既是氧化还原反应,也不属于四大基本反应类型之一,选D;
故选D。
3.B
【详解】A.该反应中Cl化合价从+5价降低为-1价,共得到个电子,同理O共失去个电子,A错误;
B.该反应中Mg化合价从0价升高为+2价,共失去个电子,同理O共得到个电子,B正确;
C.该反应中Cu化合价从+2价降低为0价,共得到个电子,C化合价从0价升高到+4价,共失去4个电子,C错误;
D.该反应中O化合价从0价降低到-2价,共得到个电子,D错误;
故答案选B。
4.D
【详解】A.在反应中中S元素化合价由+4升高至+6价,失去电子被氧化,故A错误;
B.中Cl元素化合价由+5价降为中的+4价,得到电子发生还原反应,故B错误;
C.在反应既不作氧化剂也不作还原剂,故C错误;
D.由可知,氧化剂在反应中得到电子,故D正确;
答案选D。
5.B
【分析】加入适当的氧化剂才能实现,选项中应为还原剂发生的氧化反应,还原剂中某元素的化合价升高,以此来解答。
【详解】A.I元素化合价由0价降低到-1价,发生还原反应,A不符合题意;
B.Fe元素化合价由+2价升高到+3价,发生氧化反应,B符合题意;
C.无化合价变化,不发生氧化还原反应,C不符合题意;
D.Mn元素化合价由+7价降低到+4价,发生还原反应,C不符合题意;
故答案为:B。
6.A
【详解】A.反应时,SO2中S元素的化合价升高,失电子发生氧化反应,故A正确;
B.NaClO3中Cl元素的化合价降低,得电子发生还原反应,故B错误;
C.H2SO4在反应中各元素化合价均未发生改变,既不是氧化剂,也不是还原剂,故C错误;
D.2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4反应中Cl从+5价降低为+4价,生成1个ClO2,转移1个电子,故D错误;
选A。
7.A
【详解】A.反应中N、O元素化合价有变化,属于氧化还原反应,不属于四种基本反应类型,属于属于阴影部分的反应,故选A;
B.是化合反应,不属于属于阴影部分的反应,故不选B;
C.是分解反应,不属于属于阴影部分的反应,故不选C;
D.是置换反应,不属于属于阴影部分的反应,故不选D;
选A。
8.B
【详解】CaH2中H的化合价为-1价,失去1个电子化合价升为0价,H2O中H的化合价为+1价,得到1个电子化合价降为0价,CaH2为还原剂,H2O为氧化剂,氧化产物、还原产物均为H2;
故选B。
9.B
【详解】A.的化合价升高,失去电子,的化合价降低,得电子,A错误;
B.原子化合价升高,是失去电子,失去电子,的得电子,B正确;
C.变成,化合价升高,失去电子数应为,C错误;
D.单质变成,化合价升高,失电子,生成,化合价降低,得电子,所以单线桥的箭头从指向,D错误;
故选B。
10.D
【详解】A.锌和稀硫酸反应制取氢气时,Zn作还原剂,硫酸作氧化剂,故A不选;
B.高温下用氢气还原氧化铜得到单质铜的反应中,CuO中的Cu元素化合价降低,作氧化剂,故B不选;
C.碳和水蒸气在高温下反应:,水中的H元素化合价降低,作氧化剂,故C不选;
D.氯气和溴化钠反应生成溴和氯化钠,其中溴元素化合价升高,被氧化,作还原剂,故D选;
故选D。
11.B
【详解】A.海水晒盐得到NaCl,Na为活泼金属,则电解熔融NaCl可制备Na同时产生氯气,A错误;
B.从海水中提取溴的过程中溴离子发生氧化反应生成溴单质,利用了氧化还原反应原理,B正确;
C.海水中镁以离子形成存在,经过化学反应可以获得氯化镁,然后电解熔融氯化镁可冶炼Mg,一定发生化学变化,C错误;
D.虽然海水中碘的总含量很大,但是海水中碘的浓度很低,不能直接由海水提取碘,D错误;
故选B。
12.C
【详解】A.加碘盐中含有KIO3,+5I +6H+=3I2+3H2O,I2使淀粉变蓝,所以用KI 淀粉试纸和食醋可以检验加碘盐中是否含有碘,故A正确;
B.根据图示转化Ⅲ可知氧化性Cl2>,已变蓝的淀粉 KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2NaIO3,故氧化性的强弱顺序为Cl2>>I2,故C错误;
D.根据转化关系2~I2~10e 可知,生成1molI2反应中转移的电子数为10NA,故D正确。
故选C。
13.A
【详解】A.反应符合反应事实,遵循电子转移的方向及数目,A正确;
B.在反应过程中电子转移数目是2个,故用双线桥法表示电子转移为:,B错误;
C.电子转移方向及数目均不合理。反应过程中KClO3的Cl得到电子被还原变为Cl2,HCl失去电子被氧化变为Cl2,反应过程中电子转移数目是5个,用双线桥法表示电子转移为:,C错误;
D.电子得失方向弄反。CuO变为Cu单质,Cu元素化合价降低,得到电子2×2e-,C变为CO2,失去电子数目是4e-,用双线桥法表示电子转移为:,D错误;
故合理选项是A。
14.C
【详解】反应①中Fe元素的化合价由+3降低为+2价,则Fe3+为氧化剂,I元素的化合价从-1价升高为0价,所以I2是氧化产物,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Fe3+>I2;同理,反应②中Br元素的化合价由0降低为-1价,则Br2为氧化剂,Fe元素的化合价由+2升高为+3价,则Fe3+为氧化产物,则氧化性Br2>Fe3+,因此氧化性为Br2>Fe3+>I2;
故选C。
15.CD
【详解】根据氧化还原反应方程式中氧化剂的氧化性强于氧化产物可知,氧化性①中Ti3+>Ag+,②中Ag+>Fe3+,③中Fe3+>Fe2+,综上所述,氧化性是TI3+>Ag+>Fe3+>Fe2+,答案选CD。
16.(1) NaNO2 0.75
(2)②⑤
(3)B
【详解】(1)N元素的化合价降低,则NaNO2作氧化剂,I-失去电子得到0价的I2,氮元素从+3价得到电子变成+2价,由电子守恒可知2NaNO2~HI,当有0.75 mol的还原剂被氧化时,被还原的氧化剂也是0.75 mol,故答案为:NaNO2;0.75。
(2)NaNO2在酸性环境中具有氧化性,把I-氧化为I2,淀粉遇I2变蓝,所以应该选用淀粉碘化钾试纸和食醋,而NaCl不能,故答案为:②⑤。
(3)由信息可知,维生素C具有还原性,作还原剂,维生素C能把铁离子还原为亚铁离子,亚硝酸盐作氧化剂被还原,只有B正确,故答案为:B。
17. C 钾 获得等量的单质铀,需要转移相同数目的电子,反应转移1mol电子,消耗钾、钙、镁的质量为39g、20g、12g,所以钾消耗最多 B
【详解】(1) 元素由化合态转变为游离态,可能是化合价升高被氧化,如硫离子转化为单质硫,也可能是化合价降低被还原,如铜离子转化为单质铜,故选C;
(2)获得等量的单质铀,需要转移相同数目的电子,反应转移1mol电子,消耗钾、钙、镁的质量分别为1mol×39g/mol=39g、1mol××40g/mol=20g、1mol××24g/mol=12g,则钾消耗最多,故答案为:钾;获得等量的单质铀,需要转移相同数目的电子,反应转移1mol电子,消耗钾、钙、镁的质量为39g、20g、12g,所以钾消耗最多;
(3) A.铁粉不能与氰化钠溶液反应,不能对已经泄漏的少量氰化钠做无害化处理,故错误;
B.双氧水具有氧化性,能与氰化钠溶液反应生成碳酸氢钠、水和氨气,反应的生成物都是无毒物质,能对已经泄漏的少量氰化钠做无害化处理,故正确;
C.臭氧具有强氧化性,氰化钠溶液也会被臭氧氧化,但生成物中会有氧气产生,支持燃烧的氧气会加剧火灾爆炸事故的发生,不能对已经泄漏的少量氰化钠做无害化处理,故错误;
D.氯化钠能与氰化钠溶液反应,不能对已经泄漏的少量氰化钠做无害化处理,故错误;
故选B。
18.(1)
(2)
(3) 除去中混有的 溶液变蓝
(4)
【分析】浓盐酸和二氧化锰共热制取氯气,氯气中混有氯化氢,通过饱和氯化钠溶液除去氯气中的氯化氢,然后通入淀粉碘化钾溶液中探究氯气的氧化性,接着通入石灰乳中制备漂白粉,氯气有毒,最后用氢氧化钠溶液吸收尾气,防止污染空气。
(1)
实验室用浓盐酸和二氧化锰共热制取氯气,因此圆底烧瓶中发生反应的离子方程式为:。
(2)
由分析可知,装置连接顺序应为:制备氯气→除去氯气中的氯化氢→探究氯气氧化性→制备漂白粉→处理尾气,因此连接口顺序为:。
(3)
浓盐酸有挥发性,制备的氯气中会混有氯化氢,因此饱和食盐水的作用为:除去氯气中的氯化氢;氯气有氧化性,能与碘化钾发生氧化还原反应生成碘单质,淀粉遇碘变蓝,因此淀粉KI溶液中的现象为:溶液变蓝。
(4)
氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:。
19.(1)
(2)cdbae
(3) HClO 取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀
(4) 即使浓度相同,温度高,电导率也大 35℃ Ⅱ或Ⅲ 35℃(或45℃) B2大于B1,说明温度高时溶解度大,则电导率大
【分析】实验室制氯气原理为:,制备的氯气中含有杂质气体和,因此先用饱和食盐水除去,而后用浓干燥,再利用向上排空气法收集,同时利用溶液吸收多余的,据此分析解答。
【详解】(1)根据得失电子守恒、原子守恒可知软锰矿与浓盐酸在加热条件下反应制氯气的化学方程式为;
(2)制备的氯气中含有杂质气体、,先用饱和食盐水除去,而后用浓干燥,再利用向上排空气法收集,同时利用溶液吸收多余的,故连接顺序是cdbae;
(3)新制氯水中含有的具有漂白性,久置氯水失去漂白性,说明已分解,检验久置氯水中的的操作与现象是:取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀;
(4)⑤即使浓度相同,温度高,电导率也大,故实验1、2、3的结果不足以说明猜想b成立。⑥为了探究不同温度下溶解度不同引起电导率的变化,应先选取不同温度的两个试样,然后将较低温度的试样升高温度至与另一试样的温度相同,再测试电导率,比较大小,若较高温度的饱和溶液的电导率大于另一溶液,则证明猜想b成立。故实验5可选取Ⅱ或Ⅲ,若选取Ⅱ,则测试温度均选择,若大于,说明温度高时溶解度大,则电导率大;若选取Ⅲ,则测试温度均选择,若大于,说明温度高时溶解度大,则电导率大。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.黑火药爆炸时的反应为:,该反应的还原剂是
A.C B. C. D.S
2.氧化还原反应与四种基本反应类型关系如图所示,则下列化学反应属于3区域的是
A.
B.2NaHCO3Na2CO3+CO2↑+H2O
C.
D.2Na2O2+2H2O=4NaOH+O2↑
3.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
4.工业上制取的化学反应(未配平):,下列说法正确的是
A.在反应中被还原 B.在反应中失去电子
C.在反应中作氧化剂 D.氧化剂在反应中得到电子
5.下列转化中,需要加入氧化剂才能实现的是
A. B. C. D.
6.工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。下列说法正确的是
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4在反应中作氧化剂
D.每生成1个ClO2,转移2个电子
7.氧化还原反应与四种基本反应类型的关系如下图所示。下列化学反应属于阴影部分的是
A.
B.
C.
D.
8.氢化钙可用作生氢剂,原理如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
9.下列化学反应中电子转移的表示方法正确的是
A.
B.
C.
D.
10.下列反应中,参加反应的化合物作还原剂的是
A.用锌和稀硫酸反应制取氢气
B.在高温下用氢气还原氧化铜得到单质铜
C.用碳和水蒸气在高温下反应制取氢气
D.用氯气和溴化钠反应生成溴和氯化钠
11.海水是一个巨大的化学资源宝库。下列有关海水综合利用的说法正确的是
A.从海水中可以获得,电解溶液可制备金属钠
B.从海水中提取溴的过程中利用了氧化还原反应原理
C.海水中含有镁元素,只需经过物理变化就可以得到镁单质
D.目前工业上可直接从海水中提取
12.碘在地壳中主要以的形式存在,在海水中主要以的形式存在,几种粒子之间的转化关系如图所示(淀粉遇碘单质变蓝)。
下列说法中不正确的是
A.用淀粉试纸和食醋检验加碘盐时淀粉试纸会变蓝
B.足量能使湿润的、已变蓝的淀粉试纸褪色的原因可能是:
C.由图可知氧化性的强弱顺序为
D.途径II中若生成1,则反应中转移的电子数为10
13.下列氧化还原反应中,电子转移的方向和数目均正确的是
A. B.
C. D.
14.根据反应:①,②,判断以下各物质的氧化性由强到弱的顺序正确的是
A. B.
C. D.
二、多选题
15.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①T13++2Ag=Tl++2Ag+②Ag++Fe2+=Ag+Fe3+③Fe+2Fe3+=3Fe2+。下列离子氧化性比较顺序正确的是
A.T13+>Fe3+>Ag+ B.Fe3+>Ag+>T13+
C.T13+>Ag+>Fe2+ D.T13+>Ag+>Fe3+
三、填空题
16.亚硝酸钠属有毒物质,是一种食品防腐剂。所以,在肉制品加工中使用防腐剂必须严格控制其使用量,确保食用安全。
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,反应中氧化剂是______,若有0.75mol的还原剂被氧化,则被还原的氧化剂是______mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水,②淀粉碘化钾试纸,③淀粉,④白糖,⑤食醋,⑥白酒。进行实验时,必须选用的物质有______。
(3)若误食亚硝酸盐会导致血红蛋白中亚铁离子转化为铁离子而中毒。服用维生素C可解除亚硝酸盐中毒。下列叙述正确的是______。
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C能把亚铁离子氧化为三价铁离子
D.亚硝酸盐被氧化
17.氧化还原反应在生产和生活中的很多领域都得到了广泛应用。请运用氧化还原反应的知识完成下列题目:
(1)自然界中的元素大多以化合态存在,而我们在生产和生活中需要许多单质,如金属铁、单质硅等。如果需要把某元素由化合态转变为游离态,则该元素_____
A.被氧化 B.被还原 C.有可能被氧化,也有可能被还原 D.由高价变为0价
(2)铀元素在核工业中有重要作用。物质自然界中存在的铀矿石中含有二氧化铀。工业上,可以用钾、钙、镁等金属与二氧化铀反应制得单质铀,若要获得等量的单质铀,钾、钙、镁三种金属中,哪种金属消耗得最多_____,为什么_____。
(3)某危险品仓库中存放有化工原料氰化钠(NaCN)。该物质有剧毒,一旦进入城市排水系统,后果不堪设想。当仓库发生火灾爆炸事故时,工作人员一方面封堵氰化钠泄漏渠道,另一方面对已经泄漏的少量氰化钠做无害化处理。下列物质中,可用于处理泄漏的氰化钠的是_____。
A.铁粉 B.双氧水 C.臭氧 D.氯化钠
四、实验题
18.某化学兴趣小组欲在实验室探究氯气的氧化性并模拟工业制取漂白粉,设计如图装置进行实验:
(1)圆底烧瓶中发生反应的离子方程式为_________。
(2)装置的连接顺序为_________(填接口字母)。
(3)饱和溶液的作用是________,淀粉溶液中的现象为_________。
(4)与石灰乳反应制取漂白粉的化学方程式为________。
19.含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取的化学方程式为_______。
(2)实验室制取干燥时,净化与收集所需装置的接口连接顺序为_______。
(3)某氯水久置后不能使品红溶液褪色,可推测氯水中_______已分解。检验此久置氯水中存在的操作及现象是_______。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对AgCl溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。
③提出猜想 猜想a:较高温度的AgCl饱和溶液的电导率较大。
猜想b:AgCl在水中的溶解度
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的AgCl饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 试样 测试温度/℃ 电导率/()
1 Ⅰ:25℃的AgCl饱和溶液 25 A1
2 Ⅱ:35℃的AgCl饱和溶液 35 A2
3 Ⅲ:45℃的AgCl饱和溶液 45 A3
⑤数据分析、交流讨论
实验结果为。小组同学认为,此结果可以证明③中的猜想a成立,但不足以证明猜想b成立。结合②中信息,猜想b不足以成立的理由有_______。
⑥优化实验 小组同学为进一步验证猜想b,在实验1~3的基础上完善方案,进行实验4和5,请完成表2中内容。
表2
实验序号 试样 测试温度/℃ 电导率/()
4 Ⅰ _______ B1
5 _______ _______ B2
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想b也成立。猜想b成立的判断依据是_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】在反应中,S元素由0价降低到-2价,N元素由+5价降低到0价,C元素由0价升高到+4价,则S、KNO3是氧化剂,C是还原剂,故选A。
2.D
【分析】3区域是指属于氧化还原反应,但又不是四大基本反应类型之一,据此分析。
【详解】A.Cl2+2KBr=Br2+2KCl是置换反应,属于四大基本反应类型之一,A不选;
B.2NaHCO3Na2CO3+H2O+CO2↑属于分解反应,也不是氧化还原反应,B不选;
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3是氧化还原反应,但是也属于化合反应,属于四大基本反应类型之一,C不选;
D.NaH+H2O=NaOH+H2↑既是氧化还原反应,也不属于四大基本反应类型之一,选D;
故选D。
3.B
【详解】A.该反应中Cl化合价从+5价降低为-1价,共得到个电子,同理O共失去个电子,A错误;
B.该反应中Mg化合价从0价升高为+2价,共失去个电子,同理O共得到个电子,B正确;
C.该反应中Cu化合价从+2价降低为0价,共得到个电子,C化合价从0价升高到+4价,共失去4个电子,C错误;
D.该反应中O化合价从0价降低到-2价,共得到个电子,D错误;
故答案选B。
4.D
【详解】A.在反应中中S元素化合价由+4升高至+6价,失去电子被氧化,故A错误;
B.中Cl元素化合价由+5价降为中的+4价,得到电子发生还原反应,故B错误;
C.在反应既不作氧化剂也不作还原剂,故C错误;
D.由可知,氧化剂在反应中得到电子,故D正确;
答案选D。
5.B
【分析】加入适当的氧化剂才能实现,选项中应为还原剂发生的氧化反应,还原剂中某元素的化合价升高,以此来解答。
【详解】A.I元素化合价由0价降低到-1价,发生还原反应,A不符合题意;
B.Fe元素化合价由+2价升高到+3价,发生氧化反应,B符合题意;
C.无化合价变化,不发生氧化还原反应,C不符合题意;
D.Mn元素化合价由+7价降低到+4价,发生还原反应,C不符合题意;
故答案为:B。
6.A
【详解】A.反应时,SO2中S元素的化合价升高,失电子发生氧化反应,故A正确;
B.NaClO3中Cl元素的化合价降低,得电子发生还原反应,故B错误;
C.H2SO4在反应中各元素化合价均未发生改变,既不是氧化剂,也不是还原剂,故C错误;
D.2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4反应中Cl从+5价降低为+4价,生成1个ClO2,转移1个电子,故D错误;
选A。
7.A
【详解】A.反应中N、O元素化合价有变化,属于氧化还原反应,不属于四种基本反应类型,属于属于阴影部分的反应,故选A;
B.是化合反应,不属于属于阴影部分的反应,故不选B;
C.是分解反应,不属于属于阴影部分的反应,故不选C;
D.是置换反应,不属于属于阴影部分的反应,故不选D;
选A。
8.B
【详解】CaH2中H的化合价为-1价,失去1个电子化合价升为0价,H2O中H的化合价为+1价,得到1个电子化合价降为0价,CaH2为还原剂,H2O为氧化剂,氧化产物、还原产物均为H2;
故选B。
9.B
【详解】A.的化合价升高,失去电子,的化合价降低,得电子,A错误;
B.原子化合价升高,是失去电子,失去电子,的得电子,B正确;
C.变成,化合价升高,失去电子数应为,C错误;
D.单质变成,化合价升高,失电子,生成,化合价降低,得电子,所以单线桥的箭头从指向,D错误;
故选B。
10.D
【详解】A.锌和稀硫酸反应制取氢气时,Zn作还原剂,硫酸作氧化剂,故A不选;
B.高温下用氢气还原氧化铜得到单质铜的反应中,CuO中的Cu元素化合价降低,作氧化剂,故B不选;
C.碳和水蒸气在高温下反应:,水中的H元素化合价降低,作氧化剂,故C不选;
D.氯气和溴化钠反应生成溴和氯化钠,其中溴元素化合价升高,被氧化,作还原剂,故D选;
故选D。
11.B
【详解】A.海水晒盐得到NaCl,Na为活泼金属,则电解熔融NaCl可制备Na同时产生氯气,A错误;
B.从海水中提取溴的过程中溴离子发生氧化反应生成溴单质,利用了氧化还原反应原理,B正确;
C.海水中镁以离子形成存在,经过化学反应可以获得氯化镁,然后电解熔融氯化镁可冶炼Mg,一定发生化学变化,C错误;
D.虽然海水中碘的总含量很大,但是海水中碘的浓度很低,不能直接由海水提取碘,D错误;
故选B。
12.C
【详解】A.加碘盐中含有KIO3,+5I +6H+=3I2+3H2O,I2使淀粉变蓝,所以用KI 淀粉试纸和食醋可以检验加碘盐中是否含有碘,故A正确;
B.根据图示转化Ⅲ可知氧化性Cl2>,已变蓝的淀粉 KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2
D.根据转化关系2~I2~10e 可知,生成1molI2反应中转移的电子数为10NA,故D正确。
故选C。
13.A
【详解】A.反应符合反应事实,遵循电子转移的方向及数目,A正确;
B.在反应过程中电子转移数目是2个,故用双线桥法表示电子转移为:,B错误;
C.电子转移方向及数目均不合理。反应过程中KClO3的Cl得到电子被还原变为Cl2,HCl失去电子被氧化变为Cl2,反应过程中电子转移数目是5个,用双线桥法表示电子转移为:,C错误;
D.电子得失方向弄反。CuO变为Cu单质,Cu元素化合价降低,得到电子2×2e-,C变为CO2,失去电子数目是4e-,用双线桥法表示电子转移为:,D错误;
故合理选项是A。
14.C
【详解】反应①中Fe元素的化合价由+3降低为+2价,则Fe3+为氧化剂,I元素的化合价从-1价升高为0价,所以I2是氧化产物,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Fe3+>I2;同理,反应②中Br元素的化合价由0降低为-1价,则Br2为氧化剂,Fe元素的化合价由+2升高为+3价,则Fe3+为氧化产物,则氧化性Br2>Fe3+,因此氧化性为Br2>Fe3+>I2;
故选C。
15.CD
【详解】根据氧化还原反应方程式中氧化剂的氧化性强于氧化产物可知,氧化性①中Ti3+>Ag+,②中Ag+>Fe3+,③中Fe3+>Fe2+,综上所述,氧化性是TI3+>Ag+>Fe3+>Fe2+,答案选CD。
16.(1) NaNO2 0.75
(2)②⑤
(3)B
【详解】(1)N元素的化合价降低,则NaNO2作氧化剂,I-失去电子得到0价的I2,氮元素从+3价得到电子变成+2价,由电子守恒可知2NaNO2~HI,当有0.75 mol的还原剂被氧化时,被还原的氧化剂也是0.75 mol,故答案为:NaNO2;0.75。
(2)NaNO2在酸性环境中具有氧化性,把I-氧化为I2,淀粉遇I2变蓝,所以应该选用淀粉碘化钾试纸和食醋,而NaCl不能,故答案为:②⑤。
(3)由信息可知,维生素C具有还原性,作还原剂,维生素C能把铁离子还原为亚铁离子,亚硝酸盐作氧化剂被还原,只有B正确,故答案为:B。
17. C 钾 获得等量的单质铀,需要转移相同数目的电子,反应转移1mol电子,消耗钾、钙、镁的质量为39g、20g、12g,所以钾消耗最多 B
【详解】(1) 元素由化合态转变为游离态,可能是化合价升高被氧化,如硫离子转化为单质硫,也可能是化合价降低被还原,如铜离子转化为单质铜,故选C;
(2)获得等量的单质铀,需要转移相同数目的电子,反应转移1mol电子,消耗钾、钙、镁的质量分别为1mol×39g/mol=39g、1mol××40g/mol=20g、1mol××24g/mol=12g,则钾消耗最多,故答案为:钾;获得等量的单质铀,需要转移相同数目的电子,反应转移1mol电子,消耗钾、钙、镁的质量为39g、20g、12g,所以钾消耗最多;
(3) A.铁粉不能与氰化钠溶液反应,不能对已经泄漏的少量氰化钠做无害化处理,故错误;
B.双氧水具有氧化性,能与氰化钠溶液反应生成碳酸氢钠、水和氨气,反应的生成物都是无毒物质,能对已经泄漏的少量氰化钠做无害化处理,故正确;
C.臭氧具有强氧化性,氰化钠溶液也会被臭氧氧化,但生成物中会有氧气产生,支持燃烧的氧气会加剧火灾爆炸事故的发生,不能对已经泄漏的少量氰化钠做无害化处理,故错误;
D.氯化钠能与氰化钠溶液反应,不能对已经泄漏的少量氰化钠做无害化处理,故错误;
故选B。
18.(1)
(2)
(3) 除去中混有的 溶液变蓝
(4)
【分析】浓盐酸和二氧化锰共热制取氯气,氯气中混有氯化氢,通过饱和氯化钠溶液除去氯气中的氯化氢,然后通入淀粉碘化钾溶液中探究氯气的氧化性,接着通入石灰乳中制备漂白粉,氯气有毒,最后用氢氧化钠溶液吸收尾气,防止污染空气。
(1)
实验室用浓盐酸和二氧化锰共热制取氯气,因此圆底烧瓶中发生反应的离子方程式为:。
(2)
由分析可知,装置连接顺序应为:制备氯气→除去氯气中的氯化氢→探究氯气氧化性→制备漂白粉→处理尾气,因此连接口顺序为:。
(3)
浓盐酸有挥发性,制备的氯气中会混有氯化氢,因此饱和食盐水的作用为:除去氯气中的氯化氢;氯气有氧化性,能与碘化钾发生氧化还原反应生成碘单质,淀粉遇碘变蓝,因此淀粉KI溶液中的现象为:溶液变蓝。
(4)
氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:。
19.(1)
(2)cdbae
(3) HClO 取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀
(4) 即使浓度相同,温度高,电导率也大 35℃ Ⅱ或Ⅲ 35℃(或45℃) B2大于B1,说明温度高时溶解度大,则电导率大
【分析】实验室制氯气原理为:,制备的氯气中含有杂质气体和,因此先用饱和食盐水除去,而后用浓干燥,再利用向上排空气法收集,同时利用溶液吸收多余的,据此分析解答。
【详解】(1)根据得失电子守恒、原子守恒可知软锰矿与浓盐酸在加热条件下反应制氯气的化学方程式为;
(2)制备的氯气中含有杂质气体、,先用饱和食盐水除去,而后用浓干燥,再利用向上排空气法收集,同时利用溶液吸收多余的,故连接顺序是cdbae;
(3)新制氯水中含有的具有漂白性,久置氯水失去漂白性,说明已分解,检验久置氯水中的的操作与现象是:取少量久置氯水于试管中,滴加稀硝酸酸化,再滴加硝酸银溶液,产生白色沉淀;
(4)⑤即使浓度相同,温度高,电导率也大,故实验1、2、3的结果不足以说明猜想b成立。⑥为了探究不同温度下溶解度不同引起电导率的变化,应先选取不同温度的两个试样,然后将较低温度的试样升高温度至与另一试样的温度相同,再测试电导率,比较大小,若较高温度的饱和溶液的电导率大于另一溶液,则证明猜想b成立。故实验5可选取Ⅱ或Ⅲ,若选取Ⅱ,则测试温度均选择,若大于,说明温度高时溶解度大,则电导率大;若选取Ⅲ,则测试温度均选择,若大于,说明温度高时溶解度大,则电导率大。
答案第1页,共2页
答案第1页,共2页
