第3章第1节铁的多样性同步练习(含答案)2022-2023学年上学期高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章第1节铁的多样性同步练习(含答案)2022-2023学年上学期高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 777.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 20:43:59 | ||
图片预览




文档简介
第3章第1节铁的多样性同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.通过铝热反应能冶炼难熔的金属(如Cr、V、Mn等),与铝热反应无关的是
A.铝具有还原性 B.铝具有导电性
C.铝较Cr、V、Mn等价格便宜 D.铝热反应放出大量的热
2.下列对某些问题的认识正确的是
A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
B.Na能与水反应,因此不能利用钠的置换反应制备其他金属单质X
C.纯碱属于盐,其水溶液不宜用带玻璃塞的玻璃瓶盛放
D.铝合金、 不锈钢、足球烯(C60)都是重要的金属材料
3.下列物质间的转化不能一步实现的是
A.CaO→Ca(OH)2→CaSO4 B.Fe→FeCl3→Fe(OH)3
C.C→CO→CaCO3 D.Cu→CuO→CuSO4
4.目前工业上冶炼镁通常采用的方法是
A.CO或H2还原法 B.铝热反应法
C.电解法 D.热分解法
5.关于废旧金属处理的下列说法中不正确的是
A.对废旧金属的最好处理方法是回收、再利用
B.重金属对人体有害,对废旧重金属材料的处理方法是填埋
C.废旧钢铁可用于炼钢,废铁屑可用于制铁盐
D.照相业、科研单位和医院X光室回收的定影液中,可以提取金属银
6.下列各图示中能较长时间观察到的是
A.①②③ B.①②④ C.①②③④ D.②③④
7.下列离子的检验方法合理的是
A.向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+
B.向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
8.下列有关铁及其化合物的说法正确的是
A.在自然界中,铁都以化合态形式存在
B.赤铁矿的主要成分是,磁铁矿的主要成分是
C.能通过化合反应制得,但不能通过化合反应制得
D.铁的氧化物能与酸反应生成盐和水,因此、、都是碱性氧化物
9.随着人们生活节奏的加快,方便的包装食品已被广泛接受,为了防止副食品氧化变质,延长食品食品的保质期,在包装袋中常放入抗氧化物质,下列不属于抗氧化物质的是
A.生石灰 B.亚硫酸钠 C.铁粉 D.硫酸亚铁
10.下列实验操作错误的是
A.将实验后剩余的钠粒放回原试剂瓶中
B.焰色反应前将铂丝用稀硫酸清洗并灼烧至火焰与原来颜色相同
C.可用干燥沙土扑灭着火的金属钠
D.制备时将胶头滴管伸入溶液液面下再挤出NaOH溶液
11.金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化不能全部通过一步反应直接完成的是
A.Al→Al2O3→Al(OH)3→AlCl3 B.Na→NaOH→Na2CO3→NaCl
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
12.化学在生产、生活中起着重要的作用,以下化学用语中正确的是
A.补铁剂通常需要与维C共同使用,是为了增强药品中的效果
B.侯氏制碱法中利用各个物质溶解度的不同,可直接过滤获得纯碱
C.向冷的石灰乳中通入氯气,可制得漂白粉,有效成分为次氯酸钙
D.不锈钢是最常见的一种合金钢,它的合金元素主要是锰和镍
13.根据下列反应:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是
A.Br->I->Fe2+ B.I->Fe2+>Br-
C.Fe2+>I->Br- D.Br->Fe2+>I-
14.金属材料在生产、生活中使用广泛。下列有关金属的说法正确的是
A.合金一定只含有金属元素
B.镁锂合金的硬度比金属镁的高
C.铁与盐酸发生置换反应可制取
D.未打磨的铝丝放入溶液中无明显现象是因铝的活泼性比铜弱
二、多选题
15.下列反应中,表现出氧化性的是
A.溶液使淀粉碘化钾试纸变蓝
B.向溶液中加入NaOH溶液产生红褐色沉淀
C.向溶液中加入溶液产生白色沉淀
D.向溶液中加入少量铁粉,铁粉消失
三、填空题
16.冶炼金属常用以下几种方法:
a.以C、CO或H2作还原剂还原;
b.利用铝热反应原理;
c.电解法;
d.热分解法。
(1)下列金属各采用哪种方法冶炼最佳?
①Fe、Zn、Cu等较不活泼金属_______;
②Na、Mg、Al等活泼或较活泼金属_______;
③Hg、Ag等不活泼金属_______;
④V、Cr、Mn、W等高熔点金属_______。
(2)工业上生产钾不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电解效率。现生产钾是用金属钠和熔化的KCl反应制取。有关数据如下表:
熔点/℃ 沸点/℃ 密度/(g·cm-3)
Na 97.8 883 0.97
K 63.7 774 0.86
NaCl 801 1 413 2.165
KCl 770 1 500 1.984
工业上生产金属钾的化学方程式是:KCl+NaNaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数?_______;其选择范围是_______。
17.易被空气中的氧气氧化,故制备时主要是避免氧气的介入。某学生利用稀硫酸A、铁粉B和某碱溶液C在实验室设计了如图装置制备白色固体。
(1)写出易被空气中的氧气氧化的方程式_______。
(2)装置II盛放的溶液C是_______(a.NaOH b.);配置该溶液时,为除去蒸馏水中溶解的常采用的方法是_______。
(3)铁粉与稀硫酸制备的离子方程式为_______,的作用有_______(填编号)。
a.驱赶装置内的空气
b.把物质B压入II中
c.保护白色不被空气氧化
(4)白色沉淀在_______(填“锥形瓶I”或“锥形瓶II”)内生成,经在无氧环境中干燥处理,得到的白色粉末是很好的化工_______(填“除酸剂”或“除氧剂”)。
四、实验题
18.某实验小组在实验室进行Fe2+与Fe3+相互转化的实验。
(1)向试管a中加入过量铁粉的离子方程式是___________。
(2)试管b中的实验现象是___________。
(3)试管c中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式___________。
(4)实验小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如下(w表示质量分数):
实验 序号 w(FeSO4)/% w(NaOH)/% t/s
i 2.5 15 149
ii 5 15 138
iii 10 15 99
iv 5 25 142
v 5 35 180
①实验i、ii、iii的目的是___________。
②小组同学通过实验得出结论:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好,推断的证据是___________。
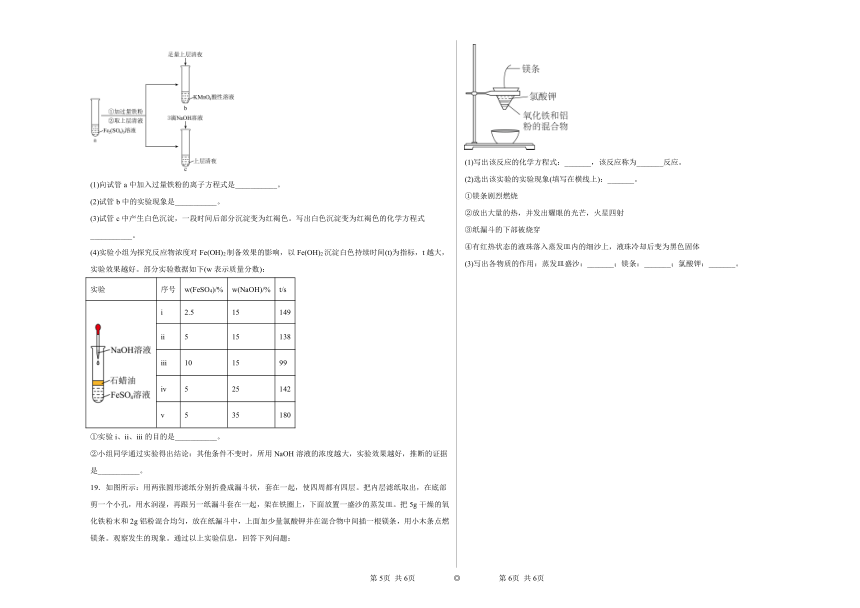
19.如图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5g干燥的氧化铁粉末和2g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:_______,该反应称为_______反应。
(2)选出该实验的实验现象(填写在横线上):_______。
①镁条剧烈燃烧
②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿
④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:_______;镁条:_______;氯酸钾:_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】
【详解】A.根据方程式可知,Al具有还原性,A有关;
B.铝热反应中没有电流产生,不需要导电性,B无关;
C.Cr、V、Mn均具有还原性,但价格较高,故热反应中用铝置换金属,C有关;
D.铝粉激烈氧化,燃烧而放出大量热,D有关;
故答案为:B。
2.C
【详解】A.浓硫酸的密度大于水,故用等体积的水稀释后,溶液的质量小于原溶液的2倍,溶液的质量分数大于原来的一半,故质量分数大于49%,A错误;
B.通常钠不能从盐溶液中置换出金属,若盐为熔融状态,钠可以置换出较不活泼的金属,如钠可以和熔融的四氯化钛反应制取钛,B错误;
C.纯碱属于盐,但是其水解显碱性,可以和玻璃中的二氧化硅反应,故其水溶液不宜用带玻璃塞的玻璃瓶盛放,C正确;
D.铝合金、不锈钢是重要的金属材料,足球烯(C60)属于无机非金属材料,D错误;
故选C。
3.C
【详解】A.CaO与水反应生成氢氧化钙,氢氧化钙与硫酸反应生成硫酸钙,转化均可一步实现,故A正确;
B.Fe与氯气反应生成FeCl3,FeCl3与NaOH反应生成Fe(OH)3,转化均可一步实现,故B正确;
C.CO为不成盐氧化物,则CO→CaCO3不能一步实现,故C错误;
D.Cu与氧气反应生成CuO,CuO与硫酸反应生成硫酸铜,转化均可一步实现,故D正确;
故选:C。
4.C
【详解】金属镁很活泼,因此目前工业上冶炼金属镁采用的是电解熔融的MgCl2来得到金属镁,综上所述故选C。
5.B
【详解】A.对废旧金属的最好处理方法是回收、再利用,降低提炼成本,A正确;
B.重金属材料填埋将会对环境造成污染,不应该填埋,B错误;
C.废铁屑可以铁盐或亚铁盐,如绿矾;废旧钢铁可以炼钢,C正确;
D.溴化银为感光层的材料,照相业、科研单位和医院X光室回收的定影液中含有银离子,通过置换可以提取金属银,D正确;
答案选B。
6.B
【详解】①稀硫酸和铁粉生成H2,氢气排除了装置中的空气,在滴加氢氧化钠溶液,可以观察到白色沉淀;
②稀硫酸和铁粉生成H2,打开a止水夹,氢气排除了装置中的空气,过一段时间关闭a止水夹,A中生成硫酸亚铁的试管压强增大,将硫酸亚铁压如B试管,可以观察到白色沉淀;
③与空气直接接触,Fe(OH)2迅速被空气氧化成灰绿色最终变成红褐色的Fe(OH)3,不能较长时间观察到Fe(OH)2白色沉淀;
④在硫酸亚铁溶液上面加苯液封,隔绝空气,能较长时间观察到Fe(OH)2白色沉淀;
综上所述,①②④符合题意;
故选B。
7.C
【详解】A.滴入硫氰化钾溶液呈红色,说明含Fe3+,但无法证明Fe2+是否存在,A错误;
B.该操作无法证明通Cl2之前是否存在Fe2+;应该先向溶液中加入硫氰化钾溶液,若不变红,再通入Cl2,溶液变红,即可证明原溶液中存在Fe2+,B错误;
C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀即Fe(OH)3,说明溶液中含有Fe3+,C正确;
D.白色沉淀逐渐变为红褐色,即Fe(OH)2转变为Fe(OH)3,该操作可以证明Fe2+的存在,无法排除Mg2+的存在,D错误。
因此,本题选C。
8.B
【详解】A.在自然界中,铁陨石有游离态的铁存在,A错误;
B.在自然界中,赤铁矿的主要成分是,磁铁矿的主要成分是,B正确;
C.能通过制得,也能通过制得,C错误;
D.不是碱性氧化物,、是碱性氧化物,D错误;
故本题选B。
9.A
【详解】A.生石灰具有吸水性,常用作干燥剂,而不属于抗氧化物质,选项 A符合;
B.亚硫酸钠具有还原性,在反应中S元素的化合价升高,属于抗氧化物质,选项B不符合;
C.还原铁粉具有还原性,在反应中Fe元素的化合价升高,属于抗氧化物质,选项C不符合;
D.硫酸亚铁具有还原性,在反应中Fe元素的化合价升高,属于抗氧化物质,选项D不符合;
答案选A。
10.B
【详解】A.钠的化学性质活泼,实验后剩余的钠粒要放回原试剂瓶中,防止钠在空气中发生危险,故A正确;
B.焰色反应中铂丝用盐酸洗涤,不能用稀硫酸,因为氯化物易挥发,而硫酸盐难挥发,不能达到完全清洗铂丝的目的,故B错误;
C.钠着火会生成过氧化钠,因此不能用水和二氧化碳灭火,可用干燥沙土扑灭,故C正确;
D.很容易被空气中的氧气氧化,因此制备时将胶头滴管伸入溶液液面下再挤出NaOH溶液,避免生成的和氧气接触,故D正确;
答案选B。
11.A
【详解】A.氧化铝和水不反应,所以不能一步生成氢氧化铝,故A错误;
B.Na→NaOH→Na2CO3→NaCl中反应方程式分别为:2Na+2H2O=2NaOH+H2、2NaOH+CO2=Na2CO3+H2O、Na2CO3+CaCl2=CaCO3+2NaCl,所以能一步实现,故B正确;
C.Mg→MgCl2→Mg(OH)2→MgSO4中反应方程式分别为:Mg+2HCl=MgCl2+H2、MgCl2+2NaOH=Mg(OH)2+2NaCl、Mg(OH)2+H2SO4=MgSO4+2H2O,所以能一步实现,故C正确;
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3中反应的方程式分别为:Fe+2HCl=FeCl2+H2、FeCl2+2NaOH=Fe(OH)2+2NaCl、4Fe(OH)2+2O2+2H2O=4Fe(OH)3,所以能一步实现,故D正确;
故选A。
12.C
【详解】A.补铁剂的有效成分为,A错误;
B.侯氏制碱法过滤得到的是碳酸氢钠沉淀,碳酸氢钠受热分解才能制得纯碱,B错误;
C.工业上采用向冷的石灰乳中通入氯气的方法制漂白粉,且其有效成分为次氯酸钙,C正确;
D.不锈钢的合金元素主要是铬和镍,D错误;
故选C。
13.B
【详解】反应2Fe3++2I-=2Fe2++I2中,I-是还原剂,Fe2+是还原产物,则还原性I->Fe2+;反应Br2+2Fe2+=2Br-+2Fe3+中,Fe2+是还原剂,Br-是还原产物,则还原性Fe2+>Br-;从而得出还原性I->Fe2+>Br-,故选B。
14.A
【详解】A.合金是指一种金属与另外一种或几种金属或非金属组成的混合物,一定是混合物,一定含有金属元素,故A正确;
B.合金一般比组成其成分的纯金属硬度高,比纯金属熔点低,镁锂合金的硬度比金属镁的低,故B错误;
C.用“铁与酸”发生置换反应的方法得到的是FeCl2,不是FeCl3,故C错误;
D.未打磨的铝丝放入CuSO4溶液中无现象是因为铝的表面形成了致密的氧化膜,阻止反应,故D错误;
故答案为A
15.AD
【详解】A.淀粉变蓝,说明有碘单质生成,即I-被氧化,表现出氧化性,故A项符合题意;
B.与OH-发生复分解反应生成Fe(OH)3,Fe元素化合价未发生变化,未表现出氧化性,故B项不符合题意;
C.溶液与溶液混合时,Cl-与Ag+发生复分解反应生成AgCl,Fe元素化合价未发生变化,未表现出氧化性,故C项不符合题意;
D.向溶液中加入少量铁粉,铁粉消失,反应离子方程式为2Fe3++Fe=3Fe2+,被还原为Fe2+,表现出氧化性,故D项符合题意;
综上所述,答案为AD。
16.(1) a c d b
(2) 熔点和沸点 801 ℃【详解】(1)①Fe、Zn、Cu等较不活泼金属以C、CO或H2作还原剂还原冶炼,故选a;
②Na、Mg、Al等活泼或较活泼金属电解法电解NaCl、MgCl2等,故选c;
③Hg、Ag等不活泼金属热分解法,例如热分解HgO,故选d;
④V、Cr、Mn、W等高熔点金属利用铝热反应原理,故选b;
(2)要进行反应Na+KCl=NaCl+K,最佳选择是使K作为气体逸出,而其他物质仍然保留在体系中,这样,根据化学平衡,反应可不断正向进行。根据表中数据可知,在801 ℃17.(1)
(2) a 煮沸
(3) abc
(4) 锥形瓶II 除氧剂
【详解】(1)很容易被氧气氧化,先变成灰绿色,最后变成红褐色。发生反应:。
(2)要制得纯净的白色的,必须防止与氧气接触,根据题意,用铁粉和稀硫酸在装置I中反应产生和,可以排除装置内的空气,同时压强增大,将溶液压入锥形瓶II中,与溶液反应,生成,所以装置II盛放的溶液为:a.NaOH;气体在溶液的溶解度随着温度的升高而降低,所以可以通过煮沸的方法,除去蒸馏水中溶解的。
(3)在装置I中铁粉和稀硫酸反应产生和,可以排除装置内的空气,同时压强增大,将溶液压入锥形瓶II中,与溶液反应,生成,故离子方程式为:,氢气的作用选:abc。
(4)在装置I中铁粉和稀硫酸反应产生和,可以排除装置内的空气,同时压强增大,将溶液压入锥形瓶II中,与溶液反应,生成,在锥形瓶II生成;具有强还原,可以用作化工生产中的除氧剂。
18.(1)
(2)高锰酸钾溶液褪色
(3)
(4) 其他条件不变时,FeSO4浓度对Fe(OH)2制备效果的影响 沉淀持续的时间t
【详解】(1)过量铁粉与反应生成,反应的离子方程式为:,故答案为:;
(2)具有强的还原性能将高锰酸钾还原为二价锰离子,因此能观察到高锰酸钾紫色褪去,故答案为:高锰酸钾溶液褪色;
(3)试管c中产生白色沉淀为,在空气中易被氧化成,反应方程式为:,故答案为:;
(4)①实验i、ii、iii中其他条件相同,FeSO4浓度的浓度逐渐增大,因此目的是探究其他条件不变时,FeSO4浓度对Fe(OH)2制备效果的影响,故答案为:其他条件不变时,FeSO4浓度对Fe(OH)2制备效果的影响;
②根据图中信息,其他条件不变时,所用NaOH溶液的浓度越大,沉淀持续的时间越长,说明制备的效果越好,故答案为:沉淀持续的时间t。
19.(1) Fe2O3+2AlAl2O3+2Fe 铝热
(2)①②③④
(3) 为防止溅落物炸裂蒸发皿 引燃剂 助燃剂
【详解】(1)氧化铁和铝粉在高温条件下发生铝热反应生成铁和氧化铝,反应的化学方程式为:Fe2O3+2AlAl2O3+2Fe;该反应为铝热反应,故答案为:Fe2O3+2AlAl2O3+2Fe;铝热;
(2)该反应在高温条件下进行,反应的现象有:镁条剧烈燃烧、放出大量的热,并发出耀眼的光芒,火星四射、纸漏斗的下部被烧穿、有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体,所以①②③④都正确,故答案为:①②③④;
(3)铝热反应中,为了防止溅落物炸裂蒸发皿,需要在蒸发皿中盛放沙;该反应需要在高温下进行,镁条作引燃剂,氯酸钾受热分解放出氧气,在反应中起到助燃剂的作用,使反应产生高温,引发铝热反应,故答案为:为防止溅落物炸裂蒸发皿;引燃剂;助燃剂。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.通过铝热反应能冶炼难熔的金属(如Cr、V、Mn等),与铝热反应无关的是
A.铝具有还原性 B.铝具有导电性
C.铝较Cr、V、Mn等价格便宜 D.铝热反应放出大量的热
2.下列对某些问题的认识正确的是
A.98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49%
B.Na能与水反应,因此不能利用钠的置换反应制备其他金属单质X
C.纯碱属于盐,其水溶液不宜用带玻璃塞的玻璃瓶盛放
D.铝合金、 不锈钢、足球烯(C60)都是重要的金属材料
3.下列物质间的转化不能一步实现的是
A.CaO→Ca(OH)2→CaSO4 B.Fe→FeCl3→Fe(OH)3
C.C→CO→CaCO3 D.Cu→CuO→CuSO4
4.目前工业上冶炼镁通常采用的方法是
A.CO或H2还原法 B.铝热反应法
C.电解法 D.热分解法
5.关于废旧金属处理的下列说法中不正确的是
A.对废旧金属的最好处理方法是回收、再利用
B.重金属对人体有害,对废旧重金属材料的处理方法是填埋
C.废旧钢铁可用于炼钢,废铁屑可用于制铁盐
D.照相业、科研单位和医院X光室回收的定影液中,可以提取金属银
6.下列各图示中能较长时间观察到的是
A.①②③ B.①②④ C.①②③④ D.②③④
7.下列离子的检验方法合理的是
A.向某溶液中滴入硫氰化钾溶液呈红色,说明不含Fe2+
B.向某溶液中通入氯气,然后再加入硫氰化钾溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入氢氧化钠溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明该溶液中只含有Fe2+,不含有Mg2+
8.下列有关铁及其化合物的说法正确的是
A.在自然界中,铁都以化合态形式存在
B.赤铁矿的主要成分是,磁铁矿的主要成分是
C.能通过化合反应制得,但不能通过化合反应制得
D.铁的氧化物能与酸反应生成盐和水,因此、、都是碱性氧化物
9.随着人们生活节奏的加快,方便的包装食品已被广泛接受,为了防止副食品氧化变质,延长食品食品的保质期,在包装袋中常放入抗氧化物质,下列不属于抗氧化物质的是
A.生石灰 B.亚硫酸钠 C.铁粉 D.硫酸亚铁
10.下列实验操作错误的是
A.将实验后剩余的钠粒放回原试剂瓶中
B.焰色反应前将铂丝用稀硫酸清洗并灼烧至火焰与原来颜色相同
C.可用干燥沙土扑灭着火的金属钠
D.制备时将胶头滴管伸入溶液液面下再挤出NaOH溶液
11.金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化不能全部通过一步反应直接完成的是
A.Al→Al2O3→Al(OH)3→AlCl3 B.Na→NaOH→Na2CO3→NaCl
C.Mg→MgCl2→Mg(OH)2→MgSO4 D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
12.化学在生产、生活中起着重要的作用,以下化学用语中正确的是
A.补铁剂通常需要与维C共同使用,是为了增强药品中的效果
B.侯氏制碱法中利用各个物质溶解度的不同,可直接过滤获得纯碱
C.向冷的石灰乳中通入氯气,可制得漂白粉,有效成分为次氯酸钙
D.不锈钢是最常见的一种合金钢,它的合金元素主要是锰和镍
13.根据下列反应:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是
A.Br->I->Fe2+ B.I->Fe2+>Br-
C.Fe2+>I->Br- D.Br->Fe2+>I-
14.金属材料在生产、生活中使用广泛。下列有关金属的说法正确的是
A.合金一定只含有金属元素
B.镁锂合金的硬度比金属镁的高
C.铁与盐酸发生置换反应可制取
D.未打磨的铝丝放入溶液中无明显现象是因铝的活泼性比铜弱
二、多选题
15.下列反应中,表现出氧化性的是
A.溶液使淀粉碘化钾试纸变蓝
B.向溶液中加入NaOH溶液产生红褐色沉淀
C.向溶液中加入溶液产生白色沉淀
D.向溶液中加入少量铁粉,铁粉消失
三、填空题
16.冶炼金属常用以下几种方法:
a.以C、CO或H2作还原剂还原;
b.利用铝热反应原理;
c.电解法;
d.热分解法。
(1)下列金属各采用哪种方法冶炼最佳?
①Fe、Zn、Cu等较不活泼金属_______;
②Na、Mg、Al等活泼或较活泼金属_______;
③Hg、Ag等不活泼金属_______;
④V、Cr、Mn、W等高熔点金属_______。
(2)工业上生产钾不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电解效率。现生产钾是用金属钠和熔化的KCl反应制取。有关数据如下表:
熔点/℃ 沸点/℃ 密度/(g·cm-3)
Na 97.8 883 0.97
K 63.7 774 0.86
NaCl 801 1 413 2.165
KCl 770 1 500 1.984
工业上生产金属钾的化学方程式是:KCl+NaNaCl+K。工业上制金属钾主要运用到上表所列的哪些物理常数?_______;其选择范围是_______。
17.易被空气中的氧气氧化,故制备时主要是避免氧气的介入。某学生利用稀硫酸A、铁粉B和某碱溶液C在实验室设计了如图装置制备白色固体。
(1)写出易被空气中的氧气氧化的方程式_______。
(2)装置II盛放的溶液C是_______(a.NaOH b.);配置该溶液时,为除去蒸馏水中溶解的常采用的方法是_______。
(3)铁粉与稀硫酸制备的离子方程式为_______,的作用有_______(填编号)。
a.驱赶装置内的空气
b.把物质B压入II中
c.保护白色不被空气氧化
(4)白色沉淀在_______(填“锥形瓶I”或“锥形瓶II”)内生成,经在无氧环境中干燥处理,得到的白色粉末是很好的化工_______(填“除酸剂”或“除氧剂”)。
四、实验题
18.某实验小组在实验室进行Fe2+与Fe3+相互转化的实验。
(1)向试管a中加入过量铁粉的离子方程式是___________。
(2)试管b中的实验现象是___________。
(3)试管c中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式___________。
(4)实验小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如下(w表示质量分数):
实验 序号 w(FeSO4)/% w(NaOH)/% t/s
i 2.5 15 149
ii 5 15 138
iii 10 15 99
iv 5 25 142
v 5 35 180
①实验i、ii、iii的目的是___________。
②小组同学通过实验得出结论:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好,推断的证据是___________。
19.如图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5g干燥的氧化铁粉末和2g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:_______,该反应称为_______反应。
(2)选出该实验的实验现象(填写在横线上):_______。
①镁条剧烈燃烧
②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿
④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:_______;镁条:_______;氯酸钾:_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】
【详解】A.根据方程式可知,Al具有还原性,A有关;
B.铝热反应中没有电流产生,不需要导电性,B无关;
C.Cr、V、Mn均具有还原性,但价格较高,故热反应中用铝置换金属,C有关;
D.铝粉激烈氧化,燃烧而放出大量热,D有关;
故答案为:B。
2.C
【详解】A.浓硫酸的密度大于水,故用等体积的水稀释后,溶液的质量小于原溶液的2倍,溶液的质量分数大于原来的一半,故质量分数大于49%,A错误;
B.通常钠不能从盐溶液中置换出金属,若盐为熔融状态,钠可以置换出较不活泼的金属,如钠可以和熔融的四氯化钛反应制取钛,B错误;
C.纯碱属于盐,但是其水解显碱性,可以和玻璃中的二氧化硅反应,故其水溶液不宜用带玻璃塞的玻璃瓶盛放,C正确;
D.铝合金、不锈钢是重要的金属材料,足球烯(C60)属于无机非金属材料,D错误;
故选C。
3.C
【详解】A.CaO与水反应生成氢氧化钙,氢氧化钙与硫酸反应生成硫酸钙,转化均可一步实现,故A正确;
B.Fe与氯气反应生成FeCl3,FeCl3与NaOH反应生成Fe(OH)3,转化均可一步实现,故B正确;
C.CO为不成盐氧化物,则CO→CaCO3不能一步实现,故C错误;
D.Cu与氧气反应生成CuO,CuO与硫酸反应生成硫酸铜,转化均可一步实现,故D正确;
故选:C。
4.C
【详解】金属镁很活泼,因此目前工业上冶炼金属镁采用的是电解熔融的MgCl2来得到金属镁,综上所述故选C。
5.B
【详解】A.对废旧金属的最好处理方法是回收、再利用,降低提炼成本,A正确;
B.重金属材料填埋将会对环境造成污染,不应该填埋,B错误;
C.废铁屑可以铁盐或亚铁盐,如绿矾;废旧钢铁可以炼钢,C正确;
D.溴化银为感光层的材料,照相业、科研单位和医院X光室回收的定影液中含有银离子,通过置换可以提取金属银,D正确;
答案选B。
6.B
【详解】①稀硫酸和铁粉生成H2,氢气排除了装置中的空气,在滴加氢氧化钠溶液,可以观察到白色沉淀;
②稀硫酸和铁粉生成H2,打开a止水夹,氢气排除了装置中的空气,过一段时间关闭a止水夹,A中生成硫酸亚铁的试管压强增大,将硫酸亚铁压如B试管,可以观察到白色沉淀;
③与空气直接接触,Fe(OH)2迅速被空气氧化成灰绿色最终变成红褐色的Fe(OH)3,不能较长时间观察到Fe(OH)2白色沉淀;
④在硫酸亚铁溶液上面加苯液封,隔绝空气,能较长时间观察到Fe(OH)2白色沉淀;
综上所述,①②④符合题意;
故选B。
7.C
【详解】A.滴入硫氰化钾溶液呈红色,说明含Fe3+,但无法证明Fe2+是否存在,A错误;
B.该操作无法证明通Cl2之前是否存在Fe2+;应该先向溶液中加入硫氰化钾溶液,若不变红,再通入Cl2,溶液变红,即可证明原溶液中存在Fe2+,B错误;
C.向某溶液中加入氢氧化钠溶液,得红褐色沉淀即Fe(OH)3,说明溶液中含有Fe3+,C正确;
D.白色沉淀逐渐变为红褐色,即Fe(OH)2转变为Fe(OH)3,该操作可以证明Fe2+的存在,无法排除Mg2+的存在,D错误。
因此,本题选C。
8.B
【详解】A.在自然界中,铁陨石有游离态的铁存在,A错误;
B.在自然界中,赤铁矿的主要成分是,磁铁矿的主要成分是,B正确;
C.能通过制得,也能通过制得,C错误;
D.不是碱性氧化物,、是碱性氧化物,D错误;
故本题选B。
9.A
【详解】A.生石灰具有吸水性,常用作干燥剂,而不属于抗氧化物质,选项 A符合;
B.亚硫酸钠具有还原性,在反应中S元素的化合价升高,属于抗氧化物质,选项B不符合;
C.还原铁粉具有还原性,在反应中Fe元素的化合价升高,属于抗氧化物质,选项C不符合;
D.硫酸亚铁具有还原性,在反应中Fe元素的化合价升高,属于抗氧化物质,选项D不符合;
答案选A。
10.B
【详解】A.钠的化学性质活泼,实验后剩余的钠粒要放回原试剂瓶中,防止钠在空气中发生危险,故A正确;
B.焰色反应中铂丝用盐酸洗涤,不能用稀硫酸,因为氯化物易挥发,而硫酸盐难挥发,不能达到完全清洗铂丝的目的,故B错误;
C.钠着火会生成过氧化钠,因此不能用水和二氧化碳灭火,可用干燥沙土扑灭,故C正确;
D.很容易被空气中的氧气氧化,因此制备时将胶头滴管伸入溶液液面下再挤出NaOH溶液,避免生成的和氧气接触,故D正确;
答案选B。
11.A
【详解】A.氧化铝和水不反应,所以不能一步生成氢氧化铝,故A错误;
B.Na→NaOH→Na2CO3→NaCl中反应方程式分别为:2Na+2H2O=2NaOH+H2、2NaOH+CO2=Na2CO3+H2O、Na2CO3+CaCl2=CaCO3+2NaCl,所以能一步实现,故B正确;
C.Mg→MgCl2→Mg(OH)2→MgSO4中反应方程式分别为:Mg+2HCl=MgCl2+H2、MgCl2+2NaOH=Mg(OH)2+2NaCl、Mg(OH)2+H2SO4=MgSO4+2H2O,所以能一步实现,故C正确;
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3中反应的方程式分别为:Fe+2HCl=FeCl2+H2、FeCl2+2NaOH=Fe(OH)2+2NaCl、4Fe(OH)2+2O2+2H2O=4Fe(OH)3,所以能一步实现,故D正确;
故选A。
12.C
【详解】A.补铁剂的有效成分为,A错误;
B.侯氏制碱法过滤得到的是碳酸氢钠沉淀,碳酸氢钠受热分解才能制得纯碱,B错误;
C.工业上采用向冷的石灰乳中通入氯气的方法制漂白粉,且其有效成分为次氯酸钙,C正确;
D.不锈钢的合金元素主要是铬和镍,D错误;
故选C。
13.B
【详解】反应2Fe3++2I-=2Fe2++I2中,I-是还原剂,Fe2+是还原产物,则还原性I->Fe2+;反应Br2+2Fe2+=2Br-+2Fe3+中,Fe2+是还原剂,Br-是还原产物,则还原性Fe2+>Br-;从而得出还原性I->Fe2+>Br-,故选B。
14.A
【详解】A.合金是指一种金属与另外一种或几种金属或非金属组成的混合物,一定是混合物,一定含有金属元素,故A正确;
B.合金一般比组成其成分的纯金属硬度高,比纯金属熔点低,镁锂合金的硬度比金属镁的低,故B错误;
C.用“铁与酸”发生置换反应的方法得到的是FeCl2,不是FeCl3,故C错误;
D.未打磨的铝丝放入CuSO4溶液中无现象是因为铝的表面形成了致密的氧化膜,阻止反应,故D错误;
故答案为A
15.AD
【详解】A.淀粉变蓝,说明有碘单质生成,即I-被氧化,表现出氧化性,故A项符合题意;
B.与OH-发生复分解反应生成Fe(OH)3,Fe元素化合价未发生变化,未表现出氧化性,故B项不符合题意;
C.溶液与溶液混合时,Cl-与Ag+发生复分解反应生成AgCl,Fe元素化合价未发生变化,未表现出氧化性,故C项不符合题意;
D.向溶液中加入少量铁粉,铁粉消失,反应离子方程式为2Fe3++Fe=3Fe2+,被还原为Fe2+,表现出氧化性,故D项符合题意;
综上所述,答案为AD。
16.(1) a c d b
(2) 熔点和沸点 801 ℃
②Na、Mg、Al等活泼或较活泼金属电解法电解NaCl、MgCl2等,故选c;
③Hg、Ag等不活泼金属热分解法,例如热分解HgO,故选d;
④V、Cr、Mn、W等高熔点金属利用铝热反应原理,故选b;
(2)要进行反应Na+KCl=NaCl+K,最佳选择是使K作为气体逸出,而其他物质仍然保留在体系中,这样,根据化学平衡,反应可不断正向进行。根据表中数据可知,在801 ℃
(2) a 煮沸
(3) abc
(4) 锥形瓶II 除氧剂
【详解】(1)很容易被氧气氧化,先变成灰绿色,最后变成红褐色。发生反应:。
(2)要制得纯净的白色的,必须防止与氧气接触,根据题意,用铁粉和稀硫酸在装置I中反应产生和,可以排除装置内的空气,同时压强增大,将溶液压入锥形瓶II中,与溶液反应,生成,所以装置II盛放的溶液为:a.NaOH;气体在溶液的溶解度随着温度的升高而降低,所以可以通过煮沸的方法,除去蒸馏水中溶解的。
(3)在装置I中铁粉和稀硫酸反应产生和,可以排除装置内的空气,同时压强增大,将溶液压入锥形瓶II中,与溶液反应,生成,故离子方程式为:,氢气的作用选:abc。
(4)在装置I中铁粉和稀硫酸反应产生和,可以排除装置内的空气,同时压强增大,将溶液压入锥形瓶II中,与溶液反应,生成,在锥形瓶II生成;具有强还原,可以用作化工生产中的除氧剂。
18.(1)
(2)高锰酸钾溶液褪色
(3)
(4) 其他条件不变时,FeSO4浓度对Fe(OH)2制备效果的影响 沉淀持续的时间t
【详解】(1)过量铁粉与反应生成,反应的离子方程式为:,故答案为:;
(2)具有强的还原性能将高锰酸钾还原为二价锰离子,因此能观察到高锰酸钾紫色褪去,故答案为:高锰酸钾溶液褪色;
(3)试管c中产生白色沉淀为,在空气中易被氧化成,反应方程式为:,故答案为:;
(4)①实验i、ii、iii中其他条件相同,FeSO4浓度的浓度逐渐增大,因此目的是探究其他条件不变时,FeSO4浓度对Fe(OH)2制备效果的影响,故答案为:其他条件不变时,FeSO4浓度对Fe(OH)2制备效果的影响;
②根据图中信息,其他条件不变时,所用NaOH溶液的浓度越大,沉淀持续的时间越长,说明制备的效果越好,故答案为:沉淀持续的时间t。
19.(1) Fe2O3+2AlAl2O3+2Fe 铝热
(2)①②③④
(3) 为防止溅落物炸裂蒸发皿 引燃剂 助燃剂
【详解】(1)氧化铁和铝粉在高温条件下发生铝热反应生成铁和氧化铝,反应的化学方程式为:Fe2O3+2AlAl2O3+2Fe;该反应为铝热反应,故答案为:Fe2O3+2AlAl2O3+2Fe;铝热;
(2)该反应在高温条件下进行,反应的现象有:镁条剧烈燃烧、放出大量的热,并发出耀眼的光芒,火星四射、纸漏斗的下部被烧穿、有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体,所以①②③④都正确,故答案为:①②③④;
(3)铝热反应中,为了防止溅落物炸裂蒸发皿,需要在蒸发皿中盛放沙;该反应需要在高温下进行,镁条作引燃剂,氯酸钾受热分解放出氧气,在反应中起到助燃剂的作用,使反应产生高温,引发铝热反应,故答案为:为防止溅落物炸裂蒸发皿;引燃剂;助燃剂。
答案第1页,共2页
答案第1页,共2页
