2024年高三高考化学二轮专题复习热点问题:工艺流程(八)(含解析)
文档属性
| 名称 | 2024年高三高考化学二轮专题复习热点问题:工艺流程(八)(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 22:07:45 | ||
图片预览




文档简介
2024年高考化学二轮专题复习热点问题:工艺流程(八)
1.六氟磷酸锂是锂离子电池的关键材料。一种的制备工艺流程如图所示。
已知:①,易发生分解反应;
②熔点为 93.8℃,沸点为 84.6℃。
下列说法错误的是
A.N2环境中,反应先生成六氟磷酸,再分解生成五氟化磷
B.发烟硫酸的作用是吸收铅皿中的水分:
C.工艺流程中,无水HF只是反应物
D.五氟化磷冷却到,保证了与LiF的无水HF在液相中反应生成
2.如图是一种综合处理SO2废气的工艺流程。下列说法正确的是
A.向B溶液中滴加KSCN溶液,溶液可能会变为红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2=2Fe3++2H2O
C.溶液酸性:A>B>C
D.加氧化亚铁可以使溶液C转化为溶液
3.一种从含砷废水[砷主要以亚砷酸形式存在]中回收砷的工艺流程如图所示。
已知:
Ⅰ.;
Ⅱ.;
Ⅲ.砷酸在酸性条件下有氧化性,能将氢硝酸氧化为。
下列说法错误的是
A.“滤渣”为
B.“沉砷”过程中可以用过量的代替
C.用氧气进行氧化脱硫生成单质时发生反应
D.能用氢碘酸、淀粉溶液检验还原后的溶液中是否仍存在砷酸
4.过氧化钙可用于改善地表水质,也可作为水产运输中的缓释供氧剂,实验室模拟工业制过氧化钙的工艺流程如图所示,下列有关说法错误的是
A.“沉淀”过程中反应的化学方程式为
B.“乙醇洗”的目的是除去晶体表面的水分,加快干燥
C.作缓释供氧剂时发生的反应为
D.过氧化钙可用于改善地表水质,利用的是过氧化钙的吸附性
5.工业上以硼镁矿(主要成分为,还含有少量、、、和等)为原料生产硼酸晶体的工艺流程如图所示。
已知:①的溶解度随温度的升高显著增大;
②、、和以氢氧化物的形式完全沉淀时,溶液的分别为3.2、9.7、5.2和12.4。
下列说法错误的是
A.“浸取”时要分批慢慢加入稀硫酸
B.“热过滤”的目的是防止温度降低时从溶液中析出
C.“除杂”时需向“浸出液”中依次加入和溶液,以除去、、等杂质离子
D.“母液”中的溶质主要是硫酸镁
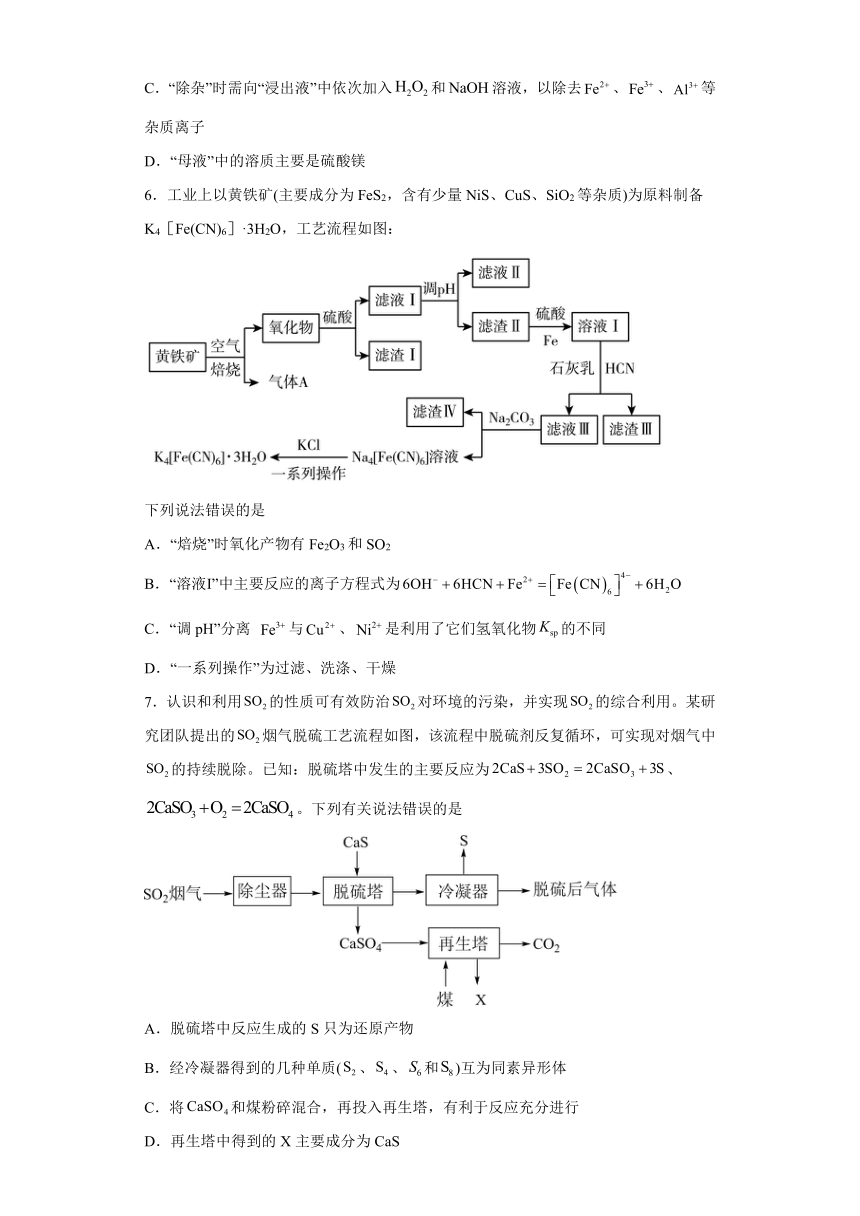
6.工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]·3H2O,工艺流程如图:
下列说法错误的是
A.“焙烧”时氧化产物有Fe2O3和SO2
B.“溶液Ⅰ”中主要反应的离子方程式为
C.“调pH”分离 与、是利用了它们氢氧化物的不同
D.“一系列操作”为过滤、洗涤、干燥
7.认识和利用的性质可有效防治对环境的污染,并实现的综合利用。某研究团队提出的烟气脱硫工艺流程如图,该流程中脱硫剂反复循环,可实现对烟气中的持续脱除。已知:脱硫塔中发生的主要反应为、。下列有关说法错误的是
A.脱硫塔中反应生成的S只为还原产物
B.经冷凝器得到的几种单质(、、和)互为同素异形体
C.将和煤粉碎混合,再投入再生塔,有利于反应充分进行
D.再生塔中得到的X主要成分为CaS
8.以硫铁矿(主要成分是,含少量和)为原料制备磷酸铁的工艺流程如下,可能用到的数据见下表。下列说法错误的是
开始沉淀 2.3 7.6 4.0
沉淀完全 4.1 9.7 5.2
A.滤渣A的主要成分为 B.操作I加入目的是除去过量的硫酸
C.调的范围为5.2~7.6 D.沉淀时,过高或者过低均不利于生成磷酸铁
9.从废弃的锂电池正极材料中回收金属,工艺流程如下。下列说法错误的是
已知:有机溶剂可萃取溶液中的,
A.做氧化剂,浸取温度不宜过高 B.操作I用到的玻璃仪器为分液漏斗、烧杯
C.试剂X为稀 D.电沉积后,可在阴极收集
10.铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝士矿形式存在(主要成分是)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝。主要的工艺流程如图所示:
下列说法错误的是
A.流程中有2次过滤,需要用到的仪器有烧杯、玻璃棒、漏斗
B.酸化②通足量的反应的离子方程式为:
C.受热分解,生成的高熔点物质可用作高温耐火材料
D.灼烧③一般在坩埚中进行,电解④添加冰晶石,目的是增强导电性
11.电镀污泥(含等金属阳离子)对环境污染极大,是典型的危险废弃物。从电镀污泥中提取镍的工艺流程如图所示。已知:丁二酮肟可与反应生成易溶于有机溶剂的配合物:。
下列说法错误的是
A.“氨浸”可除去等金属阳离子
B.“水层1”和“有机层”均可重复使用,且重复利用的目的不同
C.加入盐酸的步骤为反萃取,该过程是物理变化
D.图中“……”操作可能为过滤、洗涤、干燥、灼烧
12.废旧银锌纽扣电池(含、石墨及少量、等)的正极片中回收银的工艺流程如图:
下列说法正确的是
A.①中产生的气体为
B.②中适当增加溶液的浓度有利于提高的回收率
C.⑤中加稀硫酸的目的是反应
D.废旧银锌纽扣电池应采用深埋的方式集中处理
13.从废旧铅蓄电池铅膏(主要含和等,还有少量的盐或氧化物等)中回收铅的工艺流程如下:
下列说法正确的是
A.和溶液反应的离子方程式:
B.的主要作用是作氧化剂,氧化
C.对于离子,其中心原子的杂化方式为
D.电解时,阳极、阴极材料可分别用石墨、铅
14.铍是一种核性能优良的材料,铍精矿的主要成分为铍、铝、硅、铁的氧化物、碳酸钙及部分其他杂质,以铍精矿为原料制备氢氧化铍的工艺流程如图所示:
已知:i.和可通过调节溶液实现分步沉淀;
ii.与具有相似的化学性质。
下列说法正确的是
A.“熔炼”过程中不发生化学变化
B.“氧化”工序中用代替可达到目的且不影响产品纯度
C.“沉淀”工序中需严格控制加入量,以减少溶解损失
D.“氧化”工序的主要反应为
15.铝元素是地壳中含量最多的金属元素(约占地壳总量的 7.73%),主要以铝土矿形式存在(主要成分是Al2O3)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝,主要的工艺流程如图所示:
下列说法正确的
A.碱溶①后,溶液中主要含有的阳离子为 Na+和 Al3+
B.步骤②通入足量 CO2反应的离子方程式为:
C.Al(OH)3受热分解,生成高熔点物质和水,该高熔点物质常用作高温耐火材料
D.灼烧③一般在蒸发皿进行
16.侯氏制碱法保留了索维尔制碱法的优点,改进其缺点,又称联合制碱法,把合成氨工业与制碱工业联合在一起,简化了生产设备,减少了对环境的污染,降低了纯碱的成本,为世界所采用,工艺流程如图所示。下列说法错误的是
A.联合办厂利用了合成氨厂的NH3和副产品CO2,气体1是NH3,气体2是CO2
B.“氨盐水”得到NaHCO3利用了其溶解度随温度变化较大的原理
C.侯氏制碱法中循环利用的物质是CO2和食盐
D.侯氏制碱法改进了索维尔法中的第④步,避免了索维尔法中的副产物氯化钙,而析出NH4Cl,得到化肥,并提高了食盐利用率
17.溴及其化合物在生产中有广泛应用。工业上常用“吹出法”从海水中提溴,工艺流程示意图如图(已知吸收塔中反应:SO2+Br2+2H2O=H2SO4+2HBr)。下列说法正确的是
A.吹出塔中通入空气的主要目的是提供氧化剂
B.在海水提溴的过程中,经过2次Br-→Br2转化后得到的Br2浓度是相同的
C.该工艺流程可体现还原性:SO2>Br->Cl-
D.蒸馏塔中发生反应中,若消耗标准状况下22.4 L的Cl2,则转移电子数为NA
18.钛合金等新型合金广泛应用于航空航天领域,工业上以钛铁矿(,其中Ti为价)为主要原料制备金属钛的工艺流程如下图所示,下列说法正确的是
A.“氯化”过程中,既不是氧化剂也不是还原剂
B.“氯化”过程中,每生成气体,转移电子
C.由制备Ti的过程中,Ar气可换成氮气
D.由制备Ti反应的原子利用率为100%
19.钾长石()是含钾量较高、分布最广、储量最大的非水溶性钾资源,以钾长石为原料制取钾肥的一种工艺流程如下图所示。已知:钾长石中的钾元素和铝元素在作用下转化为和。下列说法正确的是
A.可用“水浸”操作直接提取钾长石中的主要成分
B.“浸渣Ⅰ”可以作为冶炼金属铝的主要原料
C.“碱化Ⅱ”发生的主要反应为
D.流程中只有可循环利用
20.利用废铝箔(主要成分为Al,含少量Mg、Fe等)制明矾的一种工艺流程如下:
铝箔甲溶液乙溶液明矾
下列说法中,不正确的是
A.①中加NaOH溶液,发生反应的离子方程式是
B.操作a是过滤
C.乙溶液中含有的离子是、
D.由④可推测,室温下明矾的溶解度小于和的溶解度
21.工业上将电石渣浆中的转化为,工艺流程如图。
下列说法正确的是
A.过程Ⅰ中,被还原
B.过程Ⅱ中,做氧化剂
C.该流程中发生的反应均为氧化还原反应
D.将10L 480mg/L 转化为,理论上需要 0.3mol
22.侯氏制碱法工艺流程如图所示。
下列说法不正确的是
A.饱和食盐水“吸氨”的目的是使“碳酸化”时产生更多的
B.煅烧时发生反应
C.“盐析”后溶液比“盐析”前溶液大
D.母液Ⅱ与母液Ⅰ所含粒子种类相同,但前者、、的浓度更大
23.以石灰石矿(主要成分为,含少量等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。
已知:固体B中含有及
下列说法不正确的是
A.过程Ⅱ中,溶液浸出而非是因为
B.过程Ⅲ中,反应的离子方程式为
C.过程Ⅱ和过程Ⅲ的操作均应在较高温度下进行
D.整个流程中,“变废为宝、循环利用”的物质是
24.铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝,主要的工艺流程如图所示:
下列说法正确的是
A.碱溶①后,溶液中主要含有的阳离子为和
B.步骤②通入足量反应的离子方程式为:
C.受热分解,生成高熔点物质和水,该高熔点物质常用作高温耐火材料
D.灼烧③一般在坩埚中进行,电解④添加冰晶石(),目的是增强导电性
25.一种利用废旧镀锌铁皮制备磁性纳米粒子的工艺流程如下:
已知:
下列有关说法正确的是
A.“酸溶”时的离子反应为2Fe+6H+=2Fe3++3H2↑
B.“氧化”时发生反应的离子方程式为
C.“氧化”时后的溶液中主要有、、三种阳离子
D.两次加入NaOH溶液时均发生氧化还原反应
参考答案:
1.C
【分析】在铅皿中HF和磷酸发生,不稳定,易发生分解反应生成和HF,发烟硫酸加入,发烟硫酸和水结合,在常温下除杂,再五氟化磷冷却到,加到LiF和无水HF的混合物中反应生成。
【详解】A.N2环境中,根据题中信息,易发生分解反应;则反应先生成六氟磷酸,再分解生成五氟化磷,故A正确;
B.发烟硫酸的作用是吸收铅皿中的水分:,将HF变为无水HF,故B正确;
C.工艺流程中,无水HF不仅只是反应物,在发生分解反应中是产物,故C错误;
D.无水HF在状态下是液态,五氟化磷冷却到,保证了与LiF的无水HF在液相中反应生成,故D正确。
综上所述,答案为C。
2.A
【分析】含二氧化硫的废气通入酸性硫酸铁溶液中发生反应:2Fe3++2H2O+SO2=2Fe2++ +4H+,B溶液中含FeSO4和H2SO4,溶液B转化为溶液C时发生亚铁离子被氧气氧化为三价铁离子的反应,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O。
【详解】A.尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生2Fe3++2H2O+SO2=2Fe2++ SO+4H+,B溶液中存在二价铁离子,如果二氧化硫不足,则溶液B中含有三价铁离子,加入KSCN溶液,溶液变为血红色,故A正确;
B.溶液B中发生的反应是亚铁离子被氧气氧化为三价铁离子的反应:,故B错误;
C.反应过程中溶液的体积不变,溶液A为Fe2(SO4)3溶液,溶液中三价铁离子水解显酸性,溶液B中含H2SO4,显强酸性,溶液C为硫酸铁溶液和硫酸溶液,溶液C是溶液B发生反应4Fe2++O2+4H+=4Fe3++2H2O得到,虽然消耗氢离子但H+未完全消耗,溶液仍呈酸性,溶液的酸性:B>C>A,故C错误;
D.溶液C为硫酸铁溶液和硫酸溶液,加氧化亚铁,氧化亚铁和硫酸反应生成硫酸亚铁溶液,则溶液C为硫酸铁溶液和硫酸亚铁溶液,与溶液A的组成不同,故D错误;
故选:。
3.B
【分析】含砷废水中主要以亚砷酸,加入,生成,还有过量的,将和的混合物加入过量的,发生反应Ⅰ.,滤渣为,滤液Ⅱ为,通过氧化脱硫,得到溶液,酸化后得到,还原得到。
【详解】A.将和的混合物加入过量的,发生反应Ⅰ.,滤渣为,A正确;
B.根据反应Ⅱ.,若用代替,浓度增大,平衡逆向移动,不利于沉砷,B错误;
C.根据氧化还原反应规律,用氧气进行氧化脱硫生成单质时发生反应,C正确;
D.已知信息Ⅲ.砷酸在酸性条件下有氧化性,能将氢硝酸氧化为,遇淀粉变蓝色,能用氢碘酸、淀粉溶液检验还原后的溶液中是否仍存在砷酸,D正确;
故选B。
4.D
【详解】A.由题图可知,“沉淀”过程中发生反应的反应物有、和,产物有,则反应的化学方程式为,A正确;
B.乙醇能与水互溶且易挥发,故“乙醇洗”的目的是除去晶体表面的水分,加快干燥,B正确;
C.中含有,可发生歧化反应释放出氧气,反应的化学方程式为,C正确;
D.过氧化钙中含有,有强氧化性,能杀菌消毒,改善水质,D错误;
故选D。
5.C
【分析】硼镁矿加入稀硫酸浸取,二氧化硅不反应、碳酸钙转化为微溶的硫酸钙成为滤渣,镁、铁、铝、硼进入浸出液,通过除杂将铁、铝转化为沉淀,由于的溶解度随温度的升高显著增大,故滤液降温结晶析出硼酸晶体,母液中含有硫酸镁;
【详解】A.“浸取”时,因硼镁矿粉中含有少量,加入稀硫酸会产生大量泡沫,为避免反应物从反应器中溢出,应分批慢慢加入稀硫酸,A正确;
B.的溶解度随温度的升高显著增大,“热过滤”的目的是防止温度降低时从溶液中析出,B正确;
C.“除杂”时需向“浸出液”中依次加入将亚铁离子转化为铁离子、加入氧化镁调节pH,以除去、、等杂质离子;若使用氢氧化钠会引入杂质离子钠离子,C错误;
D.由分析可知,“母液”中的溶质主要是硫酸镁,D正确;
故选C。
6.B
【分析】以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6] 3H2O,黄铁矿在空气中焙烧,FeS2、NiS、CuS反应后生成Fe2O3、NiO、CuO和SO2,气体A为SO2,氧化物中加入稀硫酸得到CuSO4、NiSO4、Fe2(SO4)3,SiO2不溶于稀硫酸,所以滤渣I为SiO2,滤液I中含有CuSO4、NiSO4、Fe2(SO4)3和硫酸,调节溶液的pH并过滤得到滤液II,滤渣II中加入Fe、稀硫酸得到溶液I,根据最终得到的物质元素知,滤渣II中含有Fe(OH)3,滤液II中含有CuSO4、NiSO4,向滤渣II中加入稀硫酸、Fe发生反应2Fe(OH)3+Fe+3H2SO4=3FeSO4+6H2O,向溶液I中加入石灰乳、HCN得到Ca2[Fe(CN)6],滤渣III为过量的Fe,向滤液中加入Na2CO3得到滤渣IV为CaCO3,滤液为Na4[Fe(CN)6],向滤液中加入KCl通过一系列操作得到K4[Fe(CN)6] 3H2O;
【详解】A.FeS2、NiS、CuS反应后生成Fe2O3、NiO、CuO和SO2,则焙烧时氧化产物有Fe2O3和SO2,故A正确;
B.石灰乳写化学式,“溶液Ⅰ”中反应的离子方程式为3Ca(OH)2+6HCN+Fe2+═[Fe(CN)6]4-+6H2O+3Ca2+,故B错误;
C.调节pH值时,部分金属阳离子转化为氢氧化物沉淀,所以“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同,故C正确;
D.从溶液中获取晶体采用过滤、洗涤、干燥的方法,所以“一系列操作”为过滤、洗涤、干燥,故D正确;
故选:B。
7.A
【分析】SO2烟气通过除尘器除尘后与CaS在脱硫塔发生、生成和气态的S单质,和煤在再生塔反应生成CO2和X(CaS),气态的S单质随气体进入冷凝器冷凝后得到S单质和脱硫后气体。
【详解】A.脱硫塔中生成S的反应为,根据得失电子守恒可知2molCaS被氧化为2molS,1molSO2被还原为1molS,故S既是氧化产物又是还原产物,A错误;
B.几种单质(、、和)均是由同种元素组成的单质,互为同素异形体,B正确;
C.和煤在再生塔反应生成CO2和X(CaS),将和煤粉碎混合,再投入再生塔,增大了反应物的接触面积,有利于反应充分进行,C正确;
D.X主要成分为CaS,D正确;
答案选A。
8.B
【分析】以硫铁矿主要成分是,含少量、和通入空气后被氧气氧化生成二氧化硫,铁元素被氧化为三价铁,在酸浸后二氧化硅不反应到滤渣A中,三氧化铝和氧化铁与硫酸反应,生成硫酸铝和硫酸铁,在还原时硫化亚铁加入后将三价铁还原为二价铁,在除铝过程中加入碳酸铁调节pH值将铝元素转化为氢氧化铝沉淀,在氧化过程中双氧水将二价铁氧化为三价铁,在沉铁过程中将三价铁转化为磷酸铁;
【详解】A.根据分析,酸浸后二氧化硅不反应到,滤渣A的主要成分为,故A正确;
B.根据分析,操作I加入目的是将三价铁还原为二价铁,故B错误;
C.用调节pH根据除去氢氧化铝,故pH调节大于5.2,而不能将二价铁沉淀,故pH小于7.6,故pH为5.2~7.6,故C正确;
D.沉淀时,过高会使Fe3+生成Fe(OH)3,过低无法生成磷酸铁沉淀,D正确;
故选B。
9.A
【分析】正极材料加入过氧化氢、稀硫酸浸取后得到溶液中含有,加入萃取就萃取分离出有机相,在加入稀硫酸反萃取得到CoSO4的水相,电沉积得到钴。
【详解】A.浸取过程中得到溶液中的,则钴发生还原反应,需要还原剂,反应中不做氧化剂,A错误;
B.操作I为分离有机相和水相的操作,为萃取分液,用到的玻璃仪器为分液漏斗、烧杯,B正确;
C.,加入酸平衡会逆向移动生成,操作加入X后得到CoSO4,试剂X为稀,C正确;
D.CoSO4电解发生还原反应生成Co,是在阴极反应,故电沉积后,可在阴极收集,D正确;
故选A。
10.D
【分析】氧化铝和氢氧化钠溶液反应生成偏铝酸钠溶液,通入二氧化碳气体生成氢氧化铝沉淀,灼烧生成氧化铝,电解得到铝单质。
【详解】A.过滤需要用到的仪器有烧杯、玻璃棒、漏斗,A正确;
B.酸化②通足量的CO2应生成氢氧化铝沉淀和碳酸氢根,离子方程式为:,B正确;
C.Al(OH)3受热分解,生成高熔点的Al2O3和水,Al2O3常用作高温耐火材料,C正确;
D.灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6),目的是降低Al2O3熔融温度,D错误;
故选D。
11.C
【分析】电镀污泥加碳酸铵和氨水进行氨浸,钙离子与碳酸根离子反应生成CaCO3,同时氨水可以使溶液pH增大,促进Fe3+、Al3+的水解,转化为Fe(OH)3、Al(OH)3,浸出渣主要成分为CaCO3、Fe(OH)3、Al(OH)3,得到的浸出液加有机物丁二酮肟和氯仿萃取镍,镍进入氯仿层,在氯仿层中加HCl反萃取得到含镍离子的溶液和有机萃取剂,有机萃取剂重复使用,充分利用萃取剂,含镍离子的溶液进行过滤、洗涤、干燥、灼烧、还原得到粗镍。
【详解】A.根据分析,氨浸后Ca2+、Fe3+、Al3+转化为CaCO3、Fe(OH)3、Al(OH)3而被除去,A正确;
B.根据分析,“水层1”和“有机层”均可重复使用,但前者是为了提高Ni的萃取率,后者是为了充分利用萃取剂,目的不相同,B正确;
C.加入盐酸进行反萃取,HCl可以解除丁二酮肟与Ni2+的配位键,为化学变化,C错误;
D.根据分析,水层经过滤、洗涤、干燥、灼烧、还原得到粗镍,D正确;
故选C。
12.B
【分析】电池中含Zn、Ag、石墨及Hg、Mn等,由流程可知,加稀硝酸后,石墨不反应,Zn、Ag、Hg、Mn和硝酸反应生成硝酸锌,硝酸银,硝酸汞,硝酸锰,再加氯化钠溶液会发生Ag++Cl-=AgCl↓,在含AgCl的滤渣中加入氨水会发反应生成,在银氨络合物中加入Zn生成银,过量的锌可以溶解于稀硫酸溶液中,以此来解答。
【详解】A.金属和硝酸反应生成氮氧化物,不是氢气,故A错误;
B.③的离子方程式为AgCl+2NH3 H2O=+Cl-+2H2O,因此②中适当增加溶液的浓度有利于提高的回收率,故B正确;
C.锌可以溶解于稀硫酸溶液中,故⑤中加稀硫酸的目的是除去银粉中的锌,转化为Zn2+,故C错误;
D.废旧电池中含有重金属离子,污染环境,所以废旧银锌纽扣电池不应采用深埋的方式集中处理,故D错误;
故选B。
13.D
【详解】A.与溶液反应生成更难溶的,转化后生成的碳酸铅可由酸浸进入溶液中,转化反应的离子方程式:,A错误;
B.第一步“溶浸”中中元素的化合价降低,做氧化剂,做还原剂,B错误;
C.对于,其中心原子的价层电子对数为4,杂化方式为,故C错误;
D.电解四氟合硼酸铅溶液时,石墨是电解池的阳极,铅是阴极,铅离子在阴极得到电子发生还原反应生成铅,故D正确;
故选D。
14.B
【分析】根据图示,“熔炼”过程中二氧化硅与碳酸钙生成硅酸钙和二氧化碳,加酸后,生成铍离子、铝离子、铁离子或亚铁离子,加入双氧水后亚铁离子生成铁离子,加入氨水,使铝离子和铍离子生成沉淀;
【详解】A .“熔炼”过程中发生反应,A错误;
B.最终为沉淀,故加入可氧化且不影响产品纯度,B正确;
C.为两性氢氧化物,溶于强酸强碱,不溶于弱碱,C错误;
D.“氧化”工序的主要反应为,D错误;
故答案为:B。
15.C
【详解】A.氧化铝和氢氧化钠反应生成偏铝酸钠,碱溶①后,溶液中主要含有的阳离子为 Na+,故A错误;
B.步骤②通入足量 CO2,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:,故B错误;
C.Al(OH)3受热生成氧化铝和水,氧化铝熔点高,常用作高温耐火材料,故C正确;
D.灼烧③一般在坩埚中进行,故D错误;
选C。
16.B
【详解】A.联合办厂利用了合成氨厂的NH3和副产品CO2,气体1是NH3,得到氨盐水,则气体2是CO2,再通入CO2反应析出碳酸氢钠固体,A正确;
B.“氨盐水”得到NaHCO3利用了其溶解度在混合溶液中较小的原理,B错误;
C.根据图示,碳酸氢钠加热分解生成CO2,最后过滤后得到有饱和食盐水,可知侯氏制碱法中循环利用的物质是CO2和食盐,C正确;
D.侯氏制碱法改进了索维尔法中的第④步,避免了索维尔法中的副产物氯化钙,而析出NH4Cl,可得到化肥,并提高了食盐利用率,D正确;
故选B。
17.C
【分析】由流程可知:酸化的海水中通入氯气发生Cl2+2Br- = Br2+2C1-,吹出塔中通入热空气吹出溴单质,在吸收塔中用二氧化硫和水吸收发生SO2+Br2+2H2O=2HBr+H2SO4,再通入氯气和水蒸气,发生Cl2+2Br- = Br2+2C1-,达到富集溴的目的,冷凝精馏分离出产品溴,以此来解答。
【详解】A.吹出塔中通入空气的主要目的是将Cl2还原Br-产生的Br2吹出,A错误;
B.海水中溴离子浓度较低,经过经氧化、吹出、吸收后,可实现溴的富集,经过2次Br - →Br2转化后得到的Br2的浓度是不相同的,B错误;
C.在吹出塔中发生反应:Cl2+2Br-=2Cl-+Br2,可知还原性:Br->Cl-;在吸收塔中发生Br2+SO2+2H2O=H2SO4+2HBr,SO2作还原剂,HBr是还原产物,可知还原性:SO2>Br-,故物质微粒的还原性:SO2>Br->Cl-,C正确;
D.在蒸馏塔中发生反应:Cl2+2Br-=2Cl-+Br2,若消耗标准状况下22.4 L的Cl2,其物质的量是1 mol,则转移电子数为2NA,D错误;
故合理选项是C。
18.B
【分析】氯化发生的反应为:2FeTiO3+7Cl2+6C2FeCl3+2TiCl4+6CO,得到TiCl4,然后镁和四氯化钛反应生成钛和氯化镁,化学方程式为TiCl4 + 2MgTi+2MgCl2。
【详解】A.“氯化”过程中,中Fe由+2价变为+3价,是还原剂,A错误;
B.反应2FeTiO3+7Cl2+6C2FeCl3+2TiCl4+6CO中,每生成6molCO,转移14mol电子,生成气体,转移电子×14mol=0.7mol,B正确;
C.高温下Ti与N2反应,由制备Ti的过程中,Ar气不可换成氮气,C错误;
D.由制备Ti反应为TiCl4 + 2MgTi+2MgCl2,属于置换反应,原子利用率不是100%,D错误;
故选B。
19.C
【分析】依题意,煅烧后钾元素、铝元素转化为NaAlO2、KAlO2、硅元素转化为CaSiO3。水浸过滤后,滤液中主要含有NaAlO2、KAlO2、Na2CO3等,通入过量CO2,生成Al(OH)3沉淀和NaHCO3、KHCO3,加入NaOH溶液碱化时,NaHCO3转化为Na2CO3并结晶析出、KHCO3转化为K2CO3,过滤分离可得K2CO3溶液。
【详解】A.钾长石是非水溶性钾资源,不能用“水浸”操作直接提取其中的主要成分,A错误;
B.“浸渣Ⅰ”主要含有CaCO3和CaSiO3,不能冶炼金属铝,B错误;
C.加入NaOH溶液碱化时,NaHCO3、KHCO3分别转化为Na2CO3、K2CO3,反应的离子方程式为:,C正确;
D.流程中除CO2可以循环利用外,还有Na2CO3也可以循环利用,D错误;
故选C。
20.C
【分析】Al有两性,能与NaOH溶液反应生成NaAlO2溶于水,而Mg、Fe不反应,以单质固体形式除去,则操作a是过滤,再加稀硫酸调节pH析出Al(OH)3沉淀,过滤固体,继续向纯固体中加入过量稀硫酸得到Al2(SO4)3和硫酸的混合溶液,最后加饱和K2SO4溶液结晶得到溶解度更小的明矾。
【详解】A.Al能与强碱反应,离子方程式是,A正确;
B.Mg、Fe不与NaOH反应,则操作是过滤,以除去难溶于溶液的杂质,B正确;
C.乙溶液中含有的离子是H+、、,C错误;
D.④是根据溶解度差异来制取明矾,即室温下明矾的溶解度小于和的溶解度,D正确;
故选C。
21.D
【分析】由流程可知,CaO与硫酸锰反应生成,通入氧气生成,涉及反应为2+O2+4OH =2+4H2O,与S2 反应生成,进而与氧气反应生成,可用于制备CaSO4 2H2O,以此解答该题。
【详解】A.过程Ⅰ中,通入氧气生成;被氧化,故A错误;
B.过程Ⅱ中,与S2 反应生成,说氧化产物,故B错误;
C.该流程中,CaO与硫酸锰反应生成不涉及化合价的变化,不属于氧化还原反应,故C错误;
D.10L 480mg/L 含有,根据得失电子守恒可知:0.10mol×8=n(O2)×4,n(O2)=0.3mol,故D正确;
故答案选D。
【点睛】本题考查物质的制备实验,为高频考点,把握制备流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大。
22.D
【详解】A.氨气极易溶于水使溶液显碱性,饱和食盐水“吸氨”的目的是可以吸收更多二氧化碳,使“碳酸化”时产生更多的,故A正确;
B.碳酸氢钠受热分解为碳酸钠、水、二氧化碳,故B正确;
C.铵根离子水解生成氢离子,溶液显酸性;加入氯化钠“盐析”后溶液中铵根离子浓度减小,溶液酸性减弱,故比“盐析”前溶液大,故C正确;
D.母液Ⅱ为加入氯化钠晶体,析出氯化铵后得到的;与母液Ⅰ所含粒子种类相同,但母液Ⅱ中碳酸氢根离子的浓度没有变的更大,故D错误;
故选D。
23.C
【分析】煅烧石灰石矿(主要成分为,含少量等),、分解分别生成CaO和MgO ,并放出CO2,煅烧后固体 CaO、MgO,加氯化铵浸取,溶解CaO,得到含氯化钙和 的滤液A,过滤,固体B中含有及,滤液A中通CO2,,生成沉淀CaCO3。
【详解】A.过程Ⅱ中,溶液浸出而非,因为,A正确;
B.过程Ⅲ中,CO2和氯化钙和反应生成CaCO3,的离子方程式为,B正确;
C.过程Ⅱ的反应物氯化铵受热易分解,过程Ⅲ中受热易分解、易挥发,不能在较高温度下进行,C错误;
D.过程Ⅰ产生的是过程Ⅲ的反应物,过程Ⅲ中的生成物是过程Ⅱ的反应物,所以可循环利用,D正确;
故答案选C。
24.C
【分析】氧化铝和氢氧化钠溶液反应生成偏铝酸钠溶液,通入二氧化碳气体生成氢氧化铝沉淀,灼烧生成氧化铝,电解得到铝单质。
【详解】A.碱溶①后,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,溶液中主要含有的阳离子为Na+,A错误;
B.酸化②通足量的CO2应生成氢氧化铝沉淀和碳酸氢根,离子方程式为AlO+CO2+2H2O=Al(OH)3↓+HCO,B错误;
C.Al(OH)3受热分解,2Al(OH)3Al2O3+3H2O,生成高熔点的Al2O3和水,Al2O3常用作高温耐火材料,C正确;
D.灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6),目的是降低Al2O3熔融温度,D错误;
故选C。
25.B
【分析】根据试题已知信息,废旧镀锌铁皮“碱洗”除去Zn和油脂,“酸溶”的反应为,“氧化”时根据 中和物质的量比为1:2,应部分氧化为,加氢氧化钠溶液“加热沉铁”时会生成 和,通氮气作保护气以免被空气氧化成,否则会影响产品的纯度, 和失水分离形成,据此分析解题。
【详解】A.加稀硫酸“酸溶”的反应为,改为浓硫酸会在常温下使铁钝化而影响酸溶反应,故A错误;
B.酸性下, 作氧化剂,作还原剂,反应的离子方程式为 ,故B正确;
C.因中和物质的量比为1:2,只能部分氧化为,所以氧化后的溶液还含有,故C错误;
D.第一次加入氢氧化钠溶液发生氧化还原反应为 ,第二次加入氢氧化钠溶液是离子互换反应使和产生 和沉淀,故D错误;
答案选B。
1.六氟磷酸锂是锂离子电池的关键材料。一种的制备工艺流程如图所示。
已知:①,易发生分解反应;
②熔点为 93.8℃,沸点为 84.6℃。
下列说法错误的是
A.N2环境中,反应先生成六氟磷酸,再分解生成五氟化磷
B.发烟硫酸的作用是吸收铅皿中的水分:
C.工艺流程中,无水HF只是反应物
D.五氟化磷冷却到,保证了与LiF的无水HF在液相中反应生成
2.如图是一种综合处理SO2废气的工艺流程。下列说法正确的是
A.向B溶液中滴加KSCN溶液,溶液可能会变为红色
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2=2Fe3++2H2O
C.溶液酸性:A>B>C
D.加氧化亚铁可以使溶液C转化为溶液
3.一种从含砷废水[砷主要以亚砷酸形式存在]中回收砷的工艺流程如图所示。
已知:
Ⅰ.;
Ⅱ.;
Ⅲ.砷酸在酸性条件下有氧化性,能将氢硝酸氧化为。
下列说法错误的是
A.“滤渣”为
B.“沉砷”过程中可以用过量的代替
C.用氧气进行氧化脱硫生成单质时发生反应
D.能用氢碘酸、淀粉溶液检验还原后的溶液中是否仍存在砷酸
4.过氧化钙可用于改善地表水质,也可作为水产运输中的缓释供氧剂,实验室模拟工业制过氧化钙的工艺流程如图所示,下列有关说法错误的是
A.“沉淀”过程中反应的化学方程式为
B.“乙醇洗”的目的是除去晶体表面的水分,加快干燥
C.作缓释供氧剂时发生的反应为
D.过氧化钙可用于改善地表水质,利用的是过氧化钙的吸附性
5.工业上以硼镁矿(主要成分为,还含有少量、、、和等)为原料生产硼酸晶体的工艺流程如图所示。
已知:①的溶解度随温度的升高显著增大;
②、、和以氢氧化物的形式完全沉淀时,溶液的分别为3.2、9.7、5.2和12.4。
下列说法错误的是
A.“浸取”时要分批慢慢加入稀硫酸
B.“热过滤”的目的是防止温度降低时从溶液中析出
C.“除杂”时需向“浸出液”中依次加入和溶液,以除去、、等杂质离子
D.“母液”中的溶质主要是硫酸镁
6.工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]·3H2O,工艺流程如图:
下列说法错误的是
A.“焙烧”时氧化产物有Fe2O3和SO2
B.“溶液Ⅰ”中主要反应的离子方程式为
C.“调pH”分离 与、是利用了它们氢氧化物的不同
D.“一系列操作”为过滤、洗涤、干燥
7.认识和利用的性质可有效防治对环境的污染,并实现的综合利用。某研究团队提出的烟气脱硫工艺流程如图,该流程中脱硫剂反复循环,可实现对烟气中的持续脱除。已知:脱硫塔中发生的主要反应为、。下列有关说法错误的是
A.脱硫塔中反应生成的S只为还原产物
B.经冷凝器得到的几种单质(、、和)互为同素异形体
C.将和煤粉碎混合,再投入再生塔,有利于反应充分进行
D.再生塔中得到的X主要成分为CaS
8.以硫铁矿(主要成分是,含少量和)为原料制备磷酸铁的工艺流程如下,可能用到的数据见下表。下列说法错误的是
开始沉淀 2.3 7.6 4.0
沉淀完全 4.1 9.7 5.2
A.滤渣A的主要成分为 B.操作I加入目的是除去过量的硫酸
C.调的范围为5.2~7.6 D.沉淀时,过高或者过低均不利于生成磷酸铁
9.从废弃的锂电池正极材料中回收金属,工艺流程如下。下列说法错误的是
已知:有机溶剂可萃取溶液中的,
A.做氧化剂,浸取温度不宜过高 B.操作I用到的玻璃仪器为分液漏斗、烧杯
C.试剂X为稀 D.电沉积后,可在阴极收集
10.铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝士矿形式存在(主要成分是)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝。主要的工艺流程如图所示:
下列说法错误的是
A.流程中有2次过滤,需要用到的仪器有烧杯、玻璃棒、漏斗
B.酸化②通足量的反应的离子方程式为:
C.受热分解,生成的高熔点物质可用作高温耐火材料
D.灼烧③一般在坩埚中进行,电解④添加冰晶石,目的是增强导电性
11.电镀污泥(含等金属阳离子)对环境污染极大,是典型的危险废弃物。从电镀污泥中提取镍的工艺流程如图所示。已知:丁二酮肟可与反应生成易溶于有机溶剂的配合物:。
下列说法错误的是
A.“氨浸”可除去等金属阳离子
B.“水层1”和“有机层”均可重复使用,且重复利用的目的不同
C.加入盐酸的步骤为反萃取,该过程是物理变化
D.图中“……”操作可能为过滤、洗涤、干燥、灼烧
12.废旧银锌纽扣电池(含、石墨及少量、等)的正极片中回收银的工艺流程如图:
下列说法正确的是
A.①中产生的气体为
B.②中适当增加溶液的浓度有利于提高的回收率
C.⑤中加稀硫酸的目的是反应
D.废旧银锌纽扣电池应采用深埋的方式集中处理
13.从废旧铅蓄电池铅膏(主要含和等,还有少量的盐或氧化物等)中回收铅的工艺流程如下:
下列说法正确的是
A.和溶液反应的离子方程式:
B.的主要作用是作氧化剂,氧化
C.对于离子,其中心原子的杂化方式为
D.电解时,阳极、阴极材料可分别用石墨、铅
14.铍是一种核性能优良的材料,铍精矿的主要成分为铍、铝、硅、铁的氧化物、碳酸钙及部分其他杂质,以铍精矿为原料制备氢氧化铍的工艺流程如图所示:
已知:i.和可通过调节溶液实现分步沉淀;
ii.与具有相似的化学性质。
下列说法正确的是
A.“熔炼”过程中不发生化学变化
B.“氧化”工序中用代替可达到目的且不影响产品纯度
C.“沉淀”工序中需严格控制加入量,以减少溶解损失
D.“氧化”工序的主要反应为
15.铝元素是地壳中含量最多的金属元素(约占地壳总量的 7.73%),主要以铝土矿形式存在(主要成分是Al2O3)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝,主要的工艺流程如图所示:
下列说法正确的
A.碱溶①后,溶液中主要含有的阳离子为 Na+和 Al3+
B.步骤②通入足量 CO2反应的离子方程式为:
C.Al(OH)3受热分解,生成高熔点物质和水,该高熔点物质常用作高温耐火材料
D.灼烧③一般在蒸发皿进行
16.侯氏制碱法保留了索维尔制碱法的优点,改进其缺点,又称联合制碱法,把合成氨工业与制碱工业联合在一起,简化了生产设备,减少了对环境的污染,降低了纯碱的成本,为世界所采用,工艺流程如图所示。下列说法错误的是
A.联合办厂利用了合成氨厂的NH3和副产品CO2,气体1是NH3,气体2是CO2
B.“氨盐水”得到NaHCO3利用了其溶解度随温度变化较大的原理
C.侯氏制碱法中循环利用的物质是CO2和食盐
D.侯氏制碱法改进了索维尔法中的第④步,避免了索维尔法中的副产物氯化钙,而析出NH4Cl,得到化肥,并提高了食盐利用率
17.溴及其化合物在生产中有广泛应用。工业上常用“吹出法”从海水中提溴,工艺流程示意图如图(已知吸收塔中反应:SO2+Br2+2H2O=H2SO4+2HBr)。下列说法正确的是
A.吹出塔中通入空气的主要目的是提供氧化剂
B.在海水提溴的过程中,经过2次Br-→Br2转化后得到的Br2浓度是相同的
C.该工艺流程可体现还原性:SO2>Br->Cl-
D.蒸馏塔中发生反应中,若消耗标准状况下22.4 L的Cl2,则转移电子数为NA
18.钛合金等新型合金广泛应用于航空航天领域,工业上以钛铁矿(,其中Ti为价)为主要原料制备金属钛的工艺流程如下图所示,下列说法正确的是
A.“氯化”过程中,既不是氧化剂也不是还原剂
B.“氯化”过程中,每生成气体,转移电子
C.由制备Ti的过程中,Ar气可换成氮气
D.由制备Ti反应的原子利用率为100%
19.钾长石()是含钾量较高、分布最广、储量最大的非水溶性钾资源,以钾长石为原料制取钾肥的一种工艺流程如下图所示。已知:钾长石中的钾元素和铝元素在作用下转化为和。下列说法正确的是
A.可用“水浸”操作直接提取钾长石中的主要成分
B.“浸渣Ⅰ”可以作为冶炼金属铝的主要原料
C.“碱化Ⅱ”发生的主要反应为
D.流程中只有可循环利用
20.利用废铝箔(主要成分为Al,含少量Mg、Fe等)制明矾的一种工艺流程如下:
铝箔甲溶液乙溶液明矾
下列说法中,不正确的是
A.①中加NaOH溶液,发生反应的离子方程式是
B.操作a是过滤
C.乙溶液中含有的离子是、
D.由④可推测,室温下明矾的溶解度小于和的溶解度
21.工业上将电石渣浆中的转化为,工艺流程如图。
下列说法正确的是
A.过程Ⅰ中,被还原
B.过程Ⅱ中,做氧化剂
C.该流程中发生的反应均为氧化还原反应
D.将10L 480mg/L 转化为,理论上需要 0.3mol
22.侯氏制碱法工艺流程如图所示。
下列说法不正确的是
A.饱和食盐水“吸氨”的目的是使“碳酸化”时产生更多的
B.煅烧时发生反应
C.“盐析”后溶液比“盐析”前溶液大
D.母液Ⅱ与母液Ⅰ所含粒子种类相同,但前者、、的浓度更大
23.以石灰石矿(主要成分为,含少量等)为原料制备高纯轻质碳酸钙的一种工艺流程如下。
已知:固体B中含有及
下列说法不正确的是
A.过程Ⅱ中,溶液浸出而非是因为
B.过程Ⅲ中,反应的离子方程式为
C.过程Ⅱ和过程Ⅲ的操作均应在较高温度下进行
D.整个流程中,“变废为宝、循环利用”的物质是
24.铝元素是地壳中含量最多的金属元素(约占地壳总量的7.73%),主要以铝土矿形式存在(主要成分是)。要从铝土矿中提取铝,首先要获得纯度较高的氧化铝,主要的工艺流程如图所示:
下列说法正确的是
A.碱溶①后,溶液中主要含有的阳离子为和
B.步骤②通入足量反应的离子方程式为:
C.受热分解,生成高熔点物质和水,该高熔点物质常用作高温耐火材料
D.灼烧③一般在坩埚中进行,电解④添加冰晶石(),目的是增强导电性
25.一种利用废旧镀锌铁皮制备磁性纳米粒子的工艺流程如下:
已知:
下列有关说法正确的是
A.“酸溶”时的离子反应为2Fe+6H+=2Fe3++3H2↑
B.“氧化”时发生反应的离子方程式为
C.“氧化”时后的溶液中主要有、、三种阳离子
D.两次加入NaOH溶液时均发生氧化还原反应
参考答案:
1.C
【分析】在铅皿中HF和磷酸发生,不稳定,易发生分解反应生成和HF,发烟硫酸加入,发烟硫酸和水结合,在常温下除杂,再五氟化磷冷却到,加到LiF和无水HF的混合物中反应生成。
【详解】A.N2环境中,根据题中信息,易发生分解反应;则反应先生成六氟磷酸,再分解生成五氟化磷,故A正确;
B.发烟硫酸的作用是吸收铅皿中的水分:,将HF变为无水HF,故B正确;
C.工艺流程中,无水HF不仅只是反应物,在发生分解反应中是产物,故C错误;
D.无水HF在状态下是液态,五氟化磷冷却到,保证了与LiF的无水HF在液相中反应生成,故D正确。
综上所述,答案为C。
2.A
【分析】含二氧化硫的废气通入酸性硫酸铁溶液中发生反应:2Fe3++2H2O+SO2=2Fe2++ +4H+,B溶液中含FeSO4和H2SO4,溶液B转化为溶液C时发生亚铁离子被氧气氧化为三价铁离子的反应,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O。
【详解】A.尾气中的二氧化硫气体,通入酸性硫酸铁溶液中发生2Fe3++2H2O+SO2=2Fe2++ SO+4H+,B溶液中存在二价铁离子,如果二氧化硫不足,则溶液B中含有三价铁离子,加入KSCN溶液,溶液变为血红色,故A正确;
B.溶液B中发生的反应是亚铁离子被氧气氧化为三价铁离子的反应:,故B错误;
C.反应过程中溶液的体积不变,溶液A为Fe2(SO4)3溶液,溶液中三价铁离子水解显酸性,溶液B中含H2SO4,显强酸性,溶液C为硫酸铁溶液和硫酸溶液,溶液C是溶液B发生反应4Fe2++O2+4H+=4Fe3++2H2O得到,虽然消耗氢离子但H+未完全消耗,溶液仍呈酸性,溶液的酸性:B>C>A,故C错误;
D.溶液C为硫酸铁溶液和硫酸溶液,加氧化亚铁,氧化亚铁和硫酸反应生成硫酸亚铁溶液,则溶液C为硫酸铁溶液和硫酸亚铁溶液,与溶液A的组成不同,故D错误;
故选:。
3.B
【分析】含砷废水中主要以亚砷酸,加入,生成,还有过量的,将和的混合物加入过量的,发生反应Ⅰ.,滤渣为,滤液Ⅱ为,通过氧化脱硫,得到溶液,酸化后得到,还原得到。
【详解】A.将和的混合物加入过量的,发生反应Ⅰ.,滤渣为,A正确;
B.根据反应Ⅱ.,若用代替,浓度增大,平衡逆向移动,不利于沉砷,B错误;
C.根据氧化还原反应规律,用氧气进行氧化脱硫生成单质时发生反应,C正确;
D.已知信息Ⅲ.砷酸在酸性条件下有氧化性,能将氢硝酸氧化为,遇淀粉变蓝色,能用氢碘酸、淀粉溶液检验还原后的溶液中是否仍存在砷酸,D正确;
故选B。
4.D
【详解】A.由题图可知,“沉淀”过程中发生反应的反应物有、和,产物有,则反应的化学方程式为,A正确;
B.乙醇能与水互溶且易挥发,故“乙醇洗”的目的是除去晶体表面的水分,加快干燥,B正确;
C.中含有,可发生歧化反应释放出氧气,反应的化学方程式为,C正确;
D.过氧化钙中含有,有强氧化性,能杀菌消毒,改善水质,D错误;
故选D。
5.C
【分析】硼镁矿加入稀硫酸浸取,二氧化硅不反应、碳酸钙转化为微溶的硫酸钙成为滤渣,镁、铁、铝、硼进入浸出液,通过除杂将铁、铝转化为沉淀,由于的溶解度随温度的升高显著增大,故滤液降温结晶析出硼酸晶体,母液中含有硫酸镁;
【详解】A.“浸取”时,因硼镁矿粉中含有少量,加入稀硫酸会产生大量泡沫,为避免反应物从反应器中溢出,应分批慢慢加入稀硫酸,A正确;
B.的溶解度随温度的升高显著增大,“热过滤”的目的是防止温度降低时从溶液中析出,B正确;
C.“除杂”时需向“浸出液”中依次加入将亚铁离子转化为铁离子、加入氧化镁调节pH,以除去、、等杂质离子;若使用氢氧化钠会引入杂质离子钠离子,C错误;
D.由分析可知,“母液”中的溶质主要是硫酸镁,D正确;
故选C。
6.B
【分析】以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6] 3H2O,黄铁矿在空气中焙烧,FeS2、NiS、CuS反应后生成Fe2O3、NiO、CuO和SO2,气体A为SO2,氧化物中加入稀硫酸得到CuSO4、NiSO4、Fe2(SO4)3,SiO2不溶于稀硫酸,所以滤渣I为SiO2,滤液I中含有CuSO4、NiSO4、Fe2(SO4)3和硫酸,调节溶液的pH并过滤得到滤液II,滤渣II中加入Fe、稀硫酸得到溶液I,根据最终得到的物质元素知,滤渣II中含有Fe(OH)3,滤液II中含有CuSO4、NiSO4,向滤渣II中加入稀硫酸、Fe发生反应2Fe(OH)3+Fe+3H2SO4=3FeSO4+6H2O,向溶液I中加入石灰乳、HCN得到Ca2[Fe(CN)6],滤渣III为过量的Fe,向滤液中加入Na2CO3得到滤渣IV为CaCO3,滤液为Na4[Fe(CN)6],向滤液中加入KCl通过一系列操作得到K4[Fe(CN)6] 3H2O;
【详解】A.FeS2、NiS、CuS反应后生成Fe2O3、NiO、CuO和SO2,则焙烧时氧化产物有Fe2O3和SO2,故A正确;
B.石灰乳写化学式,“溶液Ⅰ”中反应的离子方程式为3Ca(OH)2+6HCN+Fe2+═[Fe(CN)6]4-+6H2O+3Ca2+,故B错误;
C.调节pH值时,部分金属阳离子转化为氢氧化物沉淀,所以“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同,故C正确;
D.从溶液中获取晶体采用过滤、洗涤、干燥的方法,所以“一系列操作”为过滤、洗涤、干燥,故D正确;
故选:B。
7.A
【分析】SO2烟气通过除尘器除尘后与CaS在脱硫塔发生、生成和气态的S单质,和煤在再生塔反应生成CO2和X(CaS),气态的S单质随气体进入冷凝器冷凝后得到S单质和脱硫后气体。
【详解】A.脱硫塔中生成S的反应为,根据得失电子守恒可知2molCaS被氧化为2molS,1molSO2被还原为1molS,故S既是氧化产物又是还原产物,A错误;
B.几种单质(、、和)均是由同种元素组成的单质,互为同素异形体,B正确;
C.和煤在再生塔反应生成CO2和X(CaS),将和煤粉碎混合,再投入再生塔,增大了反应物的接触面积,有利于反应充分进行,C正确;
D.X主要成分为CaS,D正确;
答案选A。
8.B
【分析】以硫铁矿主要成分是,含少量、和通入空气后被氧气氧化生成二氧化硫,铁元素被氧化为三价铁,在酸浸后二氧化硅不反应到滤渣A中,三氧化铝和氧化铁与硫酸反应,生成硫酸铝和硫酸铁,在还原时硫化亚铁加入后将三价铁还原为二价铁,在除铝过程中加入碳酸铁调节pH值将铝元素转化为氢氧化铝沉淀,在氧化过程中双氧水将二价铁氧化为三价铁,在沉铁过程中将三价铁转化为磷酸铁;
【详解】A.根据分析,酸浸后二氧化硅不反应到,滤渣A的主要成分为,故A正确;
B.根据分析,操作I加入目的是将三价铁还原为二价铁,故B错误;
C.用调节pH根据除去氢氧化铝,故pH调节大于5.2,而不能将二价铁沉淀,故pH小于7.6,故pH为5.2~7.6,故C正确;
D.沉淀时,过高会使Fe3+生成Fe(OH)3,过低无法生成磷酸铁沉淀,D正确;
故选B。
9.A
【分析】正极材料加入过氧化氢、稀硫酸浸取后得到溶液中含有,加入萃取就萃取分离出有机相,在加入稀硫酸反萃取得到CoSO4的水相,电沉积得到钴。
【详解】A.浸取过程中得到溶液中的,则钴发生还原反应,需要还原剂,反应中不做氧化剂,A错误;
B.操作I为分离有机相和水相的操作,为萃取分液,用到的玻璃仪器为分液漏斗、烧杯,B正确;
C.,加入酸平衡会逆向移动生成,操作加入X后得到CoSO4,试剂X为稀,C正确;
D.CoSO4电解发生还原反应生成Co,是在阴极反应,故电沉积后,可在阴极收集,D正确;
故选A。
10.D
【分析】氧化铝和氢氧化钠溶液反应生成偏铝酸钠溶液,通入二氧化碳气体生成氢氧化铝沉淀,灼烧生成氧化铝,电解得到铝单质。
【详解】A.过滤需要用到的仪器有烧杯、玻璃棒、漏斗,A正确;
B.酸化②通足量的CO2应生成氢氧化铝沉淀和碳酸氢根,离子方程式为:,B正确;
C.Al(OH)3受热分解,生成高熔点的Al2O3和水,Al2O3常用作高温耐火材料,C正确;
D.灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6),目的是降低Al2O3熔融温度,D错误;
故选D。
11.C
【分析】电镀污泥加碳酸铵和氨水进行氨浸,钙离子与碳酸根离子反应生成CaCO3,同时氨水可以使溶液pH增大,促进Fe3+、Al3+的水解,转化为Fe(OH)3、Al(OH)3,浸出渣主要成分为CaCO3、Fe(OH)3、Al(OH)3,得到的浸出液加有机物丁二酮肟和氯仿萃取镍,镍进入氯仿层,在氯仿层中加HCl反萃取得到含镍离子的溶液和有机萃取剂,有机萃取剂重复使用,充分利用萃取剂,含镍离子的溶液进行过滤、洗涤、干燥、灼烧、还原得到粗镍。
【详解】A.根据分析,氨浸后Ca2+、Fe3+、Al3+转化为CaCO3、Fe(OH)3、Al(OH)3而被除去,A正确;
B.根据分析,“水层1”和“有机层”均可重复使用,但前者是为了提高Ni的萃取率,后者是为了充分利用萃取剂,目的不相同,B正确;
C.加入盐酸进行反萃取,HCl可以解除丁二酮肟与Ni2+的配位键,为化学变化,C错误;
D.根据分析,水层经过滤、洗涤、干燥、灼烧、还原得到粗镍,D正确;
故选C。
12.B
【分析】电池中含Zn、Ag、石墨及Hg、Mn等,由流程可知,加稀硝酸后,石墨不反应,Zn、Ag、Hg、Mn和硝酸反应生成硝酸锌,硝酸银,硝酸汞,硝酸锰,再加氯化钠溶液会发生Ag++Cl-=AgCl↓,在含AgCl的滤渣中加入氨水会发反应生成,在银氨络合物中加入Zn生成银,过量的锌可以溶解于稀硫酸溶液中,以此来解答。
【详解】A.金属和硝酸反应生成氮氧化物,不是氢气,故A错误;
B.③的离子方程式为AgCl+2NH3 H2O=+Cl-+2H2O,因此②中适当增加溶液的浓度有利于提高的回收率,故B正确;
C.锌可以溶解于稀硫酸溶液中,故⑤中加稀硫酸的目的是除去银粉中的锌,转化为Zn2+,故C错误;
D.废旧电池中含有重金属离子,污染环境,所以废旧银锌纽扣电池不应采用深埋的方式集中处理,故D错误;
故选B。
13.D
【详解】A.与溶液反应生成更难溶的,转化后生成的碳酸铅可由酸浸进入溶液中,转化反应的离子方程式:,A错误;
B.第一步“溶浸”中中元素的化合价降低,做氧化剂,做还原剂,B错误;
C.对于,其中心原子的价层电子对数为4,杂化方式为,故C错误;
D.电解四氟合硼酸铅溶液时,石墨是电解池的阳极,铅是阴极,铅离子在阴极得到电子发生还原反应生成铅,故D正确;
故选D。
14.B
【分析】根据图示,“熔炼”过程中二氧化硅与碳酸钙生成硅酸钙和二氧化碳,加酸后,生成铍离子、铝离子、铁离子或亚铁离子,加入双氧水后亚铁离子生成铁离子,加入氨水,使铝离子和铍离子生成沉淀;
【详解】A .“熔炼”过程中发生反应,A错误;
B.最终为沉淀,故加入可氧化且不影响产品纯度,B正确;
C.为两性氢氧化物,溶于强酸强碱,不溶于弱碱,C错误;
D.“氧化”工序的主要反应为,D错误;
故答案为:B。
15.C
【详解】A.氧化铝和氢氧化钠反应生成偏铝酸钠,碱溶①后,溶液中主要含有的阳离子为 Na+,故A错误;
B.步骤②通入足量 CO2,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:,故B错误;
C.Al(OH)3受热生成氧化铝和水,氧化铝熔点高,常用作高温耐火材料,故C正确;
D.灼烧③一般在坩埚中进行,故D错误;
选C。
16.B
【详解】A.联合办厂利用了合成氨厂的NH3和副产品CO2,气体1是NH3,得到氨盐水,则气体2是CO2,再通入CO2反应析出碳酸氢钠固体,A正确;
B.“氨盐水”得到NaHCO3利用了其溶解度在混合溶液中较小的原理,B错误;
C.根据图示,碳酸氢钠加热分解生成CO2,最后过滤后得到有饱和食盐水,可知侯氏制碱法中循环利用的物质是CO2和食盐,C正确;
D.侯氏制碱法改进了索维尔法中的第④步,避免了索维尔法中的副产物氯化钙,而析出NH4Cl,可得到化肥,并提高了食盐利用率,D正确;
故选B。
17.C
【分析】由流程可知:酸化的海水中通入氯气发生Cl2+2Br- = Br2+2C1-,吹出塔中通入热空气吹出溴单质,在吸收塔中用二氧化硫和水吸收发生SO2+Br2+2H2O=2HBr+H2SO4,再通入氯气和水蒸气,发生Cl2+2Br- = Br2+2C1-,达到富集溴的目的,冷凝精馏分离出产品溴,以此来解答。
【详解】A.吹出塔中通入空气的主要目的是将Cl2还原Br-产生的Br2吹出,A错误;
B.海水中溴离子浓度较低,经过经氧化、吹出、吸收后,可实现溴的富集,经过2次Br - →Br2转化后得到的Br2的浓度是不相同的,B错误;
C.在吹出塔中发生反应:Cl2+2Br-=2Cl-+Br2,可知还原性:Br->Cl-;在吸收塔中发生Br2+SO2+2H2O=H2SO4+2HBr,SO2作还原剂,HBr是还原产物,可知还原性:SO2>Br-,故物质微粒的还原性:SO2>Br->Cl-,C正确;
D.在蒸馏塔中发生反应:Cl2+2Br-=2Cl-+Br2,若消耗标准状况下22.4 L的Cl2,其物质的量是1 mol,则转移电子数为2NA,D错误;
故合理选项是C。
18.B
【分析】氯化发生的反应为:2FeTiO3+7Cl2+6C2FeCl3+2TiCl4+6CO,得到TiCl4,然后镁和四氯化钛反应生成钛和氯化镁,化学方程式为TiCl4 + 2MgTi+2MgCl2。
【详解】A.“氯化”过程中,中Fe由+2价变为+3价,是还原剂,A错误;
B.反应2FeTiO3+7Cl2+6C2FeCl3+2TiCl4+6CO中,每生成6molCO,转移14mol电子,生成气体,转移电子×14mol=0.7mol,B正确;
C.高温下Ti与N2反应,由制备Ti的过程中,Ar气不可换成氮气,C错误;
D.由制备Ti反应为TiCl4 + 2MgTi+2MgCl2,属于置换反应,原子利用率不是100%,D错误;
故选B。
19.C
【分析】依题意,煅烧后钾元素、铝元素转化为NaAlO2、KAlO2、硅元素转化为CaSiO3。水浸过滤后,滤液中主要含有NaAlO2、KAlO2、Na2CO3等,通入过量CO2,生成Al(OH)3沉淀和NaHCO3、KHCO3,加入NaOH溶液碱化时,NaHCO3转化为Na2CO3并结晶析出、KHCO3转化为K2CO3,过滤分离可得K2CO3溶液。
【详解】A.钾长石是非水溶性钾资源,不能用“水浸”操作直接提取其中的主要成分,A错误;
B.“浸渣Ⅰ”主要含有CaCO3和CaSiO3,不能冶炼金属铝,B错误;
C.加入NaOH溶液碱化时,NaHCO3、KHCO3分别转化为Na2CO3、K2CO3,反应的离子方程式为:,C正确;
D.流程中除CO2可以循环利用外,还有Na2CO3也可以循环利用,D错误;
故选C。
20.C
【分析】Al有两性,能与NaOH溶液反应生成NaAlO2溶于水,而Mg、Fe不反应,以单质固体形式除去,则操作a是过滤,再加稀硫酸调节pH析出Al(OH)3沉淀,过滤固体,继续向纯固体中加入过量稀硫酸得到Al2(SO4)3和硫酸的混合溶液,最后加饱和K2SO4溶液结晶得到溶解度更小的明矾。
【详解】A.Al能与强碱反应,离子方程式是,A正确;
B.Mg、Fe不与NaOH反应,则操作是过滤,以除去难溶于溶液的杂质,B正确;
C.乙溶液中含有的离子是H+、、,C错误;
D.④是根据溶解度差异来制取明矾,即室温下明矾的溶解度小于和的溶解度,D正确;
故选C。
21.D
【分析】由流程可知,CaO与硫酸锰反应生成,通入氧气生成,涉及反应为2+O2+4OH =2+4H2O,与S2 反应生成,进而与氧气反应生成,可用于制备CaSO4 2H2O,以此解答该题。
【详解】A.过程Ⅰ中,通入氧气生成;被氧化,故A错误;
B.过程Ⅱ中,与S2 反应生成,说氧化产物,故B错误;
C.该流程中,CaO与硫酸锰反应生成不涉及化合价的变化,不属于氧化还原反应,故C错误;
D.10L 480mg/L 含有,根据得失电子守恒可知:0.10mol×8=n(O2)×4,n(O2)=0.3mol,故D正确;
故答案选D。
【点睛】本题考查物质的制备实验,为高频考点,把握制备流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大。
22.D
【详解】A.氨气极易溶于水使溶液显碱性,饱和食盐水“吸氨”的目的是可以吸收更多二氧化碳,使“碳酸化”时产生更多的,故A正确;
B.碳酸氢钠受热分解为碳酸钠、水、二氧化碳,故B正确;
C.铵根离子水解生成氢离子,溶液显酸性;加入氯化钠“盐析”后溶液中铵根离子浓度减小,溶液酸性减弱,故比“盐析”前溶液大,故C正确;
D.母液Ⅱ为加入氯化钠晶体,析出氯化铵后得到的;与母液Ⅰ所含粒子种类相同,但母液Ⅱ中碳酸氢根离子的浓度没有变的更大,故D错误;
故选D。
23.C
【分析】煅烧石灰石矿(主要成分为,含少量等),、分解分别生成CaO和MgO ,并放出CO2,煅烧后固体 CaO、MgO,加氯化铵浸取,溶解CaO,得到含氯化钙和 的滤液A,过滤,固体B中含有及,滤液A中通CO2,,生成沉淀CaCO3。
【详解】A.过程Ⅱ中,溶液浸出而非,因为,A正确;
B.过程Ⅲ中,CO2和氯化钙和反应生成CaCO3,的离子方程式为,B正确;
C.过程Ⅱ的反应物氯化铵受热易分解,过程Ⅲ中受热易分解、易挥发,不能在较高温度下进行,C错误;
D.过程Ⅰ产生的是过程Ⅲ的反应物,过程Ⅲ中的生成物是过程Ⅱ的反应物,所以可循环利用,D正确;
故答案选C。
24.C
【分析】氧化铝和氢氧化钠溶液反应生成偏铝酸钠溶液,通入二氧化碳气体生成氢氧化铝沉淀,灼烧生成氧化铝,电解得到铝单质。
【详解】A.碱溶①后,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,溶液中主要含有的阳离子为Na+,A错误;
B.酸化②通足量的CO2应生成氢氧化铝沉淀和碳酸氢根,离子方程式为AlO+CO2+2H2O=Al(OH)3↓+HCO,B错误;
C.Al(OH)3受热分解,2Al(OH)3Al2O3+3H2O,生成高熔点的Al2O3和水,Al2O3常用作高温耐火材料,C正确;
D.灼烧③一般在坩埚中进行,电解④添加冰晶石(Na3AlF6),目的是降低Al2O3熔融温度,D错误;
故选C。
25.B
【分析】根据试题已知信息,废旧镀锌铁皮“碱洗”除去Zn和油脂,“酸溶”的反应为,“氧化”时根据 中和物质的量比为1:2,应部分氧化为,加氢氧化钠溶液“加热沉铁”时会生成 和,通氮气作保护气以免被空气氧化成,否则会影响产品的纯度, 和失水分离形成,据此分析解题。
【详解】A.加稀硫酸“酸溶”的反应为,改为浓硫酸会在常温下使铁钝化而影响酸溶反应,故A错误;
B.酸性下, 作氧化剂,作还原剂,反应的离子方程式为 ,故B正确;
C.因中和物质的量比为1:2,只能部分氧化为,所以氧化后的溶液还含有,故C错误;
D.第一次加入氢氧化钠溶液发生氧化还原反应为 ,第二次加入氢氧化钠溶液是离子互换反应使和产生 和沉淀,故D错误;
答案选B。
同课章节目录
