第三章 不同聚集状态的物质与性质 单元测试(含答案) 2022-2023学年高二上学期鲁科版(2019)化学选择性必修2
文档属性
| 名称 | 第三章 不同聚集状态的物质与性质 单元测试(含答案) 2022-2023学年高二上学期鲁科版(2019)化学选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 672.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-20 23:03:10 | ||
图片预览



文档简介
第三章《不同聚集状态的物质与性质》检测题
一、单选题(共13题)
1.下列各组物质中,按熔点由低到高排列正确的是
A.CO2、汽油、MgO
B.KCl、P2O5、Si
C.NH3、PH3、HBr
D.SiC、NaCl、NO2
2.下列说法错误的是
A.气态和液态物质都是由分子构成的
B.超分子的重要特征是分子识别和自组装
C.大多数晶体都是四种典型晶体之间的过渡晶体
D.石墨晶体中既有共价键和范德华力又有类似金属的导电性属于混合型晶体
3.下列说法正确的有几项
①晶体中只要有阳离子就一定有阴离子
②晶胞是晶体中最小的平行六面体
③单质分子一定是非极性分子
④离子晶体都是化合物
⑤分子晶体中都存在共价键
⑥硫酸氢钾在熔融状态下离子键、共价键均被破坏
A.0项 B.1项 C.2项 D.3项
4.下列说法中,正确的是
A.分子晶体中一定存在分子间作用力和共价键
B.共价晶体中,共价键越强,熔点越高
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.分子晶体的熔点一般比共价晶体的熔点高
5.下列比较错误的是
A.硬度:MgO>CaO>BaO B.晶格能:NaF>NaCl>NaBr
C.熔点:金刚石>NaCl>H2O D.熔点:NaF>MgF2>AlF3
6.用久置于空气中的生石灰[主要成分为CaO,还含有和]制取的流程如下:
已知75℃时,在碱性条件下会转化为和,室温下的溶解度远小于KCl。下列说法正确的是
A.氯化反应的离子方程式为
B.转化时发生反应的类型为复分解反应
C.滤液中大量存在的离子是、、和
D.如图所示KCl晶胞中与紧邻的有4个
7.下列对有关事实的解释正确的是
事实 解释
A SiO2的熔点比干冰高 SiO2分子间的范德华力比干冰大
B AgCl能溶于氨水 提供孤电子对与Ag+通过配位键形成配合物
C NH3做喷泉实验 NH3与H2O分子间形成氢键,且均为极性分子
D 某些金属盐灼烧呈现不同焰色 电子从低能轨道跃迁至高能轨道时吸收光波长不同
A.A B.B C.C D.D
8.下列有关物质的结构与性质的叙述不正确的是
A.K元素特殊的焰色反应是由于K原子核外电子能级跃迁吸收能量
B.乙烯易发生加成反应是由于分子中两个碳原子间的π键容易断裂
C.键能、,因此稳定性大于
D.金属Na中的金属键比金属K中的金属键强,因此金属Na熔点高于K
9.已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为
A.8mol B.7mol
C.6mol D.5mol
10.下列说法正确的是
A.甲酸的酸性比乙酸弱
B.[Cu(NH3)4]2+的空间构型为四面体结构
C.NaCl晶胞与CsCl晶胞中阳离子的配位数相同
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
11.下列说法正确的是
A.熔点由高到低:Na>Mg>Al B.硬度的大小:金刚石<碳化硅<晶体硅
C.键角大小: D.热稳定性:
12.一种固体导电材料为四方晶系,其晶胞参数为a pm、a pm和2a pm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为,的摩尔质量为,设为阿伏加德罗常数的值。下列说法错误的是
A.C表示的是Ag原子 B.距离Hg最近的Ag有8个
C.m原子的分数坐标为 D.该晶体的密度为
13.设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,1.12L18O2中含有中子数为NA
B.62gP4(分子结构:)中的共价键数目为3NA
C.18.9g三肽C6H31N3O4 (相对分子质量:189)中的肽键数目为0.2NA
D.在C60晶胞中,C60分子位于顶点和面心,则1mol该晶胞中的分子数为14NA
二、非选择题(共10题)
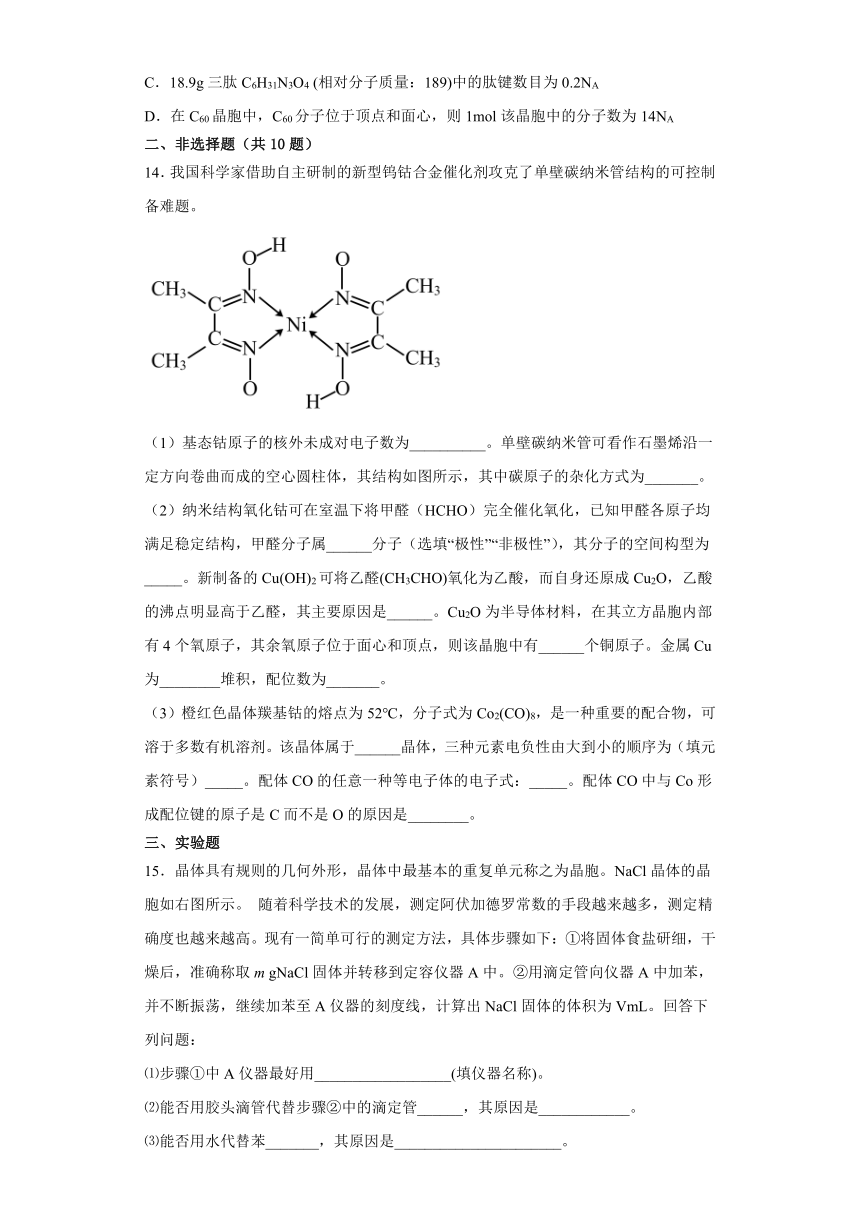
14.我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外未成对电子数为__________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其结构如图所示,其中碳原子的杂化方式为_______。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属______分子(选填“极性”“非极性”),其分子的空间构型为_____。新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。金属Cu为________堆积,配位数为_______。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的配合物,可溶于多数有机溶剂。该晶体属于______晶体,三种元素电负性由大到小的顺序为(填元素符号)_____。配体CO的任意一种等电子体的电子式:_____。配体CO中与Co形成配位键的原子是C而不是O的原因是________。
三、实验题
15.晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
16.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是_______,a中的试剂为_______。
(2)b中采用的加热方式是_______,c中的离子方程式是_______。
(3)d可选用试剂_______(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显_______色。
(5)某含氯化合物的晶胞如图所示,则其化学式为_______(用X、Cl表示)
17.根据物质的结构与性质相关知识,回答下面小题。
Ⅰ.甘氨酸锌是一种新型食品营养强化剂,可由Zn2+与甘氨酶()制备。
(1)Zn2+基态核外电子排布式为_______。
(2)甘氨酸分子中碳原子轨道的杂化类型是_______,1 mol甘氨酸分子中含有键的数目为_______。
(3)以氧化锌矿物为原料,提取锌的有关反应为ZnO+2NH3+2NH=[Zn(NH3)4]2++H2O。与NH互为等电子体的阴离子为_______,[Zn(NH3)4]2+的结构可用示意图表示为_______。
(4)闪锌矿的主要成分是一种锌的硫化物,其晶胞结构如图所示,其化学式为_______。
Ⅱ. 实验室由环己烯一步氧化制备1,2-环己二醇:
ΔH<0
(已知:1,2-环己二醇可溶于水,熔点73-77℃,沸点118-120℃)
实验步骤如下:
步骤1:向如图装置三颈烧瓶中加入60 mL乙酸,再加入几滴硫酸,随即加入15 mL 30%的双氧水,低速搅拌1.5小时。
步骤2:控制反应温度40-45℃,不断搅拌下由恒压漏斗向三颈烧瓶中缓慢滴加11 mL环己烯,冷凝回流45 min。
步骤3:将步骤2反应后的产物进行减压精馏后,加入35%的NaOH溶液,充分反应后,移入分液漏斗中,并加入乙酸丁酯振荡、分液。
步骤4:将步骤3中的有机层减压蒸馏回收溶剂,过滤,得到1,2-环己二醇。
请回答下列问题:
(5)装置中冷凝水从_______端进(填“a”或“b”)。
(6)步骤2中加入环己烯要缓慢的原因是_______。
(7)步骤2控制反应温度为40-45℃的常用方法是_______。
(8)步骤3中加入35%的NaOH溶液主要是对步骤2中的产物进行水解反应,其原因是_______。
(9)步骤3中水解反应完成的现象是_______。
(10)步骤3加入乙酸丁酯振荡、分液的目的是_______。
四、计算题
18.某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为_________。图丁为该晶胞的俯视图,该晶胞的密度为_________g·cm-3(列出计算式即可)。
19.S(黑球)和Cu(白球)形成的某种晶体的晶胞如图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为___________pm。
20.铁及其化合物在化工、医药、材料等领域具有广泛应用,回答下列问题:
Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为_______;Fe4N晶胞中与N最近的Fe原子数为_______;Fe与Fe之间的最短距离为_______cm。
21.现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)
根据上述转化关系图回答:
(1)写出下列物质的化学式 X_______;J_______
(2)物质H的电子式:_______;物质J属于哪种晶体类型:_______。
(3)写出反应①的化学方程式_______;写出反应④的离子方程式_______。
22.M3XY呈反钙钛矿结构,是一种良好的离子导体。M为金属元素,X和Y为非金属元素,三者均为短周期元素且原子序数Z(X)(1)计算M的摩尔质量________。
(2)A、M、X、Y各是_____、_______、______、_______。
(3)写出M3XY发生水解的方程式________。
(4)M3XY晶体属于立方晶系,若以X为正当晶胞的顶点,写出M和Y的坐标以及该晶体的最小重复单位_________。
23.、、、、均为周期表前四周期元素,原子序数依次增大,相关信息如表所示:
原子核外电子分别占个不同能级,且每个能级上排布的电子数相同
基态原子的轨道电子数比轨道电子数少
在周期表所列元素中电负性最大
位于周期表中第纵行
基态原子层全充满,层只有一个电子
(1)基态d原子的价电子排布图为_______;
(2)b与其同周期左右相邻元素第一电离能由大到小的顺序为_______用元素符号表示;
(3)c的氢化物水溶液中存在的氢键有_______种,请画出其中一种_______;
(4)a元素与其相邻同主族元素的最高价氧化物熔点高低关系为_______;(用化学式表示)原因是_______。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在该晶体的晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为_______,若该晶体密度为ag·cm-3,则该晶体中晶胞的体积为_______cm3(NA表示阿伏加德罗常数的值)。
参考答案:
1.A 2.A 3.B 4.B 5.D 6.B 7.C 8.A 9.A 10.D 11.D 12.D 13.D
14. 3 sp2和sp3 极性 平面三角形 乙酸分子间形成氢键,作用力大,熔沸点高 16 面心立方最密堆积 12 分子 O>C>Co C原子半径大于O,电负性小,对孤电子对的吸引较弱,更容易形成配位键
15. 容量瓶 否 实验中需要准确量取苯的体积 否 若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来
16.(1) 圆底烧瓶 饱和食盐水
(2) 水浴加热 Cl2+2OH-=Cl-+ClO-+H2O
(3)AC
(4)紫
(5)XCl
17.(1)1s22s22p63s23p63d10或[Ar]3d10
(2) sp2和sp3 9NA
(3) BH
(4)ZnS
(5)b
(6)反应放热,滴加速度过快,体系温度迅速上升导致过度氧化
(7)水浴加热
(8)使步骤2中生成的1,2-环己二醇与乙酸发生副反应生成的酯水解,提高1,2-环己二醇的产率
(9)容器中分层消失
(10)萃取产品中的1,2-环己二醇
18. VS ×1021
19. 129
20. Fe3CuN 6
21.(1) H2O NH4NO3
(2) 离子晶体
(3) AlN+3H2O=Al(OH)3+NH3 Al3++3AlO+6H2O=4Al(OH)3↓
22. 23 g mol-1 H Na O Cl Na3Ocl+H2O→ 2NaOH+NaCl M 的坐标: 1/2,0,0; 0,1/2,0; 0,0, 1/2。Y的坐标: 1/2, 1/2, 1/2。Na3OCl,或1个正当晶胞,或1个素晶胞
23.(1)
(2)N>O>C
(3) 4 F-H…F或F-H…O或O-H…F
(4) SiO2>CO2 CO2为分子晶体,SiO2是共价晶体,共价晶体中的共价键的强度远远大于范德华力
(5) H4Cu3Au
一、单选题(共13题)
1.下列各组物质中,按熔点由低到高排列正确的是
A.CO2、汽油、MgO
B.KCl、P2O5、Si
C.NH3、PH3、HBr
D.SiC、NaCl、NO2
2.下列说法错误的是
A.气态和液态物质都是由分子构成的
B.超分子的重要特征是分子识别和自组装
C.大多数晶体都是四种典型晶体之间的过渡晶体
D.石墨晶体中既有共价键和范德华力又有类似金属的导电性属于混合型晶体
3.下列说法正确的有几项
①晶体中只要有阳离子就一定有阴离子
②晶胞是晶体中最小的平行六面体
③单质分子一定是非极性分子
④离子晶体都是化合物
⑤分子晶体中都存在共价键
⑥硫酸氢钾在熔融状态下离子键、共价键均被破坏
A.0项 B.1项 C.2项 D.3项
4.下列说法中,正确的是
A.分子晶体中一定存在分子间作用力和共价键
B.共价晶体中,共价键越强,熔点越高
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.分子晶体的熔点一般比共价晶体的熔点高
5.下列比较错误的是
A.硬度:MgO>CaO>BaO B.晶格能:NaF>NaCl>NaBr
C.熔点:金刚石>NaCl>H2O D.熔点:NaF>MgF2>AlF3
6.用久置于空气中的生石灰[主要成分为CaO,还含有和]制取的流程如下:
已知75℃时,在碱性条件下会转化为和,室温下的溶解度远小于KCl。下列说法正确的是
A.氯化反应的离子方程式为
B.转化时发生反应的类型为复分解反应
C.滤液中大量存在的离子是、、和
D.如图所示KCl晶胞中与紧邻的有4个
7.下列对有关事实的解释正确的是
事实 解释
A SiO2的熔点比干冰高 SiO2分子间的范德华力比干冰大
B AgCl能溶于氨水 提供孤电子对与Ag+通过配位键形成配合物
C NH3做喷泉实验 NH3与H2O分子间形成氢键,且均为极性分子
D 某些金属盐灼烧呈现不同焰色 电子从低能轨道跃迁至高能轨道时吸收光波长不同
A.A B.B C.C D.D
8.下列有关物质的结构与性质的叙述不正确的是
A.K元素特殊的焰色反应是由于K原子核外电子能级跃迁吸收能量
B.乙烯易发生加成反应是由于分子中两个碳原子间的π键容易断裂
C.键能、,因此稳定性大于
D.金属Na中的金属键比金属K中的金属键强,因此金属Na熔点高于K
9.已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如下所示,1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为
A.8mol B.7mol
C.6mol D.5mol
10.下列说法正确的是
A.甲酸的酸性比乙酸弱
B.[Cu(NH3)4]2+的空间构型为四面体结构
C.NaCl晶胞与CsCl晶胞中阳离子的配位数相同
D.金刚石为三维骨架结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
11.下列说法正确的是
A.熔点由高到低:Na>Mg>Al B.硬度的大小:金刚石<碳化硅<晶体硅
C.键角大小: D.热稳定性:
12.一种固体导电材料为四方晶系,其晶胞参数为a pm、a pm和2a pm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为,的摩尔质量为,设为阿伏加德罗常数的值。下列说法错误的是
A.C表示的是Ag原子 B.距离Hg最近的Ag有8个
C.m原子的分数坐标为 D.该晶体的密度为
13.设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,1.12L18O2中含有中子数为NA
B.62gP4(分子结构:)中的共价键数目为3NA
C.18.9g三肽C6H31N3O4 (相对分子质量:189)中的肽键数目为0.2NA
D.在C60晶胞中,C60分子位于顶点和面心,则1mol该晶胞中的分子数为14NA
二、非选择题(共10题)
14.我国科学家借助自主研制的新型钨钴合金催化剂攻克了单壁碳纳米管结构的可控制备难题。
(1)基态钴原子的核外未成对电子数为__________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其结构如图所示,其中碳原子的杂化方式为_______。
(2)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化,已知甲醛各原子均满足稳定结构,甲醛分子属______分子(选填“极性”“非极性”),其分子的空间构型为_____。新制备的Cu(OH)2可将乙醛(CH3CHO)氧化为乙酸,而自身还原成Cu2O,乙酸的沸点明显高于乙醛,其主要原因是______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。金属Cu为________堆积,配位数为_______。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的配合物,可溶于多数有机溶剂。该晶体属于______晶体,三种元素电负性由大到小的顺序为(填元素符号)_____。配体CO的任意一种等电子体的电子式:_____。配体CO中与Co形成配位键的原子是C而不是O的原因是________。
三、实验题
15.晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是______________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为acm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
16.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放MnO2粉末的仪器名称是_______,a中的试剂为_______。
(2)b中采用的加热方式是_______,c中的离子方程式是_______。
(3)d可选用试剂_______(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 D.H2SO4
(4)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显_______色。
(5)某含氯化合物的晶胞如图所示,则其化学式为_______(用X、Cl表示)
17.根据物质的结构与性质相关知识,回答下面小题。
Ⅰ.甘氨酸锌是一种新型食品营养强化剂,可由Zn2+与甘氨酶()制备。
(1)Zn2+基态核外电子排布式为_______。
(2)甘氨酸分子中碳原子轨道的杂化类型是_______,1 mol甘氨酸分子中含有键的数目为_______。
(3)以氧化锌矿物为原料,提取锌的有关反应为ZnO+2NH3+2NH=[Zn(NH3)4]2++H2O。与NH互为等电子体的阴离子为_______,[Zn(NH3)4]2+的结构可用示意图表示为_______。
(4)闪锌矿的主要成分是一种锌的硫化物,其晶胞结构如图所示,其化学式为_______。
Ⅱ. 实验室由环己烯一步氧化制备1,2-环己二醇:
ΔH<0
(已知:1,2-环己二醇可溶于水,熔点73-77℃,沸点118-120℃)
实验步骤如下:
步骤1:向如图装置三颈烧瓶中加入60 mL乙酸,再加入几滴硫酸,随即加入15 mL 30%的双氧水,低速搅拌1.5小时。
步骤2:控制反应温度40-45℃,不断搅拌下由恒压漏斗向三颈烧瓶中缓慢滴加11 mL环己烯,冷凝回流45 min。
步骤3:将步骤2反应后的产物进行减压精馏后,加入35%的NaOH溶液,充分反应后,移入分液漏斗中,并加入乙酸丁酯振荡、分液。
步骤4:将步骤3中的有机层减压蒸馏回收溶剂,过滤,得到1,2-环己二醇。
请回答下列问题:
(5)装置中冷凝水从_______端进(填“a”或“b”)。
(6)步骤2中加入环己烯要缓慢的原因是_______。
(7)步骤2控制反应温度为40-45℃的常用方法是_______。
(8)步骤3中加入35%的NaOH溶液主要是对步骤2中的产物进行水解反应,其原因是_______。
(9)步骤3中水解反应完成的现象是_______。
(10)步骤3加入乙酸丁酯振荡、分液的目的是_______。
四、计算题
18.某六方硫钒化合物晶体的晶胞如图丙所示,该晶胞的化学式为_________。图丁为该晶胞的俯视图,该晶胞的密度为_________g·cm-3(列出计算式即可)。
19.S(黑球)和Cu(白球)形成的某种晶体的晶胞如图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为___________pm。
20.铁及其化合物在化工、医药、材料等领域具有广泛应用,回答下列问题:
Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为_______;Fe4N晶胞中与N最近的Fe原子数为_______;Fe与Fe之间的最短距离为_______cm。
21.现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)
根据上述转化关系图回答:
(1)写出下列物质的化学式 X_______;J_______
(2)物质H的电子式:_______;物质J属于哪种晶体类型:_______。
(3)写出反应①的化学方程式_______;写出反应④的离子方程式_______。
22.M3XY呈反钙钛矿结构,是一种良好的离子导体。M为金属元素,X和Y为非金属元素,三者均为短周期元素且原子序数Z(X)
(2)A、M、X、Y各是_____、_______、______、_______。
(3)写出M3XY发生水解的方程式________。
(4)M3XY晶体属于立方晶系,若以X为正当晶胞的顶点,写出M和Y的坐标以及该晶体的最小重复单位_________。
23.、、、、均为周期表前四周期元素,原子序数依次增大,相关信息如表所示:
原子核外电子分别占个不同能级,且每个能级上排布的电子数相同
基态原子的轨道电子数比轨道电子数少
在周期表所列元素中电负性最大
位于周期表中第纵行
基态原子层全充满,层只有一个电子
(1)基态d原子的价电子排布图为_______;
(2)b与其同周期左右相邻元素第一电离能由大到小的顺序为_______用元素符号表示;
(3)c的氢化物水溶液中存在的氢键有_______种,请画出其中一种_______;
(4)a元素与其相邻同主族元素的最高价氧化物熔点高低关系为_______;(用化学式表示)原因是_______。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在该晶体的晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为_______,若该晶体密度为ag·cm-3,则该晶体中晶胞的体积为_______cm3(NA表示阿伏加德罗常数的值)。
参考答案:
1.A 2.A 3.B 4.B 5.D 6.B 7.C 8.A 9.A 10.D 11.D 12.D 13.D
14. 3 sp2和sp3 极性 平面三角形 乙酸分子间形成氢键,作用力大,熔沸点高 16 面心立方最密堆积 12 分子 O>C>Co C原子半径大于O,电负性小,对孤电子对的吸引较弱,更容易形成配位键
15. 容量瓶 否 实验中需要准确量取苯的体积 否 若用水代替苯,NaCl会溶解,造成NaCl的体积不能准确测定出来
16.(1) 圆底烧瓶 饱和食盐水
(2) 水浴加热 Cl2+2OH-=Cl-+ClO-+H2O
(3)AC
(4)紫
(5)XCl
17.(1)1s22s22p63s23p63d10或[Ar]3d10
(2) sp2和sp3 9NA
(3) BH
(4)ZnS
(5)b
(6)反应放热,滴加速度过快,体系温度迅速上升导致过度氧化
(7)水浴加热
(8)使步骤2中生成的1,2-环己二醇与乙酸发生副反应生成的酯水解,提高1,2-环己二醇的产率
(9)容器中分层消失
(10)萃取产品中的1,2-环己二醇
18. VS ×1021
19. 129
20. Fe3CuN 6
21.(1) H2O NH4NO3
(2) 离子晶体
(3) AlN+3H2O=Al(OH)3+NH3 Al3++3AlO+6H2O=4Al(OH)3↓
22. 23 g mol-1 H Na O Cl Na3Ocl+H2O→ 2NaOH+NaCl M 的坐标: 1/2,0,0; 0,1/2,0; 0,0, 1/2。Y的坐标: 1/2, 1/2, 1/2。Na3OCl,或1个正当晶胞,或1个素晶胞
23.(1)
(2)N>O>C
(3) 4 F-H…F或F-H…O或O-H…F
(4) SiO2>CO2 CO2为分子晶体,SiO2是共价晶体,共价晶体中的共价键的强度远远大于范德华力
(5) H4Cu3Au
