2023年中考化学复习 第11讲 金属及其活动性顺序课件(共57张PPT)
文档属性
| 名称 | 2023年中考化学复习 第11讲 金属及其活动性顺序课件(共57张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 07:21:23 | ||
图片预览











文档简介
(共57张PPT)
第一部分
基础知识复习
第三板块 身边的化学物质
1
直击重点
2
知识梳理
3
金牌重难点
4
中考特训
5
广东真题
第11讲 金属及其活动性顺序
1.了解金属的物理特征,能区分常见的金属和非金属;认识金属材料在生产生活和社会发展中的重要作用。
2.知道常见的金属与氧气的反应;了解防止金属锈蚀的简单方法。
3.知道一些常见金属(铁、铝等)矿物;了解从铁矿石中将铁还原出来的方法。
4.了解常见金属的特性及其应用,认识加入其他元素可以改良金属特性的重要性;知道生铁和钢等重要的合金。
5.知道废弃金属对环境的污染,认识回收金属的重要性。
1.金属的物理性质
常温下是固体、有金属光泽、大多为热和电的导体,一般有延展性、密度大、硬度大、熔点高等共性。
金属的特性:铜为 色,金为 色,铁粉显 . 色;常温下汞为 态。
知识点一:
金属材料
红
液
黄
黑
2.合金:在金属中加热熔合 或 制得的具有
特性的合金。合金属于 物。
一般来说,合金比组成它的纯金属的性能优越。如: . 增大、 降低、 增强。如常见的铁的合金有生铁和钢。生铁的含碳量为 ,钢的含碳量为 。
0.03%~2%
某些金属
非金属
金属
混合
硬度
熔点
抗腐蚀性
2%~4.3%
1.钢铁的生锈
铁在潮湿空气中易生锈。铁与空气中 和 发生缓慢氧化反应生成铁锈。铁锈是红棕色的混合物,主要成分为 。铜生锈是铜与O2、H2O、CO2接触生成了铜绿,铜绿的主要成分为Cu2(OH)2CO3。食品常用的保鲜剂(双吸剂)是铁粉,就是利用铁生锈消耗O2和H2O的原理,从而保鲜食品。
知识点二:
金属资源的保护
Fe2O3·XH2O
O2
H2O
2.钢铁的防锈
(1)钢铁的防锈原理:保持钢铁制品表面的洁净和干燥,使钢铁制品与氧气或水隔绝。
(2)常用的防锈方法: 、 、电镀、烤蓝、制成不锈钢等。
3.铝制品的防锈
铝与氧气反应生成 ,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
涂油
刷漆
一层致密的氧化铝薄膜
1.常见的铁矿石:磁铁矿(主要成分: )、赤铁矿(主要成分: )。
知识点三:
铁的冶炼
2.原料:铁矿石、焦炭、石灰石、空气。石灰石的作用是 。
3.原理:在高温下,利用一氧化碳把铁从赤铁矿里还原出来。反应的化学方程式是:___________________________________________。
Fe2O3
Fe3O4
将矿石中的二氧化硅转变为炉渣而除去
3CO+Fe2O3 2Fe+3CO2
高温
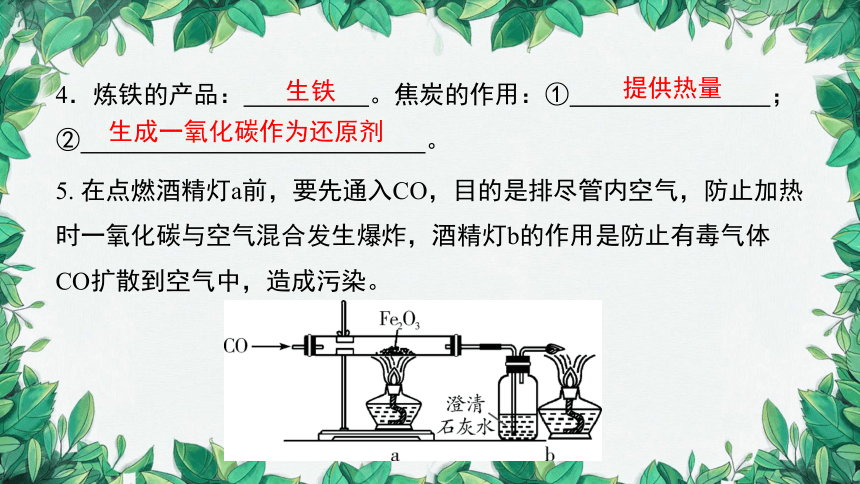
4.炼铁的产品: 。焦炭的作用:① ;② 。
5. 在点燃酒精灯a前,要先通入CO,目的是排尽管内空气,防止加热时一氧化碳与空气混合发生爆炸,酒精灯b的作用是防止有毒气体CO扩散到空气中,造成污染。
生成一氧化碳作为还原剂
生铁
提供热量
1.金属+氧气→金属氧化物(注:铁丝在纯氧中燃烧生成物是 )
知识点四:
金属的化学性质
2.金属+酸(盐酸、稀硫酸)→盐+ H2↑ (1)在金属活动性顺序中, 前金属单质与酸发生置换反应。 (2)铝、铁分别和稀盐酸反应的方程式为 , 。 (3)Fe2+的盐溶液是 色的,Fe3+的盐溶液是 色的,Cu2+的盐溶液是 色的,其余的盐溶液一般为无色。
Fe3O4
H
2Al+6HCl===2AlCl3+3H2↑
Fe+2HCl===FeCl2+H2↑
浅绿
蓝
黄
3.金属+盐溶液→新盐+新金属
(1)活泼金属才能置换出不活泼金属,但 三种金属在盐溶液中不与盐反应,而是先与水反应。
(2)盐要求可溶于水才能发生该类置换反应。
K、Ca、Na
1.比较不同金属的活动性强弱。在金属活动性顺序表中,位置越靠前的金属,金属活动性越强。
知识点五:
金属活动性顺序的应用
2.金属活动顺序的判断
①判断金属与酸能否发生置换反应。排在氢前面的金属能置换出酸中的氢,排在氢后的金属不能置换出酸中的氢。金属的位置越靠前,与酸的反应越剧烈。
②判断金属跟盐溶液能否发生置换反应。较活泼的金属能将位于其后面的金属从它们的盐溶液中置换出来。
注:不能用铁制容器盛装波尔多液农药,是因为铁与波尔多液中的
发生置换反应,腐蚀铁制容器,并且使农药失效。
3.金属与盐溶液反应后滤渣和滤液成分判断
4.设计实验验证金属的活动性
5.与金属相关的分离提纯中试剂的选择
CuSO4
1.合金是一种混合物,可以由多种金属或非金属熔合而成,并没有发生化学反应,没有生成新物质。
2.合金不一定全部由金属组成,也可以由金属与非金属组成。如生铁,就是 的合金。
3.合金具有金属特性,如导电性、导热性、延展性等,属于金属材料。金属之间是熔合到一起而不是相互化合,更不是简单地混合。组成合金的金属仍保持自己的特性。
铁和碳
(2022·福州模拟)下列关于金属的说法中不正确的是( )
A.从结构看金属原子的最外层电子数一般少于4个,易失电子
B.铁制品表面涂油漆能防锈蚀的原因是隔绝了氧气和水
C.铜锈的主要成分是Cu2(OH)2CO3,铜制品的锈蚀是铜与氧气、水蒸气共同作用的结果
D.回收废旧金属也是保护金属资源的一项重要措施
重难点一:
金属资源保护与利用
C
【思路点拨】 A.从结构看金属原子的最外层电子数一般少于4个,易失电子,故A正确;B.铁与氧气、水同时接触时会发生锈蚀,铁制品表面涂油漆能防锈蚀的原因是隔绝了氧气和水,故B正确;C.铜锈的主要成分是Cu2(OH)2CO3,由质量守恒定律可知:铜制品的锈蚀是铜与二氧化碳、氧气、水蒸气共同作用的结果,故C错误;D.回收废旧金属也是保护金属资源的一项重要措施,故D正确。
(2022·成都)我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”如图1,该方法的生产过程可用图2表示。【查阅资料】:①潮泥灰主要成分是石灰石。②铁的熔点是1535℃。
重难点二:
铁的冶炼
(1)常见的铁矿石有赤铁矿和 (合理即可)(写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为
(写一种)。
磁铁矿
充分反应,提高炉温
3CO+Fe2O3 2Fe+3CO2
高温
(4)撒入潮泥灰主要作用是 。不断翻炒液态生铁,是为了降低 的含量。
(5)钢的性能优良,如钢的熔点比纯铁 ,易于加工。
将铁矿石中的二氧化硅转化为炉渣而除去
碳或C
低
【思路点拨】 (1)常见的铁矿石有赤铁矿和磁铁矿或菱铁矿(合理即可);(2)不断鼓入空气的目的是使碳与氧气反应,放热,提高炉温;(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:3CO+Fe2O3 2Fe+3CO2。高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:4CO+Fe3O4 3Fe+4CO2;(4)撒入潮泥灰主要作用是将铁矿石中的二氧化硅转化为炉渣而除去,生铁和钢的区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量得到钢。(5)合金的熔点低于组成它的纯金属,钢的熔点比纯铁低,易于加工。
(2021·枣庄)向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液,滤液呈蓝色。下列说法正确的是( )
A.滤渣中—定有Ag、Cu
B.滤液中一定有Cu2+、Zn2+
C.向滤渣中滴加稀盐酸一定有气泡产生
D.向滤液中加入稀盐酸一定有沉淀生成
重难点三:
金属活动性顺序的应用——判断反应后溶液滤渣和滤液成分
B
【思路点拨】 由于金属活动性的强弱是锌>铜>银,向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,锌先与AgNO3反应生成硝酸锌和银,AgNO3反应完,若还有锌粉,锌才能与Cu(NO3)2反应生成硝酸锌和铜,充分反应后过滤,得到滤渣和滤液,滤液呈蓝色,说明了溶液中含有硝酸铜,锌没有剩余,滤渣中一定含有银,可能含有铜。A.由上述分析可知,滤渣中—定有Ag,可能含有Cu,故选项说法错误。B.滤液中一定有Cu2+、Zn2+,故选项说法正确。C.由于锌没有剩余,向滤渣中滴加稀盐酸一定没有气泡产生,故选项说法错误。D.滤液中不一定含有银离子,向滤液中加入稀盐酸不一定有沉淀生成,故选项说法错误。
(2022·日照模拟)现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示( 已知甲、乙、丙在生成物中化合价均为+2价)。 则下列说法中不正确的是( )
A.相对原子质量:丙>乙>甲
B.生成氢气的质量:甲>乙>丙
C.甲、乙、丙可能分别是锌、铁、镁
D.消耗硫酸的质量:甲>乙>丙
重难点四:
有关金属的坐标曲线题
C
【思路点拨】 A.三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小。在三种金属完全反应后,放出H2的质量是甲>乙>丙,所以可判断相对原子质量是丙>乙>甲,故A正确;B.根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是甲>乙>丙,故B正确;C.由金属的活泼性:丙>乙>甲,及相对原子质量:甲>乙>丙,可知甲、乙、丙不可能分别为锌、铁、镁,故C错误;D.金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:甲>乙>丙,故D正确。
金属与酸反应的坐标曲线分析(以镁、铝、锌、铁对比)
1.反应的快慢(速率)由金属的活动性顺序决定,反应速率越快,单位时间产生的氢气越多,活动性越强:Mg>Al>Zn>Fe。
2.生成氢气的质量必须用金属或酸中的不足量进行计算:当等质量的金属与足量的酸反应时,m(H2)= ,因为金属质量相等,所以“金属的化合价/金属的相对原子质量”的得
m(金属)×金属的化合价
金属的相对原子质量
数越大(注:Al为+3价),产生氢气越多:Al(3/27)>Mg(2/24)>Fe(2/56)>Zn(2/65 )。
当等质量的酸与足量的金属反应时,酸不足,以酸来算,与哪种金属及金属质量都无关。如果同种酸和酸的质量浓度都相等,则产生氢气的量一样。
★金属材料
1.(2022·临沂)下列有关金属材料的说法不正确的是( )
A.铜常用作导线,说明铜具有良好的导电性
B.“真金不怕火炼”说明金的化学性质不活泼
C.生铁和钢是含碳量不同的两种铁合金
D.铝制品具有很好的抗腐蚀性,说明铝的金属活动性比较弱
基础过关
D
2.(2022·葫芦岛)下列有关金属的说法正确的是( )
A.所有金属都呈银白色
B.常温下,所有的金属都是固体
C.为了增加金属产量,大量开采金属矿物
D.金属的回收利用,能减少对环境的污染
D
★金属资源的保护和利用
3.(2022·沈阳)为了防止钢铁制品锈蚀,下列做法不正确的是( )
A.用洗涤剂除去铁制品表面的油膜
B.在车船的表面喷涂油漆
C.在铁制品表面镀上一层其他金属
D.将使用后的菜刀用布擦干
A
4.(2022·陕西)如图所示,将两枚光亮的铁钉分别用细线吊置于甲、乙中,并使部分铁钉露出液面。放置一段时间,出现了锈蚀。下列说法不正确的是( )
A.甲、乙中,气体含氧气的体积分数不相等
B.甲中,铁钉在植物油内的部分没有锈蚀
C.乙中,铁钉在水面下的部分锈蚀最严重
D.丙中,导管内上升一段水柱
C
★金属的化学性质
5.(2022·安徽模拟)通过观察实验,学会从化学的角度分析问题,可以发展学科核心素养。下列根据镁条相关实验现象推出的结论不正确的是( )
A.镁条可以在二氧化碳中燃烧,说明燃烧不一定需要氧气
B.镁条在空气中燃烧后质量减轻,说明氧化镁逸散
C.镁条可以和盐酸反应产生氢气,说明镁适合用于实验室制取氢气
D.镁条放入滴加酚酞的热水中产生气泡,溶液变红,说明镁可与热水发生化学反应
C
6.(2022·重庆模拟)如图为某化学反应的微观示意图,已知金属镍(Ni)是一种银白色金属,含有Ni2+的溶液呈绿色。下列有关说法不正确的是( )
A.由图可知金属Ni的活动性比铜强
B.该反应的现象之一是产生红色固体
C.金属Ni和铁与硫酸铜溶液的反应现象相似
D.该反应的化学方程式为:2Ni+CuSO4===Ni2SO4+Cu
D
★金属活动性的判断和验证
7.(2022·聊城)为探究铜、锌、X三种金属的活动性,某同学做了如下实验。则三种金属的活动性由强到弱的顺序是( )
A.锌 X 铜 B.X 锌 铜
C.锌 铜 X D.铜 X 锌
A
8.(2022·徐州)如图所示,用导线将锌片和铜片分别连接到电流表的正负极,插入硫酸铜溶液中即可构成化学电池。下列说法不正确的是( )
A.该装置将化学能直接转化成电能
B.反应后烧杯中溶液的质量变小
C.实验说明锌的金属活动性大于铜
D.涉及的反应为Zn+CuSO4===Cu+ZnSO4
B
9.(2022·孝感)为验证锌,铁、铜三种金属的活动性顺序,小红设计了如图所示的四个实验,下列说法中正确的是( )
A.通过实验①②③能验证锌的金属活动性比铁的强
B.实验③中溶液的质量变大
C.X可能为锌,Y可能为硫酸亚铁
D.只做实验③和④,一定不能验证锌、铁、铜的金属活动性顺序
C
★金属反应中相关质量问题
10.(2022·怀化)现有质量相等的X、Y、Z三种金属,分别放入三份溶质质量分数相等的足量稀硫酸中,X不发生反应,Y、Z在生成物中均显+2价,Y、Z反应生成氢气的质量与反应时间的关系如图所示,则下列说法正确的是( )
A.X、Y、Z的金属活动性顺序为:Y>Z>X
B.相对原子质量:Y>Z
C.完全反应消耗稀硫酸的质量:Y<Z
D.Y与H2SO4反应的化学方程式为:Y+H2SO4===YSO4+H2↑
D
11.(2022·湖北)实验课上,某同学将一定质量的镁粉加入到硫酸亚铁溶液中,待反应结束后,过滤,得到滤液和滤渣,下列判断正确的是( )
A.滤液中一定含有硫酸镁,可能含有硫酸亚铁
B.若滤液为浅绿色,则滤渣中一定含有镁和铁
C.向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁
D.所得滤液的质量一定比原溶液的质量大
A
12.(2022·衡阳)向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法错误的是( )
A.a点时,溶液的总质量与反应前相比减小
B.b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液
C.c点时,溶液呈无色
D.d点时,过滤所得滤渣为Cu和Ag的混合物
C
★反应先后顺序问题
13.(2022·重庆)学会识图能发展科学思维。一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图。下列猜想正确的有( )
①0~t1阶段,可能是铝表面有层氧化膜
②t1~t2阶段,可能是铝和稀盐酸反应放出热量
③t3时刻,可能是稀盐酸过量
④t3时刻,可能是稀盐酸不足
A.1项 B.2项 C.3项 D.4项
D
14.(2022·常德)向一定质量CuSO4、FeSO4的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。下列说法正确的是( )
A.若滤渣中只有一种金属,则滤液中的溶质一定有三种
B.若滤渣中有两种金属,则滤液中的溶质一定有两种
C.若滤液中只有一种溶质,则向滤渣中加入稀盐酸一定有气泡产生
D.若滤液中有两种溶质,则向滤渣中加入稀盐酸不可能有气泡产生
C
15.(2022·通辽)向一定量银、铜、铁混合金属中加入硝酸银溶液充分反应,固体的质量与加入硝酸银溶液的质量关系如图所示。下列说法不正确的是( )
A.a点溶液呈浅绿色
B.b点消耗固体的质量小于析出固体的质量
C.取c点固体滴加稀盐酸,无气泡产生
D.c、d点溶液中溶质相同
D
★金属的冶炼
16.(2022·赤峰改编)铁及其合金是日常生活中应用广泛的金属材料,以下对铁的冶炼进行探究。
Ⅰ.钢铁冶炼的部分工艺流程如图所示
(1)焦炭的作用是 。
燃烧提高热量和反应提供还原剂CO
(2)在钢水铸件机中,高温钢水加工成钢制零件时,充入氮气的作用是 。
(3)流程的最后一道操作是涂层(即在金属制品表面进行喷漆或搪瓷等),该操作的主要目的是 。
作保护气,防止铁在高温下被空气中的氧气氧化
隔绝氧气和水,防止金属制品生锈
Ⅱ.在实验室中进行模拟炼铁实验如图所示(固定装置略)。
【查阅资料】CO能溶于铜液【醋酸二氨合铜(Ⅰ)和氨水的混合液】
(1)按如图连接装置A-E,在装入试剂前,先 。
(2)通入CO2一段时间后,先点燃 处酒精喷灯(填“A”或“D”)。
检查装置的气密性
A
(3)装置C中玻璃管的作用 。
(4)装置D的实验现象: 。
(5)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是 。装置E、F的接口连接顺序:a连接 . (填“b”或“c”)。
平衡装置内外压强
红色固体变成黑色
吸收一氧化碳
c
17.(2022·包头)某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是( )
A.铁丝能在空气中剧烈燃烧实现转化①
B.转化②可通过Fe3O4与CO发生置换反应实现
C.氧气和水同时存在是实现转化③的主要条件
D.通过Fe与ZnSO4溶液反应可实现转化④
能力提升
C
18.(2022·威海)物尽其用——金属之“铝”。生产生活中铁、铝及其合金制品随处可见。
(1)铝制易拉罐(如图1)某品牌碳酸
饮料的易拉罐是由铝合金制成的,
内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。
①将易拉罐剪成条状,打磨后与纯铝片相互刻划,发现纯铝片表面有划痕,说明 。
铝合金的硬度大于纯铝的硬度
②请你推测组成有机薄膜的物质具有的性质: 、
(任写两条)。
③“是否应该停止使用铝制易拉罐”是当前的一个社会性科学议题。有同学认为应该停止使用铝制易拉罐,理由可能 . (写一条即可);也有同学支持继续使用铝制易拉罐,请你结合铝的性质阐述理由 、 (任写两条)。
不与酸反应
无毒
浪费金属资源
铝的密度小
具有良好的延展性
④生活垃圾要分类投放,可与废弃易拉罐作为同一类投放的是
(填字母序号)。
A.废旧电池 B.废弃口罩 C.厨余垃圾 D.废旧铁锅
(2)储氢材料储氢材料的研发是氢能源技术的关键之一。金属铝可用作储氢材料,储氢后生成氢化铝(AlH3),其中氢元素的化合价为 ;释氢原理为氢化铝与水反应释放氢气,同时生成氢氧化铝,其反应的化学方程式为_________________________________。
D
-1
AlH3+3H2O===Al(OH)3+3H2↑
(3)制备铝:工业上常用电解氧化铝制备铝,反应的化学方程式为_______________________________。
(4)铝合金中的铟(In):如图2为铝、
铟的原子结构示意图。某同学推测
金属铟与铝的化学性质相似,理由是 。实验证明,铟可以与稀盐酸反应,其反应的化学方程式为 。
2Al2O3 4Al+3O2↑
通电
原子的最外层电子数相同
2In+6HCl===2InCl3+3H2↑
19.(2022·海南)2022年春晚舞蹈《只此青
绿》源于宋代名作《千里江山图》。
(1)《千里江山图》流传千年依旧色彩艳丽,
璀璨夺目,与所用矿石颜料有关。说明所
用矿石颜料化学性质 (填“稳定”或“不稳定”);
(2)矿石颜料之一赭石(主要成分为Fe2O3)属赤铁矿,我国早在春秋战国时就开始炼铁。用赤铁矿炼铁的主要反应原理是_______________________________(用化学方程式表示);
稳定
Fe2O3+3CO===2Fe+3CO2
(3)实验室可用如右上图所示的装置进行模拟炼铁。反应前大玻璃管中加入铁的氧化物(FexOy)试样的质量为12.6 g。加热前,应先往大玻璃管中通入CO的原因是 。实验结束后,继续通入CO气体,直至大玻璃
管冷却。此时NaOH溶液的质量增加了7.7 g。
推算该铁的氧化物的化学式中x、y的比为
(填最简整数比)。
排尽空气,防止爆炸
1∶1
1.(2022·广州)人类从石器时代进入青铜器时代,继而进入铁器时代,都是以金属材料的使用作为标志的。下列说法正确的是( )
A.铝制品在常温下有良好的抗腐蚀性
B.纯铜比铜合金更适合用于制作耐磨齿轮
C.铁锅清洗后未擦干的水可隔绝空气减缓锈蚀
D.含铅、汞等重金属的废旧电池不可回收利用
A
2.(2022·广东)对铁生锈与燃烧条件的实验探究如图所示。下列说法正确的是( )
A.对比①②可探究:接触氧气是否为铁生锈的条件之一
B.对比②③可探究:接触水是否为铁生锈的条件之一
C.对比①④可探究:温度达到着火点是否为铁燃烧的条件之一
D.对比③④可探究:接触氧气是否为铁燃烧的条件之一
C
3.(2019·广东) 探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
D
4.(2019·广东) 取一定量打磨后的铝片置于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是( )
A B C D
B
5.(2018·广东) 利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A.铁+稀盐酸 B.铜+稀盐酸
C.银+稀盐酸 D.铜+硝酸银溶液
C
第一部分
基础知识复习
第三板块 身边的化学物质
1
直击重点
2
知识梳理
3
金牌重难点
4
中考特训
5
广东真题
第11讲 金属及其活动性顺序
1.了解金属的物理特征,能区分常见的金属和非金属;认识金属材料在生产生活和社会发展中的重要作用。
2.知道常见的金属与氧气的反应;了解防止金属锈蚀的简单方法。
3.知道一些常见金属(铁、铝等)矿物;了解从铁矿石中将铁还原出来的方法。
4.了解常见金属的特性及其应用,认识加入其他元素可以改良金属特性的重要性;知道生铁和钢等重要的合金。
5.知道废弃金属对环境的污染,认识回收金属的重要性。
1.金属的物理性质
常温下是固体、有金属光泽、大多为热和电的导体,一般有延展性、密度大、硬度大、熔点高等共性。
金属的特性:铜为 色,金为 色,铁粉显 . 色;常温下汞为 态。
知识点一:
金属材料
红
液
黄
黑
2.合金:在金属中加热熔合 或 制得的具有
特性的合金。合金属于 物。
一般来说,合金比组成它的纯金属的性能优越。如: . 增大、 降低、 增强。如常见的铁的合金有生铁和钢。生铁的含碳量为 ,钢的含碳量为 。
0.03%~2%
某些金属
非金属
金属
混合
硬度
熔点
抗腐蚀性
2%~4.3%
1.钢铁的生锈
铁在潮湿空气中易生锈。铁与空气中 和 发生缓慢氧化反应生成铁锈。铁锈是红棕色的混合物,主要成分为 。铜生锈是铜与O2、H2O、CO2接触生成了铜绿,铜绿的主要成分为Cu2(OH)2CO3。食品常用的保鲜剂(双吸剂)是铁粉,就是利用铁生锈消耗O2和H2O的原理,从而保鲜食品。
知识点二:
金属资源的保护
Fe2O3·XH2O
O2
H2O
2.钢铁的防锈
(1)钢铁的防锈原理:保持钢铁制品表面的洁净和干燥,使钢铁制品与氧气或水隔绝。
(2)常用的防锈方法: 、 、电镀、烤蓝、制成不锈钢等。
3.铝制品的防锈
铝与氧气反应生成 ,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
涂油
刷漆
一层致密的氧化铝薄膜
1.常见的铁矿石:磁铁矿(主要成分: )、赤铁矿(主要成分: )。
知识点三:
铁的冶炼
2.原料:铁矿石、焦炭、石灰石、空气。石灰石的作用是 。
3.原理:在高温下,利用一氧化碳把铁从赤铁矿里还原出来。反应的化学方程式是:___________________________________________。
Fe2O3
Fe3O4
将矿石中的二氧化硅转变为炉渣而除去
3CO+Fe2O3 2Fe+3CO2
高温
4.炼铁的产品: 。焦炭的作用:① ;② 。
5. 在点燃酒精灯a前,要先通入CO,目的是排尽管内空气,防止加热时一氧化碳与空气混合发生爆炸,酒精灯b的作用是防止有毒气体CO扩散到空气中,造成污染。
生成一氧化碳作为还原剂
生铁
提供热量
1.金属+氧气→金属氧化物(注:铁丝在纯氧中燃烧生成物是 )
知识点四:
金属的化学性质
2.金属+酸(盐酸、稀硫酸)→盐+ H2↑ (1)在金属活动性顺序中, 前金属单质与酸发生置换反应。 (2)铝、铁分别和稀盐酸反应的方程式为 , 。 (3)Fe2+的盐溶液是 色的,Fe3+的盐溶液是 色的,Cu2+的盐溶液是 色的,其余的盐溶液一般为无色。
Fe3O4
H
2Al+6HCl===2AlCl3+3H2↑
Fe+2HCl===FeCl2+H2↑
浅绿
蓝
黄
3.金属+盐溶液→新盐+新金属
(1)活泼金属才能置换出不活泼金属,但 三种金属在盐溶液中不与盐反应,而是先与水反应。
(2)盐要求可溶于水才能发生该类置换反应。
K、Ca、Na
1.比较不同金属的活动性强弱。在金属活动性顺序表中,位置越靠前的金属,金属活动性越强。
知识点五:
金属活动性顺序的应用
2.金属活动顺序的判断
①判断金属与酸能否发生置换反应。排在氢前面的金属能置换出酸中的氢,排在氢后的金属不能置换出酸中的氢。金属的位置越靠前,与酸的反应越剧烈。
②判断金属跟盐溶液能否发生置换反应。较活泼的金属能将位于其后面的金属从它们的盐溶液中置换出来。
注:不能用铁制容器盛装波尔多液农药,是因为铁与波尔多液中的
发生置换反应,腐蚀铁制容器,并且使农药失效。
3.金属与盐溶液反应后滤渣和滤液成分判断
4.设计实验验证金属的活动性
5.与金属相关的分离提纯中试剂的选择
CuSO4
1.合金是一种混合物,可以由多种金属或非金属熔合而成,并没有发生化学反应,没有生成新物质。
2.合金不一定全部由金属组成,也可以由金属与非金属组成。如生铁,就是 的合金。
3.合金具有金属特性,如导电性、导热性、延展性等,属于金属材料。金属之间是熔合到一起而不是相互化合,更不是简单地混合。组成合金的金属仍保持自己的特性。
铁和碳
(2022·福州模拟)下列关于金属的说法中不正确的是( )
A.从结构看金属原子的最外层电子数一般少于4个,易失电子
B.铁制品表面涂油漆能防锈蚀的原因是隔绝了氧气和水
C.铜锈的主要成分是Cu2(OH)2CO3,铜制品的锈蚀是铜与氧气、水蒸气共同作用的结果
D.回收废旧金属也是保护金属资源的一项重要措施
重难点一:
金属资源保护与利用
C
【思路点拨】 A.从结构看金属原子的最外层电子数一般少于4个,易失电子,故A正确;B.铁与氧气、水同时接触时会发生锈蚀,铁制品表面涂油漆能防锈蚀的原因是隔绝了氧气和水,故B正确;C.铜锈的主要成分是Cu2(OH)2CO3,由质量守恒定律可知:铜制品的锈蚀是铜与二氧化碳、氧气、水蒸气共同作用的结果,故C错误;D.回收废旧金属也是保护金属资源的一项重要措施,故D正确。
(2022·成都)我国有着悠久的钢铁冶炼史,《天工开物》中记载的“炒钢法”如图1,该方法的生产过程可用图2表示。【查阅资料】:①潮泥灰主要成分是石灰石。②铁的熔点是1535℃。
重难点二:
铁的冶炼
(1)常见的铁矿石有赤铁矿和 (合理即可)(写一种)。
(2)不断鼓入空气的目的是 。
(3)炼铁炉中生成铁的化学方程式为
(写一种)。
磁铁矿
充分反应,提高炉温
3CO+Fe2O3 2Fe+3CO2
高温
(4)撒入潮泥灰主要作用是 。不断翻炒液态生铁,是为了降低 的含量。
(5)钢的性能优良,如钢的熔点比纯铁 ,易于加工。
将铁矿石中的二氧化硅转化为炉渣而除去
碳或C
低
【思路点拨】 (1)常见的铁矿石有赤铁矿和磁铁矿或菱铁矿(合理即可);(2)不断鼓入空气的目的是使碳与氧气反应,放热,提高炉温;(3)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:3CO+Fe2O3 2Fe+3CO2。高温条件下四氧化三铁和一氧化碳反应生成铁和二氧化碳,该反应的化学方程式:4CO+Fe3O4 3Fe+4CO2;(4)撒入潮泥灰主要作用是将铁矿石中的二氧化硅转化为炉渣而除去,生铁和钢的区别是含碳量不同,不断翻炒液态生铁,使生铁中碳与氧气接触反应生成二氧化碳,降低碳元素的含量得到钢。(5)合金的熔点低于组成它的纯金属,钢的熔点比纯铁低,易于加工。
(2021·枣庄)向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液,滤液呈蓝色。下列说法正确的是( )
A.滤渣中—定有Ag、Cu
B.滤液中一定有Cu2+、Zn2+
C.向滤渣中滴加稀盐酸一定有气泡产生
D.向滤液中加入稀盐酸一定有沉淀生成
重难点三:
金属活动性顺序的应用——判断反应后溶液滤渣和滤液成分
B
【思路点拨】 由于金属活动性的强弱是锌>铜>银,向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉,锌先与AgNO3反应生成硝酸锌和银,AgNO3反应完,若还有锌粉,锌才能与Cu(NO3)2反应生成硝酸锌和铜,充分反应后过滤,得到滤渣和滤液,滤液呈蓝色,说明了溶液中含有硝酸铜,锌没有剩余,滤渣中一定含有银,可能含有铜。A.由上述分析可知,滤渣中—定有Ag,可能含有Cu,故选项说法错误。B.滤液中一定有Cu2+、Zn2+,故选项说法正确。C.由于锌没有剩余,向滤渣中滴加稀盐酸一定没有气泡产生,故选项说法错误。D.滤液中不一定含有银离子,向滤液中加入稀盐酸不一定有沉淀生成,故选项说法错误。
(2022·日照模拟)现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示( 已知甲、乙、丙在生成物中化合价均为+2价)。 则下列说法中不正确的是( )
A.相对原子质量:丙>乙>甲
B.生成氢气的质量:甲>乙>丙
C.甲、乙、丙可能分别是锌、铁、镁
D.消耗硫酸的质量:甲>乙>丙
重难点四:
有关金属的坐标曲线题
C
【思路点拨】 A.三种金属的化合价、金属的质量都相等,完全反应放出氢气的质量与金属的相对原子质量成反比,即产生氢气多的相对原子质量小。在三种金属完全反应后,放出H2的质量是甲>乙>丙,所以可判断相对原子质量是丙>乙>甲,故A正确;B.根据反应生成H2的质量与反应时间的关系图所示,在三种金属完全反应后,放出H2的质量是甲>乙>丙,故B正确;C.由金属的活泼性:丙>乙>甲,及相对原子质量:甲>乙>丙,可知甲、乙、丙不可能分别为锌、铁、镁,故C错误;D.金属与酸的反应生成氢气时,氢气来源于酸中的氢元素,所以生成的氢气与消耗的酸的多少顺序一致,消耗硫酸的质量:甲>乙>丙,故D正确。
金属与酸反应的坐标曲线分析(以镁、铝、锌、铁对比)
1.反应的快慢(速率)由金属的活动性顺序决定,反应速率越快,单位时间产生的氢气越多,活动性越强:Mg>Al>Zn>Fe。
2.生成氢气的质量必须用金属或酸中的不足量进行计算:当等质量的金属与足量的酸反应时,m(H2)= ,因为金属质量相等,所以“金属的化合价/金属的相对原子质量”的得
m(金属)×金属的化合价
金属的相对原子质量
数越大(注:Al为+3价),产生氢气越多:Al(3/27)>Mg(2/24)>Fe(2/56)>Zn(2/65 )。
当等质量的酸与足量的金属反应时,酸不足,以酸来算,与哪种金属及金属质量都无关。如果同种酸和酸的质量浓度都相等,则产生氢气的量一样。
★金属材料
1.(2022·临沂)下列有关金属材料的说法不正确的是( )
A.铜常用作导线,说明铜具有良好的导电性
B.“真金不怕火炼”说明金的化学性质不活泼
C.生铁和钢是含碳量不同的两种铁合金
D.铝制品具有很好的抗腐蚀性,说明铝的金属活动性比较弱
基础过关
D
2.(2022·葫芦岛)下列有关金属的说法正确的是( )
A.所有金属都呈银白色
B.常温下,所有的金属都是固体
C.为了增加金属产量,大量开采金属矿物
D.金属的回收利用,能减少对环境的污染
D
★金属资源的保护和利用
3.(2022·沈阳)为了防止钢铁制品锈蚀,下列做法不正确的是( )
A.用洗涤剂除去铁制品表面的油膜
B.在车船的表面喷涂油漆
C.在铁制品表面镀上一层其他金属
D.将使用后的菜刀用布擦干
A
4.(2022·陕西)如图所示,将两枚光亮的铁钉分别用细线吊置于甲、乙中,并使部分铁钉露出液面。放置一段时间,出现了锈蚀。下列说法不正确的是( )
A.甲、乙中,气体含氧气的体积分数不相等
B.甲中,铁钉在植物油内的部分没有锈蚀
C.乙中,铁钉在水面下的部分锈蚀最严重
D.丙中,导管内上升一段水柱
C
★金属的化学性质
5.(2022·安徽模拟)通过观察实验,学会从化学的角度分析问题,可以发展学科核心素养。下列根据镁条相关实验现象推出的结论不正确的是( )
A.镁条可以在二氧化碳中燃烧,说明燃烧不一定需要氧气
B.镁条在空气中燃烧后质量减轻,说明氧化镁逸散
C.镁条可以和盐酸反应产生氢气,说明镁适合用于实验室制取氢气
D.镁条放入滴加酚酞的热水中产生气泡,溶液变红,说明镁可与热水发生化学反应
C
6.(2022·重庆模拟)如图为某化学反应的微观示意图,已知金属镍(Ni)是一种银白色金属,含有Ni2+的溶液呈绿色。下列有关说法不正确的是( )
A.由图可知金属Ni的活动性比铜强
B.该反应的现象之一是产生红色固体
C.金属Ni和铁与硫酸铜溶液的反应现象相似
D.该反应的化学方程式为:2Ni+CuSO4===Ni2SO4+Cu
D
★金属活动性的判断和验证
7.(2022·聊城)为探究铜、锌、X三种金属的活动性,某同学做了如下实验。则三种金属的活动性由强到弱的顺序是( )
A.锌 X 铜 B.X 锌 铜
C.锌 铜 X D.铜 X 锌
A
8.(2022·徐州)如图所示,用导线将锌片和铜片分别连接到电流表的正负极,插入硫酸铜溶液中即可构成化学电池。下列说法不正确的是( )
A.该装置将化学能直接转化成电能
B.反应后烧杯中溶液的质量变小
C.实验说明锌的金属活动性大于铜
D.涉及的反应为Zn+CuSO4===Cu+ZnSO4
B
9.(2022·孝感)为验证锌,铁、铜三种金属的活动性顺序,小红设计了如图所示的四个实验,下列说法中正确的是( )
A.通过实验①②③能验证锌的金属活动性比铁的强
B.实验③中溶液的质量变大
C.X可能为锌,Y可能为硫酸亚铁
D.只做实验③和④,一定不能验证锌、铁、铜的金属活动性顺序
C
★金属反应中相关质量问题
10.(2022·怀化)现有质量相等的X、Y、Z三种金属,分别放入三份溶质质量分数相等的足量稀硫酸中,X不发生反应,Y、Z在生成物中均显+2价,Y、Z反应生成氢气的质量与反应时间的关系如图所示,则下列说法正确的是( )
A.X、Y、Z的金属活动性顺序为:Y>Z>X
B.相对原子质量:Y>Z
C.完全反应消耗稀硫酸的质量:Y<Z
D.Y与H2SO4反应的化学方程式为:Y+H2SO4===YSO4+H2↑
D
11.(2022·湖北)实验课上,某同学将一定质量的镁粉加入到硫酸亚铁溶液中,待反应结束后,过滤,得到滤液和滤渣,下列判断正确的是( )
A.滤液中一定含有硫酸镁,可能含有硫酸亚铁
B.若滤液为浅绿色,则滤渣中一定含有镁和铁
C.向滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有镁
D.所得滤液的质量一定比原溶液的质量大
A
12.(2022·衡阳)向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法错误的是( )
A.a点时,溶液的总质量与反应前相比减小
B.b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液
C.c点时,溶液呈无色
D.d点时,过滤所得滤渣为Cu和Ag的混合物
C
★反应先后顺序问题
13.(2022·重庆)学会识图能发展科学思维。一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图。下列猜想正确的有( )
①0~t1阶段,可能是铝表面有层氧化膜
②t1~t2阶段,可能是铝和稀盐酸反应放出热量
③t3时刻,可能是稀盐酸过量
④t3时刻,可能是稀盐酸不足
A.1项 B.2项 C.3项 D.4项
D
14.(2022·常德)向一定质量CuSO4、FeSO4的混合溶液中加入一定质量的锌粉,充分反应后过滤,得到滤液和滤渣。下列说法正确的是( )
A.若滤渣中只有一种金属,则滤液中的溶质一定有三种
B.若滤渣中有两种金属,则滤液中的溶质一定有两种
C.若滤液中只有一种溶质,则向滤渣中加入稀盐酸一定有气泡产生
D.若滤液中有两种溶质,则向滤渣中加入稀盐酸不可能有气泡产生
C
15.(2022·通辽)向一定量银、铜、铁混合金属中加入硝酸银溶液充分反应,固体的质量与加入硝酸银溶液的质量关系如图所示。下列说法不正确的是( )
A.a点溶液呈浅绿色
B.b点消耗固体的质量小于析出固体的质量
C.取c点固体滴加稀盐酸,无气泡产生
D.c、d点溶液中溶质相同
D
★金属的冶炼
16.(2022·赤峰改编)铁及其合金是日常生活中应用广泛的金属材料,以下对铁的冶炼进行探究。
Ⅰ.钢铁冶炼的部分工艺流程如图所示
(1)焦炭的作用是 。
燃烧提高热量和反应提供还原剂CO
(2)在钢水铸件机中,高温钢水加工成钢制零件时,充入氮气的作用是 。
(3)流程的最后一道操作是涂层(即在金属制品表面进行喷漆或搪瓷等),该操作的主要目的是 。
作保护气,防止铁在高温下被空气中的氧气氧化
隔绝氧气和水,防止金属制品生锈
Ⅱ.在实验室中进行模拟炼铁实验如图所示(固定装置略)。
【查阅资料】CO能溶于铜液【醋酸二氨合铜(Ⅰ)和氨水的混合液】
(1)按如图连接装置A-E,在装入试剂前,先 。
(2)通入CO2一段时间后,先点燃 处酒精喷灯(填“A”或“D”)。
检查装置的气密性
A
(3)装置C中玻璃管的作用 。
(4)装置D的实验现象: 。
(5)某同学认为该装置有缺陷,需在装置E后再连接装置F,其目的是 。装置E、F的接口连接顺序:a连接 . (填“b”或“c”)。
平衡装置内外压强
红色固体变成黑色
吸收一氧化碳
c
17.(2022·包头)某同学绘制了含铁元素的部分物质转化关系图(图中“→”表示一种物质可以转化为另一种物质,部分反应物、生成物及反应条件已略去),下列说法正确的是( )
A.铁丝能在空气中剧烈燃烧实现转化①
B.转化②可通过Fe3O4与CO发生置换反应实现
C.氧气和水同时存在是实现转化③的主要条件
D.通过Fe与ZnSO4溶液反应可实现转化④
能力提升
C
18.(2022·威海)物尽其用——金属之“铝”。生产生活中铁、铝及其合金制品随处可见。
(1)铝制易拉罐(如图1)某品牌碳酸
饮料的易拉罐是由铝合金制成的,
内壁附着一层有机薄膜。该铝合金中铝的含量约为97%,还含有镁、锰、铁、铟(In)等。
①将易拉罐剪成条状,打磨后与纯铝片相互刻划,发现纯铝片表面有划痕,说明 。
铝合金的硬度大于纯铝的硬度
②请你推测组成有机薄膜的物质具有的性质: 、
(任写两条)。
③“是否应该停止使用铝制易拉罐”是当前的一个社会性科学议题。有同学认为应该停止使用铝制易拉罐,理由可能 . (写一条即可);也有同学支持继续使用铝制易拉罐,请你结合铝的性质阐述理由 、 (任写两条)。
不与酸反应
无毒
浪费金属资源
铝的密度小
具有良好的延展性
④生活垃圾要分类投放,可与废弃易拉罐作为同一类投放的是
(填字母序号)。
A.废旧电池 B.废弃口罩 C.厨余垃圾 D.废旧铁锅
(2)储氢材料储氢材料的研发是氢能源技术的关键之一。金属铝可用作储氢材料,储氢后生成氢化铝(AlH3),其中氢元素的化合价为 ;释氢原理为氢化铝与水反应释放氢气,同时生成氢氧化铝,其反应的化学方程式为_________________________________。
D
-1
AlH3+3H2O===Al(OH)3+3H2↑
(3)制备铝:工业上常用电解氧化铝制备铝,反应的化学方程式为_______________________________。
(4)铝合金中的铟(In):如图2为铝、
铟的原子结构示意图。某同学推测
金属铟与铝的化学性质相似,理由是 。实验证明,铟可以与稀盐酸反应,其反应的化学方程式为 。
2Al2O3 4Al+3O2↑
通电
原子的最外层电子数相同
2In+6HCl===2InCl3+3H2↑
19.(2022·海南)2022年春晚舞蹈《只此青
绿》源于宋代名作《千里江山图》。
(1)《千里江山图》流传千年依旧色彩艳丽,
璀璨夺目,与所用矿石颜料有关。说明所
用矿石颜料化学性质 (填“稳定”或“不稳定”);
(2)矿石颜料之一赭石(主要成分为Fe2O3)属赤铁矿,我国早在春秋战国时就开始炼铁。用赤铁矿炼铁的主要反应原理是_______________________________(用化学方程式表示);
稳定
Fe2O3+3CO===2Fe+3CO2
(3)实验室可用如右上图所示的装置进行模拟炼铁。反应前大玻璃管中加入铁的氧化物(FexOy)试样的质量为12.6 g。加热前,应先往大玻璃管中通入CO的原因是 。实验结束后,继续通入CO气体,直至大玻璃
管冷却。此时NaOH溶液的质量增加了7.7 g。
推算该铁的氧化物的化学式中x、y的比为
(填最简整数比)。
排尽空气,防止爆炸
1∶1
1.(2022·广州)人类从石器时代进入青铜器时代,继而进入铁器时代,都是以金属材料的使用作为标志的。下列说法正确的是( )
A.铝制品在常温下有良好的抗腐蚀性
B.纯铜比铜合金更适合用于制作耐磨齿轮
C.铁锅清洗后未擦干的水可隔绝空气减缓锈蚀
D.含铅、汞等重金属的废旧电池不可回收利用
A
2.(2022·广东)对铁生锈与燃烧条件的实验探究如图所示。下列说法正确的是( )
A.对比①②可探究:接触氧气是否为铁生锈的条件之一
B.对比②③可探究:接触水是否为铁生锈的条件之一
C.对比①④可探究:温度达到着火点是否为铁燃烧的条件之一
D.对比③④可探究:接触氧气是否为铁燃烧的条件之一
C
3.(2019·广东) 探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是( )
A.甲和乙:水
B.乙和丙:空气
C.甲和丙:空气
D.甲和丁:水
D
4.(2019·广东) 取一定量打磨后的铝片置于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是( )
A B C D
B
5.(2018·广东) 利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A.铁+稀盐酸 B.铜+稀盐酸
C.银+稀盐酸 D.铜+硝酸银溶液
C
同课章节目录
