专题7、8综合训练(含解析)2022——2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题7、8综合训练(含解析)2022——2023学年下学期高一化学苏教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 469.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 10:29:11 | ||
图片预览




文档简介
专题7、8综合训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.向浅绿色的Fe(NO3)2溶液中逐滴加入稀硫酸时,溶液的颜色变化应该是
A.变浅 B.加深 C.不变 D.变棕黄色
2.为检验一种氮肥的成分,某学习小组同学进行了以下实验:①加热氮肥样品生成气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种无色无味气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是
A.NH4HCO3 B.NH4Cl C.(NH4)2CO3 D.NH4NO3
3.下列物质中,不属于“城市空气质量日报”报道内容的是
A.悬浮颗粒 B.氮氧化物 C.二氧化硫 D.二氧化碳
4.下列说法正确的是
A.pH在5.6~7.0之间的雨水通常称为酸雨
B.NO可用NaOH溶液吸收
C.过氧化钠可做潜水艇中的“供氧剂”
D.大气中SO2的主要来源是汽车排出的尾气
5.某实验过程如图所示,则试管③中的现象是
A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
6.下面是实验室制取氨气的装置和选用的试剂,其中错误的是
A.①② B.③④ C.①③ D.②④
7.下列关于氮气的说法中,正确的是
A.通常情况下,氮气性质比较稳定
B.可在氧气中燃烧,生成一氧化氮
C.1molN2与3molH2完全反应生成2molNH3
D.氮元素是活泼的非金属元素,氮气在化学反应中作氧化剂
8.文献记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”下列有关“气”的说法错误的是
A.将“气”通入溴水中,溴水褪色且分层
B.常温下,将“气”通入水中生成
C.该“气”能作植物生长的调节剂,促进植物生长
D.将“气”通入酸性溶液中,发生氧化反应,溶液褪色
9.化学是材料科学的基础。下列说法错误的是
A.制造5G芯片的氮化铝晶圆属于无机非金属材料
B.制造阻燃或防火线缆的橡胶不能由加聚反应合成
C.制造特种防护服的芳纶纤维属于有机高分子材料
D.可降解聚乳酸塑料的推广应用可减少“白色污染”
10.将6.6g由甲烷与丙烯组成的混合气通入盛有溴水(足量)的洗气瓶,反应后测得溴水增重4.2g,则混合气中甲烷和丙烯的体积比
A.2∶3 B.3∶2 C.1∶2 D.2∶1
11.能证明乙烯分子中含有一个碳碳双键的事实是
A.乙烯分子中碳、氢原子的个数比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴水发生加成反应,且1mol乙烯完全加成需消耗1mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
12.实验室制备硝基苯时,经过配制混酸、硝化反应(50~60℃)、洗涤分离、干燥蒸馏等步骤,如图装置和原理能达到目的的是
A B C D
配制混酸 硝化反应 分离硝基苯 蒸馏硝基苯
A.A B.B C.C D.D
13.下列有关糖类的说法正确的是
A.糖类都符合通式Cn(H2O)m
B.符合通式Cn(H2O)m的都是糖类
C.纤维素没有甜味,不属于糖类,糖类都有甜味
D.糖类是人类维持生命的六大类营养素之一
二、多选题
14.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是
A.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料
B.X的氢化物是分子晶体,因其分子间存在氢键,所以该晶体更稳定
C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸
D.X氢化物的水溶液与X最高价氧化物对应的水化物的水溶液不能相互反应
15.下列说法不正确的是
A.烷烃的通式为CnH2n+2,随n的增大,碳元素的质量分数逐渐减小
B.和互为同系物
C.烷烃分子中一定含有碳碳单键
D.分子式为C5H12的烷烃的一氯代物的可能有一种
三、实验题
16.某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O)
(实验探究)
(1)A装置N元素的化合价是__该反应是否是氧化还原反应:__。
(2)用5.35gNH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为___L。(NH4Cl的摩尔质量为53.5g mol-1)
(3)气体通过C、D装置时,试纸颜色会发生变化的是D,原因是:___。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___。
(5)检验氨气是否收集满的方法是___。
(6)某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有__性质填序号。
a.还原性
b.极易溶于水
c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3+6NO2=7N2+12H2O该反应中氨气体现___(填“氧化性”或“还原性”)。
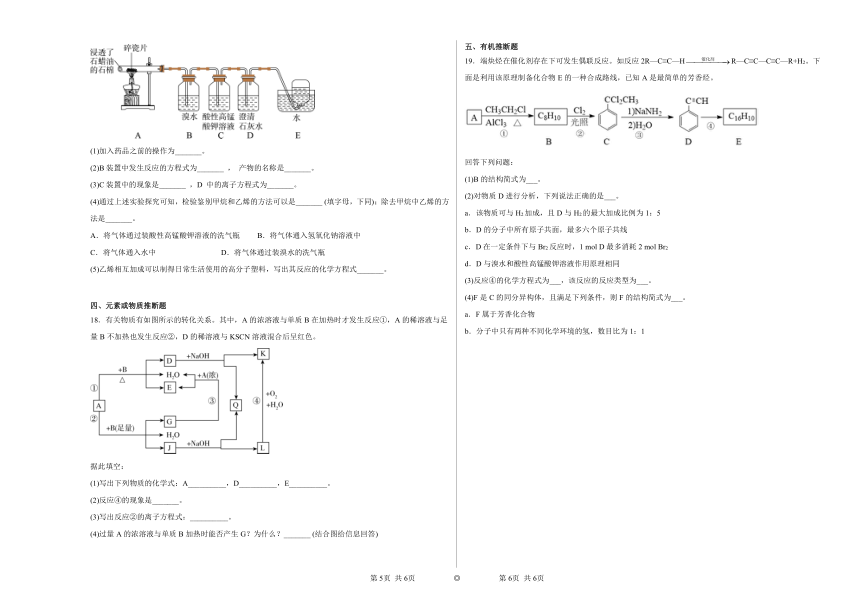
17.乙烯是一种重要的化工原料,工业上可用石蜡油制得,某实验小组用下列装置模拟该工业过程制备乙烯,并探究它的化学性质。
(1)加入药品之前的操作为_______。
(2)B装置中发生反应的方程式为_______ , 产物的名称是_______。
(3)C装置中的现象是_______ ,D 中的离子方程式为_______。
(4)通过上述实验探究可知,检验鉴别甲烷和乙烯的方法可以是_______ (填字母,下同);除去甲烷中乙烯的方法是_______。
A.将气体通过装酸性高锰酸钾溶液的洗气瓶 B.将气体通入氢氧化钠溶液中
C.将气体通入水中 D.将气体通过装溴水的洗气瓶
(5)乙烯相互加成可以制得日常生活使用的高分子塑料,写出其反应的化学方程式_______。
四、元素或物质推断题
18.有关物质有如图所示的转化关系。其中,A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B不加热也发生反应②,D的稀溶液与KSCN溶液混合后呈红色。
据此填空:
(1)写出下列物质的化学式:A__________,D__________,E__________。
(2)反应④的现象是_______。
(3)写出反应②的离子方程式:__________。
(4)过量A的浓溶液与单质B加热时能否产生G?为什么?_______ (结合图给信息回答)
五、有机推断题
19.端炔烃在催化剂存在下可发生偶联反应。如反应2R—C≡C—HR—C≡C—C≡C—R+H2。下面是利用该原理制备化合物E的一种合成路线,已知A是最简单的芳香烃。
回答下列问题:
(1)B的结构简式为___。
(2)对物质D进行分析,下列说法正确的是___。
a.该物质可与H2加成,且D与H2的最大加成比例为1:5
b.D的分子中所有原子共面,最多六个原子共线
c.D在一定条件下与Br2反应时,1 mol D最多消耗2 mol Br2
d.D与溴水和酸性高锰酸钾溶液作用原理相同
(3)反应④的化学方程式为___,该反应的反应类型为___。
(4)F是C的同分异构体,且满足下列条件,则F的结构简式为___。
a.F属于芳香化合物
b.分子中只有两种不同化学环境的氢,数目比为1:1
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀硫酸时,发生反应的离子方程式为:3Fe2++NO+4H+=3Fe3++NO↑+2H2O,三价铁离子为棕黄色。
故选D。
2.A
【详解】气体能使湿润的红色石蕊试纸变蓝,说明该气体是氨气,即该氮肥中含有;另一种气体能使澄清石灰水变浑浊,说明该气体是CO2;说明该氮肥中含有或,取少量该氮肥样品溶于水,并加入少量氯化钡溶液,没有明显变化,说明该氮肥中没有,因此该氮肥应该是碳酸氢铵, A正确。
故选A。
3.D
【详解】空气的污染途径是工厂废气的任意排放、大量燃烧化石燃料、汽车尾气的排放等,可总结为:有害气体和烟尘,空气质量报告中主要报告对人体有害的一些污染性成分的含量,可吸入颗粒物、总悬浮颗粒物,二氧化硫、二氧化氮、一氧化碳等都属于空气的污染物,二氧化碳不是污染物,不属于城市空气质量日报的内容,故D符合题意;
答案为D。
4.C
【详解】A. pH小于5.6的雨雪或其他形式的降水称为酸雨,故A错误;
B.NO是不成盐氧化物,不能与NaOH溶液反应,若NO、氧气一起通入氢氧化钠溶液,则可以被吸收,故B错误;
C.过氧化钠能分别与水、二氧化碳反应放出氧气,可做潜水艇中的“供氧剂”,故C正确;
D. 大气中SO2的主要来源是化石燃料的燃烧,可导致酸雨,汽车尾气主要含氮氧化物、一氧化碳等,故D错误;
答案为C。
5.D
【详解】管①中铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据图知,Cu有剩余,硝酸不足量,向③中加入稀硫酸,酸性条件下,硝酸根离子具有强氧化性,相当于又有稀硝酸,则硝酸和铜又发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的无色气体NO不稳定,被氧气氧化生成红棕色气体NO2,同时Cu片溶解,所以看到的现象是铜片溶解,且有无色气体生成,该气体在试管口变为红棕色,故选D。
答案选D。
6.C
【详解】①NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,不能用来制备氨气,故①错误;
②向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨气逸出,故②正确;
③固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免水倒流到试管底部、冷热不匀损坏试管,故③错误;
④浓氨水易挥发,浓氨水加热可以制取NH3,故④正确;
制取氨气的装置和选用的试剂错误的有①③。C符合题意;
故选C。
7.A
【详解】A.通常情况下,氮气分子中含有氮氮叁键,键能大,性质比较稳定,A正确;
B.N2不能在O2中燃烧,与O2在放电时反应生成NO,B错误;
C.N2与H2的反应是可逆反应,1molN2与3molH2不可能完全反应生成2molNH3,C错误;
D.氮气中氮元素的化合价为零价,在化学反应中即可升高也可降低,即可作氧化剂,也可作还原剂,D错误;
故选A。
8.B
【分析】“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”,乙烯是催熟剂,这里的“气”指的是乙烯。
【详解】A.将乙烯通入溴水中,生成1,2-二溴乙烷,1,2-二溴乙烷难溶于水,所以溴水褪色且分层,故A正确;
B.常温下,乙烯和水不反应,故B错误;
C.乙烯能作植物生长的调节剂,促进植物生长,故C正确;
D.乙烯含有碳碳双键,将乙烯通入酸性溶液中,乙烯能被高锰酸钾溶液氧化,溶液褪色,故D正确;
选B。
9.B
【详解】A.氮化铝是一种高温结构陶瓷,属于新型的无机非金属材料,A正确;
B.天然橡胶的单体为异戊二烯,合成橡胶的单体如顺丁烯等中均含有碳碳双键,通过加聚反应合成制得橡胶,B错误;
C.“涤纶”“锦纶”“腈纶”“丙纶”“维纶”“氯纶”“芳纶”等均为合成纤维,属于有机高分子材料,C正确;
D.可降解聚乳酸塑料的推广应用,可以减少难以降解塑料的使用,从而减少“白色污染”,D正确;
故答案为:B。
10.B
【分析】丙烯能与溴水加成反应使溴水增重,甲烷不能与溴水反应,所以增重的质量即为乙烯的质量。
【详解】溴水增重4.2g,即丙烯的质量为4.2g,n(C2H4)==0.1mol。则混合气体中甲烷质量为6.6g-4.2g=2.4g,n(CH4)==0.15mol。n(CH4):n(C3H6)=0.15mol:0.1mol=3:2,B正确。
11.C
【详解】A.分子中的碳氢原子个数比不能说明其含有一个碳碳双键,如环丙烷中碳、氢原子个数比也为1:2,但不含碳碳双键,A不符合题意;
B.燃烧产物的物质的量相等,只能说明该物质中碳原子和氢原子个数比为1∶2,不能说明含有一个碳碳双键,B不符合题意;
C.1mol乙烯只能与1mol溴单质加成,说明乙烯分子中含有一个碳碳双键,C符合题意;
D.被酸性KMnO4溶液氧化,说明含有该有机物中含有碳碳不饱和键等,不能说明含有一个碳碳双键,D不符合题意;
答案为C。
12.C
【详解】A.配制混酸应将浓硫酸倒入浓硝酸中,A错误;
B.硝化反应加热应选择水浴加热,B错误;
C.硝基苯难溶于水,密度比水大,在下层,可通过分液分离,C正确;
D.冷凝水应下进上出,D错误;
故选C。
13.D
【详解】A.不符合Cn(H2O)m这一通式的物质也可能属于糖类,如脱氧核糖C5H10O4、鼠李糖C6H12O5,A错误;
B.糖类俗称碳水化合物,大都可用Cn(H2O)m来表示,但符合这一通式的不一定都是糖,如乙酸CH3COOH、甲酸甲酯HCOOCH3[C2(H2O)2]等,B错误;
C.纤维素没有甜味,但属于糖类,糖不一定有甜味,如多糖:淀粉、纤维素,C错误;
D.人体的六大营养物质是:水、无机盐、蛋白质、油脂、糖类和维生素,糖类是人类维持生命的营养素之一,D正确;
答案选D。
14.BD
【分析】Z原子最外层电子数不超过8,所以X内层为K层,K层电子数是2,则Z最外层电子数是6,Y最外层电子数是3,X、Y、Z最外层电子数之和为14,X最外层电子数为14 6 3=5,X核外电子数是7,则X为N元素;N元素位于第二周期,Y和Z位于第三周期,Y的最外层电子数是3、Z原子最外层电子数是6,则Y是Al、Z是S元素,据此解答。
【详解】A.Y的氧化物是Al2O3,氧化铝既可与强酸反应又可与强碱反应,属于两性氧化物,氧化铝熔点很高,可用来制作耐火材料,故A说法正确;
B.X的氢化物是NH3,氨气形成的晶体为分子晶体,氨气的稳定性与N—H键键能有关,与氢键无关,故B说法不正确;
C.X和Z的最高价氧化物对应的水化物分别是HNO3、H2SO4,浓硝酸和浓硫酸都是强氧化性酸,故C说法正确;
D.X的氢化物是NH3,X的最高价氧化物的水化物是HNO3,氨水溶液呈碱性、硝酸溶液呈酸性,二者能相互反应,故D说法不正确;
故选:BD。
15.AC
【详解】A.烷烃的通式为CnH2n+2,随着分子中n的增大,碳元素的质量分数将逐渐增大,A错误;
B.两者中C原子之间以单键结合,剩余价电子全部与H原子结合,二者结构相似,在分子组成上相差1个CH2原子团,因此二者互为同系物,B正确;
C.烷烃分子中若只有1个C原子,该烷烃是甲烷,分子中就不存在碳碳单键,C错误;
D.分子式为C5H12表示的烷烃有正戊烷、异戊烷、新戊烷三种,若为新戊烷,其分子中也只有一种H原子,其一氯取代物仅只有一种,D正确;
故选:AC。
16. -3 否 2.24 氨气与水反应生成一水合氨呈碱性 产生白烟 用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满 B、C 还原性
【分析】A为实验室制取氨气,B中的干燥剂为了除去水,C、D为了说明干燥的氨气不能使红色石蕊试纸变色,干燥的氨气通过湿润的红色石蕊试纸,生成一水合氨,能使试纸变蓝,氨气与水反应生成一水合氨呈碱性,浓盐酸易挥发,氯化氢气体与氨气反应生成氯化铵固体,可观察到的现象是产生白烟,据此解题。
【详解】(1)A装置为制备氨气的装置,N元素的化合价是-3;该反应不是氧化还原反应;
故答案为:-3;否;
(2)5.35gNH4Cl的物质的量n==0.1mol,由化学方程式2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O可知,最多可制得0.1mol的氨气,标准状况下氨气的体积V=0.1mol×22.4L/mol=2.24L;
故答案为:2.24L;
(3)干燥的氨气不能使红色石蕊试纸变色,干燥的氨气通过湿润的红色石蕊试纸,生成一水合氨,能使试纸变蓝;
故答案为:氨气与水反应生成一水合氨呈碱性;
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,浓盐酸易挥发,氯化氢气体与氨气反应生成氯化铵固体,可观察到的现象是产生白烟;
故答案为:产生白烟;
(5)检验氨气是否收集满的方法是:用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满;
故答案为:用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满;
(6)烧瓶内产生红色喷泉的现象,说明氨气极易溶于水且具有碱性;
故答案为:B、C;
(7)由反应8NH3+6NO2=7N2+12H2O可分析出NH3作为还原剂,因此该反应中氨气体现还原性;
故答案为:还原性;
17.(1)检查装置气密性
(2) CH2=CH2+Br2→CH2BrCH2Br 1,2-二溴乙烷
(3) 酸性高锰酸钾溶液褪色 CO2+Ca2++2OH-=CaCO3↓+H2O
(4) AD D
(5)n CH2=CH2
【分析】装置A中对浸透了石蜡油的石棉加热,产生的乙烯通到B中与溴发生加成反应使溴水褪色,乙烯能被C中的酸性高锰酸钾溶液氧化使酸性高锰酸钾溶液褪色,同时产生二氧化碳,产生的二氧化碳能被D中澄清石灰水吸收,乙烯不溶于水,装置E用于收集乙烯。
【详解】(1)该实验有气体参与反应,因此加入药品之前,应先检查装置气密性。
(2)B中乙烯和溴发生加成反应生成1,2-二溴乙烷,反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br。
(3)乙烯中含碳碳双键,能被酸性高锰酸钾溶液氧化,因此C装置中的现象是:酸性高锰酸钾溶液褪色,两者反应生成了二氧化碳,二氧化碳能与D中澄清石灰水反应,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O。
(4)A.甲烷不能使酸性高锰酸钾溶液褪色,乙烯能酸性高锰酸钾溶液褪色,因此将气体通过装酸性高锰酸钾溶液的洗气瓶,可以鉴别甲烷和乙烯,但不能除去甲烷中的乙烯,因为乙烯与酸性高锰酸钾溶液反应会生成二氧化碳;
B.甲烷和乙烯均不能与氢氧化钠溶液反应,将气体通入氢氧化钠溶液中,既不能鉴别甲烷和乙烯,也不能除去甲烷中的乙烯;
C.甲烷和乙烯均不溶于水,也不与水反应,将气体通入水中,既不能鉴别甲烷和乙烯,也不能除去甲烷中的乙烯;
D.甲烷不与溴水反应,不能使溴水褪色,乙烯能与溴发生加成反应使溴水褪色,将气体通过装溴水的洗气瓶,既能鉴别甲烷和乙烯,也能除去甲烷中的乙烯;
因此鉴别甲烷和乙烯的方法可以是:AD,除去甲烷中乙烯的方法是:D。
(5)乙烯中含碳碳双键,能发生加聚反应生成聚乙烯,反应的化学方程式为:n CH2=CH2 。
18. HNO3 Fe(NO3)3 NO2 白色沉淀变成灰绿色,最终为红褐色沉淀 3Fe+8H++2NO=3Fe2++2NO↑+4H2O 不能。根据图中反应③,NO遇浓硝酸可转化为NO2
【详解】(1)转化关系图中分析判断,单质B和A的浓溶液加热时才能发生反应,说明A为金属,在浓酸溶液中发生钝化,加热发生反应,A的稀溶液和B单质反应生成产物与B与浓溶液加热反应产物不同,说明B为变价元素,判断为Fe,A为HNO3,D为Fe(NO3)3,E为NO2,G为Fe(NO3)2,L为Fe(OH)2,K为Fe(OH)3,Q为NaNO3,所以本题答案为:HNO3;Fe(NO3)3;NO2;
(2)反应④是氢氧化亚铁被空气中氧气氧化生成氢氧化铁,反应的现象是,白色沉淀迅速变化为灰绿色,最后变化为红褐色沉淀;故答案为:白色沉淀变成灰绿色,最终为红褐色沉淀;
(3)反应②是过量铁和稀硝酸反应生成硝酸亚铁、一氧化氮和水,反应的离子方程式为:3Fe+2NO+8H+═3Fe2++2NO↑+4H2O;故答案为:3Fe+2NO+8H+═3Fe2++2NO↑+4H2O;
(4)由反应2HNO3+NO═3NO2+H2O知,结合化学平衡移动原理分析,在浓HNO3中,平衡正向进行不可能生成NO;故答案为:不能。根据图中反应③,NO遇浓硝酸可转化为NO2;
【点睛】铁和稀硝酸反应的产物与量有关,硝酸足量时生成硝酸铁、一氧化氮和水,铁过量时,生成硝酸亚铁、一氧化氮和水,此为易错点。
19.(1)
(2)ab
(3) 2→+H2 取代反应
(4)
【分析】A是最简单的芳香烃,则A是,A与CH3CH2Cl在AlCl3催化作用下发生取代反应产生B:,B与Cl2在光照条件下发生取代反应产生C:,C与NaNH2、H2O发生反应产生D:,D发生取代反应产生。据此分析解答。
【详解】(1)根据上述分析可知B结构简式是;
(2)a.D是,该物质含有苯环及碳碳三键,可与H2加成,且D与H2的最大加成比例为1:5,a正确;
b.苯分子是平面分子,乙炔分子是直线型结构。乙炔分子中与苯环连接的C原子取代苯分子中H原子位置,在苯分子平面上;一条直线上两点在一个平面上,则该直线上所有点都在该平面上,所以D的分子中所有原子共平面;苯环上处于对位的C原子在同一条直线上,由于键角是180°,所以该平面上最多六个原子共直线,b正确;
c.D在一定条件下与Br2反应时,苯环及碳碳三键都可以与Br2发生加成反应,则1 mol D最多消耗5 mol Br2,c错误;
d.D与溴水发生加成反应,与酸性高锰酸钾溶液发生氧化反应,故二者的作用原理不相同,d错误;
故合理选项是ab;
(3)反应④是在一定条件下2个分子的D发生取代反应产生E:,反应方程式为:2→+H2,该反应类型为取代反应;
(4)C是,F是C的同分异构体,满足条件:a.F属于芳香化合物,说明含有苯环;b.分子中只有两种不同化学环境的氢,数目比为1:1,则符合题意的同分异构体为 。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.向浅绿色的Fe(NO3)2溶液中逐滴加入稀硫酸时,溶液的颜色变化应该是
A.变浅 B.加深 C.不变 D.变棕黄色
2.为检验一种氮肥的成分,某学习小组同学进行了以下实验:①加热氮肥样品生成气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种无色无味气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是
A.NH4HCO3 B.NH4Cl C.(NH4)2CO3 D.NH4NO3
3.下列物质中,不属于“城市空气质量日报”报道内容的是
A.悬浮颗粒 B.氮氧化物 C.二氧化硫 D.二氧化碳
4.下列说法正确的是
A.pH在5.6~7.0之间的雨水通常称为酸雨
B.NO可用NaOH溶液吸收
C.过氧化钠可做潜水艇中的“供氧剂”
D.大气中SO2的主要来源是汽车排出的尾气
5.某实验过程如图所示,则试管③中的现象是
A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
6.下面是实验室制取氨气的装置和选用的试剂,其中错误的是
A.①② B.③④ C.①③ D.②④
7.下列关于氮气的说法中,正确的是
A.通常情况下,氮气性质比较稳定
B.可在氧气中燃烧,生成一氧化氮
C.1molN2与3molH2完全反应生成2molNH3
D.氮元素是活泼的非金属元素,氮气在化学反应中作氧化剂
8.文献记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”下列有关“气”的说法错误的是
A.将“气”通入溴水中,溴水褪色且分层
B.常温下,将“气”通入水中生成
C.该“气”能作植物生长的调节剂,促进植物生长
D.将“气”通入酸性溶液中,发生氧化反应,溶液褪色
9.化学是材料科学的基础。下列说法错误的是
A.制造5G芯片的氮化铝晶圆属于无机非金属材料
B.制造阻燃或防火线缆的橡胶不能由加聚反应合成
C.制造特种防护服的芳纶纤维属于有机高分子材料
D.可降解聚乳酸塑料的推广应用可减少“白色污染”
10.将6.6g由甲烷与丙烯组成的混合气通入盛有溴水(足量)的洗气瓶,反应后测得溴水增重4.2g,则混合气中甲烷和丙烯的体积比
A.2∶3 B.3∶2 C.1∶2 D.2∶1
11.能证明乙烯分子中含有一个碳碳双键的事实是
A.乙烯分子中碳、氢原子的个数比为1∶2
B.乙烯完全燃烧生成的CO2和H2O的物质的量相等
C.乙烯易与溴水发生加成反应,且1mol乙烯完全加成需消耗1mol溴单质
D.乙烯能使酸性KMnO4溶液褪色
12.实验室制备硝基苯时,经过配制混酸、硝化反应(50~60℃)、洗涤分离、干燥蒸馏等步骤,如图装置和原理能达到目的的是
A B C D
配制混酸 硝化反应 分离硝基苯 蒸馏硝基苯
A.A B.B C.C D.D
13.下列有关糖类的说法正确的是
A.糖类都符合通式Cn(H2O)m
B.符合通式Cn(H2O)m的都是糖类
C.纤维素没有甜味,不属于糖类,糖类都有甜味
D.糖类是人类维持生命的六大类营养素之一
二、多选题
14.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的2倍。下列说法不正确的是
A.Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料
B.X的氢化物是分子晶体,因其分子间存在氢键,所以该晶体更稳定
C.X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸
D.X氢化物的水溶液与X最高价氧化物对应的水化物的水溶液不能相互反应
15.下列说法不正确的是
A.烷烃的通式为CnH2n+2,随n的增大,碳元素的质量分数逐渐减小
B.和互为同系物
C.烷烃分子中一定含有碳碳单键
D.分子式为C5H12的烷烃的一氯代物的可能有一种
三、实验题
16.某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。(制取氨气的反应原理:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O)
(实验探究)
(1)A装置N元素的化合价是__该反应是否是氧化还原反应:__。
(2)用5.35gNH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为___L。(NH4Cl的摩尔质量为53.5g mol-1)
(3)气体通过C、D装置时,试纸颜色会发生变化的是D,原因是:___。
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___。
(5)检验氨气是否收集满的方法是___。
(6)某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有__性质填序号。
a.还原性
b.极易溶于水
c.与水反应生成碱性物质
(7)氨气的用途很广。如可用氨气处理二氧化氮:8NH3+6NO2=7N2+12H2O该反应中氨气体现___(填“氧化性”或“还原性”)。
17.乙烯是一种重要的化工原料,工业上可用石蜡油制得,某实验小组用下列装置模拟该工业过程制备乙烯,并探究它的化学性质。
(1)加入药品之前的操作为_______。
(2)B装置中发生反应的方程式为_______ , 产物的名称是_______。
(3)C装置中的现象是_______ ,D 中的离子方程式为_______。
(4)通过上述实验探究可知,检验鉴别甲烷和乙烯的方法可以是_______ (填字母,下同);除去甲烷中乙烯的方法是_______。
A.将气体通过装酸性高锰酸钾溶液的洗气瓶 B.将气体通入氢氧化钠溶液中
C.将气体通入水中 D.将气体通过装溴水的洗气瓶
(5)乙烯相互加成可以制得日常生活使用的高分子塑料,写出其反应的化学方程式_______。
四、元素或物质推断题
18.有关物质有如图所示的转化关系。其中,A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B不加热也发生反应②,D的稀溶液与KSCN溶液混合后呈红色。
据此填空:
(1)写出下列物质的化学式:A__________,D__________,E__________。
(2)反应④的现象是_______。
(3)写出反应②的离子方程式:__________。
(4)过量A的浓溶液与单质B加热时能否产生G?为什么?_______ (结合图给信息回答)
五、有机推断题
19.端炔烃在催化剂存在下可发生偶联反应。如反应2R—C≡C—HR—C≡C—C≡C—R+H2。下面是利用该原理制备化合物E的一种合成路线,已知A是最简单的芳香烃。
回答下列问题:
(1)B的结构简式为___。
(2)对物质D进行分析,下列说法正确的是___。
a.该物质可与H2加成,且D与H2的最大加成比例为1:5
b.D的分子中所有原子共面,最多六个原子共线
c.D在一定条件下与Br2反应时,1 mol D最多消耗2 mol Br2
d.D与溴水和酸性高锰酸钾溶液作用原理相同
(3)反应④的化学方程式为___,该反应的反应类型为___。
(4)F是C的同分异构体,且满足下列条件,则F的结构简式为___。
a.F属于芳香化合物
b.分子中只有两种不同化学环境的氢,数目比为1:1
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】往浅绿色的Fe(NO3)2溶液中逐滴加入稀硫酸时,发生反应的离子方程式为:3Fe2++NO+4H+=3Fe3++NO↑+2H2O,三价铁离子为棕黄色。
故选D。
2.A
【详解】气体能使湿润的红色石蕊试纸变蓝,说明该气体是氨气,即该氮肥中含有;另一种气体能使澄清石灰水变浑浊,说明该气体是CO2;说明该氮肥中含有或,取少量该氮肥样品溶于水,并加入少量氯化钡溶液,没有明显变化,说明该氮肥中没有,因此该氮肥应该是碳酸氢铵, A正确。
故选A。
3.D
【详解】空气的污染途径是工厂废气的任意排放、大量燃烧化石燃料、汽车尾气的排放等,可总结为:有害气体和烟尘,空气质量报告中主要报告对人体有害的一些污染性成分的含量,可吸入颗粒物、总悬浮颗粒物,二氧化硫、二氧化氮、一氧化碳等都属于空气的污染物,二氧化碳不是污染物,不属于城市空气质量日报的内容,故D符合题意;
答案为D。
4.C
【详解】A. pH小于5.6的雨雪或其他形式的降水称为酸雨,故A错误;
B.NO是不成盐氧化物,不能与NaOH溶液反应,若NO、氧气一起通入氢氧化钠溶液,则可以被吸收,故B错误;
C.过氧化钠能分别与水、二氧化碳反应放出氧气,可做潜水艇中的“供氧剂”,故C正确;
D. 大气中SO2的主要来源是化石燃料的燃烧,可导致酸雨,汽车尾气主要含氮氧化物、一氧化碳等,故D错误;
答案为C。
5.D
【详解】管①中铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,根据图知,Cu有剩余,硝酸不足量,向③中加入稀硫酸,酸性条件下,硝酸根离子具有强氧化性,相当于又有稀硝酸,则硝酸和铜又发生反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成的无色气体NO不稳定,被氧气氧化生成红棕色气体NO2,同时Cu片溶解,所以看到的现象是铜片溶解,且有无色气体生成,该气体在试管口变为红棕色,故选D。
答案选D。
6.C
【详解】①NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,不能用来制备氨气,故①错误;
②向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨气逸出,故②正确;
③固体加热制气体时,试管口应略向下倾斜,使产生的水能够流出,以免水倒流到试管底部、冷热不匀损坏试管,故③错误;
④浓氨水易挥发,浓氨水加热可以制取NH3,故④正确;
制取氨气的装置和选用的试剂错误的有①③。C符合题意;
故选C。
7.A
【详解】A.通常情况下,氮气分子中含有氮氮叁键,键能大,性质比较稳定,A正确;
B.N2不能在O2中燃烧,与O2在放电时反应生成NO,B错误;
C.N2与H2的反应是可逆反应,1molN2与3molH2不可能完全反应生成2molNH3,C错误;
D.氮气中氮元素的化合价为零价,在化学反应中即可升高也可降低,即可作氧化剂,也可作还原剂,D错误;
故选A。
8.B
【分析】“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”,乙烯是催熟剂,这里的“气”指的是乙烯。
【详解】A.将乙烯通入溴水中,生成1,2-二溴乙烷,1,2-二溴乙烷难溶于水,所以溴水褪色且分层,故A正确;
B.常温下,乙烯和水不反应,故B错误;
C.乙烯能作植物生长的调节剂,促进植物生长,故C正确;
D.乙烯含有碳碳双键,将乙烯通入酸性溶液中,乙烯能被高锰酸钾溶液氧化,溶液褪色,故D正确;
选B。
9.B
【详解】A.氮化铝是一种高温结构陶瓷,属于新型的无机非金属材料,A正确;
B.天然橡胶的单体为异戊二烯,合成橡胶的单体如顺丁烯等中均含有碳碳双键,通过加聚反应合成制得橡胶,B错误;
C.“涤纶”“锦纶”“腈纶”“丙纶”“维纶”“氯纶”“芳纶”等均为合成纤维,属于有机高分子材料,C正确;
D.可降解聚乳酸塑料的推广应用,可以减少难以降解塑料的使用,从而减少“白色污染”,D正确;
故答案为:B。
10.B
【分析】丙烯能与溴水加成反应使溴水增重,甲烷不能与溴水反应,所以增重的质量即为乙烯的质量。
【详解】溴水增重4.2g,即丙烯的质量为4.2g,n(C2H4)==0.1mol。则混合气体中甲烷质量为6.6g-4.2g=2.4g,n(CH4)==0.15mol。n(CH4):n(C3H6)=0.15mol:0.1mol=3:2,B正确。
11.C
【详解】A.分子中的碳氢原子个数比不能说明其含有一个碳碳双键,如环丙烷中碳、氢原子个数比也为1:2,但不含碳碳双键,A不符合题意;
B.燃烧产物的物质的量相等,只能说明该物质中碳原子和氢原子个数比为1∶2,不能说明含有一个碳碳双键,B不符合题意;
C.1mol乙烯只能与1mol溴单质加成,说明乙烯分子中含有一个碳碳双键,C符合题意;
D.被酸性KMnO4溶液氧化,说明含有该有机物中含有碳碳不饱和键等,不能说明含有一个碳碳双键,D不符合题意;
答案为C。
12.C
【详解】A.配制混酸应将浓硫酸倒入浓硝酸中,A错误;
B.硝化反应加热应选择水浴加热,B错误;
C.硝基苯难溶于水,密度比水大,在下层,可通过分液分离,C正确;
D.冷凝水应下进上出,D错误;
故选C。
13.D
【详解】A.不符合Cn(H2O)m这一通式的物质也可能属于糖类,如脱氧核糖C5H10O4、鼠李糖C6H12O5,A错误;
B.糖类俗称碳水化合物,大都可用Cn(H2O)m来表示,但符合这一通式的不一定都是糖,如乙酸CH3COOH、甲酸甲酯HCOOCH3[C2(H2O)2]等,B错误;
C.纤维素没有甜味,但属于糖类,糖不一定有甜味,如多糖:淀粉、纤维素,C错误;
D.人体的六大营养物质是:水、无机盐、蛋白质、油脂、糖类和维生素,糖类是人类维持生命的营养素之一,D正确;
答案选D。
14.BD
【分析】Z原子最外层电子数不超过8,所以X内层为K层,K层电子数是2,则Z最外层电子数是6,Y最外层电子数是3,X、Y、Z最外层电子数之和为14,X最外层电子数为14 6 3=5,X核外电子数是7,则X为N元素;N元素位于第二周期,Y和Z位于第三周期,Y的最外层电子数是3、Z原子最外层电子数是6,则Y是Al、Z是S元素,据此解答。
【详解】A.Y的氧化物是Al2O3,氧化铝既可与强酸反应又可与强碱反应,属于两性氧化物,氧化铝熔点很高,可用来制作耐火材料,故A说法正确;
B.X的氢化物是NH3,氨气形成的晶体为分子晶体,氨气的稳定性与N—H键键能有关,与氢键无关,故B说法不正确;
C.X和Z的最高价氧化物对应的水化物分别是HNO3、H2SO4,浓硝酸和浓硫酸都是强氧化性酸,故C说法正确;
D.X的氢化物是NH3,X的最高价氧化物的水化物是HNO3,氨水溶液呈碱性、硝酸溶液呈酸性,二者能相互反应,故D说法不正确;
故选:BD。
15.AC
【详解】A.烷烃的通式为CnH2n+2,随着分子中n的增大,碳元素的质量分数将逐渐增大,A错误;
B.两者中C原子之间以单键结合,剩余价电子全部与H原子结合,二者结构相似,在分子组成上相差1个CH2原子团,因此二者互为同系物,B正确;
C.烷烃分子中若只有1个C原子,该烷烃是甲烷,分子中就不存在碳碳单键,C错误;
D.分子式为C5H12表示的烷烃有正戊烷、异戊烷、新戊烷三种,若为新戊烷,其分子中也只有一种H原子,其一氯取代物仅只有一种,D正确;
故选:AC。
16. -3 否 2.24 氨气与水反应生成一水合氨呈碱性 产生白烟 用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满 B、C 还原性
【分析】A为实验室制取氨气,B中的干燥剂为了除去水,C、D为了说明干燥的氨气不能使红色石蕊试纸变色,干燥的氨气通过湿润的红色石蕊试纸,生成一水合氨,能使试纸变蓝,氨气与水反应生成一水合氨呈碱性,浓盐酸易挥发,氯化氢气体与氨气反应生成氯化铵固体,可观察到的现象是产生白烟,据此解题。
【详解】(1)A装置为制备氨气的装置,N元素的化合价是-3;该反应不是氧化还原反应;
故答案为:-3;否;
(2)5.35gNH4Cl的物质的量n==0.1mol,由化学方程式2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O可知,最多可制得0.1mol的氨气,标准状况下氨气的体积V=0.1mol×22.4L/mol=2.24L;
故答案为:2.24L;
(3)干燥的氨气不能使红色石蕊试纸变色,干燥的氨气通过湿润的红色石蕊试纸,生成一水合氨,能使试纸变蓝;
故答案为:氨气与水反应生成一水合氨呈碱性;
(4)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,浓盐酸易挥发,氯化氢气体与氨气反应生成氯化铵固体,可观察到的现象是产生白烟;
故答案为:产生白烟;
(5)检验氨气是否收集满的方法是:用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满;
故答案为:用湿润的红色石蕊试纸靠近瓶口,若变蓝,则收集满;
(6)烧瓶内产生红色喷泉的现象,说明氨气极易溶于水且具有碱性;
故答案为:B、C;
(7)由反应8NH3+6NO2=7N2+12H2O可分析出NH3作为还原剂,因此该反应中氨气体现还原性;
故答案为:还原性;
17.(1)检查装置气密性
(2) CH2=CH2+Br2→CH2BrCH2Br 1,2-二溴乙烷
(3) 酸性高锰酸钾溶液褪色 CO2+Ca2++2OH-=CaCO3↓+H2O
(4) AD D
(5)n CH2=CH2
【分析】装置A中对浸透了石蜡油的石棉加热,产生的乙烯通到B中与溴发生加成反应使溴水褪色,乙烯能被C中的酸性高锰酸钾溶液氧化使酸性高锰酸钾溶液褪色,同时产生二氧化碳,产生的二氧化碳能被D中澄清石灰水吸收,乙烯不溶于水,装置E用于收集乙烯。
【详解】(1)该实验有气体参与反应,因此加入药品之前,应先检查装置气密性。
(2)B中乙烯和溴发生加成反应生成1,2-二溴乙烷,反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br。
(3)乙烯中含碳碳双键,能被酸性高锰酸钾溶液氧化,因此C装置中的现象是:酸性高锰酸钾溶液褪色,两者反应生成了二氧化碳,二氧化碳能与D中澄清石灰水反应,反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O。
(4)A.甲烷不能使酸性高锰酸钾溶液褪色,乙烯能酸性高锰酸钾溶液褪色,因此将气体通过装酸性高锰酸钾溶液的洗气瓶,可以鉴别甲烷和乙烯,但不能除去甲烷中的乙烯,因为乙烯与酸性高锰酸钾溶液反应会生成二氧化碳;
B.甲烷和乙烯均不能与氢氧化钠溶液反应,将气体通入氢氧化钠溶液中,既不能鉴别甲烷和乙烯,也不能除去甲烷中的乙烯;
C.甲烷和乙烯均不溶于水,也不与水反应,将气体通入水中,既不能鉴别甲烷和乙烯,也不能除去甲烷中的乙烯;
D.甲烷不与溴水反应,不能使溴水褪色,乙烯能与溴发生加成反应使溴水褪色,将气体通过装溴水的洗气瓶,既能鉴别甲烷和乙烯,也能除去甲烷中的乙烯;
因此鉴别甲烷和乙烯的方法可以是:AD,除去甲烷中乙烯的方法是:D。
(5)乙烯中含碳碳双键,能发生加聚反应生成聚乙烯,反应的化学方程式为:n CH2=CH2 。
18. HNO3 Fe(NO3)3 NO2 白色沉淀变成灰绿色,最终为红褐色沉淀 3Fe+8H++2NO=3Fe2++2NO↑+4H2O 不能。根据图中反应③,NO遇浓硝酸可转化为NO2
【详解】(1)转化关系图中分析判断,单质B和A的浓溶液加热时才能发生反应,说明A为金属,在浓酸溶液中发生钝化,加热发生反应,A的稀溶液和B单质反应生成产物与B与浓溶液加热反应产物不同,说明B为变价元素,判断为Fe,A为HNO3,D为Fe(NO3)3,E为NO2,G为Fe(NO3)2,L为Fe(OH)2,K为Fe(OH)3,Q为NaNO3,所以本题答案为:HNO3;Fe(NO3)3;NO2;
(2)反应④是氢氧化亚铁被空气中氧气氧化生成氢氧化铁,反应的现象是,白色沉淀迅速变化为灰绿色,最后变化为红褐色沉淀;故答案为:白色沉淀变成灰绿色,最终为红褐色沉淀;
(3)反应②是过量铁和稀硝酸反应生成硝酸亚铁、一氧化氮和水,反应的离子方程式为:3Fe+2NO+8H+═3Fe2++2NO↑+4H2O;故答案为:3Fe+2NO+8H+═3Fe2++2NO↑+4H2O;
(4)由反应2HNO3+NO═3NO2+H2O知,结合化学平衡移动原理分析,在浓HNO3中,平衡正向进行不可能生成NO;故答案为:不能。根据图中反应③,NO遇浓硝酸可转化为NO2;
【点睛】铁和稀硝酸反应的产物与量有关,硝酸足量时生成硝酸铁、一氧化氮和水,铁过量时,生成硝酸亚铁、一氧化氮和水,此为易错点。
19.(1)
(2)ab
(3) 2→+H2 取代反应
(4)
【分析】A是最简单的芳香烃,则A是,A与CH3CH2Cl在AlCl3催化作用下发生取代反应产生B:,B与Cl2在光照条件下发生取代反应产生C:,C与NaNH2、H2O发生反应产生D:,D发生取代反应产生。据此分析解答。
【详解】(1)根据上述分析可知B结构简式是;
(2)a.D是,该物质含有苯环及碳碳三键,可与H2加成,且D与H2的最大加成比例为1:5,a正确;
b.苯分子是平面分子,乙炔分子是直线型结构。乙炔分子中与苯环连接的C原子取代苯分子中H原子位置,在苯分子平面上;一条直线上两点在一个平面上,则该直线上所有点都在该平面上,所以D的分子中所有原子共平面;苯环上处于对位的C原子在同一条直线上,由于键角是180°,所以该平面上最多六个原子共直线,b正确;
c.D在一定条件下与Br2反应时,苯环及碳碳三键都可以与Br2发生加成反应,则1 mol D最多消耗5 mol Br2,c错误;
d.D与溴水发生加成反应,与酸性高锰酸钾溶液发生氧化反应,故二者的作用原理不相同,d错误;
故合理选项是ab;
(3)反应④是在一定条件下2个分子的D发生取代反应产生E:,反应方程式为:2→+H2,该反应类型为取代反应;
(4)C是,F是C的同分异构体,满足条件:a.F属于芳香化合物,说明含有苯环;b.分子中只有两种不同化学环境的氢,数目比为1:1,则符合题意的同分异构体为 。
答案第1页,共2页
答案第1页,共2页
同课章节目录
