专题7第一单元氮的固定同步练习 (含答案)2022——2023学年下学期高一化学苏教版(2019)必修第二册
文档属性
| 名称 | 专题7第一单元氮的固定同步练习 (含答案)2022——2023学年下学期高一化学苏教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 730.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 13:18:19 | ||
图片预览




文档简介
专题7第一单元氮的固定同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列反应中,不属于氮的固定的是
A.N2和H2在一定条件下合成NH3
B.豆科植物把空气中的氮气转化为化合态的氮
C.雷电时,空气中的N2与O2反应生成NO
D.由NH3制碳酸氢铵和尿素
2.下列化学用语正确的是
A.结构简式为(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
B.乙烷的结构式:
C.甲烷分子的球棍模型
D.丙烷分子的空间充填模型:
3.下列化学用语描述正确的是
A.的电子式:
B.的电子式:
C.的分子结构模型为
D.用电子式表示的形成过程:
4.NO在人体内起着多方面的重要生理作用。下列关于NO的说法错误的是。
A.NO是具有刺激性气味的红棕色气体
B.NO是汽车尾气的有害成分之一
C.NO常温下遇到O2就化合成NO2
D.NO2与水反应,有NO生成
5.氮是各种生物体生命活动不可缺少的重要元素,氮的循环为生物体提供氮元素。下列过程属于氮的固定的是
A.工业利用氮气和氢气合成氨气 B.氨气和硫酸反应制取铵态氮肥
C.氨基酸合成人体所需的蛋白质 D.硝酸盐在细菌作用下生成氮气
6.下列表示物质结构的化学用语正确的是
A.8个中子的碳原子的核素符号:12C B.HF的电子式:
C.CO2的结构式:O=C=O D.C1-离子的结构示意图:
7.下列物质的电子式书写正确的是
A. B. C. D.
8.下列分子的电子式书写正确的是
A.氨气 B.四氯化碳
C.氮气 D.二氧化碳
9.关于非金属元素Si、N、S的叙述,正确的是
A.通常情况下,它们的单质均为气体
B.它们在自然界中都存在游离态形式
C.它们都有对应的含氧酸
D.每种元素都只有一种氧化物
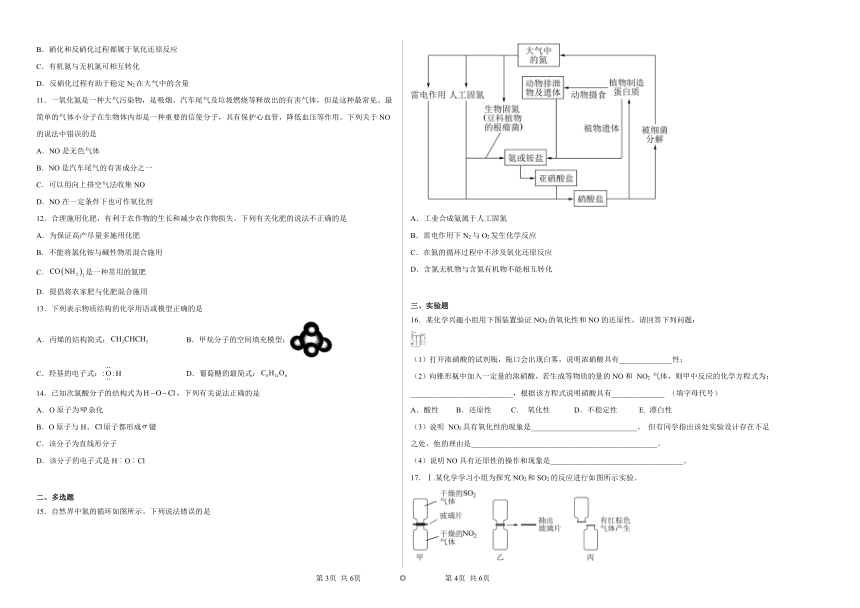
10.氮循环是生态系统物质循环的重要组成部分,如下图所示,下列说法中不正确的是
A.人类活动对氮的循环起到了主导作用
B.硝化和反硝化过程都属于氧化还原反应
C.有机氮与无机氮可相互转化
D.反硝化过程有助于稳定N2在大气中的含量
11.一氧化氮是一种大气污染物,是吸烟、汽车尾气及垃圾燃烧等释放出的有害气体,但是这种最常见、最简单的气体小分子在生物体内却是一种重要的信使分子,具有保护心血管,降低血压等作用。下列关于NO的说法中错误的是
A.NO是无色气体
B.NO是汽车尾气的有害成分之一
C.可以用向上排空气法收集NO
D.NO在一定条件下也可作氧化剂
12.合理施用化肥,有利于农作物的生长和减少农作物损失。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.是一种常用的氮肥
D.提倡将农家肥与化肥混合施用
13.下列表示物质结构的化学用语或模型正确的是
A.丙烯的结构简式: B.甲烷分子的空间填充模型:
C.羟基的电子式: D.葡萄糖的最简式:
14.已知次氯酸分子的结构式为,下列有关说法正确的是
A.O原子为杂化
B.O原子与H、原子都形成键
C.该分子为直线形分子
D.该分子的电子式是H︰O︰Cl
二、多选题
15.自然界中氮的循环如图所示。下列说法错误的是
A.工业合成氨属于人工固氮
B.雷电作用下N2与O2发生化学反应
C.在氮的循环过程中不涉及氧化还原反应
D.含氮无机物与含氮有机物不能相互转化
三、实验题
16.某化学兴趣小组用下图装置验证NO2的氧化性和NO的还原性,请回答下列问题:
(1)打开浓硝酸的试剂瓶,瓶口会出现白雾,说明浓硝酸具有______________性;
(2)向锥形瓶中加入一定量的浓硝酸,若生成等物质的量的NO和 NO2 气体,则甲中反应的化学方程式为:___________________________,根据该方程式说明硝酸具有______________ (填字母代号)
A.酸性 B.还原性 C. 氧化性 D.不稳定性 E. 漂白性
(3)说明 NO2具有氧化性的现象是____________________________, 但有同学指出该处实验设计存在不足之处,他的理由是_________________________________________________。
(4)说明NO具有还原性的操作和现象是___________________________________。
17.Ⅰ.某化学学习小组为探究NO2和SO2的反应进行如图所示实验。
(1)图甲两集气瓶中__(填“上”或“下”)瓶气体颜色深。
(2)图乙中反应的现象是___。
(3)图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有__,NO2在该反应中显__性。
(4)由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:___。
Ⅱ.某课外活动小组欲探究镁与NO2的反应。已知镁与CO2的反应为2Mg+CO22MgO+C。
(1)该小组类比Mg与CO2的反应对Mg与NO2的反应进行猜测,写出Mg与NO2反应的化学方程式:__。
(2)该小组设计如下实验验证上述猜测,实验装置(用于连接玻璃管的乳胶管均内衬锡纸)如图所示。
资料信息:2NO2+2NaOH=NaNO2+NaNO3+H2O
①装置A中的试剂是__。
②干燥管和装置B的作用分别是__、__。
③正确的实验操作步骤是__。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
四、元素或物质推断题
18.X、Y、Z、W四种短周期元素在周期表中的位置关系如图。
I.若Z元素原子的最外层电子数是电子层数的2倍。
(1)W在周期表中的位置为_________________。
(2)Y和Z可组成的化合物的化学式为____________。
Ⅱ.若Y和Z的核外电子数之和为22。
(1)工业上生产Y的简单氢化物的化学方程式为_______________________________________________。
(2)将X的最高价氧化物通入硅酸钠溶液中,产生白色沉淀,发生反应的化学方程式是_____________。
19.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,D的元素符号为___________,E的离子结构示意图为___________。
(2)D、E两种元素可形成化学式为、等化合物,则的电子式为___________,的结构式为___________(请填写具体物质的化学式)。
(3)将投入的水溶液中可生成D的单质,发生反应的离子方程式为___________,请用单线桥标出此反应中电子转移的方向和数目。
(4)与E元素的单质在水中反应的离子方程式为___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.氮的固定是指从游离态转化成化合态的过程,N2和H2在一定条件下合成NH3属于氮的固定,故A不选;
B.豆科植物把空气中的氮气转化为化合态的氮,该过程中N从游离态转化成化合态,属于氮的固定,故B不选;
C.雷电时,空气中的N2与O2反应生成NO,该过程中N从游离态转化成化合态,属于氮的固定,故C不选;
D.由NH3制碳酸氢铵和尿素,该过程中没由游离态N参与,不属于氮的固定,故D选;
正确答案是D。
2.B
【详解】A.(CH3)2CHCH3代表异丁烷,正丁烷的结构简式为CH3CH2CH2CH3,选项A错误;
B.乙烷中C原子和C原子间,C原子和H原子之间均为单键,共用一对电子对,其结构式为,选项B正确;
C.甲烷的该模型,原子紧密连起的,反映原子相对大小,为比例模型,选项C错误;
D.丙烷的该模型,原子与原子之间用一根棍子表示共用电子对,为球棍模型,选项D错误;
答案选B。
3.D
【详解】A.是离子化合物,其电子式为,A错误;
B.是共价化合物,其电子式为,B错误;
C.二氧化碳中碳原子半径大于氧原子半径,C错误;
D.硫化钾形成过程中钾失去电子,硫得到电子,D正确;
故选D。
4.A
【详解】A.NO是一种无色无味气体,A项错误;
B.汽车尾气主要成分是氮氧化物、二氧化硫和颗粒物等,其中NO能结合人体内的血红蛋白,使之丧失运送氧的能力,所以NO是尾气中的有害成分,B项正确;
C.常温常压下,一氧化氮能与空气中的氧气直接化合生成红棕色的二氧化氮,C项正确;
D.NO2与水反应生成硝酸和NO,D项正确;
答案选A。
5.A
【详解】A.工业利用氮气和氢气合成氨气,氮元素由游离态转化为化合态,属于氮的固定,故选A;
B.氨气和硫酸反应制取铵态氮肥,氮元素不是由游离态转化为化合态,不属于氮的固定,故不选B;
C.氨基酸合成人体所需的蛋白质,氮元素不是由游离态转化为化合态,不属于氮的固定,故不选C;
D.硝酸盐在细菌作用下生成氮气,氮元素由化合态转化为游离态,不属于氮的固定,故不选D;
选A。
6.C
【详解】A.碳原子的核电荷数为6,8个中子的碳原子的核素符号应是14C,故A错误;
B.HF是共价化合物,分子中不存在离子,电子式不用括号,不带电荷,故B错误;
C.CO2中碳与氧原子间是双键,结构式为O=C=O,故C正确;
D.Cl原子的核电荷数为17,Cl-的核外电子数为18,Cl-离子的结构示意图为,故D错误;
故选C。
7.A
【详解】A.氯化钠为离子化合物,氯离子带电荷并需用方括号括起来,钠离子用离子符号表示,电子式:,故A正确;
B.氮气中氮原子之间形成三个共用电子对,每个氮原子最外层达到8电子稳定结构,氮原子还有自身一对孤电子对,电子式:,故B错误;
C.氨气为共价化合物,每个氢原子与氮原子形成一个共用电子对,氮原子最外层达到8电子稳定结构,电子式为:,故C错误;
D.二氧化碳中每个氧原子分别与碳原子形成2对共用电子对,每个原子最外层都达到8电子稳定结构,则电子式为:,故D错误;
故选A。
8.C
【详解】A.氨气为共价化合物,氮原子最外层达到8个电子稳定结构,正确的电子式为:,故A错误;
B.氯原子未成键的孤电子对未标出,正确的电子式为,故B错误;
C.氮原子最外层有5个电子,要达到稳定结构需形成三对共用电子,即,故C正确;
D.二氧化碳是共价化合物,二氧化碳分子中碳原子与氧原子之间形成2对共用电子,达稳定结构,电子式为,故D错误;
故选C。
9.C
【详解】A.通常情况下,Si、S的单质为固体,N的单质为气体,故A错误;
B.自然界中没有游离态的硅,故B错误;
C. Si、N、S对应的含氧酸分别是H2SiO3、HNO3、H2SO4,故C正确;
D.N有NO、NO2、N2O3等多种氧化物,S有SO2、SO3两种氧化物,故D错误;
选C。
10.A
【详解】A.对氮的循环起到主导作用的是自然因素,人类活动只是在一定程度上影响氮的循环,故A错误;
B.图可知,硝化和反硝化过程都涉及到了化合价的变化,故都属于策化还原反应,故B正确;
C.氮化过程是动植物蛋白转化为氨气或铵根离子,即有机氮转化为无机氮的过程,故C正确;
D.固氮过程消耗了大气中的氮气,反硝化过程中生成了氮气,故反硝化过程有助于稳定N2在大气中的含量,故D正确。
故选:A。
11.C
【详解】A.通常状况下,NO是一种无色气体,A正确;
B.NO是汽车尾气的有害成分之一,遇到氧气转变为二氧化氮,会引起光化学烟雾, B正确;
C.NO遇到氧气转变为二氧化氮,不能用排空气法收集,只能用排水法收集,C错误;
D.NO中氮元素为+2价,化合价可以降低,因此能表现出氧化性、作氧化剂, D正确;
答案选C。
12.A
【详解】A.由于很多化肥易溶于水,过量施用不仅会造成浪费,部分化肥会随着雨水流入河流和湖泊,造成水体富营养化,产生水华等污染现象,故A错误;
B.氯化铵能与碱性物质反应产生氨气,降低肥效,故B正确;
C.尿素属于常用的氮肥,故C正确;
D.农家肥养分全面,但含量低,见效慢,化肥养分单一,但含量高,见效快,将二者混合施用可以取长补短,有利于养分平衡供应,从而取得良好的肥效,故D正确;
综上所述,说法不正确的是A项,故选A。
13.B
【详解】A.丙烯的结构简式为,A错误;
B.甲烷分子的空间结构为正四面体,填充模型:,B正确;
C.羟基的电子式为 ,C错误;
D.葡萄糖的最简式为,D错误;
故选B。
14.B
【详解】A.分子的结构式为,O原子应为杂化,故A错误;
B.O原子形成4个杂化轨道,其中2个杂化轨道被2对孤电子对占据,另2个杂化轨道分别与H原子的1s轨道和原子的轨道重叠形成2个键,故B正确;
C.因为O原子是杂化,所以该分子为角形,故C错误;
D.其电子式为,故D错误;
故选B。
15.CD
【详解】A.工业合成氨是将与在一定条件下反应生成,属于人工固氮,A项正确;
B.雷电作用下与发生化学反应生成,B项正确;
C.与生成的反应是氧化还原反应,所以在氮的循环过程中涉及氧化还原反应,C项错误;
D.由氮的循环示意图可知,通过生物体可以将铵盐和蛋白质相互转化,实现了含氮无机物与含氮有机物间的相互转化,D项错误;
答案选CD。
16. 挥发性 2Cu+6HNO3=2Cu(NO3)2+NO↑+NO2↑+3H2O AC 淀粉-KI 溶液变蓝 挥发出的硝酸也能使淀粉-KI溶液变蓝 (打开活塞),挤压空气囊,丙中气体由无色变为红棕色
【详解】(1)硝酸具有挥发性,挥发的HNO3接触到水蒸气形成酸雾。
(2)Cu与浓硝酸反应,应该得到硝酸铜、物质的量相等的NO和NO2还有水。将NO和NO2视为一个整体,相当于化合价降低4,Cu的化合价升高2,所以Cu的系数为2,NO和NO2的系数都是1,再根据原子守恒配平,即得:2Cu + 6HNO3 = 2Cu(NO3)2 + NO↑ + NO2↑ + 3H2O。该反应说明硝酸具有酸性和氧化性,选项AC正确。
(3)淀粉-KI 溶液中的碘离子被氧化为碘单质,淀粉溶液遇碘单质变为蓝色,所以现象为:淀粉-KI 溶液变蓝。但是实验中硝酸是具有挥发性的,甲装置中铜与硝酸的反应也是放热反应,随着温度升高,硝酸挥发也会加剧,挥发的硝酸也可能氧化碘离子生成碘单质。
(4)丙装置中,通过排水法收集了NO,打开活塞,挤压空气囊,将空气挤压进丙装置中,NO接触到氧气,被氧化为NO2,颜色变为红棕色。
【点睛】第(3)问中的检验实际上还是有一些问题,NO2通入溶液中,会与水反应生成硝酸,硝酸可以氧化碘离子得到碘单质,所以并不能认为表现的一定是NO2的氧化性。
17. 下 两气体混合后,红棕色消失 NO 氧化 NO2+SO2=NO+SO3 4Mg+2NO24MgO+N2 NaOH溶液 吸收NO2避免污染环境 收集N2 badc
【分析】Ⅱ.该实验中先通入二氧化氮气体可排尽装置中的空气,此时打开弹簧夹,干燥管吸收多余的二氧化氮,然后关闭弹簧夹,之后点燃酒精灯,二氧化氮与镁单质发生反应,A装置中盛放氢氧化钠溶液可吸收为反应的二氧化氮,B装置短进长出且装满水,可用排水法收集反应生成的氮气。
【详解】I.(1)NO2呈红棕色,SO2为无色气体,故下瓶气体颜色深;
(2)NO2有强氧化性,能被SO2,还原成NO,则两气体混合后,红棕色消失;
(3)“有红棕色气体产生”说明SO2和NO2反应的产物中有NO,NO遇空气被氧化成NO2,SO2与NO2的反应中NO2体现了氧化性;
(4)NO2和SO2反应的化学方程式为;
Ⅱ.(1)由题意分析可知,Mg与NO2发生置换反应,反应的化学方程点燃式为;
(2)①由反应可知,装置A中的试剂是NaOH溶液,作用是除去N2中混有的NO2;
②干燥管的作用是吸收NO2避免污染环境。装置B是利用排水法收集N2的装置;
③正确的实验操作步骤是:打开弹簧夹→通入NO2(排尽装置中的空气)→当硬质玻璃管充满红棕色气体后,关闭弹簧夹,点燃酒精灯。
【点睛】集气瓶有多种用途:长进短出的空瓶可收集密度比空气大的气体,短进长出的空瓶可收集密度比空气小的气体;短进长出且装满水可用排水法收集气体;短进短出的空瓶可做安全瓶,防倒吸。
18. 第三周期第ⅦA族 、
【分析】由X、Y、Z、W四种短周期元素在周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期;
Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,则Z为S元素,可推知X为N元素,Y为O元素,W为元素;
Ⅱ.若Y和Z的核外电子数之和为22,则Y为N元素,Z为P元素,可推知X为C元素,W为S元素,据此分析解答。
【详解】Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,则Z为S元素,可推知X为N元素,Y为O元素,W为元素;
(1)W为元素,位于第三周期第ⅦA族;
(2)Z为S元素,Y为O元素,O和S元素可组成、;
Ⅱ.若Y和Z的核外电子数之和为22,则Y为N元素,Z为P元素,可推知X为C元素,W为S元素;
(1)Y为N元素,其简单氢化物为,工业上生产的化学方程式为;
(2)X为C元素,其最高价氧化物为,将通入硅酸钠溶液中,有白色沉淀(硅酸)生成,反应的化学方程式为。
19. 钠 S Cl-S-S-Cl
【分析】短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层电子数是次外层电子数的3倍,A原子只能有2个电子层,最外层电子数为6,A为O;A、D同主族,则D为S;E的原子序数最大,E为;B是短周期元素中原子半径最大的主族元素,则B为;C原子的质子数比B原子的质子数多2个,则C为。
【详解】(1)由上述分析可以知道,B元素的名称为钠,D的元素符号为S,E的离子为,离子结构示意图为;
(2)分子中S与之间形成1对共用电子对,电子式为,分子中S原子之间形成1对共用电子对,S原子与原子之间形成1对共用电子,结构式为;
(3)和的水溶液发生氧化还原反应生成硫的单质,根据得失电子守恒和电荷守恒,反应的离子方程式为;过氧化钠得电子,失电子,则用单线桥标出此反应中电子转移的方向和数目为;
(4)与氯气在水中反应生成与硫酸,反应的离子方程式为。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列反应中,不属于氮的固定的是
A.N2和H2在一定条件下合成NH3
B.豆科植物把空气中的氮气转化为化合态的氮
C.雷电时,空气中的N2与O2反应生成NO
D.由NH3制碳酸氢铵和尿素
2.下列化学用语正确的是
A.结构简式为(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
B.乙烷的结构式:
C.甲烷分子的球棍模型
D.丙烷分子的空间充填模型:
3.下列化学用语描述正确的是
A.的电子式:
B.的电子式:
C.的分子结构模型为
D.用电子式表示的形成过程:
4.NO在人体内起着多方面的重要生理作用。下列关于NO的说法错误的是。
A.NO是具有刺激性气味的红棕色气体
B.NO是汽车尾气的有害成分之一
C.NO常温下遇到O2就化合成NO2
D.NO2与水反应,有NO生成
5.氮是各种生物体生命活动不可缺少的重要元素,氮的循环为生物体提供氮元素。下列过程属于氮的固定的是
A.工业利用氮气和氢气合成氨气 B.氨气和硫酸反应制取铵态氮肥
C.氨基酸合成人体所需的蛋白质 D.硝酸盐在细菌作用下生成氮气
6.下列表示物质结构的化学用语正确的是
A.8个中子的碳原子的核素符号:12C B.HF的电子式:
C.CO2的结构式:O=C=O D.C1-离子的结构示意图:
7.下列物质的电子式书写正确的是
A. B. C. D.
8.下列分子的电子式书写正确的是
A.氨气 B.四氯化碳
C.氮气 D.二氧化碳
9.关于非金属元素Si、N、S的叙述,正确的是
A.通常情况下,它们的单质均为气体
B.它们在自然界中都存在游离态形式
C.它们都有对应的含氧酸
D.每种元素都只有一种氧化物
10.氮循环是生态系统物质循环的重要组成部分,如下图所示,下列说法中不正确的是
A.人类活动对氮的循环起到了主导作用
B.硝化和反硝化过程都属于氧化还原反应
C.有机氮与无机氮可相互转化
D.反硝化过程有助于稳定N2在大气中的含量
11.一氧化氮是一种大气污染物,是吸烟、汽车尾气及垃圾燃烧等释放出的有害气体,但是这种最常见、最简单的气体小分子在生物体内却是一种重要的信使分子,具有保护心血管,降低血压等作用。下列关于NO的说法中错误的是
A.NO是无色气体
B.NO是汽车尾气的有害成分之一
C.可以用向上排空气法收集NO
D.NO在一定条件下也可作氧化剂
12.合理施用化肥,有利于农作物的生长和减少农作物损失。下列有关化肥的说法不正确的是
A.为保证高产尽量多施用化肥
B.不能将氯化铵与碱性物质混合施用
C.是一种常用的氮肥
D.提倡将农家肥与化肥混合施用
13.下列表示物质结构的化学用语或模型正确的是
A.丙烯的结构简式: B.甲烷分子的空间填充模型:
C.羟基的电子式: D.葡萄糖的最简式:
14.已知次氯酸分子的结构式为,下列有关说法正确的是
A.O原子为杂化
B.O原子与H、原子都形成键
C.该分子为直线形分子
D.该分子的电子式是H︰O︰Cl
二、多选题
15.自然界中氮的循环如图所示。下列说法错误的是
A.工业合成氨属于人工固氮
B.雷电作用下N2与O2发生化学反应
C.在氮的循环过程中不涉及氧化还原反应
D.含氮无机物与含氮有机物不能相互转化
三、实验题
16.某化学兴趣小组用下图装置验证NO2的氧化性和NO的还原性,请回答下列问题:
(1)打开浓硝酸的试剂瓶,瓶口会出现白雾,说明浓硝酸具有______________性;
(2)向锥形瓶中加入一定量的浓硝酸,若生成等物质的量的NO和 NO2 气体,则甲中反应的化学方程式为:___________________________,根据该方程式说明硝酸具有______________ (填字母代号)
A.酸性 B.还原性 C. 氧化性 D.不稳定性 E. 漂白性
(3)说明 NO2具有氧化性的现象是____________________________, 但有同学指出该处实验设计存在不足之处,他的理由是_________________________________________________。
(4)说明NO具有还原性的操作和现象是___________________________________。
17.Ⅰ.某化学学习小组为探究NO2和SO2的反应进行如图所示实验。
(1)图甲两集气瓶中__(填“上”或“下”)瓶气体颜色深。
(2)图乙中反应的现象是___。
(3)图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有__,NO2在该反应中显__性。
(4)由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:___。
Ⅱ.某课外活动小组欲探究镁与NO2的反应。已知镁与CO2的反应为2Mg+CO22MgO+C。
(1)该小组类比Mg与CO2的反应对Mg与NO2的反应进行猜测,写出Mg与NO2反应的化学方程式:__。
(2)该小组设计如下实验验证上述猜测,实验装置(用于连接玻璃管的乳胶管均内衬锡纸)如图所示。
资料信息:2NO2+2NaOH=NaNO2+NaNO3+H2O
①装置A中的试剂是__。
②干燥管和装置B的作用分别是__、__。
③正确的实验操作步骤是__。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
四、元素或物质推断题
18.X、Y、Z、W四种短周期元素在周期表中的位置关系如图。
I.若Z元素原子的最外层电子数是电子层数的2倍。
(1)W在周期表中的位置为_________________。
(2)Y和Z可组成的化合物的化学式为____________。
Ⅱ.若Y和Z的核外电子数之和为22。
(1)工业上生产Y的简单氢化物的化学方程式为_______________________________________________。
(2)将X的最高价氧化物通入硅酸钠溶液中,产生白色沉淀,发生反应的化学方程式是_____________。
19.短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,D的元素符号为___________,E的离子结构示意图为___________。
(2)D、E两种元素可形成化学式为、等化合物,则的电子式为___________,的结构式为___________(请填写具体物质的化学式)。
(3)将投入的水溶液中可生成D的单质,发生反应的离子方程式为___________,请用单线桥标出此反应中电子转移的方向和数目。
(4)与E元素的单质在水中反应的离子方程式为___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.氮的固定是指从游离态转化成化合态的过程,N2和H2在一定条件下合成NH3属于氮的固定,故A不选;
B.豆科植物把空气中的氮气转化为化合态的氮,该过程中N从游离态转化成化合态,属于氮的固定,故B不选;
C.雷电时,空气中的N2与O2反应生成NO,该过程中N从游离态转化成化合态,属于氮的固定,故C不选;
D.由NH3制碳酸氢铵和尿素,该过程中没由游离态N参与,不属于氮的固定,故D选;
正确答案是D。
2.B
【详解】A.(CH3)2CHCH3代表异丁烷,正丁烷的结构简式为CH3CH2CH2CH3,选项A错误;
B.乙烷中C原子和C原子间,C原子和H原子之间均为单键,共用一对电子对,其结构式为,选项B正确;
C.甲烷的该模型,原子紧密连起的,反映原子相对大小,为比例模型,选项C错误;
D.丙烷的该模型,原子与原子之间用一根棍子表示共用电子对,为球棍模型,选项D错误;
答案选B。
3.D
【详解】A.是离子化合物,其电子式为,A错误;
B.是共价化合物,其电子式为,B错误;
C.二氧化碳中碳原子半径大于氧原子半径,C错误;
D.硫化钾形成过程中钾失去电子,硫得到电子,D正确;
故选D。
4.A
【详解】A.NO是一种无色无味气体,A项错误;
B.汽车尾气主要成分是氮氧化物、二氧化硫和颗粒物等,其中NO能结合人体内的血红蛋白,使之丧失运送氧的能力,所以NO是尾气中的有害成分,B项正确;
C.常温常压下,一氧化氮能与空气中的氧气直接化合生成红棕色的二氧化氮,C项正确;
D.NO2与水反应生成硝酸和NO,D项正确;
答案选A。
5.A
【详解】A.工业利用氮气和氢气合成氨气,氮元素由游离态转化为化合态,属于氮的固定,故选A;
B.氨气和硫酸反应制取铵态氮肥,氮元素不是由游离态转化为化合态,不属于氮的固定,故不选B;
C.氨基酸合成人体所需的蛋白质,氮元素不是由游离态转化为化合态,不属于氮的固定,故不选C;
D.硝酸盐在细菌作用下生成氮气,氮元素由化合态转化为游离态,不属于氮的固定,故不选D;
选A。
6.C
【详解】A.碳原子的核电荷数为6,8个中子的碳原子的核素符号应是14C,故A错误;
B.HF是共价化合物,分子中不存在离子,电子式不用括号,不带电荷,故B错误;
C.CO2中碳与氧原子间是双键,结构式为O=C=O,故C正确;
D.Cl原子的核电荷数为17,Cl-的核外电子数为18,Cl-离子的结构示意图为,故D错误;
故选C。
7.A
【详解】A.氯化钠为离子化合物,氯离子带电荷并需用方括号括起来,钠离子用离子符号表示,电子式:,故A正确;
B.氮气中氮原子之间形成三个共用电子对,每个氮原子最外层达到8电子稳定结构,氮原子还有自身一对孤电子对,电子式:,故B错误;
C.氨气为共价化合物,每个氢原子与氮原子形成一个共用电子对,氮原子最外层达到8电子稳定结构,电子式为:,故C错误;
D.二氧化碳中每个氧原子分别与碳原子形成2对共用电子对,每个原子最外层都达到8电子稳定结构,则电子式为:,故D错误;
故选A。
8.C
【详解】A.氨气为共价化合物,氮原子最外层达到8个电子稳定结构,正确的电子式为:,故A错误;
B.氯原子未成键的孤电子对未标出,正确的电子式为,故B错误;
C.氮原子最外层有5个电子,要达到稳定结构需形成三对共用电子,即,故C正确;
D.二氧化碳是共价化合物,二氧化碳分子中碳原子与氧原子之间形成2对共用电子,达稳定结构,电子式为,故D错误;
故选C。
9.C
【详解】A.通常情况下,Si、S的单质为固体,N的单质为气体,故A错误;
B.自然界中没有游离态的硅,故B错误;
C. Si、N、S对应的含氧酸分别是H2SiO3、HNO3、H2SO4,故C正确;
D.N有NO、NO2、N2O3等多种氧化物,S有SO2、SO3两种氧化物,故D错误;
选C。
10.A
【详解】A.对氮的循环起到主导作用的是自然因素,人类活动只是在一定程度上影响氮的循环,故A错误;
B.图可知,硝化和反硝化过程都涉及到了化合价的变化,故都属于策化还原反应,故B正确;
C.氮化过程是动植物蛋白转化为氨气或铵根离子,即有机氮转化为无机氮的过程,故C正确;
D.固氮过程消耗了大气中的氮气,反硝化过程中生成了氮气,故反硝化过程有助于稳定N2在大气中的含量,故D正确。
故选:A。
11.C
【详解】A.通常状况下,NO是一种无色气体,A正确;
B.NO是汽车尾气的有害成分之一,遇到氧气转变为二氧化氮,会引起光化学烟雾, B正确;
C.NO遇到氧气转变为二氧化氮,不能用排空气法收集,只能用排水法收集,C错误;
D.NO中氮元素为+2价,化合价可以降低,因此能表现出氧化性、作氧化剂, D正确;
答案选C。
12.A
【详解】A.由于很多化肥易溶于水,过量施用不仅会造成浪费,部分化肥会随着雨水流入河流和湖泊,造成水体富营养化,产生水华等污染现象,故A错误;
B.氯化铵能与碱性物质反应产生氨气,降低肥效,故B正确;
C.尿素属于常用的氮肥,故C正确;
D.农家肥养分全面,但含量低,见效慢,化肥养分单一,但含量高,见效快,将二者混合施用可以取长补短,有利于养分平衡供应,从而取得良好的肥效,故D正确;
综上所述,说法不正确的是A项,故选A。
13.B
【详解】A.丙烯的结构简式为,A错误;
B.甲烷分子的空间结构为正四面体,填充模型:,B正确;
C.羟基的电子式为 ,C错误;
D.葡萄糖的最简式为,D错误;
故选B。
14.B
【详解】A.分子的结构式为,O原子应为杂化,故A错误;
B.O原子形成4个杂化轨道,其中2个杂化轨道被2对孤电子对占据,另2个杂化轨道分别与H原子的1s轨道和原子的轨道重叠形成2个键,故B正确;
C.因为O原子是杂化,所以该分子为角形,故C错误;
D.其电子式为,故D错误;
故选B。
15.CD
【详解】A.工业合成氨是将与在一定条件下反应生成,属于人工固氮,A项正确;
B.雷电作用下与发生化学反应生成,B项正确;
C.与生成的反应是氧化还原反应,所以在氮的循环过程中涉及氧化还原反应,C项错误;
D.由氮的循环示意图可知,通过生物体可以将铵盐和蛋白质相互转化,实现了含氮无机物与含氮有机物间的相互转化,D项错误;
答案选CD。
16. 挥发性 2Cu+6HNO3=2Cu(NO3)2+NO↑+NO2↑+3H2O AC 淀粉-KI 溶液变蓝 挥发出的硝酸也能使淀粉-KI溶液变蓝 (打开活塞),挤压空气囊,丙中气体由无色变为红棕色
【详解】(1)硝酸具有挥发性,挥发的HNO3接触到水蒸气形成酸雾。
(2)Cu与浓硝酸反应,应该得到硝酸铜、物质的量相等的NO和NO2还有水。将NO和NO2视为一个整体,相当于化合价降低4,Cu的化合价升高2,所以Cu的系数为2,NO和NO2的系数都是1,再根据原子守恒配平,即得:2Cu + 6HNO3 = 2Cu(NO3)2 + NO↑ + NO2↑ + 3H2O。该反应说明硝酸具有酸性和氧化性,选项AC正确。
(3)淀粉-KI 溶液中的碘离子被氧化为碘单质,淀粉溶液遇碘单质变为蓝色,所以现象为:淀粉-KI 溶液变蓝。但是实验中硝酸是具有挥发性的,甲装置中铜与硝酸的反应也是放热反应,随着温度升高,硝酸挥发也会加剧,挥发的硝酸也可能氧化碘离子生成碘单质。
(4)丙装置中,通过排水法收集了NO,打开活塞,挤压空气囊,将空气挤压进丙装置中,NO接触到氧气,被氧化为NO2,颜色变为红棕色。
【点睛】第(3)问中的检验实际上还是有一些问题,NO2通入溶液中,会与水反应生成硝酸,硝酸可以氧化碘离子得到碘单质,所以并不能认为表现的一定是NO2的氧化性。
17. 下 两气体混合后,红棕色消失 NO 氧化 NO2+SO2=NO+SO3 4Mg+2NO24MgO+N2 NaOH溶液 吸收NO2避免污染环境 收集N2 badc
【分析】Ⅱ.该实验中先通入二氧化氮气体可排尽装置中的空气,此时打开弹簧夹,干燥管吸收多余的二氧化氮,然后关闭弹簧夹,之后点燃酒精灯,二氧化氮与镁单质发生反应,A装置中盛放氢氧化钠溶液可吸收为反应的二氧化氮,B装置短进长出且装满水,可用排水法收集反应生成的氮气。
【详解】I.(1)NO2呈红棕色,SO2为无色气体,故下瓶气体颜色深;
(2)NO2有强氧化性,能被SO2,还原成NO,则两气体混合后,红棕色消失;
(3)“有红棕色气体产生”说明SO2和NO2反应的产物中有NO,NO遇空气被氧化成NO2,SO2与NO2的反应中NO2体现了氧化性;
(4)NO2和SO2反应的化学方程式为;
Ⅱ.(1)由题意分析可知,Mg与NO2发生置换反应,反应的化学方程点燃式为;
(2)①由反应可知,装置A中的试剂是NaOH溶液,作用是除去N2中混有的NO2;
②干燥管的作用是吸收NO2避免污染环境。装置B是利用排水法收集N2的装置;
③正确的实验操作步骤是:打开弹簧夹→通入NO2(排尽装置中的空气)→当硬质玻璃管充满红棕色气体后,关闭弹簧夹,点燃酒精灯。
【点睛】集气瓶有多种用途:长进短出的空瓶可收集密度比空气大的气体,短进长出的空瓶可收集密度比空气小的气体;短进长出且装满水可用排水法收集气体;短进短出的空瓶可做安全瓶,防倒吸。
18. 第三周期第ⅦA族 、
【分析】由X、Y、Z、W四种短周期元素在周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期;
Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,则Z为S元素,可推知X为N元素,Y为O元素,W为元素;
Ⅱ.若Y和Z的核外电子数之和为22,则Y为N元素,Z为P元素,可推知X为C元素,W为S元素,据此分析解答。
【详解】Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,则Z为S元素,可推知X为N元素,Y为O元素,W为元素;
(1)W为元素,位于第三周期第ⅦA族;
(2)Z为S元素,Y为O元素,O和S元素可组成、;
Ⅱ.若Y和Z的核外电子数之和为22,则Y为N元素,Z为P元素,可推知X为C元素,W为S元素;
(1)Y为N元素,其简单氢化物为,工业上生产的化学方程式为;
(2)X为C元素,其最高价氧化物为,将通入硅酸钠溶液中,有白色沉淀(硅酸)生成,反应的化学方程式为。
19. 钠 S Cl-S-S-Cl
【分析】短周期主族元素A、B、C、D、E的原子序数依次增大,A原子的最外层电子数是次外层电子数的3倍,A原子只能有2个电子层,最外层电子数为6,A为O;A、D同主族,则D为S;E的原子序数最大,E为;B是短周期元素中原子半径最大的主族元素,则B为;C原子的质子数比B原子的质子数多2个,则C为。
【详解】(1)由上述分析可以知道,B元素的名称为钠,D的元素符号为S,E的离子为,离子结构示意图为;
(2)分子中S与之间形成1对共用电子对,电子式为,分子中S原子之间形成1对共用电子对,S原子与原子之间形成1对共用电子,结构式为;
(3)和的水溶液发生氧化还原反应生成硫的单质,根据得失电子守恒和电荷守恒,反应的离子方程式为;过氧化钠得电子,失电子,则用单线桥标出此反应中电子转移的方向和数目为;
(4)与氯气在水中反应生成与硫酸,反应的离子方程式为。
答案第1页,共2页
答案第1页,共2页
