吉林省普通高中2022-2023学年高一下学期6月测试化学试卷(PDF版含答案)
文档属性
| 名称 | 吉林省普通高中2022-2023学年高一下学期6月测试化学试卷(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 13:21:14 | ||
图片预览


文档简介
2022-2023 学年度高一下学期 6 月测试 C、反应 a中焦炭做还原剂
D、“天宫二号”空间实验室的太阳能电池板的主要材料是高纯硅
化 学
4.设 NA为阿伏加德罗常数的值。下列说法正确的是( )
注意事项:
A、标准状况下,22.4LSO3的分子数为 NA
1.本试卷分为选择题和非选择题两部分,满分 100 分,考试时间 75 分钟
B、在标准状况下,将 O2和 NO2按 1:4的体积比充满于干燥的烧瓶,做喷泉实验,当水充满整个
1.答题前填写好自己的姓名、班级、考号等信息
烧瓶后(假设溶液不外溢),烧瓶内溶液中溶质的物质的量浓度是 1/28mol/L
2.请将答案正确填写在答题卡上
C、足量的 Cu 与 2mol浓硫酸加热充分反应后得到 SO2分子数目为 2NA
3.可能用到的相对原子质量:H 1 C 12 O 16 S 32 N 14 Cu 64 Si 28
D、1molCu与足量的稀硝酸充分反应得到 NO气体分子数目为 2NA
一、单选题(本大题共 15 小题,每小题 3 分,共 45 分。每小题只有一项是符合题目要求的)
5.实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验 ,下列有关甲烷的取代反应的
1.化学与材料、生活和环境密切相关。下列有关说法中正确的是( )
叙述正确的是( )
A.煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料
A. 反应结束后,向饱和食盐水中滴加紫色石蕊溶液,溶液颜色变红
B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
B. 1mol甲烷生成 CCl4最多消耗 2mol氯气
C.“海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
C. 甲烷与氯气以物质的量之比 1 ∶ 1混合时发生取代反应只生成 CH3Cl
D.新型材料聚酯纤维、光导纤维都属于有机高分子化合物
D. 甲烷与氯气的取代反应产物中 CH3Cl最多
2.有两种气态烷烃的混合物,在标准状况下,其密度为 1.16g·L-1,则关于此混合物组成的说法正确
6.已知:298K时,2SO2(g) + O2(g) 2SO3(g) △H = —Q1KJ/mol,在相同温度下,向密闭容器中
的是( )
通入 2molSO2和 1molO2,达到平衡时放出热量 Q2KJ,则下列关系式正确的是( )
A、可能是乙烷和丙烷的混合物 B、可能是甲烷和己烷的混合物
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法比较
C、一定有乙烷 D、一定有甲烷
7.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为 Ag2O和 Zn,电解质溶液为 KOH
3.制造硅半导体材料首先要制备纯硅,工业上常用石英砂(主要成分:SiO2)按照如下流程来制备纯
溶液,总反应式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。下列说法不正确的是
硅,下列说法不正确的是( )
A.锌是负极,氧化银是正极
B.锌发生氧化反应,氧化银发生还原反应
C.溶液中 OH-向正极移动,K+、H+向负极移动
D.随着电极反应的不断进行,电解质溶液的 pH会增大
A、反应 a、b、c都是置换反应
8.主链上含 5个碳原子,有甲基、乙基 2个支链的烷烃有( )
B、整个流程中只有 H2可以循环使用
A、2种 B、3种 C、4种 D、5种
第 1页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
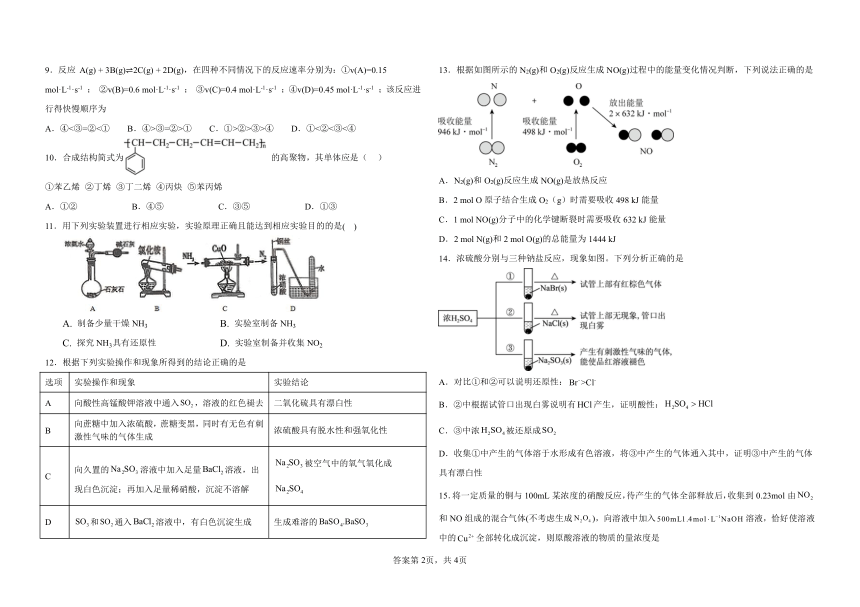
9.反应 A(g) + 3B(g) 2C(g) + 2D(g),在四种不同情况下的反应速率分别为:①v(A)=0.15 13.根据如图所示的 N2(g)和 O2(g)反应生成 NO(g)过程中的能量变化情况判断,下列说法正确的是
mol·L-1·s-1 ; ②v(B)=0.6 mol·L-1·s-1 ; ③v(C)=0.4 mol·L-1·s-1 ;④v(D)=0.45 mol·L-1·s-1 ;该反应进
行得快慢顺序为
A.④<③=②<① B.④>③=②>① C.①>②>③>④ D.①<②<③<④
10.合成结构简式为 的高聚物,其单体应是( )
A.N2(g)和 O2(g)反应生成 NO(g)是放热反应
①苯乙烯 ②丁烯 ③丁二烯 ④丙炔 ⑤苯丙烯
B.2 mol O原子结合生成 O2(g)时需要吸收 498 kJ能量
A.①② B.④⑤ C.③⑤ D.①③
C.1 mol NO(g)分子中的化学键断裂时需要吸收 632 kJ能量
11.用下列实验装置进行相应实验,实验原理正确且能达到相应实验目的的是( )
D.2 mol N(g)和 2 mol O(g)的总能量为 1444 kJ
14.浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是
A. 制备少量干燥 NH3 B. 实验室制备 NH3
C. 探究 NH3具有还原性 D. 实验室制备并收集 NO2
12.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验结论 A.对比①和②可以说明还原性:Br ->Cl-
A 向酸性高锰酸钾溶液中通入SO2,溶液的红色褪去 二氧化硫具有漂白性 B.②中根据试管口出现白雾说明有HCl产生,证明酸性:H2SO4 HCl
向蔗糖中加入浓硫酸,蔗糖变黑,同时有无色有刺
B 浓硫酸具有脱水性和强氧化性 C.③中浓H2SO4被还原成SO2
激性气味的气体生成
D.收集①中产生的气体溶于水形成有色溶液,将③中产生的气体通入其中,证明③中产生的气体
Na SO
向久置的Na 2SO
2 3 被空气中的氧气氧化成
3 溶液中加入足量BaCl2溶液,出C 具有漂白性
现白色沉淀;再加入足量稀硝酸,沉淀不溶解 Na2SO4 15.将一定质量的铜与 100mL某浓度的硝酸反应,待产生的气体全部释放后,收集到 0.23mol由NO2
1
D SO N O3和SO2通入BaCl2溶液中,有白色沉淀生成 生成难溶的BaSO .BaSO 和 NO组成的混合气体(不考虑生成 2 4 ),向溶液中加入500mL1.4mol L NaOH 溶液,恰好使溶液4 3
中的Cu2 全部转化成沉淀,则原酸溶液的物质的量浓度是
答案第 2页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
A.9mol L 1 B. 7mol L 1 C.9.3mol L 1 D. 9.15mol L 1 D.NaoH溶液一次性迅速倒入
二、非选择题(本题共 4 小题,55 分) 17.(每空 2分,共 16分)已知乙烯能发生如图转化关系:
16.(每空 2分,共 14分)用如图所示的装置测定中和反应反应热。
实验药品:100mL0.50mol L 1盐酸、50mL0.50mol L 1NaOH溶液、
50mL0.50mol L 1氨水。
实验步骤:略。
已知弱碱电离时吸热。 (1)A为乙烯的同系物,相对分子质量比乙烯大 14,根据乙烯的性质推测 A的性质,下列说法错.误.
回答下列问题。
的是________________________。
(1)从实验装置上看,还缺少________________,其能否用铜质材料替代?______(填“能”或“不能”),
A.A与Cl2在一定条件下能发生取代反应
理由是__________________________________________________。
(2)装置中隔热层的作用是________________________________________。 B.A与溴水反应产物为BrCH2CH2CH2Br
(3)将浓度为0.50mol L 1的酸溶液和0.50mol L 1的碱溶液各 50 mL混合(溶液密度均为1g mL 1 ),生
C.A发生加成聚合产物为
成的溶液的比热容 c 4.18J g 1 ℃ 1,测得温度如下:
D.A不能使酸性高锰酸钾溶液褪色
反应物 起始温度 t1 /℃ 最高温度 t2 /℃ (2)D的结构简式为:________________。
(3)写出反应①的反应类型:________________。
甲组(HCl+NaOH) 15.0 18.3
(4)写出反应②的化学方程式:
乙组(HCl NH3 H2O ) 15.0 18.1 ___________________________________________。
(5)实验室通过下图装置制备乙酸乙酯,浓硫酸的作用是
①两组实验结果存在差异的原因是_________________________________。
________________,试管 b中溶液是________________,请指出该装
②HCl aq NH3 H2O aq NH4Cl aq H2O l 的 H _______________(保留一位小数)。
置的一处明显错误__________________________________。
③某同学利用上述装置重新做甲组实验,测得反应热 H 偏大,则可能的原因是______(填序号)。
(6)E是乙酸乙酯的同分异构体,且 E能与NaHCO3溶液反应,则 E的结构简式可能为(写出 1种):
A.测完盐酸的温度直接测 NaOH溶液温度
__________________________________。
B.做该实验时室温较高
C.杯盖未盖严
第 3页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
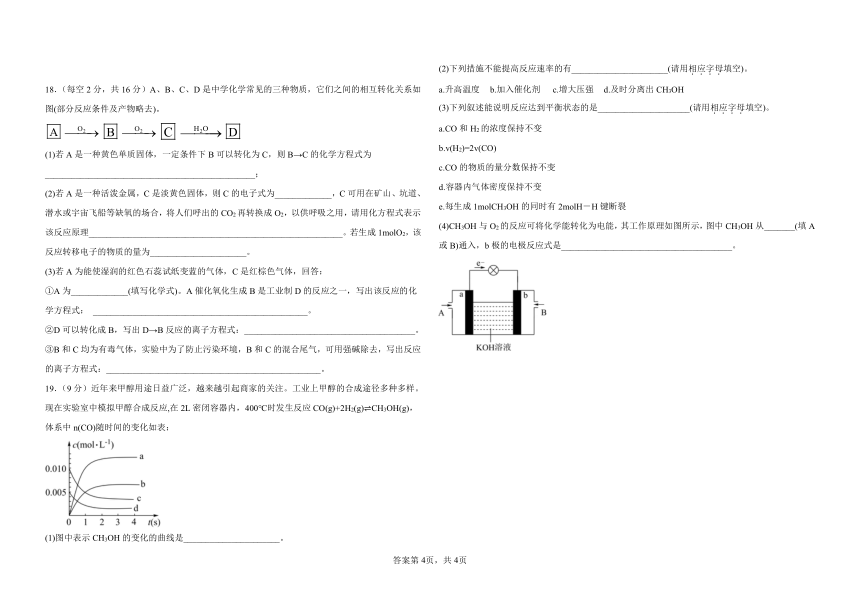
(2)下列措施不能提高反应速率的有______________________(请用相.应.字.母.填空)。
18.(每空 2分,共 16分)A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如 a.升高温度 b.加入催化剂 c.增大压强 d.及时分离出 CH3OH
图(部分反应条件及产物略去)。 (3)下列叙述能说明反应达到平衡状态的是_____________________(请用相.应.字.母.填空)。
A O 2 B O 2 C H 2O D a.CO和 H2的浓度保持不变
b.v(H2)=2v(CO)
(1)若 A是一种黄色单质固体,一定条件下 B可以转化为 C,则 B→C的化学方程式为
c.CO的物质的量分数保持不变
________________________________________________;
d.容器内气体密度保持不变
(2)若 A是一种活泼金属,C是淡黄色固体,则 C的电子式为_____________,C可用在矿山、坑道、
e.每生成 1molCH3OH的同时有 2molH-H键断裂
潜水或宇宙飞船等缺氧的场合,将人们呼出的 CO2再转换成 O2,以供呼吸之用,请用化方程式表示
(4)CH3OH与 O2的反应可将化学能转化为电能,其工作原理如图所示,图中 CH3OH从_______(填 A
该反应原理__________________________________________________________。若生成 1molO2,该
或 B)通入,b极的电极反应式是_______________________________________。
反应转移电子的物质的量为______________________。
(3)若 A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,回答:
①A为_____________(填写化学式)。A催化氧化生成 B是工业制 D的反应之一,写出该反应的化
学方程式: _________________________________________________。
②D可以转化成 B,写出 D→B反应的离子方程式:_______________________________________。
③B和 C均为有毒气体,实验中为了防止污染环境,B和 C的混合尾气,可用强碱除去,写出反应
的离子方程式:_________________________________________________。
19.(9分)近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。
现在实验室中模拟甲醇合成反应,在 2L密闭容器内,400℃时发生反应 CO(g)+2H2(g) CH3OH(g),
体系中 n(CO)随时间的变化如表:
(1)图中表示 CH3OH的变化的曲线是______________________。
答案第 4页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
高一化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
B D B B A A C A B D C B C A C
16.(每空 2 分,共 14 分)
(1)玻璃搅拌器 不能 金属材料易散热,会使实验误差增大
(2)减少实验过程中的热量损失
(3) NH3 H2O为弱碱,电离时要吸热,导致放热较少 51.8kJ mol 1 AC
【详解】(1)由简易量热计的构造可知该装置缺少的仪器是玻璃搅拌器;金属材料易散热,会使实验误差增
大,所以不可以用铜质材料替代玻璃搅拌器。
(2)做中和反应反应热的测定实验要做好保温工作,隔热层的作用是减少实验过程中的热量损。
(3)①两组实验一个是强酸和强碱的反应,一个是强酸和弱碱的反应,NH3 H2O为弱碱,电离时要吸热,
导致放热较少。
②50mL0.50mol L 1盐酸与50mL0.50mol L 1氨水的总质量为100mL 1g mL 1 100g , c 4.18J g 1 ℃ 1,
则生成 0.025 mol 水放出的热量为 4.18J g 1 ℃ 1 100g 3.1℃ 1.2958kJ,所以生成 1 mol 水放出的热量为
1.2958 kJ 51.832kJ,则反应HCl aq NH3 H2O aq NH Cl aq H 10.025 4 2
O l 的 H 51.8kJ mol 。
③测完盐酸的温度直接测 NaOH 溶液温度时,温度计上残留的酸液未用水冲洗干净,酸碱中和会放热,导
致一部分反应物损失,使测得的 H 偏大,A 项可能;做该实验时室温较高,不会影响实验结果,B 项不可
能;杯盖未盖严会导致热量散失,使测得的 H 偏大,C 项可能;NaOH 溶液一次性迅速倒入可以减少实验
误差,减少热量损失,D项不可能;故答案为:AC。
16.(每空 2 分,共 16 分)
(1)BD (2)CH3COOH (3)加成反应 (4)2CH CH OH+O C3 2 2 u △ 2CH3CHO+ 2H2O
(5) 催化剂和吸水剂 饱和碳酸钠溶液 试管 a 溶液中没加碎瓷片,可能导致加热时溶液发生暴沸;
(6)CH3CH2CH2COOH 或(CH3)2CHCOOH
【分析】乙烯与水发生加成反应生成乙醇,则 B 为乙醇,乙醇在铜做催化剂的条件下和氧气反应成成乙醛,
C 为乙醛,氧化反应直接生成乙酸,则 D 为乙酸,在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸
乙酯,则 D为乙酸,以此来解析;
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
(1)A 为乙烯的同系物,相对分子质量比乙烯大 14,则 A 为丙烯;
A.丙烯分子中含有甲基,一定条件下,能与氯气在发生取代反应生成不饱和氯代烃,A 正确;
B.丙烯分子中含有碳碳双键,能与溴水发生加成反应生成 CH3CHBrCH2Br, B 错误;
C.丙烯分子中含有碳碳双键,一定条件下,能发生加聚反应生成 ,C 正确;
D.丙烯分子中含有碳碳双键,能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,D错误;
故选 BD;
(2)D 为乙酸,D 的结构简式为:CH3COOH;
(3)反应①为乙烯与水发生加成反应生成乙醇,属于加成反应;
(4)反应②乙醇在铜做催化剂的条件下和氧气反应成成乙醛和水,反应的化学方程式为:
2CH3CH2OH+O2 C u △ 2CH3CHO+ 2H2O;
(5)在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸乙酯,浓硫酸的作用为催化剂和吸水剂;由实
验装置图可知,试管 b 中盛有的饱和碳酸钠溶液用于降低乙酸乙酯的溶解度,便于分层,与乙酸乙酯中的
乙酸蒸汽反应,除去乙酸,吸收乙酸乙酯中易溶于水的乙醇;该实验装置存在明显的缺陷,一是试管 a溶
液中没加碎瓷片,可能导致加热时溶液发生暴沸
(6)乙酸乙酯的同分异构体,且 E 能与 NaHCO3溶液反应说明 E 中含有羧基,E的结构简式 CH3CH2CH2COOH,
(CH3)2CHCOOH;
18.(每空 2 分,共 16 分)
(1)2SO2+O2 2SO3
(2) 2Na2O2+2CO2=2Na2CO3+O2 2mol
催化剂
(3) NH3 4NH3+5O2 4NO+6H2O 3Cu+8H++2NO 3 =3Cu2++2NO↑+4H2O
Δ
NO+NO +2OH-=2NO 2 2 +H2O
【详解】(1)A 是一种黄色单质固体,一定条件下 B 可以转化为 C,则 A 应为 S,B 为 SO2,C 为 SO3,C 与
水反应生成 D 为 H2SO4,则 B→C 的化学方程式为 2SO2+O2 2SO3;
(2)A 是一种活泼金属,C 是淡黄色固体,则 A 为 Na,B 为 Na2O,C 为 Na2O2,C 与水反应生成 D 为 NaOH,
C 为 Na2O2,含有离子键和共价键,电子式是 ,过氧化钠能将人们呼出的 CO2再转换成 O2,
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
反应的方程式为 2Na2O2+2CO2=2 Na2CO3+O2,根据方程式可知,若生成 1mol O2,该反应转移电子的物质的
量为 2mol,故答案为: ;2Na2O2+2CO2=2Na2CO3+O2;2mol;
(3)A 为能使湿润的红色石蕊试纸变蓝的气体,则 A 为 NH3,C 是红棕色气体,C 为 NO2,所以 B 为 NO,
二氧化氮与水反应生成 D为硝酸,
①根据上面的分析可知,A 为 NH3,NH3催化氧化生成 NO,该反应的化学方程式:
催化剂
4NH3+5O2 4NO+6H2O;
Δ
② 硝酸转化为一氧化氮的反应的离子方程式为 3Cu+8H++2NO 2+3 =3Cu +2NO↑+4H2O;
③NO 和 NO2可用强碱除去,发生归中反应,反应的离子方程式:NO+NO2+2OH-=2NO 2 +H2O。
19.(9 分 除标识外每空均 2 分)(1)b (2)d (3)ac (4) A(1 分) O2+4e-+2H2O=4OH-
【分析】(1)CH3OH 是产物,随反应进行浓度增大,平衡时物质的量为 CO 物质的量的变化量 n(CO);
(2)根据影响化学反应速率的因素分析;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(4)CH3OH 与 O2的反应可将化学能转化为电能,形成的是原电池反应,甲醇在负极失电子发生氧化反应,正
极是氧气得到电子发生还原反应。
【详解】(1)CH3OH 是产物,随反应进行物质的量增大,平衡时物质的量为 CO 物质的量的变化量 n(CO),
表中 CO的物质的量 0~3s 变化=0.02mol-0.007mol=0.013mol,所以图象中只有 b 符合,因此本题正确答案是
b;
(2)升高温度、增大压强和使用催化剂都能使化学反应速率增大,及时分离出 CH3OH,使生成物浓度减小,
逆反应速率减小,平衡正向移动,正反应速率也随之减小,
因此本题正确答案是 d;
(3)a.CO和 H2的浓度保持不变,说明反应达到平衡状态,故 a 正确;
b.反应速率之比等于化学方程式计量数之比,v(H2)=2v(CO)为正反应速率之比,故 b 错误;
c.反应从开始到平衡的建立过程中 CO 的物质的量的分数在不断改变,当 CO 的物质的量分数保持不变时,
说明反应达到平衡状态,故 c正确;
d.根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所
以不能据此判断是否达到平衡状态,故 d 错误;
e.每生成 1molCH3OH 的同时有 2molH-H 键断裂均表示正反应速率之比,所以不能据此判断是否达到平衡
状态,故 e 错误。
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
因此本题正确答案是 ac;
(4)电子由 a 流向 b 说明 a 为负极,b 为正极,CH3OH 与 O2的反应可将化学能转化为电能,甲醇失电子发
生氧化反应,所以 CH3OH 从 A 通,B 通入氧气,b电极发生的电极反应为氧气得到电子生成氢氧根离子,
电极反应为:O -2+4e +2H O=4OH-2 ,
因此,本题正确答案是:A;O2+4e-+2H2O=4OH-。
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
D、“天宫二号”空间实验室的太阳能电池板的主要材料是高纯硅
化 学
4.设 NA为阿伏加德罗常数的值。下列说法正确的是( )
注意事项:
A、标准状况下,22.4LSO3的分子数为 NA
1.本试卷分为选择题和非选择题两部分,满分 100 分,考试时间 75 分钟
B、在标准状况下,将 O2和 NO2按 1:4的体积比充满于干燥的烧瓶,做喷泉实验,当水充满整个
1.答题前填写好自己的姓名、班级、考号等信息
烧瓶后(假设溶液不外溢),烧瓶内溶液中溶质的物质的量浓度是 1/28mol/L
2.请将答案正确填写在答题卡上
C、足量的 Cu 与 2mol浓硫酸加热充分反应后得到 SO2分子数目为 2NA
3.可能用到的相对原子质量:H 1 C 12 O 16 S 32 N 14 Cu 64 Si 28
D、1molCu与足量的稀硝酸充分反应得到 NO气体分子数目为 2NA
一、单选题(本大题共 15 小题,每小题 3 分,共 45 分。每小题只有一项是符合题目要求的)
5.实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验 ,下列有关甲烷的取代反应的
1.化学与材料、生活和环境密切相关。下列有关说法中正确的是( )
叙述正确的是( )
A.煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料
A. 反应结束后,向饱和食盐水中滴加紫色石蕊溶液,溶液颜色变红
B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
B. 1mol甲烷生成 CCl4最多消耗 2mol氯气
C.“海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
C. 甲烷与氯气以物质的量之比 1 ∶ 1混合时发生取代反应只生成 CH3Cl
D.新型材料聚酯纤维、光导纤维都属于有机高分子化合物
D. 甲烷与氯气的取代反应产物中 CH3Cl最多
2.有两种气态烷烃的混合物,在标准状况下,其密度为 1.16g·L-1,则关于此混合物组成的说法正确
6.已知:298K时,2SO2(g) + O2(g) 2SO3(g) △H = —Q1KJ/mol,在相同温度下,向密闭容器中
的是( )
通入 2molSO2和 1molO2,达到平衡时放出热量 Q2KJ,则下列关系式正确的是( )
A、可能是乙烷和丙烷的混合物 B、可能是甲烷和己烷的混合物
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法比较
C、一定有乙烷 D、一定有甲烷
7.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为 Ag2O和 Zn,电解质溶液为 KOH
3.制造硅半导体材料首先要制备纯硅,工业上常用石英砂(主要成分:SiO2)按照如下流程来制备纯
溶液,总反应式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2。下列说法不正确的是
硅,下列说法不正确的是( )
A.锌是负极,氧化银是正极
B.锌发生氧化反应,氧化银发生还原反应
C.溶液中 OH-向正极移动,K+、H+向负极移动
D.随着电极反应的不断进行,电解质溶液的 pH会增大
A、反应 a、b、c都是置换反应
8.主链上含 5个碳原子,有甲基、乙基 2个支链的烷烃有( )
B、整个流程中只有 H2可以循环使用
A、2种 B、3种 C、4种 D、5种
第 1页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
9.反应 A(g) + 3B(g) 2C(g) + 2D(g),在四种不同情况下的反应速率分别为:①v(A)=0.15 13.根据如图所示的 N2(g)和 O2(g)反应生成 NO(g)过程中的能量变化情况判断,下列说法正确的是
mol·L-1·s-1 ; ②v(B)=0.6 mol·L-1·s-1 ; ③v(C)=0.4 mol·L-1·s-1 ;④v(D)=0.45 mol·L-1·s-1 ;该反应进
行得快慢顺序为
A.④<③=②<① B.④>③=②>① C.①>②>③>④ D.①<②<③<④
10.合成结构简式为 的高聚物,其单体应是( )
A.N2(g)和 O2(g)反应生成 NO(g)是放热反应
①苯乙烯 ②丁烯 ③丁二烯 ④丙炔 ⑤苯丙烯
B.2 mol O原子结合生成 O2(g)时需要吸收 498 kJ能量
A.①② B.④⑤ C.③⑤ D.①③
C.1 mol NO(g)分子中的化学键断裂时需要吸收 632 kJ能量
11.用下列实验装置进行相应实验,实验原理正确且能达到相应实验目的的是( )
D.2 mol N(g)和 2 mol O(g)的总能量为 1444 kJ
14.浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是
A. 制备少量干燥 NH3 B. 实验室制备 NH3
C. 探究 NH3具有还原性 D. 实验室制备并收集 NO2
12.根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验结论 A.对比①和②可以说明还原性:Br ->Cl-
A 向酸性高锰酸钾溶液中通入SO2,溶液的红色褪去 二氧化硫具有漂白性 B.②中根据试管口出现白雾说明有HCl产生,证明酸性:H2SO4 HCl
向蔗糖中加入浓硫酸,蔗糖变黑,同时有无色有刺
B 浓硫酸具有脱水性和强氧化性 C.③中浓H2SO4被还原成SO2
激性气味的气体生成
D.收集①中产生的气体溶于水形成有色溶液,将③中产生的气体通入其中,证明③中产生的气体
Na SO
向久置的Na 2SO
2 3 被空气中的氧气氧化成
3 溶液中加入足量BaCl2溶液,出C 具有漂白性
现白色沉淀;再加入足量稀硝酸,沉淀不溶解 Na2SO4 15.将一定质量的铜与 100mL某浓度的硝酸反应,待产生的气体全部释放后,收集到 0.23mol由NO2
1
D SO N O3和SO2通入BaCl2溶液中,有白色沉淀生成 生成难溶的BaSO .BaSO 和 NO组成的混合气体(不考虑生成 2 4 ),向溶液中加入500mL1.4mol L NaOH 溶液,恰好使溶液4 3
中的Cu2 全部转化成沉淀,则原酸溶液的物质的量浓度是
答案第 2页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
A.9mol L 1 B. 7mol L 1 C.9.3mol L 1 D. 9.15mol L 1 D.NaoH溶液一次性迅速倒入
二、非选择题(本题共 4 小题,55 分) 17.(每空 2分,共 16分)已知乙烯能发生如图转化关系:
16.(每空 2分,共 14分)用如图所示的装置测定中和反应反应热。
实验药品:100mL0.50mol L 1盐酸、50mL0.50mol L 1NaOH溶液、
50mL0.50mol L 1氨水。
实验步骤:略。
已知弱碱电离时吸热。 (1)A为乙烯的同系物,相对分子质量比乙烯大 14,根据乙烯的性质推测 A的性质,下列说法错.误.
回答下列问题。
的是________________________。
(1)从实验装置上看,还缺少________________,其能否用铜质材料替代?______(填“能”或“不能”),
A.A与Cl2在一定条件下能发生取代反应
理由是__________________________________________________。
(2)装置中隔热层的作用是________________________________________。 B.A与溴水反应产物为BrCH2CH2CH2Br
(3)将浓度为0.50mol L 1的酸溶液和0.50mol L 1的碱溶液各 50 mL混合(溶液密度均为1g mL 1 ),生
C.A发生加成聚合产物为
成的溶液的比热容 c 4.18J g 1 ℃ 1,测得温度如下:
D.A不能使酸性高锰酸钾溶液褪色
反应物 起始温度 t1 /℃ 最高温度 t2 /℃ (2)D的结构简式为:________________。
(3)写出反应①的反应类型:________________。
甲组(HCl+NaOH) 15.0 18.3
(4)写出反应②的化学方程式:
乙组(HCl NH3 H2O ) 15.0 18.1 ___________________________________________。
(5)实验室通过下图装置制备乙酸乙酯,浓硫酸的作用是
①两组实验结果存在差异的原因是_________________________________。
________________,试管 b中溶液是________________,请指出该装
②HCl aq NH3 H2O aq NH4Cl aq H2O l 的 H _______________(保留一位小数)。
置的一处明显错误__________________________________。
③某同学利用上述装置重新做甲组实验,测得反应热 H 偏大,则可能的原因是______(填序号)。
(6)E是乙酸乙酯的同分异构体,且 E能与NaHCO3溶液反应,则 E的结构简式可能为(写出 1种):
A.测完盐酸的温度直接测 NaOH溶液温度
__________________________________。
B.做该实验时室温较高
C.杯盖未盖严
第 3页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
(2)下列措施不能提高反应速率的有______________________(请用相.应.字.母.填空)。
18.(每空 2分,共 16分)A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如 a.升高温度 b.加入催化剂 c.增大压强 d.及时分离出 CH3OH
图(部分反应条件及产物略去)。 (3)下列叙述能说明反应达到平衡状态的是_____________________(请用相.应.字.母.填空)。
A O 2 B O 2 C H 2O D a.CO和 H2的浓度保持不变
b.v(H2)=2v(CO)
(1)若 A是一种黄色单质固体,一定条件下 B可以转化为 C,则 B→C的化学方程式为
c.CO的物质的量分数保持不变
________________________________________________;
d.容器内气体密度保持不变
(2)若 A是一种活泼金属,C是淡黄色固体,则 C的电子式为_____________,C可用在矿山、坑道、
e.每生成 1molCH3OH的同时有 2molH-H键断裂
潜水或宇宙飞船等缺氧的场合,将人们呼出的 CO2再转换成 O2,以供呼吸之用,请用化方程式表示
(4)CH3OH与 O2的反应可将化学能转化为电能,其工作原理如图所示,图中 CH3OH从_______(填 A
该反应原理__________________________________________________________。若生成 1molO2,该
或 B)通入,b极的电极反应式是_______________________________________。
反应转移电子的物质的量为______________________。
(3)若 A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,回答:
①A为_____________(填写化学式)。A催化氧化生成 B是工业制 D的反应之一,写出该反应的化
学方程式: _________________________________________________。
②D可以转化成 B,写出 D→B反应的离子方程式:_______________________________________。
③B和 C均为有毒气体,实验中为了防止污染环境,B和 C的混合尾气,可用强碱除去,写出反应
的离子方程式:_________________________________________________。
19.(9分)近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。
现在实验室中模拟甲醇合成反应,在 2L密闭容器内,400℃时发生反应 CO(g)+2H2(g) CH3OH(g),
体系中 n(CO)随时间的变化如表:
(1)图中表示 CH3OH的变化的曲线是______________________。
答案第 4页,共 4页
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
高一化学参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
B D B B A A C A B D C B C A C
16.(每空 2 分,共 14 分)
(1)玻璃搅拌器 不能 金属材料易散热,会使实验误差增大
(2)减少实验过程中的热量损失
(3) NH3 H2O为弱碱,电离时要吸热,导致放热较少 51.8kJ mol 1 AC
【详解】(1)由简易量热计的构造可知该装置缺少的仪器是玻璃搅拌器;金属材料易散热,会使实验误差增
大,所以不可以用铜质材料替代玻璃搅拌器。
(2)做中和反应反应热的测定实验要做好保温工作,隔热层的作用是减少实验过程中的热量损。
(3)①两组实验一个是强酸和强碱的反应,一个是强酸和弱碱的反应,NH3 H2O为弱碱,电离时要吸热,
导致放热较少。
②50mL0.50mol L 1盐酸与50mL0.50mol L 1氨水的总质量为100mL 1g mL 1 100g , c 4.18J g 1 ℃ 1,
则生成 0.025 mol 水放出的热量为 4.18J g 1 ℃ 1 100g 3.1℃ 1.2958kJ,所以生成 1 mol 水放出的热量为
1.2958 kJ 51.832kJ,则反应HCl aq NH3 H2O aq NH Cl aq H 10.025 4 2
O l 的 H 51.8kJ mol 。
③测完盐酸的温度直接测 NaOH 溶液温度时,温度计上残留的酸液未用水冲洗干净,酸碱中和会放热,导
致一部分反应物损失,使测得的 H 偏大,A 项可能;做该实验时室温较高,不会影响实验结果,B 项不可
能;杯盖未盖严会导致热量散失,使测得的 H 偏大,C 项可能;NaOH 溶液一次性迅速倒入可以减少实验
误差,减少热量损失,D项不可能;故答案为:AC。
16.(每空 2 分,共 16 分)
(1)BD (2)CH3COOH (3)加成反应 (4)2CH CH OH+O C3 2 2 u △ 2CH3CHO+ 2H2O
(5) 催化剂和吸水剂 饱和碳酸钠溶液 试管 a 溶液中没加碎瓷片,可能导致加热时溶液发生暴沸;
(6)CH3CH2CH2COOH 或(CH3)2CHCOOH
【分析】乙烯与水发生加成反应生成乙醇,则 B 为乙醇,乙醇在铜做催化剂的条件下和氧气反应成成乙醛,
C 为乙醛,氧化反应直接生成乙酸,则 D 为乙酸,在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸
乙酯,则 D为乙酸,以此来解析;
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
(1)A 为乙烯的同系物,相对分子质量比乙烯大 14,则 A 为丙烯;
A.丙烯分子中含有甲基,一定条件下,能与氯气在发生取代反应生成不饱和氯代烃,A 正确;
B.丙烯分子中含有碳碳双键,能与溴水发生加成反应生成 CH3CHBrCH2Br, B 错误;
C.丙烯分子中含有碳碳双键,一定条件下,能发生加聚反应生成 ,C 正确;
D.丙烯分子中含有碳碳双键,能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,D错误;
故选 BD;
(2)D 为乙酸,D 的结构简式为:CH3COOH;
(3)反应①为乙烯与水发生加成反应生成乙醇,属于加成反应;
(4)反应②乙醇在铜做催化剂的条件下和氧气反应成成乙醛和水,反应的化学方程式为:
2CH3CH2OH+O2 C u △ 2CH3CHO+ 2H2O;
(5)在浓硫酸作用下,乙醇和乙酸共热发生酯化反应生成乙酸乙酯,浓硫酸的作用为催化剂和吸水剂;由实
验装置图可知,试管 b 中盛有的饱和碳酸钠溶液用于降低乙酸乙酯的溶解度,便于分层,与乙酸乙酯中的
乙酸蒸汽反应,除去乙酸,吸收乙酸乙酯中易溶于水的乙醇;该实验装置存在明显的缺陷,一是试管 a溶
液中没加碎瓷片,可能导致加热时溶液发生暴沸
(6)乙酸乙酯的同分异构体,且 E 能与 NaHCO3溶液反应说明 E 中含有羧基,E的结构简式 CH3CH2CH2COOH,
(CH3)2CHCOOH;
18.(每空 2 分,共 16 分)
(1)2SO2+O2 2SO3
(2) 2Na2O2+2CO2=2Na2CO3+O2 2mol
催化剂
(3) NH3 4NH3+5O2 4NO+6H2O 3Cu+8H++2NO 3 =3Cu2++2NO↑+4H2O
Δ
NO+NO +2OH-=2NO 2 2 +H2O
【详解】(1)A 是一种黄色单质固体,一定条件下 B 可以转化为 C,则 A 应为 S,B 为 SO2,C 为 SO3,C 与
水反应生成 D 为 H2SO4,则 B→C 的化学方程式为 2SO2+O2 2SO3;
(2)A 是一种活泼金属,C 是淡黄色固体,则 A 为 Na,B 为 Na2O,C 为 Na2O2,C 与水反应生成 D 为 NaOH,
C 为 Na2O2,含有离子键和共价键,电子式是 ,过氧化钠能将人们呼出的 CO2再转换成 O2,
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
反应的方程式为 2Na2O2+2CO2=2 Na2CO3+O2,根据方程式可知,若生成 1mol O2,该反应转移电子的物质的
量为 2mol,故答案为: ;2Na2O2+2CO2=2Na2CO3+O2;2mol;
(3)A 为能使湿润的红色石蕊试纸变蓝的气体,则 A 为 NH3,C 是红棕色气体,C 为 NO2,所以 B 为 NO,
二氧化氮与水反应生成 D为硝酸,
①根据上面的分析可知,A 为 NH3,NH3催化氧化生成 NO,该反应的化学方程式:
催化剂
4NH3+5O2 4NO+6H2O;
Δ
② 硝酸转化为一氧化氮的反应的离子方程式为 3Cu+8H++2NO 2+3 =3Cu +2NO↑+4H2O;
③NO 和 NO2可用强碱除去,发生归中反应,反应的离子方程式:NO+NO2+2OH-=2NO 2 +H2O。
19.(9 分 除标识外每空均 2 分)(1)b (2)d (3)ac (4) A(1 分) O2+4e-+2H2O=4OH-
【分析】(1)CH3OH 是产物,随反应进行浓度增大,平衡时物质的量为 CO 物质的量的变化量 n(CO);
(2)根据影响化学反应速率的因素分析;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(4)CH3OH 与 O2的反应可将化学能转化为电能,形成的是原电池反应,甲醇在负极失电子发生氧化反应,正
极是氧气得到电子发生还原反应。
【详解】(1)CH3OH 是产物,随反应进行物质的量增大,平衡时物质的量为 CO 物质的量的变化量 n(CO),
表中 CO的物质的量 0~3s 变化=0.02mol-0.007mol=0.013mol,所以图象中只有 b 符合,因此本题正确答案是
b;
(2)升高温度、增大压强和使用催化剂都能使化学反应速率增大,及时分离出 CH3OH,使生成物浓度减小,
逆反应速率减小,平衡正向移动,正反应速率也随之减小,
因此本题正确答案是 d;
(3)a.CO和 H2的浓度保持不变,说明反应达到平衡状态,故 a 正确;
b.反应速率之比等于化学方程式计量数之比,v(H2)=2v(CO)为正反应速率之比,故 b 错误;
c.反应从开始到平衡的建立过程中 CO 的物质的量的分数在不断改变,当 CO 的物质的量分数保持不变时,
说明反应达到平衡状态,故 c正确;
d.根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所
以不能据此判断是否达到平衡状态,故 d 错误;
e.每生成 1molCH3OH 的同时有 2molH-H 键断裂均表示正反应速率之比,所以不能据此判断是否达到平衡
状态,故 e 错误。
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
因此本题正确答案是 ac;
(4)电子由 a 流向 b 说明 a 为负极,b 为正极,CH3OH 与 O2的反应可将化学能转化为电能,甲醇失电子发
生氧化反应,所以 CH3OH 从 A 通,B 通入氧气,b电极发生的电极反应为氧气得到电子生成氢氧根离子,
电极反应为:O -2+4e +2H O=4OH-2 ,
因此,本题正确答案是:A;O2+4e-+2H2O=4OH-。
{#{QQABbYaUggAAABBAAQACEwESCgAQkgGAAKgGwEAYoEAByBNABAA=}#}
同课章节目录
