第一章 原子结构与性质 测试题(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第一章 原子结构与性质 测试题(含解析) 2022-2023学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 493.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 14:57:56 | ||
图片预览




文档简介
第一章《原子结构与性质》测试题
一、单选题(共12题)
1.下列叙述正确的是
A.第一电离能:LiB.、、均为酸性氧化物
C.通过比较酸性,判断硫与碳的非金属性强弱
D.第三周期主族元素,离子半径随原子序数的增大而减小
2.下列关于元素及其化合物的说法正确的是
A.碱性: B.热稳定性:
C.原子半径r: D.原子的最外层电子数n:
3.高铁酸钾()是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为胶体,下列说法不正确的是
A.高铁酸钾中铁元素的化合价为+6价
B.Fe元素位于周期表ds区
C.高铁酸钾属于强电解质
D.用对饮用水处理时,能起到消毒杀菌和吸附杂质的双重作用
4.我国导航卫星的“心脏”使用的是铷原子钟和氢原子钟,下列关于铷的说法正确的是( )
A.Rb和Rb互为同素异形体 B.Rb和Rb具有相同的中子数
C.Rb原子的核外电子数是37 D.Rb的质子数是87
5.具有下列结构的原子一定属于碱金属元素的是()
A.最外层只有1个电子
B.最外层电子数为次外层电子数的一半
C.M层电子数为K层电子数的
D.K、L层电子数之和等于M、N层电子数之和
6.如图是部分短周期元素的主要化合价与原子序数的关系,下列说法正确的是
A.最高正化合价:X>Z>Y
B.Z和R形成的化合物是离子化合物
C.最高价氧化物对应水化物的碱性,Z>Y
D.Z的氧化物既可以和盐酸反应,也可以和NaOH溶液反应
7.下列是原子基态的最外层电子排布,其电负性最大的是
A.2s2 B.2s22p 1 C.3s23p4 D.2s22p5
8.为原子序数依次增大的短周期主族元素,的核外电子总数与其周期数相同,的价电子层中的未成对电子有3个,的最外层电子数为其内层电子数的3倍,与可形成原子个数比为2∶1的分子。下列说法错误的是
A.原子半径:
B.简单氢化物的还原性:
C.与可形成含有非极性键的化合物
D.同周期中第一电离能小于的元素有4种
9.下列说法正确的是
A.p能级能量一定比s能级的能量高
B.原子的核外电子仅从激发态跃迁到基态才产生原子光谱
C.2p、3p、4p能级的轨道数依次增多
D.2p和3p轨道的形状均为哑铃形
10.1817年,瑞典的贝采利乌斯从硫酸厂的铅室底部的红色粉状物质中制得硒。硒是氧族元素,下列关于硒的基态原子说法正确的有
①位于周期表p区;②电子占据17个原子轨道;③有34种不同运动状态的电子;④占据8个能级;⑤电子占据的最高能层符号是4p;⑥价电子为3d104s24p4
A.3项 B.4项 C.5项 D.6项
11.第N能层所含能级数、原子轨道数和最多容纳电子数分别为
A.3、32、2× 32 B.4、42、2× 32 C.5、42、5× 32 D.4、42、2× 42
12.下列说法正确的是
A.所有的非金属元素都分布在p区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中从第ⅢB到第ⅡB的10个纵列的元素都是金属元素
D.稀有气体在ds区
二、非选择题(共10题)
13.W、X、Y和Z都是元素周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物;
②Y 和Z属同族元素,他们能形成两种常见化合物;
③X和Z属同一周期元素,他们能形成两种气态化合物;
④W和Z能形成组成为W2Z和W2Z2的化合物;
⑤X和Y不在同一周期,他们能形成组成为XY2的化合物。请回答:
(1)Y元素名称是___________;
(2)用一方程式证明Y与X非金属性的强弱__________,证明Y与Z非金属性的强弱_____________。
(3)标准状况22.4LXZ2和通过足量的W2Z2时,转移的电子数是____,W2Z2的质量将增加______g
(4)观察W元素的焰色的操作注意事项__________________________
(5)上述某元素形成的分子式为C8H10的属于苯的同系物的同分异构体有______________ 种。其中,苯环上的一氯代物种类最多的结构简式为_______________。
14.洪特规则
(1)内容:基态原子中,填入_______的电子总是先单独分占,且自旋平行。
(2)特例:在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有_______的能量和_______的稳定性。
如:24Cr的电子排布式为_______,为半充满状态,易错写为1s22s22p63s23p63d44s2。
15.今年是诺贝尔奖颁发120周年,其中很多获得诺贝尔化学奖的研究成果都极大的影响着我们的生活。请回答与诺贝尔化学奖获奖成果相关的下列问题:
(1)1995年,诺贝尔化学奖授予Paul Crutzen、Mario Molina 和F.S Rowland 三位科学家,以表彰他们在平流层臭氧化学研究领域所做出的贡献。氟利昂(CCl2F2等)及氮的氧化物在O3分解中起重要作用,N、O、F的第一电离能由大到小的顺序为___________。
(2)2019年,诺贝尔化学奖授予John B Goodenough,M.stanley Whittlingham 和 Akira Yoshino,以表彰他们在锂离子电池的发展方面作出的卓越贡献。
①从原子结构理论角度解释,Fe3+比Fe2+稳定的原因为___________。
②早在1973年,Whittingham 发现一种极强富能材料TiS2,以此作为锂电池的全新阴极。Ti的基态原子核外电子排布式为___________。下列硫的各种微粒中,电离最外层一个电子所需能量最大的是___________。(填字母)。
A.[Ne]3s23p3 B.[Ne]3s23p4 C.[Ne]3s23p33d1 D.[Ne]3s23p5
16.磁铁矿的主要成分是Fe3O4。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。
(1)Fe2+的核外电子排布式为_______,具有_______种运动状态不同的电子。
(2)步骤一:取少量磁铁矿石样品,粉碎后加入过量的试剂A溶解,试剂A可选用_______(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(3)步骤二:验证:Fe3+。取溶解后的液体少许,加入少量_______,若观察到溶液变为血红色,则证明有Fe3+。
(4)步骤三:验证:Fe2+。取溶解后的液体少许,加入少量_______,若观察到_______,则证明有Fe2+。
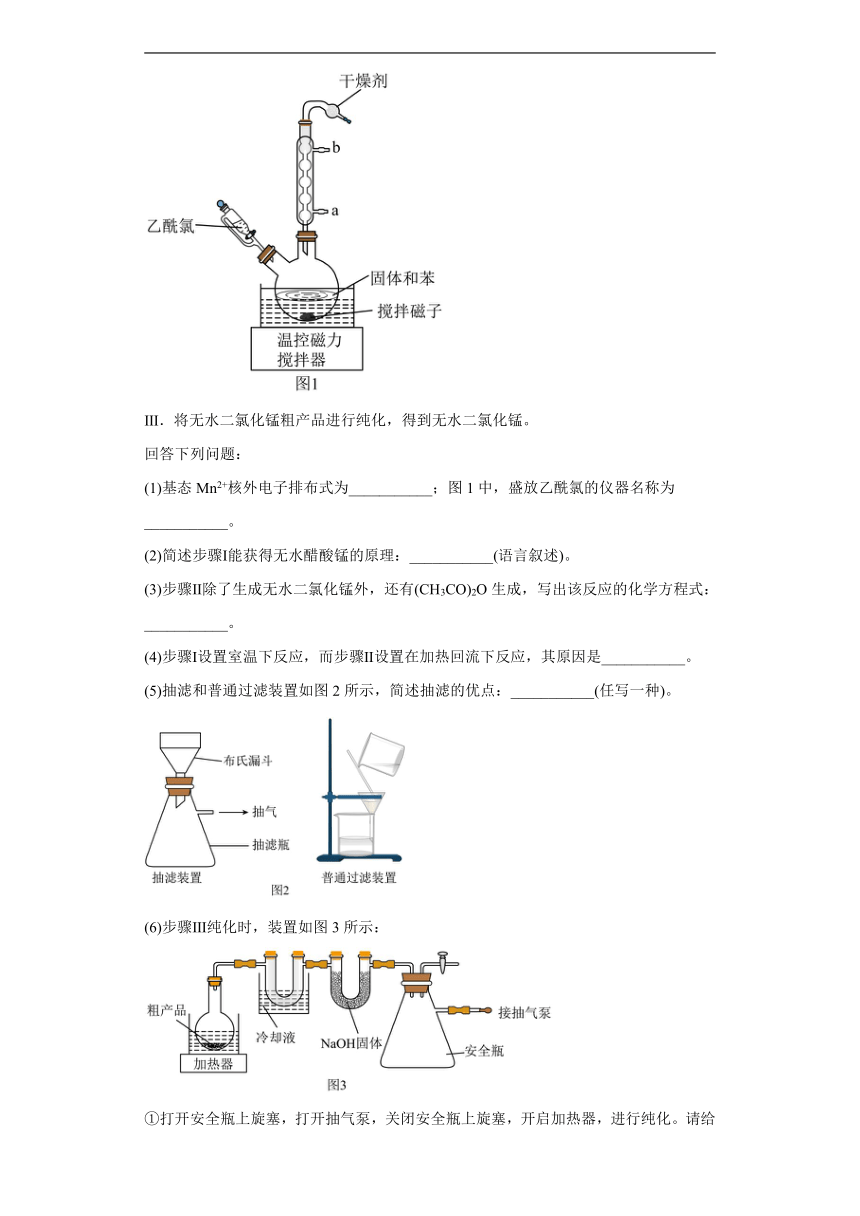
17.无水二氯化锰(MnCl2,极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯)常用于铝合金冶炼、有机氯化物触媒等,某兴趣小组用四水醋酸锰[(CH3COO)2Mn·4H2O]和乙酰氯(CH3COCl,沸点:51℃,与水反应生成CH3COOH和HCl为原料制备无水二氯化锰。实验步骤如下:
Ⅰ.将四水醋酸锰、乙酰氯和苯加入容器中,室温搅拌、静置一会,抽滤,得到无水醋酸锰;
Ⅱ.将无水醋酸锰、苯加入烧瓶中,滴加乙酰氯,加热回流,反应完全后,静置,抽滤、洗涤,得到无水二氯化锰粗产品。装置(夹持装置已省略)如图1所示;
Ⅲ.将无水二氯化锰粗产品进行纯化,得到无水二氯化锰。
回答下列问题:
(1)基态Mn2+核外电子排布式为___________;图1中,盛放乙酰氯的仪器名称为___________。
(2)简述步骤Ⅰ能获得无水醋酸锰的原理:___________(语言叙述)。
(3)步骤Ⅱ除了生成无水二氯化锰外,还有(CH3CO)2O生成,写出该反应的化学方程式:___________。
(4)步骤Ⅰ设置室温下反应,而步骤Ⅱ设置在加热回流下反应,其原因是___________。
(5)抽滤和普通过滤装置如图2所示,简述抽滤的优点:___________(任写一种)。
(6)步骤Ⅲ纯化时,装置如图3所示:
①打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给纯化完成后的操作排序:纯化完成→(___________ )→(___________ )→(___________)→(___________ ) →将产品转至干燥器中保存,_______
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图3装置中U形管内NaOH固体的作用是___________(写一条即可)。
(7)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通。过测定产品中氯元素的含量确定纯度。合理的是___________(填“甲”或“乙”)同学的方法。
18.Ⅰ.某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠、镁、铝、钾金属块,通过观察现象判断金属性的相对强弱。实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮他选出合适的方法_______(填字母)。
A.把烧杯中的冷水换成热水B.把烧杯中的冷水换成盐酸C.把烧杯中的冷水换成浓硝酸
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。(已知酸性强弱:亚硫酸>碳酸)
(2)实验步骤:连接仪器、_______、加药品后,打开a,然后滴入浓硫酸,加热。
(3)问题探究:
①装置E中酸性KMnO4溶液的作用是_______。
②试管F中发生反应的离子方程式为_______。
③能说明非金属性碳强于硅的实验现象是_______。
④依据试管D中的反应,能否证明非金属性硫强于碳?_______(填“能”或“否”)。
19.完成下列基本计算:
(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的摩尔质量为________,此质量的NOx在标准状况下的体积约为________;
(2)19.2g Cu与足量稀硝酸反应时,转移电子总数是_____NA(NA表示阿伏加德罗常数);
(3)元素M的某种原子,其氯化物(MCl2)11.1g配成溶液后,需用1mol/L的AgNO3溶液200mL才能把氯离子完全沉淀下来。已知该原子中:质子数=中子数。
① 该原子M的质量数A为_____________。
② 写出该原子(核素)符号___________。
③ M元素在周期表中的位置是_______________。
20.一定质量的某金属X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个 Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
21.已知一个12C原子的质量为1.993×10-23 g。填表:(保留三位小数)
35Cl 37Cl
原子质量(×10-23 g) 5.807 6.139
相对原子质量 ①________ ②________
原子百分率(丰度) 74.82% 25.18%
元素的相对原子质量 ③________
22.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18,请回答下列问题:
(1)X元素位于元素周期表中位置为_______。
(2)Z所在族的简单氢化物中,沸点最高的是_______(写化学式),原因为_______。
(3)W、Ⅹ、Z三种元素形成的一种具有杀菌消毒作用的化合物中化学键类型为_______;的电子式为_______。
(4)Y与Z形成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为_______。
参考答案:
1.B
A.同主族元素,越向下,第一电离能越小,A错误;
B.、、均能与碱反应生成盐和水、均属于酸性氧化物,B正确;
C.不是硫最高价氧化物对应的水化物,不能根据酸性强弱判断非金属性强弱,C错误;
D.第三周期的Na+、Mg2+、Al3+的离子核外电子层结构排布相同,P3-、S2-、Cl-的离子核外电子层结构排布结构相同,核电荷数越大,离子半径越小,且P3-、S2-、Cl-比Na+、Mg2+、Al3+离子核外多1个电子层,离子半径大,则第三周期主族元素的离子半径由大到小的关系是P3->S2->Cl->Na+>Mg2+>Al3+,D错误;
故选B。
2.A
A.元素金属性越强,其最高价氧化物对应水化物的碱性越强,金属性:Na> Mg,故碱性:,A正确;
B.元素非金属性越强,其简单氢化物越稳定,非金属性:Cl>Br,故热稳定性:,B错误;
C.通常电子层数越多,原子半径越大,同周期主族元素原子半径随原子序数的增大而减小,所以原子半径:,C错误;
D.原子最外电子数n的关系为:,故D错误;
故选A。
3.B
A.中钾、氧元素化合价分别为+1、-2,则铁元素的化合价为+6价,A正确;
B.Fe为26号元素,元素位于周期表d区,B错误;
C.强电解质是指在水溶液中或熔融状态下,能够完全电离的化合物,即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,一般是强酸、强碱和大部分盐类;高铁酸钾属于强电解质,C正确;
D.用对饮用水处理时,六价铁具有强氧化性转变为三价铁,能起到消毒杀菌;铁离子水解生成氢氧化铁胶体,具有吸附杂质的作用,D正确;
故选B。
4.C
A.Rb和Rb的质子数均为37,中子数分别为48、50,互为同位素,同素异形体指同种元素形成的不同单质,A项错误;
B.Rb和Rb的中子数分别为49、50,B项错误;
C.原子中:核外电子数=质子数,Rb原子的核外电子数是37,C项正确;
D.Rb的质子数是37,质量数是87,D项错误。
答案选C。
5.C
A.氢原子的最外层只有1个电子,但氢元素不是碱金属元素,故A错误;
B.硅原子最外层电子数为次外层电子数的一半,但硅元素不是碱金属元素,故B错误;
C.由M层电子数为K层电子数的可知,该原子为钠原子,钠元素是碱金属元素,故C正确;
D.由K、L层电子数之和等于M、N层电子数之和可知,该原子的M层有8个电子、N层有2个电子,为钙原子,钙元素不属于碱金属元素,故D错误;
故选C。
6.D
结合元素周期表分析,X为氧元素,Y为钠元素,Z为铝元素,W为硫元素,R为氯元素;
A.X为氧元素没有最高正价,A项错误;
B.Z和R形成的化合物为氯化铝,氯化铝是共价化合物,B项错误;
C.Z为铝元素,Y为钠元素,氢氧化钠的碱性强于氢氧化铝,即Y>Z,C项错误;
D.Z的氧化物是两性氧化物,既可以和盐酸反应,也可以和NaOH溶液反应,D项正确;
答案选D。
7.D
A.2s2为4号元素Be,其为金属元素;
B.2s22p1为5号元素B,其为非金属元素,但非金属性比较弱;
C.3s23p4为16号元素S,其为非金属元素,且非金属性比较强;
D.2s22p5为9号元素F,其为非金属元素,且非金属性最强;
依据元素在周期表中的位置判断,以上元素中,非金属性F>S>B>Be,因此电负性最大的是F元素,故选D。
8.D
的核外电子总数与其周期数相同,W为H;的价电子层中的未成对电子有3个,则X为N;的最外层电子数为其内层电子数的3倍,则Y为O;与可形成原子个数比为2∶1的分子,Z为S;据此分析。
A.一般电子层数越多半径越大,而同周期元素的原子随核电荷数增加半径减小,故原子半径:,故A正确;
B.非金属性越强其简单氢化物的还原性越弱,故简单氢化物的还原性:,故B正确;
C.与可形成H2O2,为含有非极性键的化合物,故C正确;
D.第二周期中电离能小于N元素的有Li、Be、B、C、O共5种元素,故D错误;
故选D。
9.D
A.p能级能量与s能级的能量比较还要考虑能层的影响,故A错误;
B.原子光谱有吸收光谱和发射光谱两种,故B错误;
C.2p、3p、4p能级的轨道数均为3,故C错误;
D.p轨道的形状为哑铃形,故D正确;
故选D。
10.A
①硒的外围电子排布式为4s24p4,位于周期表p区,故此项正确;
②硒的基态原子电子排布式为1s22s22p63s23p63d104s24p4,第一层占据1个s轨道,第二层占据1个s和3个p轨道,第三层占据1个s、3个p和5个d轨道,第四层占据1个s和3个p轨道,一共占据18个原子轨道,故此项错误;
③硒原子一共有34个电子,分别处于不同能层和不同能级,同一能级中自旋相反,所以一共有34种不同运动状态的电子,故此项正确;
④第一能层中有1s 1个能级,第二层中有2s和2p 2个能级,第三层中有3s、3p、3d 3个能级,第四层有4s、4p 2个能级,共占据8个能级,故此项正确;
⑤4p为能级符号,不是能层符号,故此项错误;
⑥主族元素的价电子为外围电子,应为4s24p4,故此项错误,故选A。
【点睛】核外电子排布遵循以下几点:1、能量最低原理;2、泡利不相容原理;3、洪特规则;其中根据构造原理,4s能级的能量低于3d能级,这是经常出现的考点。
11.D
第N能级为第4层,含有的轨道能级分别为s、p、 d、f的顺序依次为1、3, 5、7,共有16个轨道,每一个轨道可容纳2个电子,可以最多容纳32个电子;
故选D。
12.C
A.H是非金属元素,位于s区,A错误;
B.He的最外层电子数为2,在p区,B错误;
C.元素周期表中从第ⅢB到第ⅡB的10个纵列的元素为过渡金属,均属于金属元素,C正确;
D.稀有气体在p区,D错误;
故选C。
13. 硫 H2SO4+Na2CO3=Na2SO4+H2O+CO2↑ O2+2H2S=2H2O+2S NA 28 隔着蓝色钴玻璃观察 4
W、X、Y和Z都是周期表中前20号元素,②Y和Z属同主族元素,它们能形成两种常见化合物,化合物为SO2、SO3,则分别为O、S元素中的一种,结合③中X和Z属同周期元素,它们能形成两种气态化合物,可推知X为C元素,Z为O元素,Y为S元素,⑤X和Y不在同一周期,它们能形成组成CS2,由①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物,则W为K,化合物W2Y为K2S;④W和Z能形成组成为K2O和K2O2的化合物,据此解答。
(1)由上述分析可知,Y为硫元素,
故答案为硫;
(2)由上述分析可知,Y为硫元素,X为碳元素,Z为氧元素,元素的非金属性越强,最高价氧化物水化物的酸性越强,能证明硫酸的酸性强于碳酸,则证明硫的非金属性比碳强,化学方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;元素的非金属性越强氢化物还原性越强,能证明还原性H2S大于H2O,则证明氧的非金属性强于硫,化学方程式为:O2+2H2S=2H2O+ 2S,
故答案为H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;O2+2H2S=2H2O+ 2S;
(3)标准状况22.4LCO2为1mol,反应2CO2+2K2O2=2K2CO3+O2中,K2O2既作氧化剂又作还原剂,部分K2O2中氧元素从-1价升高到0价,每生成1molO2转移2mol电子,则有1mol CO2反应时生成0.5mol O2转移1mol电子,转移的电子数是NA;根据质量守恒定律,K2O2的质量增加等于气体质量的减小,44g-32g=28g,
故答案为NA ;28;
(4))由上述分析可知,W为钾元素,观察钾元素的焰色隔着蓝色钴玻璃观察,滤去钠元素的黄光,
故答案为隔着蓝色钴玻璃观察;
(5)C8H10的属于苯的同系物的同分异构体有乙苯、邻二甲苯、间二甲苯和对二甲苯共4种,苯环上的一氯代物分别有3种、2种、3种和1种,种类最多的是乙苯、间二甲苯,结构简式为、,
故答案为4;、。
14.(1)简并轨道
(2) 较低 较大 1s22s22p63s23p63d54s1
【解析】略
15. F>N>O Fe3+最外层电子排布为3d5,为半充满结构,因此更稳定 [Ar]3d24s2 A
(1)同一周期,从左到右,第一电离能逐渐增大,但N元素半充满结构,第一电离能大于O元素,N、O、F的第一电离能由大到小的顺序为F>N>O;
(2)①Fe3+最外层电子排布为3d5,为半充满结构,因此更稳定;
②Ti的基态原子核外电子排布式为[Ar]3d24s2;[Ne]3s23p3达到半充满稳定结构,因此电离最外层一个电子所需能量最大,答案选A。
16.(1) 1s22s22p63s23p63d6 24
(2)D
(3)KSCN溶液
(4) 酸性高锰酸钾溶液 酸性高锰酸钾褪色
证明磁铁矿石中存在+2、+3价的铁元素,将磁铁矿用酸溶解后,检验Fe2+和Fe3+即可证明,实验室用KSCN溶液检验Fe3+,Fe2+具有还原性,加入酸性高锰酸钾,若酸性高锰酸钾褪色,说明含有Fe2+。
(1)Fe为26号元素,其核外电子排布式为1s22s22p63s23p63d64s2,铁原子失去最外层4s能级2个电子,形成Fe2+,则Fe2+的核外电子排布式为1s22s22p63s23p63d6;核外有多少个电子,就有多少种运动状态不同的电子,Fe2+核外有24个电子,则有24种运动状态不同的电子,故答案为:1s22s22p63s23p63d6;24;
(2)氨水和氢氧化钠能与Fe2+、Fe3+反应生成沉淀,不能用于溶解磁铁矿石,检验Fe2+需加入高锰酸钾,若加入稀盐酸,Cl-也能被酸性高锰酸钾氧化,干扰Fe2+的检验,因此用硫酸溶解磁铁矿石,即试剂A为硫酸,故答案为:D;
(3)实验室通常用KSCN溶液检验Fe3+,KSCN溶液遇Fe3+变为血红色,因此取溶解后的液体少许,加入少量KSCN溶液,若观察到溶液变为血红色,则证明有Fe3+,故答案为:KSCN溶液;
(4)Fe2+具有还原性,能使酸性高锰酸钾褪色,因此取溶解后的液体少许,加入少量酸性高锰酸钾溶液,若观察到酸性高锰酸钾褪色,则证明有Fe2+,故答案为:酸性高锰酸钾溶液;酸性高锰酸钾褪色。
17.(1) 1s2 2s2 2p6 3s2 3p6 3d5或[Ar]3d5 恒压滴液漏斗
(2)乙酰氯与四水醋酸锰中的结晶水反应生成CH3COOH和HCl,从而获得无水醋酸锰(或其他合理叙述)
(3)(CH3COO)2 Mn+2CH3COC1MnCl2 +2(CH3CO)2O
(4)步骤Ⅰ常温下可防止生成MnCl2,步骤Ⅱ加热回流能促进反应生成MnCl2(或其他合理叙述)
(5)抽滤速度快、液体和固体分离比较完全、滤出的固体容易干燥等(写出一条即可)
(6) cdba 吸收产生的酸性气体或防止外部水气进入样品(写出一条即可)
(7)乙
本题是一道无机物制备类的实验题,由题给流程可知,四水醋酸锰和乙酰氯溶解在苯中搅拌抽滤得到醋酸锰固体,向加入醋酸锰固体中加入苯和乙酰氯回流搅拌,醋酸锰和乙酰氯反应得到氯化锰沉淀,抽滤、洗涤得到无水二氯化锰。
(1)锰为25号元素,则基态Mn2+核外电子排布式为1s2 2s2 2p6 3s2 3p6 3d5或[Ar]3d5;由图可知盛放乙酰氯的仪器名称为恒压滴液漏斗;
(2)根据题给信息可知,四水醋酸锰和乙酰氯反应生成CH3COOH和HCl为原料制备无水二氯化锰,故步骤Ⅰ能获得无水醋酸锰的原理为:乙酰氯与四水醋酸锰中的结晶水反应生成CH3COOH和HCl,从而获得无水醋酸锰(或其他合理叙述);
(3)步骤Ⅱ中无水醋酸锰和乙酰氯反应生成无水二氯化锰粗产品,相应的方程式为:(CH3COO)2 Mn+2CH3COC1MnCl2 +2(CH3CO)2O;
(4)根据题给信息可知,CH3COCl沸点较低,容易挥发,步骤I为了使反应更加充分,防止CH3COCl挥发,应该在低温下进行,而步骤Ⅱ有回流装置,可防止挥发,加热可以加快反应速率,故答案为:步骤Ⅰ常温下可防止生成MnCl2,步骤Ⅱ加热回流能促进反应生成MnCl2(或其他合理叙述);
(5)抽滤和普通过滤相比,最大的优点是,抽滤可以使过滤速度快、液体和固体分离比较完全、滤出的固体容易干燥等;
(6)①纯化完成后的操作和纯化的操作相反,纯化完成后首先关闭加热器,待烧瓶冷却至室温,然后打开安全瓶上旋塞,关闭抽气泵,最后拔出圆底烧瓶的瓶塞,将产品转至干燥器中保存,故答案为cdba;
②由于可能混有酸性气体且无水二氯化锰极易吸水潮解,因此NaOH固体的作用是吸收产生的酸性气体或防止外部水气进入样品(写出一条即可)。
(7)由于无水二氯化锰极易吸水潮解,且锰离子水解,所以应该通过测定产品中氯元素的含量确定纯度,所以合理的是乙同学的方法。
18.(1)AB
(2)检查装置气密性
(3) 除去过量的SO2 CO2+H2O+SiO=H2SiO3↓+CO(或2CO2+2H2O+SiO=H2SiO3↓+2HCO) E试管中的溶液褪色不完全,F试管中出现白色沉淀 否
II.铜与浓硫酸共热生成二氧化硫,二氧化硫与饱和碳酸氢钠溶液反应生成二氧化碳,酸性高锰酸钾溶液除去二氧化碳中过量的二氧化硫,二氧化碳与硅酸钠溶液反应生成硅酸。
(1)
A.镁和热水能缓慢反应,铝和热水不反应,把烧杯中的冷水换成热水,可判断Mg、Al的活泼性,故选A;
B.镁和同浓度的盐酸反应比铝剧烈,把烧杯中的冷水换成盐酸,可判断Mg、Al的活泼性,故选B;
C.把烧杯中的冷水换成浓硝酸,铝在浓硝酸中钝化,且镁和硝酸反应放出二氧化氮气体,污染空气,故不选C;
选AB。
(2)
本实验涉及气体反应,连接仪器后要检验装置气密性。
(3)
①二氧化硫能被酸性高锰酸钾溶液氧化,二氧化硫、二氧化碳都能与硅酸钠反应生成硅酸沉淀,装置E中酸性KMnO4溶液的作用是除去多余的二氧化硫,防止干扰。
②试管F中二氧化碳和硅酸钠反应生成硅酸沉淀和碳酸钠,发生反应的离子方程式为CO2+H2O+SiO=H2SiO3↓+CO(或2CO2+2H2O+SiO=H2SiO3↓+2HCO)。
③元素非金属性越强,最高价含氧酸酸性越强,CO2+H2O+SiO=H2SiO3↓+CO反应发生说明碳的非金属性强于硅,能说明非金属性碳强于硅的实验现象是E试管中的溶液褪色不完全,F试管中出现白色沉淀。
④二氧化硫和水反应生成亚硫酸,亚硫酸不是硫的最高价含氧酸,所以依据试管D中的反应,不能证明非金属性硫强于碳。
19.(1) 46g/mol 4.48L
(2)0.6
(3) 40 40Ca 第四周期第ⅡA族
(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的物质的量是0.2mol,所以摩尔质量为9.2g÷0.2mol=46g/mol;此质量的NOx在标准状况下的体积约为0.2mol×22.4L/mol=4.48L;
(2)19.2g Cu的物质的量是19.2g÷64g/mol=0.3mol,与足量稀硝酸反应时生成硝酸铜,铜元素化合价从0价升高到+2价,转移电子总数是0.6NA;
(3)由可知,n (Cl-)=n(Ag+)=0.2L×1mol/L=0.2mol,所以MCl2的物质的量是0.1mol,则M(MCl2)=11.1g÷0.1mol=111g/mol,由摩尔质量与相对分子质量的数值相等及质量数=质子数+中子数,则M=111-35.5×2=40,又因为质子数=中子数,所以Z=20,则M是Ca;
①该原子M的质量数A=40;②该原子(核素)符号为;③Ca元素在周期表中的位置是第四周期第ⅡA族。
20.(1)Z、n、A的值分别为13、3、27
(2)
(1)离子的物质的量为0.1mol,质子的物质的量为1.3mol,中子的物质的量为1.4mol,所以每个离子中的质子数为1.3/0.1=13,每个离子中的中子数为1.4/0.1=14,所以质子数Z为13,质量数A为13+14=27,离子的电荷数为0.3/0.1=3,所以n为3;
(2)该金属为铝,铝和氢氧化钠和水反应生成偏铝酸钠和氢气,。
21. 34.964 36.963 35.467
计算35Cl和37Cl两种原子的相对原子质量时,可利用相对原子质量的定义进行求解;计算元素的相对原子质量时,利用公式:“元素的相对原子质量=各种能稳定存在的核素的相对原子质量与其丰度的乘积之和”进行计算。
①M(35Cl)== 34.964;
②M(37Cl)== 36.963;
③M(Cl)= 34.964×74.82%+36.963×25.18%=35.467。
答案为:34.964;36.963;35.467。
22. 第三周期第IA族 HF HF分子之间形成了氢键,增加了分子之间的吸引作用,使HF的沸点最高 离子键、共价键 SiCl4+3H2O=H2SiO3↓+4HCl
W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne 原子的核外电子数相差1,且原子半径大于氧,则X为Na元素;由原子序数可知Y、Z均处于第三周期,所在的周期中Z元素的原子得电子能力最强,则Z为Cl元素,四种元素的最外层电子数之和为18,则Y原子最外层电子数为18-6-1-7=4,则Y为Si元素。
根据上述分析可知: W是O,X是Na,Y是Si,Z是Cl元素。
(1)X是Na元素,原子核外电子排布是2、8、1,根据原子结构与元素位置关系可知X位于元素周期表第三周期第IA族;
(2)Cl元素所在族的简单氢化物中,由于HF分子之间形成了氢键,增加了分子之间的吸引作用,使HF的沸点最高;
(3)W、X、Z三种元素形成的化合物为NaClO,物质中含有的化学键类型为离子键、共价键; X2W2是Na2O2,其电子式为:
(4)Y与Z形成的化合物为SiCl4,和足量水反应,生成一种弱酸和一种强酸,应生成硅酸与HCl,该反应的化学方程式是:SiCl4+3H2O=H2SiO3↓+4HCl
一、单选题(共12题)
1.下列叙述正确的是
A.第一电离能:Li
C.通过比较酸性,判断硫与碳的非金属性强弱
D.第三周期主族元素,离子半径随原子序数的增大而减小
2.下列关于元素及其化合物的说法正确的是
A.碱性: B.热稳定性:
C.原子半径r: D.原子的最外层电子数n:
3.高铁酸钾()是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为胶体,下列说法不正确的是
A.高铁酸钾中铁元素的化合价为+6价
B.Fe元素位于周期表ds区
C.高铁酸钾属于强电解质
D.用对饮用水处理时,能起到消毒杀菌和吸附杂质的双重作用
4.我国导航卫星的“心脏”使用的是铷原子钟和氢原子钟,下列关于铷的说法正确的是( )
A.Rb和Rb互为同素异形体 B.Rb和Rb具有相同的中子数
C.Rb原子的核外电子数是37 D.Rb的质子数是87
5.具有下列结构的原子一定属于碱金属元素的是()
A.最外层只有1个电子
B.最外层电子数为次外层电子数的一半
C.M层电子数为K层电子数的
D.K、L层电子数之和等于M、N层电子数之和
6.如图是部分短周期元素的主要化合价与原子序数的关系,下列说法正确的是
A.最高正化合价:X>Z>Y
B.Z和R形成的化合物是离子化合物
C.最高价氧化物对应水化物的碱性,Z>Y
D.Z的氧化物既可以和盐酸反应,也可以和NaOH溶液反应
7.下列是原子基态的最外层电子排布,其电负性最大的是
A.2s2 B.2s22p 1 C.3s23p4 D.2s22p5
8.为原子序数依次增大的短周期主族元素,的核外电子总数与其周期数相同,的价电子层中的未成对电子有3个,的最外层电子数为其内层电子数的3倍,与可形成原子个数比为2∶1的分子。下列说法错误的是
A.原子半径:
B.简单氢化物的还原性:
C.与可形成含有非极性键的化合物
D.同周期中第一电离能小于的元素有4种
9.下列说法正确的是
A.p能级能量一定比s能级的能量高
B.原子的核外电子仅从激发态跃迁到基态才产生原子光谱
C.2p、3p、4p能级的轨道数依次增多
D.2p和3p轨道的形状均为哑铃形
10.1817年,瑞典的贝采利乌斯从硫酸厂的铅室底部的红色粉状物质中制得硒。硒是氧族元素,下列关于硒的基态原子说法正确的有
①位于周期表p区;②电子占据17个原子轨道;③有34种不同运动状态的电子;④占据8个能级;⑤电子占据的最高能层符号是4p;⑥价电子为3d104s24p4
A.3项 B.4项 C.5项 D.6项
11.第N能层所含能级数、原子轨道数和最多容纳电子数分别为
A.3、32、2× 32 B.4、42、2× 32 C.5、42、5× 32 D.4、42、2× 42
12.下列说法正确的是
A.所有的非金属元素都分布在p区
B.最外层电子数为2的元素都分布在s区
C.元素周期表中从第ⅢB到第ⅡB的10个纵列的元素都是金属元素
D.稀有气体在ds区
二、非选择题(共10题)
13.W、X、Y和Z都是元素周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物;
②Y 和Z属同族元素,他们能形成两种常见化合物;
③X和Z属同一周期元素,他们能形成两种气态化合物;
④W和Z能形成组成为W2Z和W2Z2的化合物;
⑤X和Y不在同一周期,他们能形成组成为XY2的化合物。请回答:
(1)Y元素名称是___________;
(2)用一方程式证明Y与X非金属性的强弱__________,证明Y与Z非金属性的强弱_____________。
(3)标准状况22.4LXZ2和通过足量的W2Z2时,转移的电子数是____,W2Z2的质量将增加______g
(4)观察W元素的焰色的操作注意事项__________________________
(5)上述某元素形成的分子式为C8H10的属于苯的同系物的同分异构体有______________ 种。其中,苯环上的一氯代物种类最多的结构简式为_______________。
14.洪特规则
(1)内容:基态原子中,填入_______的电子总是先单独分占,且自旋平行。
(2)特例:在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有_______的能量和_______的稳定性。
如:24Cr的电子排布式为_______,为半充满状态,易错写为1s22s22p63s23p63d44s2。
15.今年是诺贝尔奖颁发120周年,其中很多获得诺贝尔化学奖的研究成果都极大的影响着我们的生活。请回答与诺贝尔化学奖获奖成果相关的下列问题:
(1)1995年,诺贝尔化学奖授予Paul Crutzen、Mario Molina 和F.S Rowland 三位科学家,以表彰他们在平流层臭氧化学研究领域所做出的贡献。氟利昂(CCl2F2等)及氮的氧化物在O3分解中起重要作用,N、O、F的第一电离能由大到小的顺序为___________。
(2)2019年,诺贝尔化学奖授予John B Goodenough,M.stanley Whittlingham 和 Akira Yoshino,以表彰他们在锂离子电池的发展方面作出的卓越贡献。
①从原子结构理论角度解释,Fe3+比Fe2+稳定的原因为___________。
②早在1973年,Whittingham 发现一种极强富能材料TiS2,以此作为锂电池的全新阴极。Ti的基态原子核外电子排布式为___________。下列硫的各种微粒中,电离最外层一个电子所需能量最大的是___________。(填字母)。
A.[Ne]3s23p3 B.[Ne]3s23p4 C.[Ne]3s23p33d1 D.[Ne]3s23p5
16.磁铁矿的主要成分是Fe3O4。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。
(1)Fe2+的核外电子排布式为_______,具有_______种运动状态不同的电子。
(2)步骤一:取少量磁铁矿石样品,粉碎后加入过量的试剂A溶解,试剂A可选用_______(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(3)步骤二:验证:Fe3+。取溶解后的液体少许,加入少量_______,若观察到溶液变为血红色,则证明有Fe3+。
(4)步骤三:验证:Fe2+。取溶解后的液体少许,加入少量_______,若观察到_______,则证明有Fe2+。
17.无水二氯化锰(MnCl2,极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯)常用于铝合金冶炼、有机氯化物触媒等,某兴趣小组用四水醋酸锰[(CH3COO)2Mn·4H2O]和乙酰氯(CH3COCl,沸点:51℃,与水反应生成CH3COOH和HCl为原料制备无水二氯化锰。实验步骤如下:
Ⅰ.将四水醋酸锰、乙酰氯和苯加入容器中,室温搅拌、静置一会,抽滤,得到无水醋酸锰;
Ⅱ.将无水醋酸锰、苯加入烧瓶中,滴加乙酰氯,加热回流,反应完全后,静置,抽滤、洗涤,得到无水二氯化锰粗产品。装置(夹持装置已省略)如图1所示;
Ⅲ.将无水二氯化锰粗产品进行纯化,得到无水二氯化锰。
回答下列问题:
(1)基态Mn2+核外电子排布式为___________;图1中,盛放乙酰氯的仪器名称为___________。
(2)简述步骤Ⅰ能获得无水醋酸锰的原理:___________(语言叙述)。
(3)步骤Ⅱ除了生成无水二氯化锰外,还有(CH3CO)2O生成,写出该反应的化学方程式:___________。
(4)步骤Ⅰ设置室温下反应,而步骤Ⅱ设置在加热回流下反应,其原因是___________。
(5)抽滤和普通过滤装置如图2所示,简述抽滤的优点:___________(任写一种)。
(6)步骤Ⅲ纯化时,装置如图3所示:
①打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给纯化完成后的操作排序:纯化完成→(___________ )→(___________ )→(___________)→(___________ ) →将产品转至干燥器中保存,_______
a.拔出圆底烧瓶的瓶塞
b.关闭抽气泵
c.关闭加热器,待烧瓶冷却至室温
d.打开安全瓶上旋塞
②图3装置中U形管内NaOH固体的作用是___________(写一条即可)。
(7)用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通。过测定产品中氯元素的含量确定纯度。合理的是___________(填“甲”或“乙”)同学的方法。
18.Ⅰ.某研究性学习小组设计了一组实验验证元素周期律。
(1)甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠、镁、铝、钾金属块,通过观察现象判断金属性的相对强弱。实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮他选出合适的方法_______(填字母)。
A.把烧杯中的冷水换成热水B.把烧杯中的冷水换成盐酸C.把烧杯中的冷水换成浓硝酸
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题。(已知酸性强弱:亚硫酸>碳酸)
(2)实验步骤:连接仪器、_______、加药品后,打开a,然后滴入浓硫酸,加热。
(3)问题探究:
①装置E中酸性KMnO4溶液的作用是_______。
②试管F中发生反应的离子方程式为_______。
③能说明非金属性碳强于硅的实验现象是_______。
④依据试管D中的反应,能否证明非金属性硫强于碳?_______(填“能”或“否”)。
19.完成下列基本计算:
(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的摩尔质量为________,此质量的NOx在标准状况下的体积约为________;
(2)19.2g Cu与足量稀硝酸反应时,转移电子总数是_____NA(NA表示阿伏加德罗常数);
(3)元素M的某种原子,其氯化物(MCl2)11.1g配成溶液后,需用1mol/L的AgNO3溶液200mL才能把氯离子完全沉淀下来。已知该原子中:质子数=中子数。
① 该原子M的质量数A为_____________。
② 写出该原子(核素)符号___________。
③ M元素在周期表中的位置是_______________。
20.一定质量的某金属X和足量的稀H2SO4反应共有0.3mol电子发生转移,生成6.02×1022个 Xn+ ,这些阳离子共有1.3×6.02×1023个质子、1.4×6.02×1023个中子。
(1)求Z、n和A的值。(写过程)
(2)写出该金属与NaOH溶液反应的化学方程式。
21.已知一个12C原子的质量为1.993×10-23 g。填表:(保留三位小数)
35Cl 37Cl
原子质量(×10-23 g) 5.807 6.139
相对原子质量 ①________ ②________
原子百分率(丰度) 74.82% 25.18%
元素的相对原子质量 ③________
22.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和的核外电子数相差1;在Z所在的周期中,Z元素的原子得电子能力最强;四种元素的最外层电子数之和为18,请回答下列问题:
(1)X元素位于元素周期表中位置为_______。
(2)Z所在族的简单氢化物中,沸点最高的是_______(写化学式),原因为_______。
(3)W、Ⅹ、Z三种元素形成的一种具有杀菌消毒作用的化合物中化学键类型为_______;的电子式为_______。
(4)Y与Z形成的化合物在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为_______。
参考答案:
1.B
A.同主族元素,越向下,第一电离能越小,A错误;
B.、、均能与碱反应生成盐和水、均属于酸性氧化物,B正确;
C.不是硫最高价氧化物对应的水化物,不能根据酸性强弱判断非金属性强弱,C错误;
D.第三周期的Na+、Mg2+、Al3+的离子核外电子层结构排布相同,P3-、S2-、Cl-的离子核外电子层结构排布结构相同,核电荷数越大,离子半径越小,且P3-、S2-、Cl-比Na+、Mg2+、Al3+离子核外多1个电子层,离子半径大,则第三周期主族元素的离子半径由大到小的关系是P3->S2->Cl->Na+>Mg2+>Al3+,D错误;
故选B。
2.A
A.元素金属性越强,其最高价氧化物对应水化物的碱性越强,金属性:Na> Mg,故碱性:,A正确;
B.元素非金属性越强,其简单氢化物越稳定,非金属性:Cl>Br,故热稳定性:,B错误;
C.通常电子层数越多,原子半径越大,同周期主族元素原子半径随原子序数的增大而减小,所以原子半径:,C错误;
D.原子最外电子数n的关系为:,故D错误;
故选A。
3.B
A.中钾、氧元素化合价分别为+1、-2,则铁元素的化合价为+6价,A正确;
B.Fe为26号元素,元素位于周期表d区,B错误;
C.强电解质是指在水溶液中或熔融状态下,能够完全电离的化合物,即溶于水的部分或者熔融状态时,可以完全变成阴阳离子的化合物,一般是强酸、强碱和大部分盐类;高铁酸钾属于强电解质,C正确;
D.用对饮用水处理时,六价铁具有强氧化性转变为三价铁,能起到消毒杀菌;铁离子水解生成氢氧化铁胶体,具有吸附杂质的作用,D正确;
故选B。
4.C
A.Rb和Rb的质子数均为37,中子数分别为48、50,互为同位素,同素异形体指同种元素形成的不同单质,A项错误;
B.Rb和Rb的中子数分别为49、50,B项错误;
C.原子中:核外电子数=质子数,Rb原子的核外电子数是37,C项正确;
D.Rb的质子数是37,质量数是87,D项错误。
答案选C。
5.C
A.氢原子的最外层只有1个电子,但氢元素不是碱金属元素,故A错误;
B.硅原子最外层电子数为次外层电子数的一半,但硅元素不是碱金属元素,故B错误;
C.由M层电子数为K层电子数的可知,该原子为钠原子,钠元素是碱金属元素,故C正确;
D.由K、L层电子数之和等于M、N层电子数之和可知,该原子的M层有8个电子、N层有2个电子,为钙原子,钙元素不属于碱金属元素,故D错误;
故选C。
6.D
结合元素周期表分析,X为氧元素,Y为钠元素,Z为铝元素,W为硫元素,R为氯元素;
A.X为氧元素没有最高正价,A项错误;
B.Z和R形成的化合物为氯化铝,氯化铝是共价化合物,B项错误;
C.Z为铝元素,Y为钠元素,氢氧化钠的碱性强于氢氧化铝,即Y>Z,C项错误;
D.Z的氧化物是两性氧化物,既可以和盐酸反应,也可以和NaOH溶液反应,D项正确;
答案选D。
7.D
A.2s2为4号元素Be,其为金属元素;
B.2s22p1为5号元素B,其为非金属元素,但非金属性比较弱;
C.3s23p4为16号元素S,其为非金属元素,且非金属性比较强;
D.2s22p5为9号元素F,其为非金属元素,且非金属性最强;
依据元素在周期表中的位置判断,以上元素中,非金属性F>S>B>Be,因此电负性最大的是F元素,故选D。
8.D
的核外电子总数与其周期数相同,W为H;的价电子层中的未成对电子有3个,则X为N;的最外层电子数为其内层电子数的3倍,则Y为O;与可形成原子个数比为2∶1的分子,Z为S;据此分析。
A.一般电子层数越多半径越大,而同周期元素的原子随核电荷数增加半径减小,故原子半径:,故A正确;
B.非金属性越强其简单氢化物的还原性越弱,故简单氢化物的还原性:,故B正确;
C.与可形成H2O2,为含有非极性键的化合物,故C正确;
D.第二周期中电离能小于N元素的有Li、Be、B、C、O共5种元素,故D错误;
故选D。
9.D
A.p能级能量与s能级的能量比较还要考虑能层的影响,故A错误;
B.原子光谱有吸收光谱和发射光谱两种,故B错误;
C.2p、3p、4p能级的轨道数均为3,故C错误;
D.p轨道的形状为哑铃形,故D正确;
故选D。
10.A
①硒的外围电子排布式为4s24p4,位于周期表p区,故此项正确;
②硒的基态原子电子排布式为1s22s22p63s23p63d104s24p4,第一层占据1个s轨道,第二层占据1个s和3个p轨道,第三层占据1个s、3个p和5个d轨道,第四层占据1个s和3个p轨道,一共占据18个原子轨道,故此项错误;
③硒原子一共有34个电子,分别处于不同能层和不同能级,同一能级中自旋相反,所以一共有34种不同运动状态的电子,故此项正确;
④第一能层中有1s 1个能级,第二层中有2s和2p 2个能级,第三层中有3s、3p、3d 3个能级,第四层有4s、4p 2个能级,共占据8个能级,故此项正确;
⑤4p为能级符号,不是能层符号,故此项错误;
⑥主族元素的价电子为外围电子,应为4s24p4,故此项错误,故选A。
【点睛】核外电子排布遵循以下几点:1、能量最低原理;2、泡利不相容原理;3、洪特规则;其中根据构造原理,4s能级的能量低于3d能级,这是经常出现的考点。
11.D
第N能级为第4层,含有的轨道能级分别为s、p、 d、f的顺序依次为1、3, 5、7,共有16个轨道,每一个轨道可容纳2个电子,可以最多容纳32个电子;
故选D。
12.C
A.H是非金属元素,位于s区,A错误;
B.He的最外层电子数为2,在p区,B错误;
C.元素周期表中从第ⅢB到第ⅡB的10个纵列的元素为过渡金属,均属于金属元素,C正确;
D.稀有气体在p区,D错误;
故选C。
13. 硫 H2SO4+Na2CO3=Na2SO4+H2O+CO2↑ O2+2H2S=2H2O+2S NA 28 隔着蓝色钴玻璃观察 4
W、X、Y和Z都是周期表中前20号元素,②Y和Z属同主族元素,它们能形成两种常见化合物,化合物为SO2、SO3,则分别为O、S元素中的一种,结合③中X和Z属同周期元素,它们能形成两种气态化合物,可推知X为C元素,Z为O元素,Y为S元素,⑤X和Y不在同一周期,它们能形成组成CS2,由①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物,则W为K,化合物W2Y为K2S;④W和Z能形成组成为K2O和K2O2的化合物,据此解答。
(1)由上述分析可知,Y为硫元素,
故答案为硫;
(2)由上述分析可知,Y为硫元素,X为碳元素,Z为氧元素,元素的非金属性越强,最高价氧化物水化物的酸性越强,能证明硫酸的酸性强于碳酸,则证明硫的非金属性比碳强,化学方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;元素的非金属性越强氢化物还原性越强,能证明还原性H2S大于H2O,则证明氧的非金属性强于硫,化学方程式为:O2+2H2S=2H2O+ 2S,
故答案为H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;O2+2H2S=2H2O+ 2S;
(3)标准状况22.4LCO2为1mol,反应2CO2+2K2O2=2K2CO3+O2中,K2O2既作氧化剂又作还原剂,部分K2O2中氧元素从-1价升高到0价,每生成1molO2转移2mol电子,则有1mol CO2反应时生成0.5mol O2转移1mol电子,转移的电子数是NA;根据质量守恒定律,K2O2的质量增加等于气体质量的减小,44g-32g=28g,
故答案为NA ;28;
(4))由上述分析可知,W为钾元素,观察钾元素的焰色隔着蓝色钴玻璃观察,滤去钠元素的黄光,
故答案为隔着蓝色钴玻璃观察;
(5)C8H10的属于苯的同系物的同分异构体有乙苯、邻二甲苯、间二甲苯和对二甲苯共4种,苯环上的一氯代物分别有3种、2种、3种和1种,种类最多的是乙苯、间二甲苯,结构简式为、,
故答案为4;、。
14.(1)简并轨道
(2) 较低 较大 1s22s22p63s23p63d54s1
【解析】略
15. F>N>O Fe3+最外层电子排布为3d5,为半充满结构,因此更稳定 [Ar]3d24s2 A
(1)同一周期,从左到右,第一电离能逐渐增大,但N元素半充满结构,第一电离能大于O元素,N、O、F的第一电离能由大到小的顺序为F>N>O;
(2)①Fe3+最外层电子排布为3d5,为半充满结构,因此更稳定;
②Ti的基态原子核外电子排布式为[Ar]3d24s2;[Ne]3s23p3达到半充满稳定结构,因此电离最外层一个电子所需能量最大,答案选A。
16.(1) 1s22s22p63s23p63d6 24
(2)D
(3)KSCN溶液
(4) 酸性高锰酸钾溶液 酸性高锰酸钾褪色
证明磁铁矿石中存在+2、+3价的铁元素,将磁铁矿用酸溶解后,检验Fe2+和Fe3+即可证明,实验室用KSCN溶液检验Fe3+,Fe2+具有还原性,加入酸性高锰酸钾,若酸性高锰酸钾褪色,说明含有Fe2+。
(1)Fe为26号元素,其核外电子排布式为1s22s22p63s23p63d64s2,铁原子失去最外层4s能级2个电子,形成Fe2+,则Fe2+的核外电子排布式为1s22s22p63s23p63d6;核外有多少个电子,就有多少种运动状态不同的电子,Fe2+核外有24个电子,则有24种运动状态不同的电子,故答案为:1s22s22p63s23p63d6;24;
(2)氨水和氢氧化钠能与Fe2+、Fe3+反应生成沉淀,不能用于溶解磁铁矿石,检验Fe2+需加入高锰酸钾,若加入稀盐酸,Cl-也能被酸性高锰酸钾氧化,干扰Fe2+的检验,因此用硫酸溶解磁铁矿石,即试剂A为硫酸,故答案为:D;
(3)实验室通常用KSCN溶液检验Fe3+,KSCN溶液遇Fe3+变为血红色,因此取溶解后的液体少许,加入少量KSCN溶液,若观察到溶液变为血红色,则证明有Fe3+,故答案为:KSCN溶液;
(4)Fe2+具有还原性,能使酸性高锰酸钾褪色,因此取溶解后的液体少许,加入少量酸性高锰酸钾溶液,若观察到酸性高锰酸钾褪色,则证明有Fe2+,故答案为:酸性高锰酸钾溶液;酸性高锰酸钾褪色。
17.(1) 1s2 2s2 2p6 3s2 3p6 3d5或[Ar]3d5 恒压滴液漏斗
(2)乙酰氯与四水醋酸锰中的结晶水反应生成CH3COOH和HCl,从而获得无水醋酸锰(或其他合理叙述)
(3)(CH3COO)2 Mn+2CH3COC1MnCl2 +2(CH3CO)2O
(4)步骤Ⅰ常温下可防止生成MnCl2,步骤Ⅱ加热回流能促进反应生成MnCl2(或其他合理叙述)
(5)抽滤速度快、液体和固体分离比较完全、滤出的固体容易干燥等(写出一条即可)
(6) cdba 吸收产生的酸性气体或防止外部水气进入样品(写出一条即可)
(7)乙
本题是一道无机物制备类的实验题,由题给流程可知,四水醋酸锰和乙酰氯溶解在苯中搅拌抽滤得到醋酸锰固体,向加入醋酸锰固体中加入苯和乙酰氯回流搅拌,醋酸锰和乙酰氯反应得到氯化锰沉淀,抽滤、洗涤得到无水二氯化锰。
(1)锰为25号元素,则基态Mn2+核外电子排布式为1s2 2s2 2p6 3s2 3p6 3d5或[Ar]3d5;由图可知盛放乙酰氯的仪器名称为恒压滴液漏斗;
(2)根据题给信息可知,四水醋酸锰和乙酰氯反应生成CH3COOH和HCl为原料制备无水二氯化锰,故步骤Ⅰ能获得无水醋酸锰的原理为:乙酰氯与四水醋酸锰中的结晶水反应生成CH3COOH和HCl,从而获得无水醋酸锰(或其他合理叙述);
(3)步骤Ⅱ中无水醋酸锰和乙酰氯反应生成无水二氯化锰粗产品,相应的方程式为:(CH3COO)2 Mn+2CH3COC1MnCl2 +2(CH3CO)2O;
(4)根据题给信息可知,CH3COCl沸点较低,容易挥发,步骤I为了使反应更加充分,防止CH3COCl挥发,应该在低温下进行,而步骤Ⅱ有回流装置,可防止挥发,加热可以加快反应速率,故答案为:步骤Ⅰ常温下可防止生成MnCl2,步骤Ⅱ加热回流能促进反应生成MnCl2(或其他合理叙述);
(5)抽滤和普通过滤相比,最大的优点是,抽滤可以使过滤速度快、液体和固体分离比较完全、滤出的固体容易干燥等;
(6)①纯化完成后的操作和纯化的操作相反,纯化完成后首先关闭加热器,待烧瓶冷却至室温,然后打开安全瓶上旋塞,关闭抽气泵,最后拔出圆底烧瓶的瓶塞,将产品转至干燥器中保存,故答案为cdba;
②由于可能混有酸性气体且无水二氯化锰极易吸水潮解,因此NaOH固体的作用是吸收产生的酸性气体或防止外部水气进入样品(写出一条即可)。
(7)由于无水二氯化锰极易吸水潮解,且锰离子水解,所以应该通过测定产品中氯元素的含量确定纯度,所以合理的是乙同学的方法。
18.(1)AB
(2)检查装置气密性
(3) 除去过量的SO2 CO2+H2O+SiO=H2SiO3↓+CO(或2CO2+2H2O+SiO=H2SiO3↓+2HCO) E试管中的溶液褪色不完全,F试管中出现白色沉淀 否
II.铜与浓硫酸共热生成二氧化硫,二氧化硫与饱和碳酸氢钠溶液反应生成二氧化碳,酸性高锰酸钾溶液除去二氧化碳中过量的二氧化硫,二氧化碳与硅酸钠溶液反应生成硅酸。
(1)
A.镁和热水能缓慢反应,铝和热水不反应,把烧杯中的冷水换成热水,可判断Mg、Al的活泼性,故选A;
B.镁和同浓度的盐酸反应比铝剧烈,把烧杯中的冷水换成盐酸,可判断Mg、Al的活泼性,故选B;
C.把烧杯中的冷水换成浓硝酸,铝在浓硝酸中钝化,且镁和硝酸反应放出二氧化氮气体,污染空气,故不选C;
选AB。
(2)
本实验涉及气体反应,连接仪器后要检验装置气密性。
(3)
①二氧化硫能被酸性高锰酸钾溶液氧化,二氧化硫、二氧化碳都能与硅酸钠反应生成硅酸沉淀,装置E中酸性KMnO4溶液的作用是除去多余的二氧化硫,防止干扰。
②试管F中二氧化碳和硅酸钠反应生成硅酸沉淀和碳酸钠,发生反应的离子方程式为CO2+H2O+SiO=H2SiO3↓+CO(或2CO2+2H2O+SiO=H2SiO3↓+2HCO)。
③元素非金属性越强,最高价含氧酸酸性越强,CO2+H2O+SiO=H2SiO3↓+CO反应发生说明碳的非金属性强于硅,能说明非金属性碳强于硅的实验现象是E试管中的溶液褪色不完全,F试管中出现白色沉淀。
④二氧化硫和水反应生成亚硫酸,亚硫酸不是硫的最高价含氧酸,所以依据试管D中的反应,不能证明非金属性硫强于碳。
19.(1) 46g/mol 4.48L
(2)0.6
(3) 40 40Ca 第四周期第ⅡA族
(1)9.2g氮的氧化物NOx中氮原子的物质的量为0.2mol,则NOx的物质的量是0.2mol,所以摩尔质量为9.2g÷0.2mol=46g/mol;此质量的NOx在标准状况下的体积约为0.2mol×22.4L/mol=4.48L;
(2)19.2g Cu的物质的量是19.2g÷64g/mol=0.3mol,与足量稀硝酸反应时生成硝酸铜,铜元素化合价从0价升高到+2价,转移电子总数是0.6NA;
(3)由可知,n (Cl-)=n(Ag+)=0.2L×1mol/L=0.2mol,所以MCl2的物质的量是0.1mol,则M(MCl2)=11.1g÷0.1mol=111g/mol,由摩尔质量与相对分子质量的数值相等及质量数=质子数+中子数,则M=111-35.5×2=40,又因为质子数=中子数,所以Z=20,则M是Ca;
①该原子M的质量数A=40;②该原子(核素)符号为;③Ca元素在周期表中的位置是第四周期第ⅡA族。
20.(1)Z、n、A的值分别为13、3、27
(2)
(1)离子的物质的量为0.1mol,质子的物质的量为1.3mol,中子的物质的量为1.4mol,所以每个离子中的质子数为1.3/0.1=13,每个离子中的中子数为1.4/0.1=14,所以质子数Z为13,质量数A为13+14=27,离子的电荷数为0.3/0.1=3,所以n为3;
(2)该金属为铝,铝和氢氧化钠和水反应生成偏铝酸钠和氢气,。
21. 34.964 36.963 35.467
计算35Cl和37Cl两种原子的相对原子质量时,可利用相对原子质量的定义进行求解;计算元素的相对原子质量时,利用公式:“元素的相对原子质量=各种能稳定存在的核素的相对原子质量与其丰度的乘积之和”进行计算。
①M(35Cl)== 34.964;
②M(37Cl)== 36.963;
③M(Cl)= 34.964×74.82%+36.963×25.18%=35.467。
答案为:34.964;36.963;35.467。
22. 第三周期第IA族 HF HF分子之间形成了氢键,增加了分子之间的吸引作用,使HF的沸点最高 离子键、共价键 SiCl4+3H2O=H2SiO3↓+4HCl
W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne 原子的核外电子数相差1,且原子半径大于氧,则X为Na元素;由原子序数可知Y、Z均处于第三周期,所在的周期中Z元素的原子得电子能力最强,则Z为Cl元素,四种元素的最外层电子数之和为18,则Y原子最外层电子数为18-6-1-7=4,则Y为Si元素。
根据上述分析可知: W是O,X是Na,Y是Si,Z是Cl元素。
(1)X是Na元素,原子核外电子排布是2、8、1,根据原子结构与元素位置关系可知X位于元素周期表第三周期第IA族;
(2)Cl元素所在族的简单氢化物中,由于HF分子之间形成了氢键,增加了分子之间的吸引作用,使HF的沸点最高;
(3)W、X、Z三种元素形成的化合物为NaClO,物质中含有的化学键类型为离子键、共价键; X2W2是Na2O2,其电子式为:
(4)Y与Z形成的化合物为SiCl4,和足量水反应,生成一种弱酸和一种强酸,应生成硅酸与HCl,该反应的化学方程式是:SiCl4+3H2O=H2SiO3↓+4HCl
