专题4第一单元分子的空间结构同步练习 (含解析)2022——2023学年高中化学苏教版(2019)选择性必修2
文档属性
| 名称 | 专题4第一单元分子的空间结构同步练习 (含解析)2022——2023学年高中化学苏教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 372.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 18:23:52 | ||
图片预览



文档简介
专题4第一单元分子的空间结构同步练习
一、单选题
1. 甲醛分子式为,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质。下列关于其结构及性质的分析正确的是( )
A. 原子采取杂化,原子采取杂化
B. 甲醛分子中心原子价层电子对数为,含有一对孤电子对,是三角锥形结构
C. 一个甲醛分子中含有个键和个键
D. 甲醛分子为非极性分子
2. 下列叙述正确的是
A. 该配合物中配体是,配位数是。
B. 离子的空间构型为形,中心原子的杂化形式为
C. 、等与互为等电子体,则和的结构式分别为、
D. 分子的中心原子的价层电子对数为,该分子的模型是正四面体形
3. 下列对一些事实的理论解释正确的是
选项 实验事实 理论解释
A. 原子的第一电离能大于原子 原子能级半充满
B. 为直线形分子 分子中之间的夹角
C. 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D. 碘单质在中溶解度很大 和都是极性分子
A. B. C. D.
4. 下列说法正确的是( )
A. 次氯酸分子的结构式为,其分子为直线形的极性分子
B. 乳酸 分子中含有一个手性碳原子
C. 和分子中心原子分别为和杂化,空间构型分别为形、平面三角形
D. 配位键常用表示,其中原子可以提供接受孤电子对的空轨道
5. 下列说法不正确的是( )
A. 和都有手性碳原子
B. 与中心原子的价层电子对数相同
C. 中硼原子的杂化类型与苯中碳原子的杂化类型相同
D. 和是等电子体,但两者具有不同的化学性质
6. 下列说法不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶规律解释
B. 乳酸分子中含有一个手性碳原子
C. 的立体构型为三角锥型,中心原子的杂化方式为
D. 酸性:磷酸次氯酸
7. 下列关于粒子结构的描述不正确的是( )
A. 根据等电子原理判断,分子中所有原子在同一平面上
B. 和均是含一个极性键的 电子粒子
C. 和 均是四面体构型的非极性分子
D. 和杂化轨道类型均为 杂化,立体构型分别为形、平面三角形
8. 下列描述中不正确的是( )
A. 为直线形的非极性分子 B. 的立体构型为平面三角形
C. 中有对完全相同的成键电子对 D. 和的中心原子均为杂化
9. 下列说法正确的是( )
A. 中其碳原子的杂化类型有 和,其中有个键,个键
B. 分子的模型是直线形
C. 和互为等电子体,故性质相似
D. 的空间构型为三角锥形
10. 下列说法中正确的是( )
A. 和都是正四面体形分子,且键角都为
B. 乙烯分子中,碳原子的杂化轨道形成键,未杂化的轨道形成键
C. 键长,因此稳定性
D. 分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用弱
11. 为践行社会主义核心价值观,创建和谐社会,实现碳达峰和碳中和,我国科学家独创了一种二氧化碳转化新路径:通过电催化与生物合成相结合,以二氧化碳和水为原料成功合成了葡萄糖和脂肪酸,为人工和半人工合成“粮食”提供了新路径。关于上述物质,下列说法正确的是
A. 和均为极性分子,故C易溶于水
B. 晶体属于分子晶体,晶体中一个分子周围紧邻的分子有个
C. 分子中原子上有对孤电子对,故H分子的模型为形
D. 葡萄糖为分子晶体,脂肪酸为离子晶体
12. 关于、和的结构与性质,下列说法不正确的是
A. 空间结构为平面形 B. 为极性分子
C. 的沸点高于 D. 中、杂化方式均相同
13. 通常状况下,是一种油状液体,下列对的有关叙述正确的是 ( )
A. 中键键长比中键键长短
B. 分子中的原子无孤电子对
C. 分子的空间构型为三角锥型
D. 稳定性弱于,因为的键能比的键能大
14. 我国科学家最近成功合成了世界上首个五氮阴离子盐用代表。经射线衍射测得化合物的晶体结构,其局都结构如下图所示,从结构角度分析中两种阳离子的不同之处是( )
A. 中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C. 空间结构 D. 共价键类型
15. 下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
下列说法正确的是
A. 沸点:
B. 分子是非极性分子
C. 形成的单质中键与键个数之比为
D. ,,形成的简单氢化物在常温常压下均为气体
二、实验题
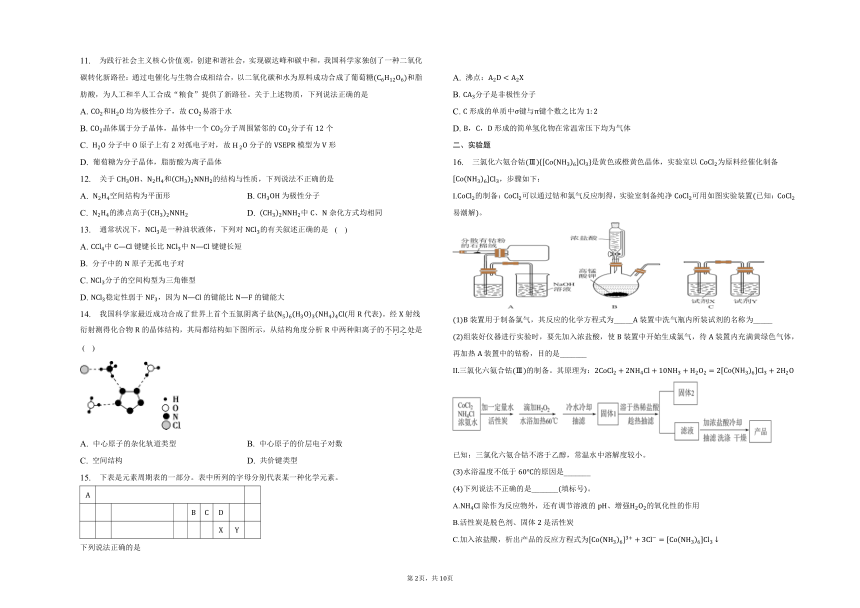
16. 三氯化六氨合钴Ⅲ是黄色或橙黄色晶体,实验室以为原料经催化制备,步骤如下:
I.的制备:可以通过钴和氯气反应制得,实验室制备纯净可用如图实验装置已知:易潮解。
装置用于制备氯气,其反应的化学方程式为_____装置中洗气瓶内所装试剂的名称为_____
组装好仪器进行实验时,要先加入浓盐酸,使装置中开始生成氯气,待装置内充满黄绿色气体,再加热装置中的钴粉,目的是_______
三氯化六氨合钴Ⅲ的制备。其原理为:
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
水浴温度不低于的原因是_______
下列说法不正确的是_______填标号。
A.除作为反应物外,还有调节溶液的、增强的氧化性的作用
B.活性炭是脱色剂、固体是活性炭
C.加入浓盐酸,析出产品的反应方程式为
D.可用乙醇水溶液洗涤产品
晶体结构测定与钴含量分析。
测定晶体结构最科学的方法是_______,从而获取晶胞形状和大小、分子或原子在微观空间的有序排列。中心离子的价层电子对为,其空间结构为_______
利用将氧化成,被还原后的产物为。然后用标准溶液滴定生成的,所得产物为。若称取样品的质量为,滴定时,达到终点消耗标准溶液的平均体积为。该样品中钴元素的质量分数为_______。
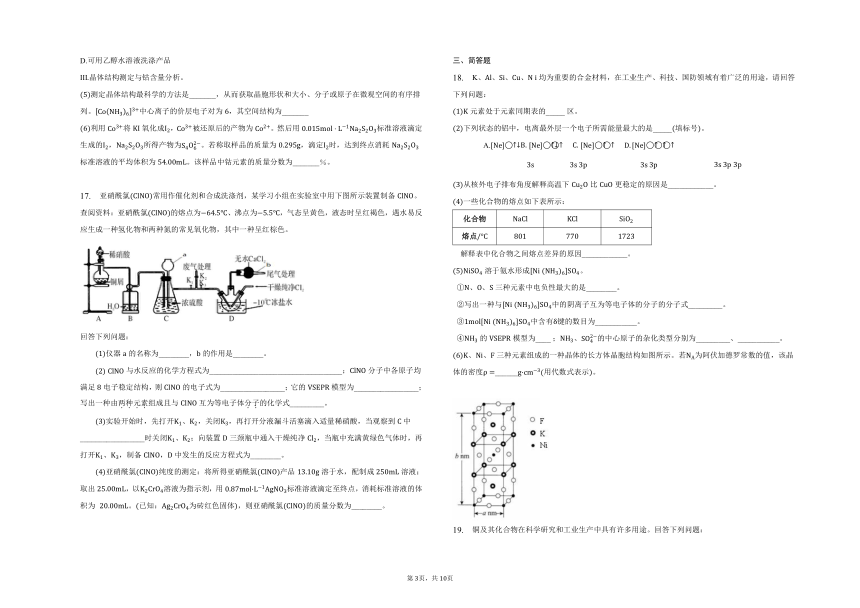
17. 亚硝酰氯常用作催化剂和合成洗涤剂,某学习小组在实验室中用下图所示装置制备。查阅资料:亚硝酰氯的熔点为、沸点为,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
回答下列问题:
仪器的名称为________,的作用是________。
与水反应的化学方程式为___________________________________;分子中各原子均满足电子稳定结构,则的电子式为_________________;它的模型为_________________;写出一种由两种元素组成且与互为等电子体分子的化学式_________。
实验开始时,先打开、,关闭,再打开分液漏斗活塞滴入适量稀硝酸,当观察到中_________________时关闭、;向装置三颈瓶中通入干燥纯净,当瓶中充满黄绿色气体时,再打开、,制备,中发生的反应方程式为________。
亚硝酰氯纯度的测定:将所得亚硝酰氯产品溶于水,配制成溶液;取出,以溶液为指示剂,用标准溶液滴定至终点,消耗标准溶液的体积为 。已知:为砖红色固体,则亚硝酰氯的质量分数为________。
三、简答题
18. K、、、、 均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
元素处于元素同期表的_____ 区。
下列状态的铝中,电离最外层一个电子所需能量最大的是_____填标号。
A.
从核外电子排布角度解释高温下比更稳定的原因是____________。
一些化合物的熔点如下表所示:
化合物
熔点
解释表中化合物之间熔点差异的原因____________。
溶于氨水形成 。
、、三种元素中电负性最大的是________。
写出一种与 中的阴离子互为等电子体的分子的分子式_________。
中含有键的数目为___________。
的模型为____ ;、的中心原子的杂化类型分别为_________、___________。
、、三种元素组成的一种晶体的长方体晶胞结构如图所示。若为阿伏加德罗常数的值,该晶体的密度______用代数式表示。
19. 铜及其化合物在科学研究和工业生产中具有许多用途。回答下列问题:
中阳离子的基态核外电子排布式为________;和在元素周期表中的位置相邻,在元素周期表中的位置是________。
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体。
乙醇分子中原子的杂化轨道类型为________;能与以配位键形成,则的空间构型是________。
中存在的化学键除了极性共价键外,还有________。
极易溶于水的原因主要有两个,一是________,二是________。
溶液中加入过量溶液能生成配离子,中含有的键数目为________,与互为等电子体的离子有________写出一种即可。
与形成的化合物的晶胞结构如图所示,若晶体密度为,则与最近距离为________用表示阿伏加德罗常数的值,列出计算表达式,不用化简。
答案和解析
1.【答案】
【解析】
【分析】
本题考查杂化轨道、价层电子对互斥理论、化学键、分子极性等,题目难度较易,注意理解杂化轨道理论与价层电子对互斥理论,注意根据分子构型进行分子极性的判断。
【解答】
A.中原子成个键、个双键,杂化轨道数为,原子采取杂化,原子成个双键,含有对孤电子对,杂化轨道数为,原子采取杂化,故A错误;
B.甲醛分子中成个键、个双键,中心原子价层电子对数为,不含孤电子对,为平面三角形,故B错误;
C.甲醛的结构简式为,结构式为,甲醛中,含有碳氧双键以及两个碳氢单键,故其中个键,个键,故C正确;
D.甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,所以极性分子,故D错误。
2.【答案】
【解析】
【分析】
本题综合考查物质的结构与性质,涉及配合物基本知识,杂化方式判断、等电子原理、价层电子对互斥理论等,难度不大。
【解答】
A. 该配合物中配体是,配位数是,故A错误;
B. 离子的键电子对数目为,孤电子对数为,故其空间构型为形,中心原子的杂化形式为,故B正确;
C. 的结构式应该写作,故C错误;
D. 分子键电子对为,孤电子对数为,模型是平面三角形,故D错误;
故选B。
3.【答案】
【解析】
【试题解析】
【分析】
本题考查物质结构与性质,掌握原子结构、分子结构以及晶体结构为解题关键,难度不大。
【解答】
A.氮原子能级半充满,所以比较稳定,氮原子的第一电离能大于氧原子,故A正确;
B.为形分子,分子中之间的夹角小于,故B错误;
C.金刚石是原子晶体,石墨是混合型晶体,金刚石熔点低于石墨,故C错误;
D.碘单质在中溶解度很大,和都是非极性分子,故D错误。
故选A。
4.【答案】
【解析】
【分析】
本题考查了手性碳原子、杂化类型的判断和分子空间构型的判断,题目难度中等,注意掌握价层电子对互斥理论,侧重于考查学生对基础知识的应用能力。
【解答】
A.中价层电子对数为,孤电子对数为,空间构型为型,故A错误;
B.原子连有四个不同的原子和原子团时属于手性碳原子,乳酸 分子中中间的属于手性碳原子,故B正确;
C.由价层电子对互斥理论可知和中原子的价层电子对数分别为、,均为杂化,空间构型分别为形、平面三角形,故C错误;
D.配位键常用表示,其中原子可以提供孤电子对,故D错误。
故选B。
5.【答案】
【解析】
【分析】
本题考查微粒的空间构型以及手性分子的判断,熟练掌握价层电子对互斥理论是解答关键,注意等电子体,具有相似的结构,但化学性质不同,为易错点,题目难度中等。
【解答】
A.是手性分子,不是手性分子,故A错误;
B.分子中心原子原子价层电子对数键数孤对电子对数,中心原子原子价层电子对数键个数孤电子对个数,故B正确;
C.中硼原子价层电子对个数键个数孤电子对个数,无孤对电子,硼原子轨道的杂化类型为,苯分子中上无孤对电子,形成个键,碳原子轨道的杂化类型为,杂化类型相同,故C正确;
D.和是等电子体,价电子数都为,具有相似的结构,但化学性质不同,二氧化硫以还原性为主,而臭氧具有强氧化性,故D正确。
6.【答案】
【解析】
【分析】
本题考查相似相溶原理、手性碳原子、杂化类型判断、有机物的酸性比较,难度一般,解题关键是理解分子结构和性质的相关理论。
【解答】
A.碘、四氯化碳、甲烷都为非极性分子,水为极性分子,根据相似相溶原理,碘易溶于四氯化碳,甲烷难溶于水,故A正确;
B.乳酸分子中只有标有的一个手性碳原子,故B正确;
C.的中的孤电子对数为,杂化轨道数为,中心原子的杂化方式为,立体构型为平面三角形,故C错误;
D.的非羟基氧原子数比的多,含氧酸中非羟基氧原子数越多,酸性越强,所以磷酸的酸性强于次氯酸,故D正确;
故选C。
7.【答案】
【解析】略
8.【答案】
【解析】
【分析】
本题考查分子的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点。
【解答】
A.与分子构型相同,二氧化碳的分子结构为,则的结构为,属于直线形的非极性分子,故A正确;
B.中的价层电子对数,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C.中含有一个成键电子对,所以中含有个键,则分子中有对完全相同的成键电子对,故C正确;
D.中的价层电子对数,中的价层电子对数,所以中心原子均为杂化,故D正确。
故选B。
9.【答案】
【解析】
【分析】
本题考查了杂化类型和微粒空间构型的判断,利用价层电子对互斥理论分析解答即可,难点是孤电子对的计算方法,题目难度不大。
【解答】
A.碳碳双键为杂化,甲基上为杂化,含个键,个键,故A错误;
B.二氧化碳分子中原子价层电子对个数且不含孤电子对,为直线形分子,故B正确;
C.等电子体是研究同价电子数同原子数的分子和离子,而二氧化硅是原子晶体,化学式中硅、氧原子个数之比为:,所以两者不能互称为等电子体,性质不同,故C错误;
D.中的价层电子对数,为杂化,无孤电子对,所以的空间构型为正四面体,故D错误。
10.【答案】
【解析】
【分析】
本题主要考查的是物质的结构,涉及分子空间构型、杂化类型的判断、键长与分子稳定性的关系、键角等知识,意在考查学生的知识应用能力。
【解答】
A.的键角为,的键角为,故A错误;
B.乙烯分子中,碳原子的价层电子对数为,碳原子的杂化轨道形成键,两个碳原子中未参加杂化的轨道“肩并肩”形成键,故B正确;
C.键长越长,键能越小,分子的稳定性越差,则稳定性,故C错误;
D.分子为三角锥形,键角小于,是因为分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用大,故D错误。
故选:。
11.【答案】
【解析】
【分析】
本题考查原子杂化类型判断、分子空间构型判断等知识点,侧重考查分析、判断及知识综合运用能力,明确价层电子对互斥理论内涵是解本题关键,知道相似相溶原理,题目难度不大。
【解答】
A.为直线形分子,正负电荷重心重合,为非极性分子;为形结构,正负电荷重心不重合,为极性分子,根据相似相溶原理知,在水中的溶解度较小,故A错误;
B.晶体属于分子晶体,干冰晶胞属于面心立方堆积,晶体中一个分子周围紧邻的分子有个,故B正确;
C.中原子价层电子对个数且含有个孤电子对,原子采用杂化,分子的模型为四面体,空间构型为形,故C错误;
D.葡萄糖属于多羟基醛为分子晶体,脂肪酸为分子晶体,故D错误;
故选:。
12.【答案】
【解析】解析 中原子的杂化方式为 , 的空间结构不是平面形,A错误;甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由极性键组成的极性分子,B正确; 分子中连接原子的原子数多,存在氢键的数目多,而偏二甲肼 只有一端可以形成氢键,另一端的两个甲基基团比较大,影响了分子的排列,沸点比 的低,C正确; 中、杂化方式均为 ,D正确。
13.【答案】
【解析】
【分析】
本题考查分子空间结构,注意由价层电子对数和孤对电子数判断空间构型,掌握键能和键长对共价键强弱的影响关系是解答关键。
【解答】
A.中键键长比中键键长长,故A错误;
B.原子最外层有个电子,分子中原子的价层电子对数为,孤对电子数为,故B错误;
C.分子中原子的价层电子对数为,孤对电子数为,空间构型为三角锥型,故C正确;
D.因为的键能比的键能小,稳定性弱于,故D错误。
故选C。
14.【答案】
【解析】
【分析】
中的阳离子为和,中原子形成个键,不含孤电子对,价层电子对数为,采用杂化,空间构型为正四面体,中原子形成个键,含有个孤电子对,价层电子对数为,采用杂化,空间构型为三角锥形。
【解答】
A.由上述分析可知,和中心原子的杂化轨道类型均为杂化,故A不符合题意;
B.由上述分析可知,和中心原子的价层电子对数均为,故B不符合题意;
C.的空间构型为正四面体,的空间构型为三角锥形,故C符合题意;
D.和中含有的共价键均为键,故D不符合题意;
答案选C。
15.【答案】
【解析】
【分析】
本题考查元素周期表、分子结构与性质、化学键等,难度不大,注意把握元素周期表的结构。
【解答】
由元素在周期表中的位置可知,为氢元素,为碳元素,为氮元素,为氧元素,为硫元素,为元素,
A.水分子之间存在氢键,沸点较高,常温下为液体,硫化氢为气态,故A错误;
B.分子是三角锥形,正负电荷重心不重合,属于极性分子,故B错误;
C.氮气分子中存在氮氮三键,三键含有个键、个键,分子中与之比为:,故C正确;
D.、、的最简单氢化物分别是、、,在常温常压下为液体,故D错误。
故选C。
16.【答案】浓;浓硫酸
排尽装置中的空气,防止加热时钴被氧气氧化
温度低,反应速率小
射线行射仪;正八面体
【解析】
【分析】
本题考查物质的制备实验,涉及物质的分离与提纯、对操作的分析评价等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等。
【解答】
的制备时,实验室用高锰酸钾和浓盐酸制备氯气,其原理为浓。易潮解,中洗气瓶应装浓硫酸干燥。
钴和铁类似,在温度较高时,能与氧气反应,所以用氯气排尽装置中的空气,防止加热时钴被氧气氧化。
三氯化六氨合结Ⅲ的制备时,要保持较高温度来提高反应速率。
氯化铵水溶液显酸性,有调节溶液的、增强的氧化性的作用,A正确
B.活性炭是催化剂,B错误;
C.加入浓盐酸,析出产品的反应方程式为,C正确;
D.三氯化六氨合钴不溶于乙醇,可用乙醇水溶液洗涤产品,D正确;
测定晶体结构最常见的仪器是射线行射仪;中心离子采取杂化,配位数为,其空间结构为正八面体。
按得失电子守恒、元素质量守恒,测定过程中存在关系式:,则产品中钴的百分含量是。
17.【答案】长颈漏斗;防止空气中的水蒸气进入三颈烧瓶,以免发生水解
;;平面三角形;合理即可
红棕色完全消失;
【解析】
【分析】
本题是制备实验的考查,题目难度中等,“明确实验目的、实验原理、实验操作步骤及每个环节需要的注意事项是解题的关键,要求学生掌握元素化合物的基础知识及具备实验问题的分析思想。
【解答】
本实验的目的是制备,该物质易与水反应,所以制备过程要保持干燥;装置中利用铜和稀硝酸反应生成,装置中盛水可以除去可能产生的,装置对进行干燥,之后进入装置中与干燥纯净氯气在冰盐水浴条件下反应生成,装置可以防止空气中的水蒸气进入反应装置使水解;实验时,需先打开、,关闭,再打开分液漏斗活塞滴入适量稀硝酸,利用产生的将装置中的空气排尽,易被氧气氧化成,当观察到中红棕色气体完全消失后说明装置中空气被排尽,此时装置中充满;此时关闭、,向装置三颈瓶中通入干燥纯净,当瓶中充满黄绿色气体时,再打开、,制备。
根据仪器的结构特点可知其为长颈漏斗;装置可以防止空气中的水蒸气进入三颈烧瓶,以免发生水解。
遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色,说明其中一种为,另一种应为,氢化物为,根据元素守恒可得化学方程式为;分子中各原子均满足电子稳定结构,说明与其他原子共用一对电子,与其他原子共用对电子,与其他原子共用对电子,所以电子式为,因氮原子与氯原子之间形成单键,氮原子与氧原子形成氮氧双键,故模型为平面三角形;由两种元素组成且与互为等电子体分子的化学式为,因为原子分子,且总价电子数为,二氧化硫也是原子分子,且总价电子数为。
根据分析可知当观察到中红棕色完全消失时关闭、;中为与反应生成的反应,化学方程式为。
亚硝酰氯溶于水可以产生氯离子,氯离子和银离子发生反应:,滴定终点氯离子完全反应,根据元素守恒可知溶液中,则样品中,所以纯度为。
18.【答案】 ;
;
基态的价电子排布式为,为全充满状态,更稳定或“离子核外电子处于稳定的全充满状态”;
、为离子晶体,为原子晶体, 半径大于半径,晶格能;
、表示卤素原子,任写一种 四面体形 、
;
【解析】
【分析】
本题主要考查晶体类型,杂化轨道,电离能,电负性、晶胞计算,难度一般,注意掌握相应知识是解题关键;
【解答】
位于第族,位于区;
微粒都是原子失去一个电子后得到的,但是微粒能量高于,稳定性,所以失电子能量;
都是原子,但是是基态、是激发态,能量:,稳定性,所以失去一个电子能量:。微粒是失去一个电子得到的,且轨道中电子处于全满状态,较稳定,所以失去一个电子能量。
通过以上分析知,电离最外层一个电子所需能量最大的是。故选:。
轨道中电子排布达到全满、半满、全空时原子最稳定,的最外层电子排布为,而的最外层电子排布为,因最外层电子排布达到全满时稳定,所以固态稳定性强于;
、为离子晶体,为原子晶体,所以二氧化硅的熔点比前两者高; 半径大于半径,氯化钠离子键键能更大,晶格能;
同周期从左往右电负性逐渐增强,故有,同主族从上往下电负性逐渐减弱,故有,所以电负性最强的为
中的阴离子为硫酸根,根据等电子体的定义可知有、等;
中每个氨分中含有个键,每个氨分子与镍离子之间形成一个配位键也是键,每个硫酸根含有个键,所以 中含有键的数目是
氨气中价层电子对个数且含有个孤电子对,所以原子采用杂化,模型为四面体形;离子中价层电子对个数,没有孤电子对,所以其立体构型是正四面体,硫原子采取杂化;
根据均摊法可知该晶胞中原子个数,原子个数,原子个数,晶胞体积,晶胞密度
19.【答案】;第四周期第Ⅷ族;
;正四面体形;
离子键、配位键;
氨分子和水分子之间能形成氢键;氨分子和水分子都是极性分子;
;;
【解析】
【分析】
本题是对物质结构与性质的综合考查,涉及核外电子排布、杂化轨道、化学键、等电子体、晶胞结构与计算等,中计算关键明确微粒距离与晶胞棱长关系,注意识记常见晶胞结构特点,难度中等。
【解答】
中阳离子,核外电子排布式为,的原子序数比铜小,位于元素周期表中第四周期第Ⅷ族,
故答案为:;第四周期第Ⅷ族;
乙醇分子中的每个原子形成个键,没有孤电子对,价层电子对数为,则应为杂化;与以配位键形成,中氮原子采用杂化,没有孤对电子,空间构型为正四面体形;
中,与形成离子键,与形成配位键,中原子与原子之间形成极性键,
与 形成氢键,和是极性分子,根据“相似相溶”原理,在中溶解度极大;
故答案为:;正四面体形;离子键、配位键;氨分子和水分子之间能形成氢键;氨分子和水分子都是极性分子,相似相溶;
与互为等电子体,中、之间形成三键,三键含有个键、个键, 中含有的键, 中含有的键数目为:;将原子用碳原子与个单位负电荷替换可得到与互为等电子体的一种离子:;
故答案为:;;
晶胞中原子数目为、原子数目为,晶胞的质量为,晶胞体积,则晶胞棱长原子与周围的个原子形成正四面体结构,原子与正四面体顶点的距离最近,原子与原子连线处于晶胞体对角线上,且体对角线长度的,等于晶胞棱长的,故C与最近距离为。
故答案为:。
第1页,共1页
一、单选题
1. 甲醛分子式为,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质。下列关于其结构及性质的分析正确的是( )
A. 原子采取杂化,原子采取杂化
B. 甲醛分子中心原子价层电子对数为,含有一对孤电子对,是三角锥形结构
C. 一个甲醛分子中含有个键和个键
D. 甲醛分子为非极性分子
2. 下列叙述正确的是
A. 该配合物中配体是,配位数是。
B. 离子的空间构型为形,中心原子的杂化形式为
C. 、等与互为等电子体,则和的结构式分别为、
D. 分子的中心原子的价层电子对数为,该分子的模型是正四面体形
3. 下列对一些事实的理论解释正确的是
选项 实验事实 理论解释
A. 原子的第一电离能大于原子 原子能级半充满
B. 为直线形分子 分子中之间的夹角
C. 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶体
D. 碘单质在中溶解度很大 和都是极性分子
A. B. C. D.
4. 下列说法正确的是( )
A. 次氯酸分子的结构式为,其分子为直线形的极性分子
B. 乳酸 分子中含有一个手性碳原子
C. 和分子中心原子分别为和杂化,空间构型分别为形、平面三角形
D. 配位键常用表示,其中原子可以提供接受孤电子对的空轨道
5. 下列说法不正确的是( )
A. 和都有手性碳原子
B. 与中心原子的价层电子对数相同
C. 中硼原子的杂化类型与苯中碳原子的杂化类型相同
D. 和是等电子体,但两者具有不同的化学性质
6. 下列说法不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶规律解释
B. 乳酸分子中含有一个手性碳原子
C. 的立体构型为三角锥型,中心原子的杂化方式为
D. 酸性:磷酸次氯酸
7. 下列关于粒子结构的描述不正确的是( )
A. 根据等电子原理判断,分子中所有原子在同一平面上
B. 和均是含一个极性键的 电子粒子
C. 和 均是四面体构型的非极性分子
D. 和杂化轨道类型均为 杂化,立体构型分别为形、平面三角形
8. 下列描述中不正确的是( )
A. 为直线形的非极性分子 B. 的立体构型为平面三角形
C. 中有对完全相同的成键电子对 D. 和的中心原子均为杂化
9. 下列说法正确的是( )
A. 中其碳原子的杂化类型有 和,其中有个键,个键
B. 分子的模型是直线形
C. 和互为等电子体,故性质相似
D. 的空间构型为三角锥形
10. 下列说法中正确的是( )
A. 和都是正四面体形分子,且键角都为
B. 乙烯分子中,碳原子的杂化轨道形成键,未杂化的轨道形成键
C. 键长,因此稳定性
D. 分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用弱
11. 为践行社会主义核心价值观,创建和谐社会,实现碳达峰和碳中和,我国科学家独创了一种二氧化碳转化新路径:通过电催化与生物合成相结合,以二氧化碳和水为原料成功合成了葡萄糖和脂肪酸,为人工和半人工合成“粮食”提供了新路径。关于上述物质,下列说法正确的是
A. 和均为极性分子,故C易溶于水
B. 晶体属于分子晶体,晶体中一个分子周围紧邻的分子有个
C. 分子中原子上有对孤电子对,故H分子的模型为形
D. 葡萄糖为分子晶体,脂肪酸为离子晶体
12. 关于、和的结构与性质,下列说法不正确的是
A. 空间结构为平面形 B. 为极性分子
C. 的沸点高于 D. 中、杂化方式均相同
13. 通常状况下,是一种油状液体,下列对的有关叙述正确的是 ( )
A. 中键键长比中键键长短
B. 分子中的原子无孤电子对
C. 分子的空间构型为三角锥型
D. 稳定性弱于,因为的键能比的键能大
14. 我国科学家最近成功合成了世界上首个五氮阴离子盐用代表。经射线衍射测得化合物的晶体结构,其局都结构如下图所示,从结构角度分析中两种阳离子的不同之处是( )
A. 中心原子的杂化轨道类型 B. 中心原子的价层电子对数
C. 空间结构 D. 共价键类型
15. 下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
下列说法正确的是
A. 沸点:
B. 分子是非极性分子
C. 形成的单质中键与键个数之比为
D. ,,形成的简单氢化物在常温常压下均为气体
二、实验题
16. 三氯化六氨合钴Ⅲ是黄色或橙黄色晶体,实验室以为原料经催化制备,步骤如下:
I.的制备:可以通过钴和氯气反应制得,实验室制备纯净可用如图实验装置已知:易潮解。
装置用于制备氯气,其反应的化学方程式为_____装置中洗气瓶内所装试剂的名称为_____
组装好仪器进行实验时,要先加入浓盐酸,使装置中开始生成氯气,待装置内充满黄绿色气体,再加热装置中的钴粉,目的是_______
三氯化六氨合钴Ⅲ的制备。其原理为:
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
水浴温度不低于的原因是_______
下列说法不正确的是_______填标号。
A.除作为反应物外,还有调节溶液的、增强的氧化性的作用
B.活性炭是脱色剂、固体是活性炭
C.加入浓盐酸,析出产品的反应方程式为
D.可用乙醇水溶液洗涤产品
晶体结构测定与钴含量分析。
测定晶体结构最科学的方法是_______,从而获取晶胞形状和大小、分子或原子在微观空间的有序排列。中心离子的价层电子对为,其空间结构为_______
利用将氧化成,被还原后的产物为。然后用标准溶液滴定生成的,所得产物为。若称取样品的质量为,滴定时,达到终点消耗标准溶液的平均体积为。该样品中钴元素的质量分数为_______。
17. 亚硝酰氯常用作催化剂和合成洗涤剂,某学习小组在实验室中用下图所示装置制备。查阅资料:亚硝酰氯的熔点为、沸点为,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
回答下列问题:
仪器的名称为________,的作用是________。
与水反应的化学方程式为___________________________________;分子中各原子均满足电子稳定结构,则的电子式为_________________;它的模型为_________________;写出一种由两种元素组成且与互为等电子体分子的化学式_________。
实验开始时,先打开、,关闭,再打开分液漏斗活塞滴入适量稀硝酸,当观察到中_________________时关闭、;向装置三颈瓶中通入干燥纯净,当瓶中充满黄绿色气体时,再打开、,制备,中发生的反应方程式为________。
亚硝酰氯纯度的测定:将所得亚硝酰氯产品溶于水,配制成溶液;取出,以溶液为指示剂,用标准溶液滴定至终点,消耗标准溶液的体积为 。已知:为砖红色固体,则亚硝酰氯的质量分数为________。
三、简答题
18. K、、、、 均为重要的合金材料,在工业生产、科技、国防领域有着广泛的用途,请回答下列问题:
元素处于元素同期表的_____ 区。
下列状态的铝中,电离最外层一个电子所需能量最大的是_____填标号。
A.
从核外电子排布角度解释高温下比更稳定的原因是____________。
一些化合物的熔点如下表所示:
化合物
熔点
解释表中化合物之间熔点差异的原因____________。
溶于氨水形成 。
、、三种元素中电负性最大的是________。
写出一种与 中的阴离子互为等电子体的分子的分子式_________。
中含有键的数目为___________。
的模型为____ ;、的中心原子的杂化类型分别为_________、___________。
、、三种元素组成的一种晶体的长方体晶胞结构如图所示。若为阿伏加德罗常数的值,该晶体的密度______用代数式表示。
19. 铜及其化合物在科学研究和工业生产中具有许多用途。回答下列问题:
中阳离子的基态核外电子排布式为________;和在元素周期表中的位置相邻,在元素周期表中的位置是________。
将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体。
乙醇分子中原子的杂化轨道类型为________;能与以配位键形成,则的空间构型是________。
中存在的化学键除了极性共价键外,还有________。
极易溶于水的原因主要有两个,一是________,二是________。
溶液中加入过量溶液能生成配离子,中含有的键数目为________,与互为等电子体的离子有________写出一种即可。
与形成的化合物的晶胞结构如图所示,若晶体密度为,则与最近距离为________用表示阿伏加德罗常数的值,列出计算表达式,不用化简。
答案和解析
1.【答案】
【解析】
【分析】
本题考查杂化轨道、价层电子对互斥理论、化学键、分子极性等,题目难度较易,注意理解杂化轨道理论与价层电子对互斥理论,注意根据分子构型进行分子极性的判断。
【解答】
A.中原子成个键、个双键,杂化轨道数为,原子采取杂化,原子成个双键,含有对孤电子对,杂化轨道数为,原子采取杂化,故A错误;
B.甲醛分子中成个键、个双键,中心原子价层电子对数为,不含孤电子对,为平面三角形,故B错误;
C.甲醛的结构简式为,结构式为,甲醛中,含有碳氧双键以及两个碳氢单键,故其中个键,个键,故C正确;
D.甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,所以极性分子,故D错误。
2.【答案】
【解析】
【分析】
本题综合考查物质的结构与性质,涉及配合物基本知识,杂化方式判断、等电子原理、价层电子对互斥理论等,难度不大。
【解答】
A. 该配合物中配体是,配位数是,故A错误;
B. 离子的键电子对数目为,孤电子对数为,故其空间构型为形,中心原子的杂化形式为,故B正确;
C. 的结构式应该写作,故C错误;
D. 分子键电子对为,孤电子对数为,模型是平面三角形,故D错误;
故选B。
3.【答案】
【解析】
【试题解析】
【分析】
本题考查物质结构与性质,掌握原子结构、分子结构以及晶体结构为解题关键,难度不大。
【解答】
A.氮原子能级半充满,所以比较稳定,氮原子的第一电离能大于氧原子,故A正确;
B.为形分子,分子中之间的夹角小于,故B错误;
C.金刚石是原子晶体,石墨是混合型晶体,金刚石熔点低于石墨,故C错误;
D.碘单质在中溶解度很大,和都是非极性分子,故D错误。
故选A。
4.【答案】
【解析】
【分析】
本题考查了手性碳原子、杂化类型的判断和分子空间构型的判断,题目难度中等,注意掌握价层电子对互斥理论,侧重于考查学生对基础知识的应用能力。
【解答】
A.中价层电子对数为,孤电子对数为,空间构型为型,故A错误;
B.原子连有四个不同的原子和原子团时属于手性碳原子,乳酸 分子中中间的属于手性碳原子,故B正确;
C.由价层电子对互斥理论可知和中原子的价层电子对数分别为、,均为杂化,空间构型分别为形、平面三角形,故C错误;
D.配位键常用表示,其中原子可以提供孤电子对,故D错误。
故选B。
5.【答案】
【解析】
【分析】
本题考查微粒的空间构型以及手性分子的判断,熟练掌握价层电子对互斥理论是解答关键,注意等电子体,具有相似的结构,但化学性质不同,为易错点,题目难度中等。
【解答】
A.是手性分子,不是手性分子,故A错误;
B.分子中心原子原子价层电子对数键数孤对电子对数,中心原子原子价层电子对数键个数孤电子对个数,故B正确;
C.中硼原子价层电子对个数键个数孤电子对个数,无孤对电子,硼原子轨道的杂化类型为,苯分子中上无孤对电子,形成个键,碳原子轨道的杂化类型为,杂化类型相同,故C正确;
D.和是等电子体,价电子数都为,具有相似的结构,但化学性质不同,二氧化硫以还原性为主,而臭氧具有强氧化性,故D正确。
6.【答案】
【解析】
【分析】
本题考查相似相溶原理、手性碳原子、杂化类型判断、有机物的酸性比较,难度一般,解题关键是理解分子结构和性质的相关理论。
【解答】
A.碘、四氯化碳、甲烷都为非极性分子,水为极性分子,根据相似相溶原理,碘易溶于四氯化碳,甲烷难溶于水,故A正确;
B.乳酸分子中只有标有的一个手性碳原子,故B正确;
C.的中的孤电子对数为,杂化轨道数为,中心原子的杂化方式为,立体构型为平面三角形,故C错误;
D.的非羟基氧原子数比的多,含氧酸中非羟基氧原子数越多,酸性越强,所以磷酸的酸性强于次氯酸,故D正确;
故选C。
7.【答案】
【解析】略
8.【答案】
【解析】
【分析】
本题考查分子的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点。
【解答】
A.与分子构型相同,二氧化碳的分子结构为,则的结构为,属于直线形的非极性分子,故A正确;
B.中的价层电子对数,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C.中含有一个成键电子对,所以中含有个键,则分子中有对完全相同的成键电子对,故C正确;
D.中的价层电子对数,中的价层电子对数,所以中心原子均为杂化,故D正确。
故选B。
9.【答案】
【解析】
【分析】
本题考查了杂化类型和微粒空间构型的判断,利用价层电子对互斥理论分析解答即可,难点是孤电子对的计算方法,题目难度不大。
【解答】
A.碳碳双键为杂化,甲基上为杂化,含个键,个键,故A错误;
B.二氧化碳分子中原子价层电子对个数且不含孤电子对,为直线形分子,故B正确;
C.等电子体是研究同价电子数同原子数的分子和离子,而二氧化硅是原子晶体,化学式中硅、氧原子个数之比为:,所以两者不能互称为等电子体,性质不同,故C错误;
D.中的价层电子对数,为杂化,无孤电子对,所以的空间构型为正四面体,故D错误。
10.【答案】
【解析】
【分析】
本题主要考查的是物质的结构,涉及分子空间构型、杂化类型的判断、键长与分子稳定性的关系、键角等知识,意在考查学生的知识应用能力。
【解答】
A.的键角为,的键角为,故A错误;
B.乙烯分子中,碳原子的价层电子对数为,碳原子的杂化轨道形成键,两个碳原子中未参加杂化的轨道“肩并肩”形成键,故B正确;
C.键长越长,键能越小,分子的稳定性越差,则稳定性,故C错误;
D.分子为三角锥形,键角小于,是因为分子中孤电子对与成键电子对的排斥作用比成键电子对之间的排斥作用大,故D错误。
故选:。
11.【答案】
【解析】
【分析】
本题考查原子杂化类型判断、分子空间构型判断等知识点,侧重考查分析、判断及知识综合运用能力,明确价层电子对互斥理论内涵是解本题关键,知道相似相溶原理,题目难度不大。
【解答】
A.为直线形分子,正负电荷重心重合,为非极性分子;为形结构,正负电荷重心不重合,为极性分子,根据相似相溶原理知,在水中的溶解度较小,故A错误;
B.晶体属于分子晶体,干冰晶胞属于面心立方堆积,晶体中一个分子周围紧邻的分子有个,故B正确;
C.中原子价层电子对个数且含有个孤电子对,原子采用杂化,分子的模型为四面体,空间构型为形,故C错误;
D.葡萄糖属于多羟基醛为分子晶体,脂肪酸为分子晶体,故D错误;
故选:。
12.【答案】
【解析】解析 中原子的杂化方式为 , 的空间结构不是平面形,A错误;甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由极性键组成的极性分子,B正确; 分子中连接原子的原子数多,存在氢键的数目多,而偏二甲肼 只有一端可以形成氢键,另一端的两个甲基基团比较大,影响了分子的排列,沸点比 的低,C正确; 中、杂化方式均为 ,D正确。
13.【答案】
【解析】
【分析】
本题考查分子空间结构,注意由价层电子对数和孤对电子数判断空间构型,掌握键能和键长对共价键强弱的影响关系是解答关键。
【解答】
A.中键键长比中键键长长,故A错误;
B.原子最外层有个电子,分子中原子的价层电子对数为,孤对电子数为,故B错误;
C.分子中原子的价层电子对数为,孤对电子数为,空间构型为三角锥型,故C正确;
D.因为的键能比的键能小,稳定性弱于,故D错误。
故选C。
14.【答案】
【解析】
【分析】
中的阳离子为和,中原子形成个键,不含孤电子对,价层电子对数为,采用杂化,空间构型为正四面体,中原子形成个键,含有个孤电子对,价层电子对数为,采用杂化,空间构型为三角锥形。
【解答】
A.由上述分析可知,和中心原子的杂化轨道类型均为杂化,故A不符合题意;
B.由上述分析可知,和中心原子的价层电子对数均为,故B不符合题意;
C.的空间构型为正四面体,的空间构型为三角锥形,故C符合题意;
D.和中含有的共价键均为键,故D不符合题意;
答案选C。
15.【答案】
【解析】
【分析】
本题考查元素周期表、分子结构与性质、化学键等,难度不大,注意把握元素周期表的结构。
【解答】
由元素在周期表中的位置可知,为氢元素,为碳元素,为氮元素,为氧元素,为硫元素,为元素,
A.水分子之间存在氢键,沸点较高,常温下为液体,硫化氢为气态,故A错误;
B.分子是三角锥形,正负电荷重心不重合,属于极性分子,故B错误;
C.氮气分子中存在氮氮三键,三键含有个键、个键,分子中与之比为:,故C正确;
D.、、的最简单氢化物分别是、、,在常温常压下为液体,故D错误。
故选C。
16.【答案】浓;浓硫酸
排尽装置中的空气,防止加热时钴被氧气氧化
温度低,反应速率小
射线行射仪;正八面体
【解析】
【分析】
本题考查物质的制备实验,涉及物质的分离与提纯、对操作的分析评价等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等。
【解答】
的制备时,实验室用高锰酸钾和浓盐酸制备氯气,其原理为浓。易潮解,中洗气瓶应装浓硫酸干燥。
钴和铁类似,在温度较高时,能与氧气反应,所以用氯气排尽装置中的空气,防止加热时钴被氧气氧化。
三氯化六氨合结Ⅲ的制备时,要保持较高温度来提高反应速率。
氯化铵水溶液显酸性,有调节溶液的、增强的氧化性的作用,A正确
B.活性炭是催化剂,B错误;
C.加入浓盐酸,析出产品的反应方程式为,C正确;
D.三氯化六氨合钴不溶于乙醇,可用乙醇水溶液洗涤产品,D正确;
测定晶体结构最常见的仪器是射线行射仪;中心离子采取杂化,配位数为,其空间结构为正八面体。
按得失电子守恒、元素质量守恒,测定过程中存在关系式:,则产品中钴的百分含量是。
17.【答案】长颈漏斗;防止空气中的水蒸气进入三颈烧瓶,以免发生水解
;;平面三角形;合理即可
红棕色完全消失;
【解析】
【分析】
本题是制备实验的考查,题目难度中等,“明确实验目的、实验原理、实验操作步骤及每个环节需要的注意事项是解题的关键,要求学生掌握元素化合物的基础知识及具备实验问题的分析思想。
【解答】
本实验的目的是制备,该物质易与水反应,所以制备过程要保持干燥;装置中利用铜和稀硝酸反应生成,装置中盛水可以除去可能产生的,装置对进行干燥,之后进入装置中与干燥纯净氯气在冰盐水浴条件下反应生成,装置可以防止空气中的水蒸气进入反应装置使水解;实验时,需先打开、,关闭,再打开分液漏斗活塞滴入适量稀硝酸,利用产生的将装置中的空气排尽,易被氧气氧化成,当观察到中红棕色气体完全消失后说明装置中空气被排尽,此时装置中充满;此时关闭、,向装置三颈瓶中通入干燥纯净,当瓶中充满黄绿色气体时,再打开、,制备。
根据仪器的结构特点可知其为长颈漏斗;装置可以防止空气中的水蒸气进入三颈烧瓶,以免发生水解。
遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色,说明其中一种为,另一种应为,氢化物为,根据元素守恒可得化学方程式为;分子中各原子均满足电子稳定结构,说明与其他原子共用一对电子,与其他原子共用对电子,与其他原子共用对电子,所以电子式为,因氮原子与氯原子之间形成单键,氮原子与氧原子形成氮氧双键,故模型为平面三角形;由两种元素组成且与互为等电子体分子的化学式为,因为原子分子,且总价电子数为,二氧化硫也是原子分子,且总价电子数为。
根据分析可知当观察到中红棕色完全消失时关闭、;中为与反应生成的反应,化学方程式为。
亚硝酰氯溶于水可以产生氯离子,氯离子和银离子发生反应:,滴定终点氯离子完全反应,根据元素守恒可知溶液中,则样品中,所以纯度为。
18.【答案】 ;
;
基态的价电子排布式为,为全充满状态,更稳定或“离子核外电子处于稳定的全充满状态”;
、为离子晶体,为原子晶体, 半径大于半径,晶格能;
、表示卤素原子,任写一种 四面体形 、
;
【解析】
【分析】
本题主要考查晶体类型,杂化轨道,电离能,电负性、晶胞计算,难度一般,注意掌握相应知识是解题关键;
【解答】
位于第族,位于区;
微粒都是原子失去一个电子后得到的,但是微粒能量高于,稳定性,所以失电子能量;
都是原子,但是是基态、是激发态,能量:,稳定性,所以失去一个电子能量:。微粒是失去一个电子得到的,且轨道中电子处于全满状态,较稳定,所以失去一个电子能量。
通过以上分析知,电离最外层一个电子所需能量最大的是。故选:。
轨道中电子排布达到全满、半满、全空时原子最稳定,的最外层电子排布为,而的最外层电子排布为,因最外层电子排布达到全满时稳定,所以固态稳定性强于;
、为离子晶体,为原子晶体,所以二氧化硅的熔点比前两者高; 半径大于半径,氯化钠离子键键能更大,晶格能;
同周期从左往右电负性逐渐增强,故有,同主族从上往下电负性逐渐减弱,故有,所以电负性最强的为
中的阴离子为硫酸根,根据等电子体的定义可知有、等;
中每个氨分中含有个键,每个氨分子与镍离子之间形成一个配位键也是键,每个硫酸根含有个键,所以 中含有键的数目是
氨气中价层电子对个数且含有个孤电子对,所以原子采用杂化,模型为四面体形;离子中价层电子对个数,没有孤电子对,所以其立体构型是正四面体,硫原子采取杂化;
根据均摊法可知该晶胞中原子个数,原子个数,原子个数,晶胞体积,晶胞密度
19.【答案】;第四周期第Ⅷ族;
;正四面体形;
离子键、配位键;
氨分子和水分子之间能形成氢键;氨分子和水分子都是极性分子;
;;
【解析】
【分析】
本题是对物质结构与性质的综合考查,涉及核外电子排布、杂化轨道、化学键、等电子体、晶胞结构与计算等,中计算关键明确微粒距离与晶胞棱长关系,注意识记常见晶胞结构特点,难度中等。
【解答】
中阳离子,核外电子排布式为,的原子序数比铜小,位于元素周期表中第四周期第Ⅷ族,
故答案为:;第四周期第Ⅷ族;
乙醇分子中的每个原子形成个键,没有孤电子对,价层电子对数为,则应为杂化;与以配位键形成,中氮原子采用杂化,没有孤对电子,空间构型为正四面体形;
中,与形成离子键,与形成配位键,中原子与原子之间形成极性键,
与 形成氢键,和是极性分子,根据“相似相溶”原理,在中溶解度极大;
故答案为:;正四面体形;离子键、配位键;氨分子和水分子之间能形成氢键;氨分子和水分子都是极性分子,相似相溶;
与互为等电子体,中、之间形成三键,三键含有个键、个键, 中含有的键, 中含有的键数目为:;将原子用碳原子与个单位负电荷替换可得到与互为等电子体的一种离子:;
故答案为:;;
晶胞中原子数目为、原子数目为,晶胞的质量为,晶胞体积,则晶胞棱长原子与周围的个原子形成正四面体结构,原子与正四面体顶点的距离最近,原子与原子连线处于晶胞体对角线上,且体对角线长度的,等于晶胞棱长的,故C与最近距离为。
故答案为:。
第1页,共1页
