第三章第二节分子晶体与共价晶体同步练习 (含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章第二节分子晶体与共价晶体同步练习 (含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 20:07:53 | ||
图片预览



文档简介
第三章第二节分子晶体与共价晶体同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于共价晶体、分子晶体的叙述中,正确的是
A.金刚石为共价键三维骨架结构,晶体中的最小环上有6个碳原子
B.分子晶体中一定存在共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
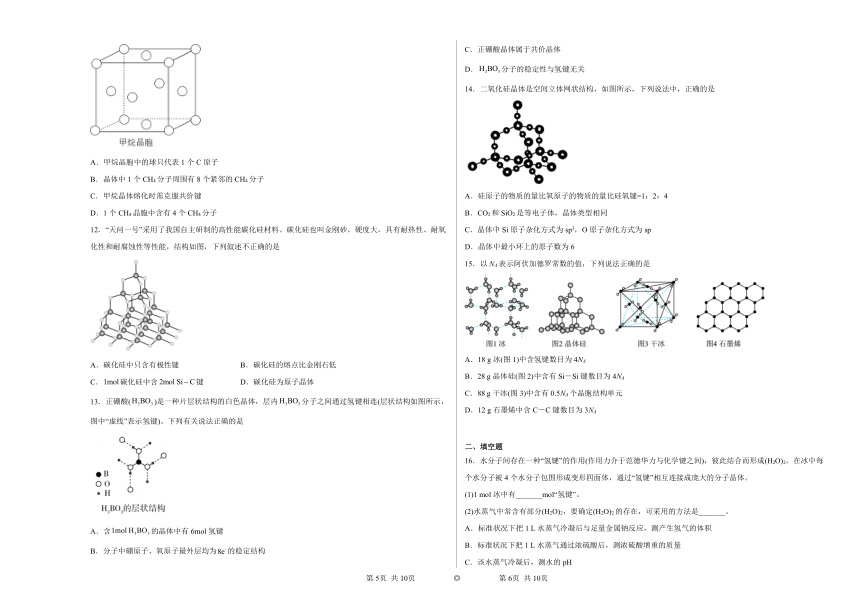
2.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是
A.C60摩尔质量是720
B.C60与苯互为同素异形体
C.C60晶体中仅存在范德华力
D.每个C60分子周围与它距离最近且等距离的C60分子有12个
3.20世纪,科学家发现并证明碳有新的单质分子(晶体的晶胞结构如图所示)存在,后来科学家又发现了管状碳分子和洋葱状碳分子。下列说法错误的是
A.晶体中每个分子周围与它距离最近且相等的分子有80个
B.熔点比较:晶体<金刚石
C.金刚石、、管状碳和洋葱状碳互为同素异形体
D.12g金刚石中含有共价键的数目为
4.钻石的魅力在于它经过大自然千百万年的孕育,再经打磨,能放射出闪烁的光芒,钻石就是经过打磨的金刚石。已知金刚石的结构如图所示,由此可看出在含有共价键形成的碳原子环中,其中形成最小的环所需碳原子数及任意两个键间的夹角是
A.6个 120° B.5个 108° C.4个 109°28′ D.6个 109°28′
5.图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体结构
B.冰晶体具有空间网状结构,是共价晶体
C.水分子间通过键形成冰晶体
D.冰融化后,水分子之间的空隙增大
6.二氧化硅晶体是立体网状结构,其结构如图所示。
下列关于二氧化硅晶体的说法不正确的是
A.晶体中每个硅原子与4个氧原子相连
B.晶体中硅、氧原子个数比为
C.晶体中最小环上的原子数为8
D.晶体中硅、氧原子最外层都满足8电子结构
7. 分子和晶胞示意图如图所示。下列关于晶体的说法不正确的是
A.晶体可能具有很高的熔、沸点
B.晶体可能易溶于四氯化碳中
C.晶体的一个晶胞中含有的碳原子数为240
D.晶体中每个分子与12个C分子紧邻
8.下列说法错误的是
A.SiC和Si的结构相似,都属于共价晶体,熔点
B.B与Si的单质性质差异很大
C.和的价电子数相同
D.如图所示银的晶胞中含有4个银原子
9.Al2O3在一定条件下可转化为硬度、熔点都很高的氮化铝晶体,氮化铝的晶胞如图所示。下列说法正确的是
A.氮化铝属于分子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al的配位数为2
10.北京2022年冬奥会采用CO2临界直冷技术,实现“水立方”变为“冰立方”。干冰晶胞如图所示。下列说法错误的是
A.冰、干冰晶体类型不同 B.“水立方”变为“冰立方”,密度减小
C.用干冰制冷比用氟利昂制冷环保 D.1个干冰晶胞的质量约为
11.甲烷晶体的晶胞结构如图所示,下列说法正确的是
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有8个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有4个CH4分子
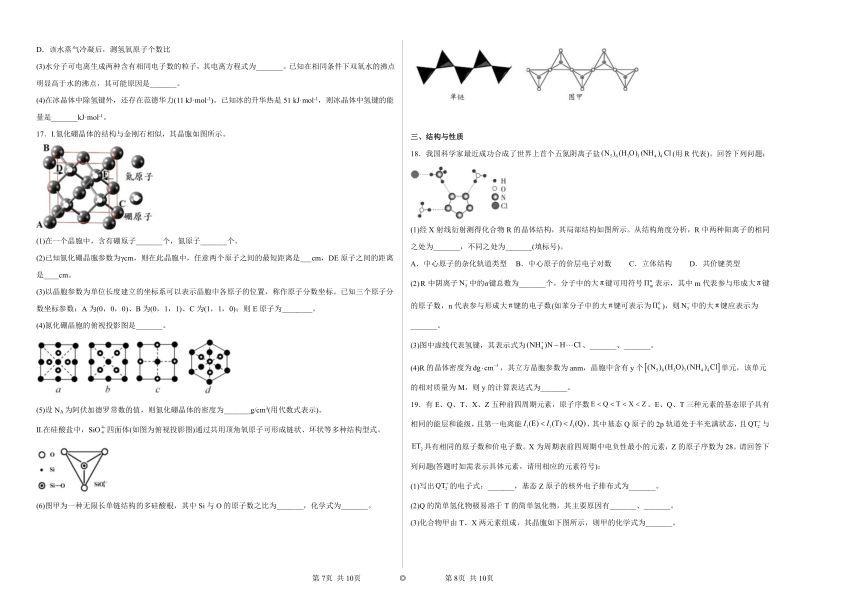
12.“天问一号”采用了我国自主研制的高性能碳化硅材料。碳化硅也叫金刚砂,硬度大,具有耐热性、耐氧化性和耐腐蚀性等性能,结构如图,下列叙述不正确的是
A.碳化硅中只含有极性键 B.碳化硅的熔点比金刚石低
C.碳化硅中含键 D.碳化硅为原子晶体
13.正硼酸()是一种片层状结构的白色晶体,层内分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关说法正确的是
A.含的晶体中有6mol氢键
B.分子中硼原子、氧原子最外层均为的稳定结构
C.正硼酸晶体属于共价晶体
D.分子的稳定性与氢键无关
14.二氧化硅晶体是空间立体网状结构,如图所示,下列说法中,正确的是
A.硅原子的物质的量比氧原子的物质的量比硅氧键=1:2:4
B.CO2和SiO2是等电子体,晶体类型相同
C.晶体中Si原子杂化方式为sp3,O原子杂化方式为sp
D.晶体中最小环上的原子数为6
15.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(图1)中含氢键数目为4NA
B.28 g晶体硅(图2)中含有Si-Si键数目为4NA
C.88 g干冰(图3)中含有0.5NA个晶胞结构单元
D.12 g石墨烯中含C-C键数目为3NA
二、填空题
16.水分子间存在一种“氢键”的作用(作用力介于范德华力与化学键之间),彼此结合而形成(H2O)2。在冰中每个水分子被4个水分子包围形成变形四面体,通过“氢键”相互连接成庞大的分子晶体。
(1)1 mol冰中有_______mol“氢键”。
(2)水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是_______。
A.标准状况下把1 L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.标准状况下把1 L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢氧原子个数比
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为_______。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是_______。
(4)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是_______kJ·mol-1。
17.I.氮化硼晶体的结构与金刚石相似,其晶胞如图所示。
(1)在一个晶胞中,含有硼原子_______个,氮原子_______个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离是___cm,DE原子之间的距离是____cm。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则E原子为________。
(4)氮化硼晶胞的俯视投影图是_______。
(5)设NA为阿伏加德罗常数的值,则氮化硼晶体的密度为_______g/cm3(用代数式表示)。
II.在硅酸盐中,SiO四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。
(6)图甲为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为_______,化学式为_______。
三、结构与性质
18.我国科学家最近成功合成了世界上首个五氮阴离子盐(用R代表)。回答下列问题:
(1)经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。从结构角度分析,R中两种阳离子的相同之处为_______,不同之处为_______(填标号)。
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数 C.立体结构 D.共价键类型
(2)中阴离子中的σ键总数为_______个。分子中的大键可用符号表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大键可表示为),则中的大键应表示为_______。
(3)图中虚线代表氢键,其表示式为、_______、_______。
(4)R的晶体密度为,其立方晶胞参数为anm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为_______。
19.有E、Q、T、X、Z五种前四周期元素,原子序数。E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能,其中基态Q原子的2p轨道处于半充满状态,且与具有相同的原子数和价电子数。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出的电子式:_______,基态Z原子的核外电子排布式为_______。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有_______、_______。
(3)化合物甲由T、X两元素组成,其晶胞如下图所示,则甲的化学式为_______。
(4)化合物乙的晶胞如下图所示,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为_______,其硬度超过金刚石的原因是_______。
②乙的晶体中E、Q两种元素原子的杂化方式均为_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.金刚石属于共价晶体,其中的碳采取sp3杂化轨道与周围的4个碳原子形成正四面体结构,以共价键形成空间网状结构,晶体中最小环上有6个碳原子,A项正确;
B.分子晶体中不一定存在共价键,如稀有气体形成的晶体为分子晶体,稀有气体是单原子分子,原子间没有共价键,B项错误;
C.HF分子间存在氢键,HI分子间不存在氢键,故HI的沸点低于HF,C项错误;
D.SiO2属于共价晶体,在SiO2晶体中1个Si原子和4个O原子形成4个共价键,D项错误;
答案选A。
2.D
【详解】A.C60的摩尔质量为720g/mol,A错误;
B.由同种元素形成的不同种单质互为同素异形体,而苯是碳氢形成的化合物,B错误;
C.C60属于分子晶体,晶体中不仅存在范德华力,还存在碳与碳之间的共价键,C错误;
D.根据晶胞的结构可知,以晶胞中顶点上的C60分子为研究对象,与它距离最近等距离的C60分子分布在立方体的面心上,每个C60分子被8个立方体共用,有12个面与之相连,所以每个C60分子周围与它距离最近等距离的C60分子有12个,D正确;
答案选D。
3.A
【详解】A.以晶胞顶角上的为例,与之距离最近且相等的分子在该点所在面的面心上,所以这样的分子共有个,A错误;
B.金刚石属于共价晶体,属于分子晶体,因此金刚石的熔点比晶体的高,B正确;
C.金刚石、、管状碳和洋葱状碳,都是由碳元素形成的不同单质,互为同素异形体,C正确;
D.金刚石中每个碳原子参与形成4个共价键,但每个共价键为2个碳原子所共有,所以12g金刚石中含有共价键的数目为,D正确;
故选:A。
4.D
【详解】根据金刚石的晶体结构特点可知,最小环上碳原子数为6个,每个碳原子与相连的4个碳原子形成正四面体结构,因而任意两个键的夹角为109°28′,故选:D。
5.A
【详解】A.如图所示,每个水分子可以与另外四个水分子之间形成氢键,从而形成四面体结构,A正确;
B.冰晶体属于分子晶体,B错误;
C.冰晶体中的水分子主要是靠氢键结合在一起,氢键不是化学键,而是一种分子间作用力,C错误;
D.冰晶体中形成的氢键具有方向性和饱和性,故水分子间由氢键连接后,分子间空隙变大,而冰融化成水后,体积减小,水分子之间空隙减小,D错误;
故选A。
6.C
【详解】A.由二氧化硅晶体结构图可知,每个硅原子连有4个氧原子,A正确;
B.每个硅原子连有4个氧原子,每个氧原子连有2个硅原子,硅原子、氧原子个数比为,B正确;
C.晶体中最小环上含有6个硅原子和6个氧原子,最小环上的原子总数为12,C错误;
D.晶体中每个硅原子形成四对共用电子对,每个氧原子形成两对共用电子对,二者都满足最外层8电子结构,D正确;
故答案选C。
7.A
【详解】A.构成晶体的基本微粒是分子,因此晶体是分子晶体,不可能具有很高的熔、沸点,A错误;
B.由于是非极性分子,其可能易溶于四氯化碳中,B正确;
C.每个的晶胞中含有的分子数为,因此含有的碳原子数为,C正确;
D.如果以晶胞中一个顶点的分子为研究对象,则共用这个顶点的面的面心的分子与其距离最近且相等,有个,D正确;
故选A。
8.B
【详解】A.碳化硅和硅都是共价晶体,共价晶体的熔点取决于共价键的强弱,碳硅键的键长小于硅硅键、键能大于硅硅键,则碳化硅的熔点高于硅,A正确;
B.由对角线规则可知,处于对角线上的硼与硅的单质性质相似,B错误;
C.和互为同位素,核外电子数和核外电子排布相同,则价电子数相同,C正确;
D.由晶胞结构可知,晶胞中银原子的个数为,D正确;
故选B。
9.B
【详解】A.硬度高、熔点高一般不会是分子晶体,描述错误,A不符题意;
B.硬度高、熔点高正好适合在高温环境下切割金属的道具材料,描述正确,B符合题意;
C.根据晶胞结构,顶点和体心有Al原子,故晶胞含有Al原子个数为,描述错误,C不符题意;
D.由晶胞体心的Al原子周围的N原子个数可知,Al原子的配位数应是4,描述错误,D不符题意;
综上,本题选B。
10.A
【详解】A.冰、干冰都属于分子晶体,A项错误;
B.在冰晶体中,每个水分子周围只有四个紧邻的水分子,由于水分子之间的主要作用力为氢键,而氢键具有饱和性和方向性,所以氢键的存在使四面体中心的水分子与四面体顶角方向的4个紧邻水分子相互作用,这一排列使冰晶体中水分子的空间利用率不高,留有相当大的空隙,使得冰的密度比液态水的小,故“水立方”变为“冰立方”,密度减小,B项正确;
C.氟利昂排放到大气中会破坏O3层,干冰不能破坏O3层,氟利昂的温室效应是二氧化碳的3400~15000倍,故用干冰制冷比用氟利昂制冷环保,C项正确;
D.由干冰的晶胞可知,1个晶胞中含CO2的个数为=4,则1个干冰晶胞的质量约为=,D项正确;
答案选A。
11.D
【详解】A.甲烷晶体为分子晶体,晶胞中的每个球都代表1个CH4分子,A不正确;
B.晶体中1个CH4分子周围有紧邻的CH4分子数为,B不正确;
C.甲烷晶体为分子晶体,熔化时只需克服分子间的作用力,不需要破坏分子内的共价键,C不正确;
D.1个CH4晶胞中含有CH4分子的数目为,D正确;
故选D。
12.C
【详解】A.由图可知,碳化硅中只含有碳硅极性键,故A正确;
B.碳化硅和金刚石都是原子晶体,碳化硅中碳硅键的键能小于金刚石中碳碳键、键长大于金刚石中碳碳键,共价键弱于金刚石中碳碳键,所以碳化硅的熔点比金刚石低,故B正确;
C.由图可知,碳化硅中,1个碳原子与4故硅原子形成碳硅极性键,所以1mol碳化硅中含4mol碳硅键,故C错误;
D.由碳化硅也叫金刚砂,硬度大,具有耐热性可知,碳化硅为熔沸点高、硬度大的原子晶体,故D正确;
故选C。
13.D
【详解】A.由题图可看出,1个H3BO3分子周围共有6个氢键,1个氢键为2个H3BO3分子所共有,因此1 mol H3BO3的晶体中只含有3 mol氢键,选项A错误;
B.硼原子有3个价电子,与相邻的氧原子形成共价单键,硼原子的最外层只有6个电子,选项B错误;
C.H3BO3是以分子形成晶体,为分子晶体,选项C错误;
D.分子的稳定性与化学键有关,与氢键无关,选项D正确;
答案选D。
14.A
【详解】A.根据图知,该晶体中每个Si原子连接4个O原子、每个O原子连接2个Si原子,则Si、O原子个数之比为2∶4 =1∶2,每个Si原子含有4个硅氧键,则硅原子的物质的量比氧原子的物质的量比硅氧键=1∶2∶4,A正确;
B.CO2晶体是由分子构成的,SiO2晶体是由原子构成的,则前者为分子晶体、后者为共价晶体,晶体类型不同,B错误;
C.该晶体中每个Si原子形成4个共价键,每个O原子形成2个共价键且每个O原子还含有2个孤电子对,则Si、O原子的价层电子对数都是4,则Si、O原子都采用sp3杂化,C错误;
D.由二氧化硅晶体结构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为12,D错误;
故选A。
15.C
【详解】A.由图可知,每个水分子与4个水分子形成4个氢键,每个水分子形成的氢键数目为4×=2个,则18 g冰中含氢键数目为×2×NA mol—1=2NA,故A错误;
B.由图可知,晶体硅中每个硅原子与4个硅原子形成4个硅硅键,每个硅原子形成的硅硅键数目为4×=2个,则28 g冰中含氢键数目为×2×NA mol—1=2NA,故B错误;
C.由晶胞结构可知,晶胞中含有二氧化碳的个数为8×+6×=4,则88 g干冰中含有的晶胞结构单元为××NA mol—1=0.5NA,故C正确;
D.由图可知,石墨烯中每个碳原子与3个碳原子形成碳碳键,每个碳原子形成的碳碳键数目为3×=1.5个,则12 g石墨烯中含碳碳键数目为×1.5×NA mol—1=1.5NA,故D错误;
故选C。
16.(1)2
(2)AB
(3) H2O+H2OH3O++OH- 双氧水分子之间存在更强烈的氢键作用
(4)20
【详解】(1)冰中每个水分子被4个水分子包围形成变形四面体,1 mol冰中含有氢键的物质的量为,故答案:2。
(2)A.该物质也能与金属钠反应产生氢气,1 L水蒸气冷凝后与足量金属钠反应,若混有该物质,由于(H2O)2也能生成氢气,且一分子(H2O)2生成2分子氢气,所以产生氢气体积多,故A正确;
B.该物质也能被浓硫酸吸收,若1 L水蒸气通过浓硫酸后,由于相对H2O而言,(H2O)2的相对分子质量大,所以分子数目相同时,浓硫酸增重的质量大,说明存在该物质,故B正确;C.该物质的pH也等于7,无论该物质是否存在,pH都等于7,故C错误;
D.该物质的分子中氢氧原子个数比仍为2∶1,无论是否存在,氢氧原子个数比不变,故D错误;故答案:AB。
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为H2O+H2OH3O++OH-,已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是双氧水的相对分子质量比水的相对分子质量稍大,但题中强调双氧水的沸点明显高于水,因此可判断双氧水分子之间存在着更为强烈的氢键作用。故答案:H2O+H2OH3O++OH-;双氧水分子之间存在更强烈的氢键作用。
(4)1 mol冰吸收的总能量为51 kJ,克服范德华力吸收的能量为11 kJ,故克服氢键吸收的总能量为40 kJ,而1 mol 冰中含有2 mol氢键,故冰晶体中氢键的能量是20 kJ·mol-1,故答案:20。
17. 4 4 b 1:3 或
【分析】结合晶胞示意图、确定原子的相对位置关系、进行计算;用均摊法计算晶胞密度、硅酸盐的化学式;
【详解】I(1)硼原子位于晶胞内,氮原子位于顶点和面心,则在一个晶胞中,含有硼原子4个,个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离为N与B之间,最短距离为晶胞体对角线的,则是cm,DE原子即晶体中两个距离最近的B原子,二者之间的距离为晶胞的棱长的,即是cm。
(3)已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则由E原子的位置知,E的原子分数坐标为。
(4)由晶胞示意图知,氮化硼晶胞的俯视投影图是b。
(5)1个氮化硼晶胞内含有的氮原子和硼原子均为4个,则晶胞的质量为,氮化硼晶胞参数为γcm,则晶胞体积为,晶胞密度即晶体的密度为。
II(6)观察图可知,每个四面体通过两个氧原子与其他四面体连接形成链状结构,所以每个四面体中的硅原子数是1,氧原子数是,即Si与O的原子数之比为1:3;化学式为或。
18.(1) ABD C
(2) 5
(3)
(4)(或)
【解析】(1)
中键数为3,中心原子孤电子对数为,价层电子对数为4,杂化轨道类型为,立体结构为三角锥形;中键数为4,中心原子孤电子对数为,价层电子对数为4,杂化轨道类型为,立体结构为正四面体形;和中均含极性共价键和配位键,故两种阳离子的相同之处为A、B、D,不同之处为C。
(2)
由图中的结构可知中的键数为5;中的5个原子参与形成大键,每个原子中参与形成大键的电子数为1(孤电子对不参与),故参与形成大键的电子数为,中大键应表示为。
(3)
当H与N、O、F相连时,可以与相邻分子的N、O、F相连,所以还可以形成的氢键有:和;
(4)
晶体的密度为,晶胞的体积为,晶胞的质量为,则,。
19.(1)
(2) 这两种氢化物均为极性分子 分子之间能形成氢键
(3)
(4) 共价晶体 键的键长小于键,键能大于键
【分析】由题意知,X为周期表前四周期中电负性最小的元素,则X为K元素;Z的原子序数为28,则Z为Ni元素;E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能I1(E)【详解】(1)、具有相同的原子数和价电子数,电子式相似,故的电子式为,基态Ni原子的核外电子排布式为。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有这两种氢化物均为极性分子、分子之间能形成氢键。
(3)由化合物甲的晶胞可知,K原子位于顶点和面心,则K原子数为4,O2原子团位于棱心和体心,则O2原子团数为4,即K原子和O2原子团的个数之比为1:1,则甲的化学式为。
(4)①由化合物乙的晶胞可知,乙的化学式为其硬度大,属于共价晶体,其硬度超过金刚石的原因是键的键长小于键,键能大于键。
②晶体中C、N两种元素原子的杂化方式均为杂化。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于共价晶体、分子晶体的叙述中,正确的是
A.金刚石为共价键三维骨架结构,晶体中的最小环上有6个碳原子
B.分子晶体中一定存在共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
2.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是
A.C60摩尔质量是720
B.C60与苯互为同素异形体
C.C60晶体中仅存在范德华力
D.每个C60分子周围与它距离最近且等距离的C60分子有12个
3.20世纪,科学家发现并证明碳有新的单质分子(晶体的晶胞结构如图所示)存在,后来科学家又发现了管状碳分子和洋葱状碳分子。下列说法错误的是
A.晶体中每个分子周围与它距离最近且相等的分子有80个
B.熔点比较:晶体<金刚石
C.金刚石、、管状碳和洋葱状碳互为同素异形体
D.12g金刚石中含有共价键的数目为
4.钻石的魅力在于它经过大自然千百万年的孕育,再经打磨,能放射出闪烁的光芒,钻石就是经过打磨的金刚石。已知金刚石的结构如图所示,由此可看出在含有共价键形成的碳原子环中,其中形成最小的环所需碳原子数及任意两个键间的夹角是
A.6个 120° B.5个 108° C.4个 109°28′ D.6个 109°28′
5.图为冰晶体的结构模型,大球代表O,小球代表H。下列有关说法正确的是
A.冰晶体中每个水分子与另外四个水分子形成四面体结构
B.冰晶体具有空间网状结构,是共价晶体
C.水分子间通过键形成冰晶体
D.冰融化后,水分子之间的空隙增大
6.二氧化硅晶体是立体网状结构,其结构如图所示。
下列关于二氧化硅晶体的说法不正确的是
A.晶体中每个硅原子与4个氧原子相连
B.晶体中硅、氧原子个数比为
C.晶体中最小环上的原子数为8
D.晶体中硅、氧原子最外层都满足8电子结构
7. 分子和晶胞示意图如图所示。下列关于晶体的说法不正确的是
A.晶体可能具有很高的熔、沸点
B.晶体可能易溶于四氯化碳中
C.晶体的一个晶胞中含有的碳原子数为240
D.晶体中每个分子与12个C分子紧邻
8.下列说法错误的是
A.SiC和Si的结构相似,都属于共价晶体,熔点
B.B与Si的单质性质差异很大
C.和的价电子数相同
D.如图所示银的晶胞中含有4个银原子
9.Al2O3在一定条件下可转化为硬度、熔点都很高的氮化铝晶体,氮化铝的晶胞如图所示。下列说法正确的是
A.氮化铝属于分子晶体
B.氮化铝可用于制造切割金属的刀具
C.1个氮化铝晶胞中含有9个Al原子
D.氮化铝晶体中Al的配位数为2
10.北京2022年冬奥会采用CO2临界直冷技术,实现“水立方”变为“冰立方”。干冰晶胞如图所示。下列说法错误的是
A.冰、干冰晶体类型不同 B.“水立方”变为“冰立方”,密度减小
C.用干冰制冷比用氟利昂制冷环保 D.1个干冰晶胞的质量约为
11.甲烷晶体的晶胞结构如图所示,下列说法正确的是
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有8个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有4个CH4分子
12.“天问一号”采用了我国自主研制的高性能碳化硅材料。碳化硅也叫金刚砂,硬度大,具有耐热性、耐氧化性和耐腐蚀性等性能,结构如图,下列叙述不正确的是
A.碳化硅中只含有极性键 B.碳化硅的熔点比金刚石低
C.碳化硅中含键 D.碳化硅为原子晶体
13.正硼酸()是一种片层状结构的白色晶体,层内分子之间通过氢键相连(层状结构如图所示,图中“虚线”表示氢键)。下列有关说法正确的是
A.含的晶体中有6mol氢键
B.分子中硼原子、氧原子最外层均为的稳定结构
C.正硼酸晶体属于共价晶体
D.分子的稳定性与氢键无关
14.二氧化硅晶体是空间立体网状结构,如图所示,下列说法中,正确的是
A.硅原子的物质的量比氧原子的物质的量比硅氧键=1:2:4
B.CO2和SiO2是等电子体,晶体类型相同
C.晶体中Si原子杂化方式为sp3,O原子杂化方式为sp
D.晶体中最小环上的原子数为6
15.以NA表示阿伏加德罗常数的值,下列说法正确的是
A.18 g冰(图1)中含氢键数目为4NA
B.28 g晶体硅(图2)中含有Si-Si键数目为4NA
C.88 g干冰(图3)中含有0.5NA个晶胞结构单元
D.12 g石墨烯中含C-C键数目为3NA
二、填空题
16.水分子间存在一种“氢键”的作用(作用力介于范德华力与化学键之间),彼此结合而形成(H2O)2。在冰中每个水分子被4个水分子包围形成变形四面体,通过“氢键”相互连接成庞大的分子晶体。
(1)1 mol冰中有_______mol“氢键”。
(2)水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是_______。
A.标准状况下把1 L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B.标准状况下把1 L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C.该水蒸气冷凝后,测水的pH
D.该水蒸气冷凝后,测氢氧原子个数比
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为_______。已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是_______。
(4)在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是_______kJ·mol-1。
17.I.氮化硼晶体的结构与金刚石相似,其晶胞如图所示。
(1)在一个晶胞中,含有硼原子_______个,氮原子_______个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离是___cm,DE原子之间的距离是____cm。
(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则E原子为________。
(4)氮化硼晶胞的俯视投影图是_______。
(5)设NA为阿伏加德罗常数的值,则氮化硼晶体的密度为_______g/cm3(用代数式表示)。
II.在硅酸盐中,SiO四面体(如图为俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构型式。
(6)图甲为一种无限长单链结构的多硅酸根,其中Si与O的原子数之比为_______,化学式为_______。
三、结构与性质
18.我国科学家最近成功合成了世界上首个五氮阴离子盐(用R代表)。回答下列问题:
(1)经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。从结构角度分析,R中两种阳离子的相同之处为_______,不同之处为_______(填标号)。
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数 C.立体结构 D.共价键类型
(2)中阴离子中的σ键总数为_______个。分子中的大键可用符号表示,其中m代表参与形成大键的原子数,n代表参与形成大键的电子数(如苯分子中的大键可表示为),则中的大键应表示为_______。
(3)图中虚线代表氢键,其表示式为、_______、_______。
(4)R的晶体密度为,其立方晶胞参数为anm,晶胞中含有y个单元,该单元的相对质量为M,则y的计算表达式为_______。
19.有E、Q、T、X、Z五种前四周期元素,原子序数。E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能,其中基态Q原子的2p轨道处于半充满状态,且与具有相同的原子数和价电子数。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出的电子式:_______,基态Z原子的核外电子排布式为_______。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有_______、_______。
(3)化合物甲由T、X两元素组成,其晶胞如下图所示,则甲的化学式为_______。
(4)化合物乙的晶胞如下图所示,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为_______,其硬度超过金刚石的原因是_______。
②乙的晶体中E、Q两种元素原子的杂化方式均为_______。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】A.金刚石属于共价晶体,其中的碳采取sp3杂化轨道与周围的4个碳原子形成正四面体结构,以共价键形成空间网状结构,晶体中最小环上有6个碳原子,A项正确;
B.分子晶体中不一定存在共价键,如稀有气体形成的晶体为分子晶体,稀有气体是单原子分子,原子间没有共价键,B项错误;
C.HF分子间存在氢键,HI分子间不存在氢键,故HI的沸点低于HF,C项错误;
D.SiO2属于共价晶体,在SiO2晶体中1个Si原子和4个O原子形成4个共价键,D项错误;
答案选A。
2.D
【详解】A.C60的摩尔质量为720g/mol,A错误;
B.由同种元素形成的不同种单质互为同素异形体,而苯是碳氢形成的化合物,B错误;
C.C60属于分子晶体,晶体中不仅存在范德华力,还存在碳与碳之间的共价键,C错误;
D.根据晶胞的结构可知,以晶胞中顶点上的C60分子为研究对象,与它距离最近等距离的C60分子分布在立方体的面心上,每个C60分子被8个立方体共用,有12个面与之相连,所以每个C60分子周围与它距离最近等距离的C60分子有12个,D正确;
答案选D。
3.A
【详解】A.以晶胞顶角上的为例,与之距离最近且相等的分子在该点所在面的面心上,所以这样的分子共有个,A错误;
B.金刚石属于共价晶体,属于分子晶体,因此金刚石的熔点比晶体的高,B正确;
C.金刚石、、管状碳和洋葱状碳,都是由碳元素形成的不同单质,互为同素异形体,C正确;
D.金刚石中每个碳原子参与形成4个共价键,但每个共价键为2个碳原子所共有,所以12g金刚石中含有共价键的数目为,D正确;
故选:A。
4.D
【详解】根据金刚石的晶体结构特点可知,最小环上碳原子数为6个,每个碳原子与相连的4个碳原子形成正四面体结构,因而任意两个键的夹角为109°28′,故选:D。
5.A
【详解】A.如图所示,每个水分子可以与另外四个水分子之间形成氢键,从而形成四面体结构,A正确;
B.冰晶体属于分子晶体,B错误;
C.冰晶体中的水分子主要是靠氢键结合在一起,氢键不是化学键,而是一种分子间作用力,C错误;
D.冰晶体中形成的氢键具有方向性和饱和性,故水分子间由氢键连接后,分子间空隙变大,而冰融化成水后,体积减小,水分子之间空隙减小,D错误;
故选A。
6.C
【详解】A.由二氧化硅晶体结构图可知,每个硅原子连有4个氧原子,A正确;
B.每个硅原子连有4个氧原子,每个氧原子连有2个硅原子,硅原子、氧原子个数比为,B正确;
C.晶体中最小环上含有6个硅原子和6个氧原子,最小环上的原子总数为12,C错误;
D.晶体中每个硅原子形成四对共用电子对,每个氧原子形成两对共用电子对,二者都满足最外层8电子结构,D正确;
故答案选C。
7.A
【详解】A.构成晶体的基本微粒是分子,因此晶体是分子晶体,不可能具有很高的熔、沸点,A错误;
B.由于是非极性分子,其可能易溶于四氯化碳中,B正确;
C.每个的晶胞中含有的分子数为,因此含有的碳原子数为,C正确;
D.如果以晶胞中一个顶点的分子为研究对象,则共用这个顶点的面的面心的分子与其距离最近且相等,有个,D正确;
故选A。
8.B
【详解】A.碳化硅和硅都是共价晶体,共价晶体的熔点取决于共价键的强弱,碳硅键的键长小于硅硅键、键能大于硅硅键,则碳化硅的熔点高于硅,A正确;
B.由对角线规则可知,处于对角线上的硼与硅的单质性质相似,B错误;
C.和互为同位素,核外电子数和核外电子排布相同,则价电子数相同,C正确;
D.由晶胞结构可知,晶胞中银原子的个数为,D正确;
故选B。
9.B
【详解】A.硬度高、熔点高一般不会是分子晶体,描述错误,A不符题意;
B.硬度高、熔点高正好适合在高温环境下切割金属的道具材料,描述正确,B符合题意;
C.根据晶胞结构,顶点和体心有Al原子,故晶胞含有Al原子个数为,描述错误,C不符题意;
D.由晶胞体心的Al原子周围的N原子个数可知,Al原子的配位数应是4,描述错误,D不符题意;
综上,本题选B。
10.A
【详解】A.冰、干冰都属于分子晶体,A项错误;
B.在冰晶体中,每个水分子周围只有四个紧邻的水分子,由于水分子之间的主要作用力为氢键,而氢键具有饱和性和方向性,所以氢键的存在使四面体中心的水分子与四面体顶角方向的4个紧邻水分子相互作用,这一排列使冰晶体中水分子的空间利用率不高,留有相当大的空隙,使得冰的密度比液态水的小,故“水立方”变为“冰立方”,密度减小,B项正确;
C.氟利昂排放到大气中会破坏O3层,干冰不能破坏O3层,氟利昂的温室效应是二氧化碳的3400~15000倍,故用干冰制冷比用氟利昂制冷环保,C项正确;
D.由干冰的晶胞可知,1个晶胞中含CO2的个数为=4,则1个干冰晶胞的质量约为=,D项正确;
答案选A。
11.D
【详解】A.甲烷晶体为分子晶体,晶胞中的每个球都代表1个CH4分子,A不正确;
B.晶体中1个CH4分子周围有紧邻的CH4分子数为,B不正确;
C.甲烷晶体为分子晶体,熔化时只需克服分子间的作用力,不需要破坏分子内的共价键,C不正确;
D.1个CH4晶胞中含有CH4分子的数目为,D正确;
故选D。
12.C
【详解】A.由图可知,碳化硅中只含有碳硅极性键,故A正确;
B.碳化硅和金刚石都是原子晶体,碳化硅中碳硅键的键能小于金刚石中碳碳键、键长大于金刚石中碳碳键,共价键弱于金刚石中碳碳键,所以碳化硅的熔点比金刚石低,故B正确;
C.由图可知,碳化硅中,1个碳原子与4故硅原子形成碳硅极性键,所以1mol碳化硅中含4mol碳硅键,故C错误;
D.由碳化硅也叫金刚砂,硬度大,具有耐热性可知,碳化硅为熔沸点高、硬度大的原子晶体,故D正确;
故选C。
13.D
【详解】A.由题图可看出,1个H3BO3分子周围共有6个氢键,1个氢键为2个H3BO3分子所共有,因此1 mol H3BO3的晶体中只含有3 mol氢键,选项A错误;
B.硼原子有3个价电子,与相邻的氧原子形成共价单键,硼原子的最外层只有6个电子,选项B错误;
C.H3BO3是以分子形成晶体,为分子晶体,选项C错误;
D.分子的稳定性与化学键有关,与氢键无关,选项D正确;
答案选D。
14.A
【详解】A.根据图知,该晶体中每个Si原子连接4个O原子、每个O原子连接2个Si原子,则Si、O原子个数之比为2∶4 =1∶2,每个Si原子含有4个硅氧键,则硅原子的物质的量比氧原子的物质的量比硅氧键=1∶2∶4,A正确;
B.CO2晶体是由分子构成的,SiO2晶体是由原子构成的,则前者为分子晶体、后者为共价晶体,晶体类型不同,B错误;
C.该晶体中每个Si原子形成4个共价键,每个O原子形成2个共价键且每个O原子还含有2个孤电子对,则Si、O原子的价层电子对数都是4,则Si、O原子都采用sp3杂化,C错误;
D.由二氧化硅晶体结构图可知,晶体中最小环上含有6个硅原子和6个氧原子,所以最小环上的原子数为12,D错误;
故选A。
15.C
【详解】A.由图可知,每个水分子与4个水分子形成4个氢键,每个水分子形成的氢键数目为4×=2个,则18 g冰中含氢键数目为×2×NA mol—1=2NA,故A错误;
B.由图可知,晶体硅中每个硅原子与4个硅原子形成4个硅硅键,每个硅原子形成的硅硅键数目为4×=2个,则28 g冰中含氢键数目为×2×NA mol—1=2NA,故B错误;
C.由晶胞结构可知,晶胞中含有二氧化碳的个数为8×+6×=4,则88 g干冰中含有的晶胞结构单元为××NA mol—1=0.5NA,故C正确;
D.由图可知,石墨烯中每个碳原子与3个碳原子形成碳碳键,每个碳原子形成的碳碳键数目为3×=1.5个,则12 g石墨烯中含碳碳键数目为×1.5×NA mol—1=1.5NA,故D错误;
故选C。
16.(1)2
(2)AB
(3) H2O+H2OH3O++OH- 双氧水分子之间存在更强烈的氢键作用
(4)20
【详解】(1)冰中每个水分子被4个水分子包围形成变形四面体,1 mol冰中含有氢键的物质的量为,故答案:2。
(2)A.该物质也能与金属钠反应产生氢气,1 L水蒸气冷凝后与足量金属钠反应,若混有该物质,由于(H2O)2也能生成氢气,且一分子(H2O)2生成2分子氢气,所以产生氢气体积多,故A正确;
B.该物质也能被浓硫酸吸收,若1 L水蒸气通过浓硫酸后,由于相对H2O而言,(H2O)2的相对分子质量大,所以分子数目相同时,浓硫酸增重的质量大,说明存在该物质,故B正确;C.该物质的pH也等于7,无论该物质是否存在,pH都等于7,故C错误;
D.该物质的分子中氢氧原子个数比仍为2∶1,无论是否存在,氢氧原子个数比不变,故D错误;故答案:AB。
(3)水分子可电离生成两种含有相同电子数的粒子,其电离方程式为H2O+H2OH3O++OH-,已知在相同条件下双氧水的沸点明显高于水的沸点,其可能原因是双氧水的相对分子质量比水的相对分子质量稍大,但题中强调双氧水的沸点明显高于水,因此可判断双氧水分子之间存在着更为强烈的氢键作用。故答案:H2O+H2OH3O++OH-;双氧水分子之间存在更强烈的氢键作用。
(4)1 mol冰吸收的总能量为51 kJ,克服范德华力吸收的能量为11 kJ,故克服氢键吸收的总能量为40 kJ,而1 mol 冰中含有2 mol氢键,故冰晶体中氢键的能量是20 kJ·mol-1,故答案:20。
17. 4 4 b 1:3 或
【分析】结合晶胞示意图、确定原子的相对位置关系、进行计算;用均摊法计算晶胞密度、硅酸盐的化学式;
【详解】I(1)硼原子位于晶胞内,氮原子位于顶点和面心,则在一个晶胞中,含有硼原子4个,个。
(2)已知氮化硼晶胞参数为γcm,则在此晶胞中,任意两个原子之间的最短距离为N与B之间,最短距离为晶胞体对角线的,则是cm,DE原子即晶体中两个距离最近的B原子,二者之间的距离为晶胞的棱长的,即是cm。
(3)已知三个原子分数坐标参数:A为(0,0,0)、B为(0,1,1)、C为(1,1,0);则由E原子的位置知,E的原子分数坐标为。
(4)由晶胞示意图知,氮化硼晶胞的俯视投影图是b。
(5)1个氮化硼晶胞内含有的氮原子和硼原子均为4个,则晶胞的质量为,氮化硼晶胞参数为γcm,则晶胞体积为,晶胞密度即晶体的密度为。
II(6)观察图可知,每个四面体通过两个氧原子与其他四面体连接形成链状结构,所以每个四面体中的硅原子数是1,氧原子数是,即Si与O的原子数之比为1:3;化学式为或。
18.(1) ABD C
(2) 5
(3)
(4)(或)
【解析】(1)
中键数为3,中心原子孤电子对数为,价层电子对数为4,杂化轨道类型为,立体结构为三角锥形;中键数为4,中心原子孤电子对数为,价层电子对数为4,杂化轨道类型为,立体结构为正四面体形;和中均含极性共价键和配位键,故两种阳离子的相同之处为A、B、D,不同之处为C。
(2)
由图中的结构可知中的键数为5;中的5个原子参与形成大键,每个原子中参与形成大键的电子数为1(孤电子对不参与),故参与形成大键的电子数为,中大键应表示为。
(3)
当H与N、O、F相连时,可以与相邻分子的N、O、F相连,所以还可以形成的氢键有:和;
(4)
晶体的密度为,晶胞的体积为,晶胞的质量为,则,。
19.(1)
(2) 这两种氢化物均为极性分子 分子之间能形成氢键
(3)
(4) 共价晶体 键的键长小于键,键能大于键
【分析】由题意知,X为周期表前四周期中电负性最小的元素,则X为K元素;Z的原子序数为28,则Z为Ni元素;E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能I1(E)
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有这两种氢化物均为极性分子、分子之间能形成氢键。
(3)由化合物甲的晶胞可知,K原子位于顶点和面心,则K原子数为4,O2原子团位于棱心和体心,则O2原子团数为4,即K原子和O2原子团的个数之比为1:1,则甲的化学式为。
(4)①由化合物乙的晶胞可知,乙的化学式为其硬度大,属于共价晶体,其硬度超过金刚石的原因是键的键长小于键,键能大于键。
②晶体中C、N两种元素原子的杂化方式均为杂化。
答案第1页,共2页
答案第1页,共2页
