第三章第四节配合物与超分子同步练习 (含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章第四节配合物与超分子同步练习 (含解析)2022-2023学年下学期高二化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 809.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-21 20:13:28 | ||
图片预览




文档简介
第三章第四节配合物与超分子同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知:铜离子的配位数通常为4,和均为深蓝色。某化学小组设计如下实验制备铜的配合物。
下列说法不正确的是
A.b中得到配合物,其配体为
B.硫酸铜溶液呈蓝色的原因是的颜色所致
C.由实验可知,的配位能力比弱
D.加热c中溶液有可能得到蓝色浑浊液
2.配合物中,中心离子的化合价是
A.+1 B.+2 C.+3 D.无法确定
3.下列物质中,不属于配合物的是
A. B.
C. D.
4.与甲基咪唑( )反应可以得到,其结构如图所示,下列说法不正确的是
A.甲基咪唑中碳原子的杂化方式为
B.甲基咪唑易溶于水的主要原因是能与水形成氢键
C.1个离子中含有42个键
D.离子中的配位数为6
5.已知胆矾的结构示意图如图。下列说法正确的是
A.胆矾在不同温度下分步失去结晶水 B.的配位数为5
C.的价层电子排布式为 D.图示结构中存在配位键和氢键两种化学键
6.尿素是我国氮肥的主导品种,但土壤中广泛存在的脲酶能快速催化尿素水解成,使肥效大大降低。Schiff碱的金属配合物是一种高效绿色的配合物型脲酶抑制剂,引起了国内外学者的广泛关注。以下是一种Schiff碱的铜配合物的合成过程,下列说法正确的是
A.1mol该配合物含键为24mol
B.该配合物中碳原子的杂化方式为、
C.该配合物中心离子为,配位数为4
D.向该配合物中滴加溶液,溶液变红
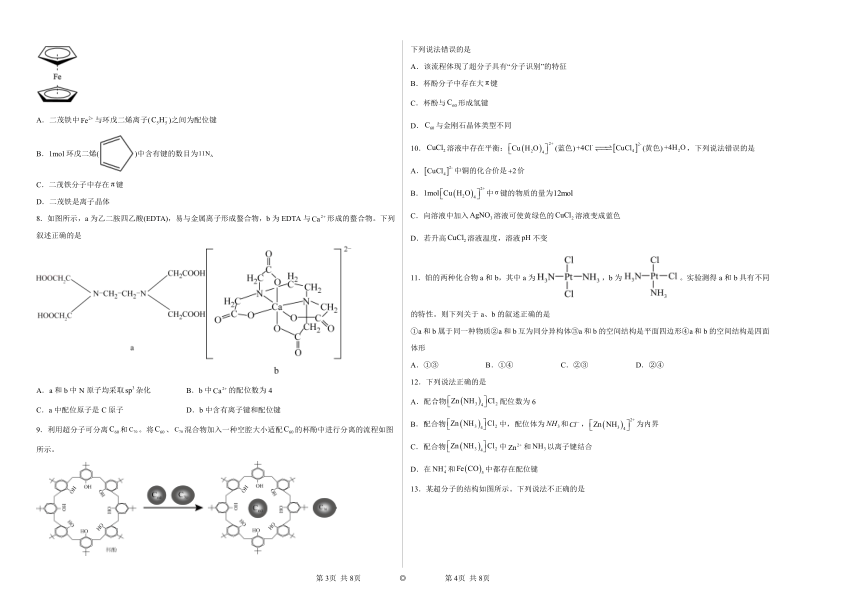
7.二茂铁分子是一种金属有机配合物,二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,它是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
A.二茂铁中与环戊二烯离子()之间为配位键
B.1mol环戊二烯()中含有键的数目为
C.二茂铁分子中存在键
D.二茂铁是离子晶体
8.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有离子键和配位键
9.利用超分子可分离和。将、混合物加入一种空腔大小适配的杯酚中进行分离的流程如图所示。
下列说法错误的是
A.该流程体现了超分子具有“分子识别”的特征
B.杯酚分子中存在大键
C.杯酚与形成氢键
D.与金刚石晶体类型不同
10.溶液中存在平衡:(蓝色)(黄色),下列说法错误的是
A.中铜的化合价是价
B.中键的物质的量为
C.向溶液中加入溶液可使黄绿色的溶液变成蓝色
D.若升高溶液温度,溶液不变
11.铂的两种化合物a和b,其中a为,b为。实验测得a和b具有不同的特性。则下列关于a、b的叙述正确的是
①a和b属于同一种物质②a和b互为同分异构体③a和b的空间结构是平面四边形④a和b的空间结构是四面体形
A.①③ B.①④ C.②③ D.②④
12.下列说法正确的是
A.配合物配位数为6
B.配合物中,配位体为和,为内界
C.配合物中和以离子键结合
D.在和中都存在配位键
13.某超分子的结构如图所示。下列说法不正确的是
A.此超分子中含有酰胺基
B.的分子式为C14H10,其一氯代物有3种
C.此超分子属于高分子
D.此超分子完全燃烧后会生成CO2,干冰晶胞中CO2的配位数为12
14.用相同浓度的和溶液进行实验:
下列说法不正确的是
A.相同浓度的和溶液中,的浓度不同
B.提供空轨道,提供孤电子对,两者以配位键结合成
C.溶液2不显红色,说明与的结合力强于与的结合力
D.由对比实验可知,用溶液检验溶液中的比用KSCN溶液更好
15.配合物可用于离子检验,下列说法不正确的是
A.此配合物中存在离子键、配位键、极性键
B.配离子为,中心离子为,配位原子为N
C.1mol配合物中含有12molσ键
D.该配合物为离子化合物,易电离,1mol配合物电离得到阴阳离子共4mol
二、填空题
16.铜及其化合物在工农业生产中有广泛的应用。
Ⅰ.金属铜的原子堆积模型如图-1所示,
(1)该晶胞中每个Cu原子周围最近距离的Cu原子数目为_______。
Ⅱ.能与、、、等形成配位数为4的配合物。
(2)向溶液中加入过量NaOH溶液可生成。中除了配位键外,还存在的化学键类型有_______(填字母)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(3)将CuO投入、的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为溶液。
①CuO被浸取的离子方程式为_______。
②结构中,若用两个分子代替两个分子,可以得到两种不同结构的化合物,由此推测的空间构型为_______。
(4)可以与乙二胺()形成配离子,如题图-2所示:
③H、O、N三种元素的电负性从大到小的顺序为_______。
④乙二胺分子中N原子成键时采取的杂化类型是_______。乙二胺和三甲胺均属于胺,但乙二胺比三甲胺的沸点高很多,原因是_______。
Ⅲ.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,
(5)下列物质中,属于顺磁性物质的是_______(填标号)。
A. B. C.
17.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有_______种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为_______,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为_______(填“发射”或“吸收”)光谱。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥模型解释NH3的键角比PH3的键角大的原因:_______。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供_______,在BH3·NH3中B原子的杂化方式为_______。
三、结构与性质
18.晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钴、钙等多种化学物质。请回答下列问题:
(1)科学家常利用_______区分晶体硼和无定形硼,二者之间互为_______。第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第_______位,其基态能量最低的能级电子云轮廓图为_______。
(2)硅酸根有多种结构形式,一种无限长链状结构如图所示,其化学式为_______,Si原子的杂化类型为_______。
(3)N元素位于元素周期表_______区;该元素形成的简单氢化物的沸点比的沸点高,其原因为_______。
(4)的几何构型为正八面体形,Co在中心。
①中,1个Co提供_______个空轨道。该配位离子的作用力为_______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将中的两个分子换成两个可以形成_______种不同的结构形式。
19.材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的价层电子排布图为___________;基态As原子核外电子占据的能量最高的能级的电子云形状为___________。
(2)Si、P、S、Cl的第一电离能由大到小的顺序为___________。
(3)M与Ga位于同周期,的一种配合物组成为。
①下列有关、的说法正确的是___________(填字母)。
a.分子空间结构相同
b.中心原子杂化轨道类型相同
c.键角大小相同
②1mol含___________mol键。
③配合物T与组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量溶液可生成2mol。则T的化学式为___________。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,该晶胞中B原子与相邻的P原子构成___________(填“立方体”“正四面体”或“正八面体”)。
已知该晶体的密度为,设是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________pm(列式即可)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.和均为深蓝色,b加入过量的氢氧化钠得到配合物,由化学式可知,其配体为,A正确;
B.水分子中氧原子可以提供孤电子对,能和铜离子形成配离子,硫酸铜溶液呈蓝色的原因是的颜色所致,B正确;
C.由实验ac可知,的配位能力比强,C错误;
D.加热c中溶液会促进一水合氨向电离的方向进行,使得一水合氨浓度减小,导致转化为氢氧化铜沉淀,故有可能得到蓝色浑浊液,D正确;
故选C。
2.C
【详解】由化学式可知,硝酸根离子化合价为-1,氯离子化合价为-1,根据化合价代数和为零可知,中心离子的化合价是+3;
故选C。
3.C
【详解】A.该物质中,铜离子提供空轨道,水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故A不选;
B.该物质中,银离子提供空轨道,NH3中氮原子提供孤电子对而形成配位键,所以该物质属于配合物,故B不选;
C.属于一般化合物,不含配体,所以不属于配合物,故C选;
D.中铝原子提供空轨道,F原子提供孤电子对,所以该物质属于配合物,故D不选;
故选C。
4.C
【详解】A.甲基咪唑中单键碳原子的杂化方式为、双键碳原子的杂化方式为,故A正确;
B.甲基咪唑易溶于水的主要原因是N原子与水中的H原子形成氢键,故B正确;
C.单键全是键、配位键是键、双键中有1个键,1个甲基咪唑中有12个键,1个离子中含有个键,故C错误;
D.2个Cl-、4个甲基咪唑均为Si原子的配体,离子中的配位数为6,故D正确;
选C。
5.A
【详解】A.由图可知,晶体中含有2种不同的水,一类是配体水分子、一类是形成氢键的水分子,两者结构不同,故胆矾在不同温度下分步失去结晶水,A正确;
B.由图可知,的配位数为6,B错误;
C.为铜原子失去2个电子后形成的例子,其价层电子排布式为,C错误;
D.氢键不是化学键,D错误;
故选A。
6.C
【详解】A.根据该配合物的结构可知,1mol该配合物中含键共39mol,A错误;
B.中碳原子杂化方式为sp杂化、苯环和键中碳原子杂化方式为杂化、其余碳原子杂化方式为杂化,B错误;
C.中心离子的配位数为4,C正确;
D.与形成配位键,无法与结合生成硫氰合铁离子,溶液不变红色,D错误;
故选:C。
7.D
【详解】A.由二茂铁的熔沸点较低可知二茂铁为分子晶体,亚铁离子提供空轨道,环戊二烯离子()提供孤电子,二者之间形成配位键,A正确;
B.1个环戊二烯()分子中含有键的数目为11,B正确;
C.由题给信息可知二茂铁分子中存在键,C正确;
D.由二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,可知其是分子晶体,D错误;
故选:D。
8.A
【详解】A.a中N原子有3对键电子对,1对孤电子对,b中N原子有4对键电子对,没有孤电子对,则a、b中N原子均采取杂化,A正确;
B.b为配离子,提供孤电子对的有2个N原子和4个O原子,所以的配位数为6,B错误;
C.a不是配合物,C错误;
D.与N、O之间形成配位键,其他原子之间形成共价键,b中不含离子键,D错误;
故选A。
9.C
【详解】A.利用杯酚分离和体现了超分子具有“分子识别”的特征,A项正确;
B.杯酚分子中含有苯环结构,存在大键,B项正确;
C.杯酚与形成的不是氢键,C项错误;
D.金刚石是共价晶体,为分子晶体,二者晶体类型不同,D项正确;
故选C。
10.D
【详解】A.由化合价的代数和为0可知,四氯合铜离子中铜元素的化合价为价,故A正确;
B.四水合铜离子中配位键属于σ键,水分子中的氢氧键为σ键,则1mol四水合铜离子中含有σ键的物质的量为12mol,故B正确;
C.向氯化铜溶液中加入硝酸银溶液,氯离子与银离子反应生成氯化银沉淀,氯离子的浓度减小,平衡向逆反应方向移动,四水合铜离子的浓度增大,溶液由黄绿色变成蓝色,故C正确;
D.氯化铜在溶液中的水解反应是吸热反应,升高温度,平衡向正反应方向移动,溶液中氢离子浓度增大,溶液pH减小,故D错误;
故选D。
11.C
【详解】①因为a和b具有不同的特性,所以a和b一定不是同一种物质,①错误;②性质不同说明结构不同,而a和b的分子式相同,故二者互为同分异构体,②正确;③a和b的空间结构若为四面体形,则没有这两种异构体,因此a和b的空间结构是平面四边形,③正确,④错误。故选C。
12.D
【详解】A.配合物,内界有4个氨分子作为配位体,所以配位数为4,故A错误;
B.配合物中,配位体为,为内界,故B错误;
C.配合物中和以配位键结合,故C错误;
D.在中,氮原子提供孤电子对,氢离子有空轨道,它们之间形成配位键,中也存在配位键,故D正确。
故选D。
13.C
【详解】A.从此超分子的结构图中可以看出,分子中含有多个酰胺基,A正确;
B.分子中有14个碳原子,不饱和度为10,则分子式为C14H10,该分子中有3种氢原子(带 号位置),则其一氯代物有3种,B正确;
C.此超分子的相对分子质量小于10000,则不属于高分子,C不正确;
D.此超分子中含有碳元素,完全燃烧后会生成CO2,干冰晶胞中CO2分子位于顶点和面心,配位数为=12,D正确;
故选C。
14.D
【详解】A. 溶液1显红色而溶液2不显红色说明相同浓度的和溶液中的浓度不同,故A正确;
B. Fe的核外电子排布为1s22s22p63s23p63d64s2,Fe3+是失去4s上的电子和3d上的一个电子得到的,其存在空轨道,CN-的电子式为,碳原子提供孤电子对,两者以配位键结合成,故B正确;
C. 溶液2不显红色,说明[Fe(CN)6]3-不会转化为Fe(SCN)3,说明与的结合力强于与的结合力,故C正确;
D. FeCl3溶液为棕黄色,K3[Fe(CN)6]溶液为黄色,若用KCN检验FeCl3溶液现象不明显,因此用KCN溶液检验FeCl3溶液中的Fe3+不如用KSCN溶液好,故D错误;
故选:D。
15.B
【详解】A. Na+与之间存在离子键,CN 与Fe3+之间存在配位键,CN 中碳原子与氮原子之间存在极性键,A项正确;
B. 配合物Na3[Fe(CN)6]中,配离子为,中心离子为Fe3+,配位原子为C,B项错误;
C. CN 中碳原子与氮原子之间存在1个σ键,CN 与Fe3+之间的配位键属于σ键,则1mol配合物Na3[Fe(CN)6]中σ键为(6+6)mol =12mol,C项正确;
D. 该配合物为离子化合物,易电离,其电离方程式为Na3[Fe(CN)6]=3Na++,1mol该配合物电离得到阴、阳离子共4mol,D项正确;
故选B。
16.(1)12
(2)AC
(3) 正方形
(4) O>N>H sp3 乙二胺可以形成分子间氢键
(5)BC
【详解】(1)金属铜的原子堆积模型位面心立方最密堆积,该晶胞中每个Cu原子周围最近距离的Cu原子数目为12;
(2)根据信息可知能与形成配位键,中除了配位键外,Na+与之间存在离子键,之间存在极性共价键,故还存在的化学键类型有离子键、极性共价键,故答案为:AC;
(3)①将CuO投入、生成,CuO被浸取的离子方程式为;
②结构中,若用两个分子代替两个分子,如果是正四面体结构,两个分子代替两个分子,得到只有一种结构;可以得到两种不同结构的化合物,由此推测的空间构型为正方形结构;
(4)③同周期元素从左到右电负性依次增大,故电负性为O>N>H;
④乙二胺分子中N原子与H和C形成3个键,有一对个电子对,价层电子对为4,采取sp3杂化;乙二胺分子间可以形成氢键,三甲胺不能形成氢键,只有分子间作用力,所以乙二胺沸点高;
(5)具有未成对电子的物质具有顺磁性,Cu+价电子排布为3d10,Cu2+价电子排布为3d9,+2价的铜离子形成的物质具有顺磁性,故答案为BC;
17.(1)D
(2)3
(3) 直线形 发射
(4)N的原子半径比P小、电负性比P大,使得NH3分子中共用电子对之间的距离比PH3分子中近、斥力大
(5) 孤电子对 sp3
【详解】(1)基态氮原子的能量最低,能量越高的轨道中电子个数越多,原子能量越高,依据图示可知,A为基态原子,能量最低,B、C、D为激发态原子,而D中能量较高的轨道中电子数最多,所以能量最高。
(2)同一周期主族元素从左向右第一电离能呈增大趋势,第IIA、VA族元素为全充满或半充满的稳定状态,第一电离能比同周期相邻元素第一电离能大,因此第二周期主族元素中,第一电离能在B和N之间的元素有Be、C、O三种元素。
(3)NaN3的阴离子为,其中心原子价层电子对数为2+=2,无孤对电子,采取sp杂化,空间构型为直线形;电子从激发态跃迁到低能级,以光的形式释放能量,Na在空气中燃烧发出黄色火焰用光谱仪摄取的光谱为发射光谱。
(4)NH3、PH3的中心原子均采取sp3杂化,N的电负性比P大、原子半径比P小,N原子对键合电子的吸引能力更强,因而NH3分子中成键电子对间的距离较近、斥力较大,NH3的键角比PH3的键角大。
(5)B原子形成3个B-H键,B原子有空轨道,氨分子中N原子有1个孤电子对,B与N之间形成配位键,氮原子提供孤电子对,硼原子提供空轨道;在BH3·NH3中B原子形成3个B-H键,还形成1个配位键,杂化轨道数目为4,采取sp3杂化。
18.(1) X射线衍射实验 同素异形体 2 球形
(2) 或
(3) p 氨分子间存在氢键,分子间只有范德华力
(4) 6 CD 2
【解析】(1)
X射线衍射实验能研究晶体中原子排列,科学家常利用X射线衍射实验区分晶体硼和无定形硼,二者之间互为同素异形体。Be原子价电子排布式为2s2,结构稳定,第一电离能大于同周期相邻元素,所以B元素排在第2位;基态原子的电子排布式为1s22s22p1,最低的能级为1s,电子云轮廓图为球形。
(2)
根据图示,每个硅原子与4个氧原子成键,其中2个氧原子与2个Si原子成键,根据均摊原则,其化学式为,Si原子形成4个σ键,无孤电子对,所以Si原子的杂化类型为。
(3)
N原子价电子排布为2s22p3,N元素位于元素周期表p区;该元素形成的简单氢化物是NH3,NH3分子间存在氢键,分子间只有范德华力,所以NH3的沸点比的沸点高;
(4)
①中,1个Co与6个NH3形成6个配位键,所以提供6个空轨道。该配位离子的作用力为共价键、配位键,选CD;
②若将中的两个分子换成两个,2个可能位于正八面体同一个楞上或位于正八面体对位,可以形成2种不同的结构形式。
19.(1) 哑铃形(或纺锤形)
(2)
(3) b 23
(4) 正四面体
【详解】(1)锗是32号元素,价层电子排布式为,有2个未成对电子,价层电子排布图为。砷原子价层电子排布式为,电子占据的能级中,4p能级能量最高,电子云形状为哑铃形或纺锤形;
(2)磷原子3p能级为半充满状态,故磷的第一电离能大于硫、但小于氯,则Si、P、S、Cl的第一电离能由大到小的顺序为;
(3)①和的键角、空间结构不同,中心原子的杂化轨道类型相同,均为杂化,故选b;
②、中的共价键都是键,每个分子形成一个配位键,配位键也是键,所以1mol含23mol键;
③该配合物中的配位数为6,依题意,1molT中有2mol在外界,能电离出2mol,只有1mol形成配离子,故T的化学式为;
(4)由题图知,B原子位于体对角线的处,B原子与相邻的4个P原子构成正四面体。面心上六个P原子构成正八面体,该正八面体的边长等于面对角线长的一半,设BP晶胞棱长为,1个晶胞含4个BP,所以,,故正八面体的边长为。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知:铜离子的配位数通常为4,和均为深蓝色。某化学小组设计如下实验制备铜的配合物。
下列说法不正确的是
A.b中得到配合物,其配体为
B.硫酸铜溶液呈蓝色的原因是的颜色所致
C.由实验可知,的配位能力比弱
D.加热c中溶液有可能得到蓝色浑浊液
2.配合物中,中心离子的化合价是
A.+1 B.+2 C.+3 D.无法确定
3.下列物质中,不属于配合物的是
A. B.
C. D.
4.与甲基咪唑( )反应可以得到,其结构如图所示,下列说法不正确的是
A.甲基咪唑中碳原子的杂化方式为
B.甲基咪唑易溶于水的主要原因是能与水形成氢键
C.1个离子中含有42个键
D.离子中的配位数为6
5.已知胆矾的结构示意图如图。下列说法正确的是
A.胆矾在不同温度下分步失去结晶水 B.的配位数为5
C.的价层电子排布式为 D.图示结构中存在配位键和氢键两种化学键
6.尿素是我国氮肥的主导品种,但土壤中广泛存在的脲酶能快速催化尿素水解成,使肥效大大降低。Schiff碱的金属配合物是一种高效绿色的配合物型脲酶抑制剂,引起了国内外学者的广泛关注。以下是一种Schiff碱的铜配合物的合成过程,下列说法正确的是
A.1mol该配合物含键为24mol
B.该配合物中碳原子的杂化方式为、
C.该配合物中心离子为,配位数为4
D.向该配合物中滴加溶液,溶液变红
7.二茂铁分子是一种金属有机配合物,二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,它是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
A.二茂铁中与环戊二烯离子()之间为配位键
B.1mol环戊二烯()中含有键的数目为
C.二茂铁分子中存在键
D.二茂铁是离子晶体
8.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有离子键和配位键
9.利用超分子可分离和。将、混合物加入一种空腔大小适配的杯酚中进行分离的流程如图所示。
下列说法错误的是
A.该流程体现了超分子具有“分子识别”的特征
B.杯酚分子中存在大键
C.杯酚与形成氢键
D.与金刚石晶体类型不同
10.溶液中存在平衡:(蓝色)(黄色),下列说法错误的是
A.中铜的化合价是价
B.中键的物质的量为
C.向溶液中加入溶液可使黄绿色的溶液变成蓝色
D.若升高溶液温度,溶液不变
11.铂的两种化合物a和b,其中a为,b为。实验测得a和b具有不同的特性。则下列关于a、b的叙述正确的是
①a和b属于同一种物质②a和b互为同分异构体③a和b的空间结构是平面四边形④a和b的空间结构是四面体形
A.①③ B.①④ C.②③ D.②④
12.下列说法正确的是
A.配合物配位数为6
B.配合物中,配位体为和,为内界
C.配合物中和以离子键结合
D.在和中都存在配位键
13.某超分子的结构如图所示。下列说法不正确的是
A.此超分子中含有酰胺基
B.的分子式为C14H10,其一氯代物有3种
C.此超分子属于高分子
D.此超分子完全燃烧后会生成CO2,干冰晶胞中CO2的配位数为12
14.用相同浓度的和溶液进行实验:
下列说法不正确的是
A.相同浓度的和溶液中,的浓度不同
B.提供空轨道,提供孤电子对,两者以配位键结合成
C.溶液2不显红色,说明与的结合力强于与的结合力
D.由对比实验可知,用溶液检验溶液中的比用KSCN溶液更好
15.配合物可用于离子检验,下列说法不正确的是
A.此配合物中存在离子键、配位键、极性键
B.配离子为,中心离子为,配位原子为N
C.1mol配合物中含有12molσ键
D.该配合物为离子化合物,易电离,1mol配合物电离得到阴阳离子共4mol
二、填空题
16.铜及其化合物在工农业生产中有广泛的应用。
Ⅰ.金属铜的原子堆积模型如图-1所示,
(1)该晶胞中每个Cu原子周围最近距离的Cu原子数目为_______。
Ⅱ.能与、、、等形成配位数为4的配合物。
(2)向溶液中加入过量NaOH溶液可生成。中除了配位键外,还存在的化学键类型有_______(填字母)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(3)将CuO投入、的混合溶液中进行“氨浸”,控制温度为50~55℃,pH约为9.5,CuO转化为溶液。
①CuO被浸取的离子方程式为_______。
②结构中,若用两个分子代替两个分子,可以得到两种不同结构的化合物,由此推测的空间构型为_______。
(4)可以与乙二胺()形成配离子,如题图-2所示:
③H、O、N三种元素的电负性从大到小的顺序为_______。
④乙二胺分子中N原子成键时采取的杂化类型是_______。乙二胺和三甲胺均属于胺,但乙二胺比三甲胺的沸点高很多,原因是_______。
Ⅲ.将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,
(5)下列物质中,属于顺磁性物质的是_______(填标号)。
A. B. C.
17.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有_______种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为_______,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为_______(填“发射”或“吸收”)光谱。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥模型解释NH3的键角比PH3的键角大的原因:_______。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供_______,在BH3·NH3中B原子的杂化方式为_______。
三、结构与性质
18.晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钴、钙等多种化学物质。请回答下列问题:
(1)科学家常利用_______区分晶体硼和无定形硼,二者之间互为_______。第二周期元素的第一电离能按由小到大的顺序排列,B元素排在第_______位,其基态能量最低的能级电子云轮廓图为_______。
(2)硅酸根有多种结构形式,一种无限长链状结构如图所示,其化学式为_______,Si原子的杂化类型为_______。
(3)N元素位于元素周期表_______区;该元素形成的简单氢化物的沸点比的沸点高,其原因为_______。
(4)的几何构型为正八面体形,Co在中心。
①中,1个Co提供_______个空轨道。该配位离子的作用力为_______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键
②若将中的两个分子换成两个可以形成_______种不同的结构形式。
19.材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态Ge原子的价层电子排布图为___________;基态As原子核外电子占据的能量最高的能级的电子云形状为___________。
(2)Si、P、S、Cl的第一电离能由大到小的顺序为___________。
(3)M与Ga位于同周期,的一种配合物组成为。
①下列有关、的说法正确的是___________(填字母)。
a.分子空间结构相同
b.中心原子杂化轨道类型相同
c.键角大小相同
②1mol含___________mol键。
③配合物T与组成元素相同,中心离子的配位数相同。1molT溶于水,加入足量溶液可生成2mol。则T的化学式为___________。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,该晶胞中B原子与相邻的P原子构成___________(填“立方体”“正四面体”或“正八面体”)。
已知该晶体的密度为,设是阿伏加德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________pm(列式即可)。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.和均为深蓝色,b加入过量的氢氧化钠得到配合物,由化学式可知,其配体为,A正确;
B.水分子中氧原子可以提供孤电子对,能和铜离子形成配离子,硫酸铜溶液呈蓝色的原因是的颜色所致,B正确;
C.由实验ac可知,的配位能力比强,C错误;
D.加热c中溶液会促进一水合氨向电离的方向进行,使得一水合氨浓度减小,导致转化为氢氧化铜沉淀,故有可能得到蓝色浑浊液,D正确;
故选C。
2.C
【详解】由化学式可知,硝酸根离子化合价为-1,氯离子化合价为-1,根据化合价代数和为零可知,中心离子的化合价是+3;
故选C。
3.C
【详解】A.该物质中,铜离子提供空轨道,水分子中氧原子提供孤电子对而形成配位键,所以该物质属于配合物,故A不选;
B.该物质中,银离子提供空轨道,NH3中氮原子提供孤电子对而形成配位键,所以该物质属于配合物,故B不选;
C.属于一般化合物,不含配体,所以不属于配合物,故C选;
D.中铝原子提供空轨道,F原子提供孤电子对,所以该物质属于配合物,故D不选;
故选C。
4.C
【详解】A.甲基咪唑中单键碳原子的杂化方式为、双键碳原子的杂化方式为,故A正确;
B.甲基咪唑易溶于水的主要原因是N原子与水中的H原子形成氢键,故B正确;
C.单键全是键、配位键是键、双键中有1个键,1个甲基咪唑中有12个键,1个离子中含有个键,故C错误;
D.2个Cl-、4个甲基咪唑均为Si原子的配体,离子中的配位数为6,故D正确;
选C。
5.A
【详解】A.由图可知,晶体中含有2种不同的水,一类是配体水分子、一类是形成氢键的水分子,两者结构不同,故胆矾在不同温度下分步失去结晶水,A正确;
B.由图可知,的配位数为6,B错误;
C.为铜原子失去2个电子后形成的例子,其价层电子排布式为,C错误;
D.氢键不是化学键,D错误;
故选A。
6.C
【详解】A.根据该配合物的结构可知,1mol该配合物中含键共39mol,A错误;
B.中碳原子杂化方式为sp杂化、苯环和键中碳原子杂化方式为杂化、其余碳原子杂化方式为杂化,B错误;
C.中心离子的配位数为4,C正确;
D.与形成配位键,无法与结合生成硫氰合铁离子,溶液不变红色,D错误;
故选:C。
7.D
【详解】A.由二茂铁的熔沸点较低可知二茂铁为分子晶体,亚铁离子提供空轨道,环戊二烯离子()提供孤电子,二者之间形成配位键,A正确;
B.1个环戊二烯()分子中含有键的数目为11,B正确;
C.由题给信息可知二茂铁分子中存在键,C正确;
D.由二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,可知其是分子晶体,D错误;
故选:D。
8.A
【详解】A.a中N原子有3对键电子对,1对孤电子对,b中N原子有4对键电子对,没有孤电子对,则a、b中N原子均采取杂化,A正确;
B.b为配离子,提供孤电子对的有2个N原子和4个O原子,所以的配位数为6,B错误;
C.a不是配合物,C错误;
D.与N、O之间形成配位键,其他原子之间形成共价键,b中不含离子键,D错误;
故选A。
9.C
【详解】A.利用杯酚分离和体现了超分子具有“分子识别”的特征,A项正确;
B.杯酚分子中含有苯环结构,存在大键,B项正确;
C.杯酚与形成的不是氢键,C项错误;
D.金刚石是共价晶体,为分子晶体,二者晶体类型不同,D项正确;
故选C。
10.D
【详解】A.由化合价的代数和为0可知,四氯合铜离子中铜元素的化合价为价,故A正确;
B.四水合铜离子中配位键属于σ键,水分子中的氢氧键为σ键,则1mol四水合铜离子中含有σ键的物质的量为12mol,故B正确;
C.向氯化铜溶液中加入硝酸银溶液,氯离子与银离子反应生成氯化银沉淀,氯离子的浓度减小,平衡向逆反应方向移动,四水合铜离子的浓度增大,溶液由黄绿色变成蓝色,故C正确;
D.氯化铜在溶液中的水解反应是吸热反应,升高温度,平衡向正反应方向移动,溶液中氢离子浓度增大,溶液pH减小,故D错误;
故选D。
11.C
【详解】①因为a和b具有不同的特性,所以a和b一定不是同一种物质,①错误;②性质不同说明结构不同,而a和b的分子式相同,故二者互为同分异构体,②正确;③a和b的空间结构若为四面体形,则没有这两种异构体,因此a和b的空间结构是平面四边形,③正确,④错误。故选C。
12.D
【详解】A.配合物,内界有4个氨分子作为配位体,所以配位数为4,故A错误;
B.配合物中,配位体为,为内界,故B错误;
C.配合物中和以配位键结合,故C错误;
D.在中,氮原子提供孤电子对,氢离子有空轨道,它们之间形成配位键,中也存在配位键,故D正确。
故选D。
13.C
【详解】A.从此超分子的结构图中可以看出,分子中含有多个酰胺基,A正确;
B.分子中有14个碳原子,不饱和度为10,则分子式为C14H10,该分子中有3种氢原子(带 号位置),则其一氯代物有3种,B正确;
C.此超分子的相对分子质量小于10000,则不属于高分子,C不正确;
D.此超分子中含有碳元素,完全燃烧后会生成CO2,干冰晶胞中CO2分子位于顶点和面心,配位数为=12,D正确;
故选C。
14.D
【详解】A. 溶液1显红色而溶液2不显红色说明相同浓度的和溶液中的浓度不同,故A正确;
B. Fe的核外电子排布为1s22s22p63s23p63d64s2,Fe3+是失去4s上的电子和3d上的一个电子得到的,其存在空轨道,CN-的电子式为,碳原子提供孤电子对,两者以配位键结合成,故B正确;
C. 溶液2不显红色,说明[Fe(CN)6]3-不会转化为Fe(SCN)3,说明与的结合力强于与的结合力,故C正确;
D. FeCl3溶液为棕黄色,K3[Fe(CN)6]溶液为黄色,若用KCN检验FeCl3溶液现象不明显,因此用KCN溶液检验FeCl3溶液中的Fe3+不如用KSCN溶液好,故D错误;
故选:D。
15.B
【详解】A. Na+与之间存在离子键,CN 与Fe3+之间存在配位键,CN 中碳原子与氮原子之间存在极性键,A项正确;
B. 配合物Na3[Fe(CN)6]中,配离子为,中心离子为Fe3+,配位原子为C,B项错误;
C. CN 中碳原子与氮原子之间存在1个σ键,CN 与Fe3+之间的配位键属于σ键,则1mol配合物Na3[Fe(CN)6]中σ键为(6+6)mol =12mol,C项正确;
D. 该配合物为离子化合物,易电离,其电离方程式为Na3[Fe(CN)6]=3Na++,1mol该配合物电离得到阴、阳离子共4mol,D项正确;
故选B。
16.(1)12
(2)AC
(3) 正方形
(4) O>N>H sp3 乙二胺可以形成分子间氢键
(5)BC
【详解】(1)金属铜的原子堆积模型位面心立方最密堆积,该晶胞中每个Cu原子周围最近距离的Cu原子数目为12;
(2)根据信息可知能与形成配位键,中除了配位键外,Na+与之间存在离子键,之间存在极性共价键,故还存在的化学键类型有离子键、极性共价键,故答案为:AC;
(3)①将CuO投入、生成,CuO被浸取的离子方程式为;
②结构中,若用两个分子代替两个分子,如果是正四面体结构,两个分子代替两个分子,得到只有一种结构;可以得到两种不同结构的化合物,由此推测的空间构型为正方形结构;
(4)③同周期元素从左到右电负性依次增大,故电负性为O>N>H;
④乙二胺分子中N原子与H和C形成3个键,有一对个电子对,价层电子对为4,采取sp3杂化;乙二胺分子间可以形成氢键,三甲胺不能形成氢键,只有分子间作用力,所以乙二胺沸点高;
(5)具有未成对电子的物质具有顺磁性,Cu+价电子排布为3d10,Cu2+价电子排布为3d9,+2价的铜离子形成的物质具有顺磁性,故答案为BC;
17.(1)D
(2)3
(3) 直线形 发射
(4)N的原子半径比P小、电负性比P大,使得NH3分子中共用电子对之间的距离比PH3分子中近、斥力大
(5) 孤电子对 sp3
【详解】(1)基态氮原子的能量最低,能量越高的轨道中电子个数越多,原子能量越高,依据图示可知,A为基态原子,能量最低,B、C、D为激发态原子,而D中能量较高的轨道中电子数最多,所以能量最高。
(2)同一周期主族元素从左向右第一电离能呈增大趋势,第IIA、VA族元素为全充满或半充满的稳定状态,第一电离能比同周期相邻元素第一电离能大,因此第二周期主族元素中,第一电离能在B和N之间的元素有Be、C、O三种元素。
(3)NaN3的阴离子为,其中心原子价层电子对数为2+=2,无孤对电子,采取sp杂化,空间构型为直线形;电子从激发态跃迁到低能级,以光的形式释放能量,Na在空气中燃烧发出黄色火焰用光谱仪摄取的光谱为发射光谱。
(4)NH3、PH3的中心原子均采取sp3杂化,N的电负性比P大、原子半径比P小,N原子对键合电子的吸引能力更强,因而NH3分子中成键电子对间的距离较近、斥力较大,NH3的键角比PH3的键角大。
(5)B原子形成3个B-H键,B原子有空轨道,氨分子中N原子有1个孤电子对,B与N之间形成配位键,氮原子提供孤电子对,硼原子提供空轨道;在BH3·NH3中B原子形成3个B-H键,还形成1个配位键,杂化轨道数目为4,采取sp3杂化。
18.(1) X射线衍射实验 同素异形体 2 球形
(2) 或
(3) p 氨分子间存在氢键,分子间只有范德华力
(4) 6 CD 2
【解析】(1)
X射线衍射实验能研究晶体中原子排列,科学家常利用X射线衍射实验区分晶体硼和无定形硼,二者之间互为同素异形体。Be原子价电子排布式为2s2,结构稳定,第一电离能大于同周期相邻元素,所以B元素排在第2位;基态原子的电子排布式为1s22s22p1,最低的能级为1s,电子云轮廓图为球形。
(2)
根据图示,每个硅原子与4个氧原子成键,其中2个氧原子与2个Si原子成键,根据均摊原则,其化学式为,Si原子形成4个σ键,无孤电子对,所以Si原子的杂化类型为。
(3)
N原子价电子排布为2s22p3,N元素位于元素周期表p区;该元素形成的简单氢化物是NH3,NH3分子间存在氢键,分子间只有范德华力,所以NH3的沸点比的沸点高;
(4)
①中,1个Co与6个NH3形成6个配位键,所以提供6个空轨道。该配位离子的作用力为共价键、配位键,选CD;
②若将中的两个分子换成两个,2个可能位于正八面体同一个楞上或位于正八面体对位,可以形成2种不同的结构形式。
19.(1) 哑铃形(或纺锤形)
(2)
(3) b 23
(4) 正四面体
【详解】(1)锗是32号元素,价层电子排布式为,有2个未成对电子,价层电子排布图为。砷原子价层电子排布式为,电子占据的能级中,4p能级能量最高,电子云形状为哑铃形或纺锤形;
(2)磷原子3p能级为半充满状态,故磷的第一电离能大于硫、但小于氯,则Si、P、S、Cl的第一电离能由大到小的顺序为;
(3)①和的键角、空间结构不同,中心原子的杂化轨道类型相同,均为杂化,故选b;
②、中的共价键都是键,每个分子形成一个配位键,配位键也是键,所以1mol含23mol键;
③该配合物中的配位数为6,依题意,1molT中有2mol在外界,能电离出2mol,只有1mol形成配离子,故T的化学式为;
(4)由题图知,B原子位于体对角线的处,B原子与相邻的4个P原子构成正四面体。面心上六个P原子构成正八面体,该正八面体的边长等于面对角线长的一半,设BP晶胞棱长为,1个晶胞含4个BP,所以,,故正八面体的边长为。
答案第1页,共2页
答案第1页,共2页
