阶段性综合训练(考查内容专题1、2、3)(含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 阶段性综合训练(考查内容专题1、2、3)(含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 619.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 08:07:28 | ||
图片预览




文档简介
阶段性综合训练(考查内容专题1、2、3)
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在指定条件下,下列选项所示的物质间转化能实现的是
A.NO(g)HNO3(aq) B.稀硝酸NO2
C.NO2(g)HNO3(aq) D. (aq) (aq)
2.下列均为在日常生活中能找到的物质,按混合物、碱、盐顺序排列的是
A.白醋、生石灰、食盐 B.冰水混合物、水泥、硝酸铵
C.管道煤气、熟石灰、熟石膏 D.牙膏、纯碱、小苏打
3.NA是阿伏加德罗常数。下列说法正确的是
A.1.2g Mg完全转化为MgO时转移电子数为0.1NA
B.标准状况下,22.4L SO3中含有 SO3的物质的量为1mol
C.2.2g D218O中含有的中子数为NA
D.0.1mol·L-1Na2SO4 溶液中含有的氧原子数为0.4NA
4.合成17 t NH3,放出Q kJ热量。利用浓氨水吸收氯气工业的尾气,同时得到副产品NH4Cl;也可以用FeCl2溶液吸收氯气制得FeCl3溶液,然后制备Fe(OH)3胶体;经实验发现,溶液几乎都有丁达尔效应(粒子对光的散射现象),且丁达尔现象随其浓度升高逐渐增强,胶体的丁达尔现象比溶液的强。现用以下装置区别FeCl3溶液和Fe(OH)3胶体,下列说法不正确的是
A.溶液靠近光源时,溶液和胶体均有明显的丁达尔现象
B.胶体靠近光源时,胶体有明显的丁达尔现象,溶液无明显现象
C.通过溶液、胶体互换位置,出现二次丁达尔现象的为溶液,只出现一次丁达尔现象的为胶体
D.通过溶液、胶体互换位置,只出现一次丁达尔现象的为溶液,出现二次丁达尔现象的为胶体
5.实验室从废定影液(含和等)中回收Ag和的主要步骤流程如下,其中部分操作的装置如图所示(已知苯的密度小于水),下列叙述正确的是
A.用装置甲分离时,用玻璃棒轻轻搅拌
B.用装置乙在空气中高温灼烧制取Ag
C.用装置丙制备用于氧化滤液中的
D.用装置丁分液时从上口倒出有机相
6.设为阿伏加德罗常数的数值,下列说法正确的是
A.1mol/L NaCl溶液中含有个 B.标准状况下,中含有个分子
C.常温下,含有个氧原子 D.铝与足量稀盐酸反应生成个分子
7.设为阿伏加德罗常数的值,下列说法正确的是
A.中含有的电子数为
B.物质的量浓度为的溶液中,含有的数目为
C.重水中含有的质子数为
D.标准状况下,气体中碳原子数为
8.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,2.24L 中分子数为0.1 NA
B.常温常压下,18g 与18g 所含电子数均为10 NA
C.常温常压下,92g的和混合气体含有的原子数为6 NA
D.常温常压下,22.4L氯气与足量的镁粉充分反应,转移的电子数为2 NA
9.反应可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子: B.分子的结构式:Cl-Cl
C.分子的电子式: D.的结构示意图:
10.化学与生产、生活密切相关。下列说法不正确的是
A.海水资源的综合利用涉及制取镁和溴等,其过程中均涉及氧化还原反应
B.“燃煤固硫”“汽车尾气催化净化”等措施均涉及化学变化
C.北斗卫星导航系统由中国自主研发、独立运行,其所用芯片的主要成分为
D.“神舟13号”宇宙飞船返回舱所用高温结构陶瓷,属于新型无机非金属材料
11.下列关于物质保存的方法错误的是
A.硝酸银溶液保存在棕色细口瓶中 B.氯水保存在棕色细口瓶中
C.液氯保存在干燥的钢瓶中 D.漂白粉可露置在空气中保存
12.将足量通入下列各溶液中,所含离子还能大量共存的是
A.、、、 B.、、、
C.、、、 D.、、、
13.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.碳酸钠与:碳酸氢钠与
B.溶液与溶液:溶液与溶液
C.溶液与硝酸溶液:溶液与硝酸溶液
D.澄清石灰水与盐酸:溶液与硫酸
14.海水提溴和海带提碘都需经过浓缩、氧化、提取三个步骤。有关叙述错误的是
A.提取溴时利用溴的挥发性
B.提溴的浓缩液来自于海水晒盐后的卤水
C.提取碘时利用碘的升华特性
D.氧化步骤都可以通入氯气来实现
15.海水开发利用的部分过程如图所示。下列说法错误的是
A.上述过程涉及氧化还原反应
B.可以采用蒸馏法从海中获得淡水
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
二、实验题
16.氮化铝(AlN)是一种性能优异的新型材料,化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并进行相关性质实验。查阅资料:
①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4ClNaCl+N2↑+2H2O
②工业制氮化铝:Al2O3+3C+N22AlN+3CO,氮化铝在高温下会与水反应。
③对比实验资料表:
资料编号 反应物 生成物1 生成物2
(1) 铝与氢氧化钠溶液 无色无味气体 相同钠盐
(2) 氮化铝与氢氧化钠溶液 无色刺激性气味气体
I.氮化铝的制备
(1)实验中使用的装置如图所示,请按照氮气气流方向将各装置连接,顺序依次为_______;C→B→_______→_______→E。
(2)仪器m的名称是_______。
(3)B装置内的X是_______,E中氯化钯溶液的作用是_______。
Ⅱ.氮化铝的性质实验
(4)取上述实验所制得的少量氮化铝于试管中,加入氢氧化钠溶液,发生反应的化学方程式_______。
(5)设计实验可将氮化铝转化为AlCl3,再与MgCl2、稀盐酸混合配成溶液,往混合液中逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如图所示。则溶液中Al3+、Mg2+两种阳离子的物质的量浓度之比为_______。
17.某研究小组利用下图所示装置探究卤素的性质。
(1)实验室用MnO2与浓盐酸反应制取Cl2,利用了MnO2的_______ (填“氧化性”或“还原性”)
(2)①中溶液由无色变为黄色,发生反应的离子方程式是_______。
(3)②中NaOH溶液的作用是_______,发生反应的离子方程式是_______。
(4)若用排空气法收集一瓶氯气,可利用方框中的装置代替装置①,请将方框中的收集装置补充完整_____。
三、原理综合题
18.I.阅读古诗回答有关问题。
《石灰吟》
于谦
千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。
(1)从物质分类的角度看,诗中“千锤万凿出深山”所开采的物质属于_______(填字母序号)。
A.酸 B.碱 C.盐 D.无氧酸盐 E.含氧酸盐
(2)关于“烈火焚烧若等闲”发生的反应,反应的产物中有无电解质_______(填写“有”或“无”)。
(3)诗中涉及的物质中,摩尔质量最大的是_______(填化学式),该物质中原子的总数为_______(用表示阿伏加德罗常数的值)。
II.现有物质 ①铜 ②干冰 ③盐酸 ④ ⑤蔗糖 ⑥固体 ⑦溶液⑧熔融的
(4)能导电的是:_______(填序号,下同),属于电解质的是_______。
(5)按要求写出反应的方程式:
i.若要除去固体中的固体,除杂时发生的化学方程式为_______。
ii.写出③的浓溶液和④反应制备氯气的离子方程式_______。
III.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(6)下图为离子反应、氧化还原反应和置换反应三者间的关系,其中表示离子反应的是_______(填字母)。
(7)有同学认为所有酸碱中和反应均可表示为。请举个例子反驳上述观点(用离子方程式表示)_______。
(8)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:。则的化学式是_______。当有参与反应时,该反应转移的电子数目为_______(用表示阿伏加德罗常数的值),其中是该反应的_______(填字母)。
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
四、工业流程题
19.从海水中可以获得淡水、食盐并可提取镁和溴等物质。
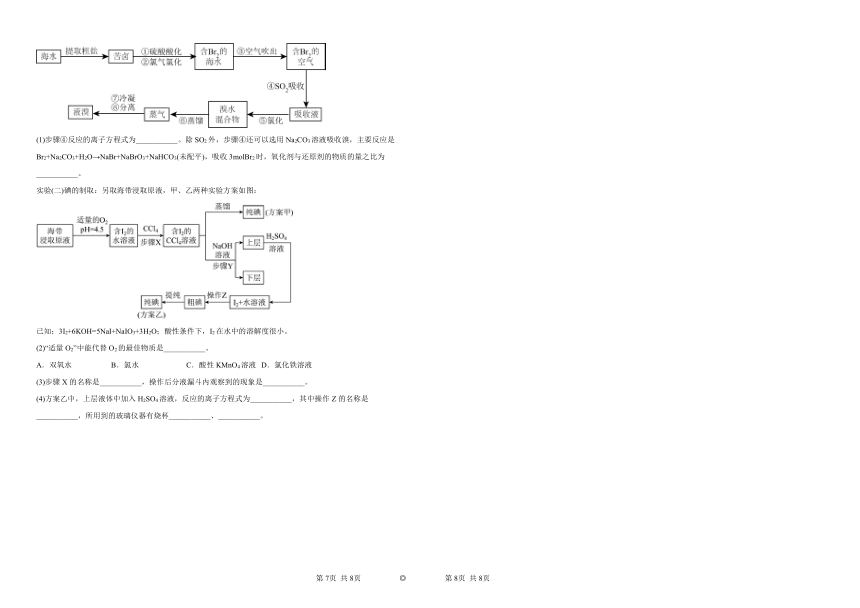
实验(一)海水提溴:空方气吹出法是工业规模提溴的常用法,其流程如图:
(1)步骤④反应的离子方程式为___________。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收3molBr2时,氧化剂与还原剂的物质的量之比为___________。
实验(二)碘的制取:另取海带浸取原液,甲、乙两种实验方案如图:
已知:3I2+6KOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
(2)“适量O2”中能代替O2的最佳物质是___________。
A.双氧水 B.氯水 C.酸性KMnO4溶液 D.氯化铁溶液
(3)步骤X的名称是___________,操作后分液漏斗内观察到的现象是___________。
(4)方案乙中,上层液体中加入H2SO4溶液,反应的离子方程式为___________,其中操作Z的名称是___________,所用到的玻璃仪器有烧杯___________、___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.NO不与H2O反应,选项A不符合题意;
B.稀HNO3与Cu反应生成NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,选项B不符合题意;
C. 发生反应为3NO2+H2O= 2HNO3+NO,能实现转化,选项C符合题意;
D.中的N为最高价+5价,O3为氧化剂,因此不能生成,选项D不符合题意;
答案选C。
2.C
【详解】A.生石灰为CaO,是氧化物不是碱,食盐中有其他添加剂,属于混合物,A错误;
B.冰水混合物为纯净物,水泥属于混合物,不是碱,B错误;
C.管道煤气中含有一氧化碳、甲烷等气体,属于混合物,熟石灰为氢氧化钙,属于碱,熟石膏为硫酸钙晶体,属于盐,C正确;
D.纯碱为碳酸钠属于盐而不是碱,D错误;
故答案选C。
3.A
【详解】A.每个镁反应转移2个电子,故1.2克镁即0.05mol镁反应转移0.1mol电子,A正确;
B.标况下三氧化硫不是气体 ,不能使用气体摩尔体积进行计算,B错误;
C.2.2g D218O的物质的量为,每个分子中的中子数为1×2+10=12,故物质中含有的中子数为1.2NA,C错误;
D.溶液的体积没有说明,且溶液中水分子含有氧原子,不能计算,D错误;
故选A。
4.C
【详解】A.根据题意,溶液几乎都有丁达尔效应(粒子对光的散射现象),当溶液靠近光源时,溶液和胶体都有明显丁达尔现象,故A正确;
B.胶体靠近光源时,胶体有丁达尔现象,通过胶体后光源变弱,溶液没有明显的丁达尔现象,而故B正确;
C.直接与光源接触光强,溶液有丁达尔响应。但经过溶液后光变弱胶体就无法丁达尔效应了,因此通过溶液、胶体互换位置,出现二次丁达尔现象的为胶体,只出现一次丁达尔现象的为溶液,故C错误;
D.根据C选项分析得到D是正确的,故D正确。
综上所述,答案为C。
5.D
【详解】A.过滤分离 时,用玻璃棒不断搅拌,容易损坏滤纸,选项A不正确;
B.蒸发皿不能用于灼烧,在空气中高温灼烧 会生成 SO2,污染环境,同时生成的 Ag 会被氧化成 Ag2O,选项B不正确;
C.MnO2与浓盐酸需加热才能反应生成 Cl2,选项C不正确;
D.苯的密度小于水,有机层在上层,分液时,先放出水相,再从分液漏斗上口倒出有机相, 选项D 正确;
答案选D。
6.C
【详解】A.题干未告知溶液体积,故无法计算1mol/L NaCl溶液中含有的数目,A错误;
B.标准状况下H2O为液体,故无法计算22.4LH2O中含有H2O的分子数目,B错误;
C.常温下,含有氧原子的数目为=,C正确;
D.根据反应方程式为:2Al+6HCl=2AlCl3+3H2↑可知,铝与足量稀盐酸反应生成3NA个H2分子,D错误;
故答案为:C。
7.D
【详解】A.0.1molAl3+中含有的电子数为,A错误;
B.物质的量浓度为1 mol L 1的BaCl2溶液中,溶液体积未知,无法计算Cl 个数,B错误;
C.18g重水(D2O)中含有的质子数为,C错误;
D.标准状况下,22.4L CO气体物质的量为1mol,因此所含的碳原子数为NA,D正确;
故选D。
8.C
【详解】A.标准状况下,三氧化硫为固态,无法计算2.24L三氧化硫的物质的量和含有的分子数目,故A错误;
B.水和重水的摩尔质量不相等,则18g水和18g重水的物质的量不相等,含有的电子数不相等,故B错误;
C.二氧化氮和四氧化二氮的最简式相同,均为NO2,则92g混合物中含有的原子数目为×3×NAmol—1=6NA,故C正确;
D.常温常压下,气体摩尔体积大于22.4L/mol,则22.4L氯气的物质的量小于1mol,与足量的镁粉充分反应,转移的电子数小于2NA,故D错误;
故选C。
9.B
【详解】A.氮元素的质子数为7 ,中子数为9的氮原子的质量数=质子数+中子数=7+9=16 ,该核素可以表示为:,故A错误;
B.Cl2分子是两个氯原子共用一对电子形成的,结构式为Cl-Cl,故B正确;
C.N2分子是两个氮原子共用三对电子形成的,每个氮原子还有一对未参与成键的电子,其电子式为 ,故C错误;
D.Cl-是Cl得到1个电子形成的,最外层电子数为8,结构示意图为: ,故D错误;
故答案选B。
10.C
【详解】A.镁和溴在海水中都是以化合态形式存在,则海水资源的综合利用涉及制取镁和溴等,其过程中均涉及氧化还原反应,A正确;
B.过程属于物理变化,“燃煤固硫”主要是指把氧化钙或碳酸钙和含硫的煤混合后燃烧,涉及化学变化,“汽车尾气催化净化”是指CO与NO,在催化剂的作用下反应生成无毒的CO2和N2,属于化学变化,B正确;
C.芯片的主要成分为硅,C错误;
D.高温结构陶瓷属于新型无机非金属材料,D正确;
故选C。
11.D
【详解】A.液体药品应该保存在细口瓶中,硝酸银见光易分解,保存在棕色细口瓶中,A项正确;
B.氯水见光易分解,因此保存在棕色细口瓶中,B项正确;
C.液氯与干燥的钢瓶不反应,因此可用钢瓶来储存液氯,C项正确;
D.漂白粉露置于空气中会吸收二氧化碳变成次氯酸,次氯酸见光易分解而变质,D项错误;
答案选D。
12.C
【详解】A.与会发生氧化还原反应生成S单质,不能共存,故A不选;
B.将足量通入溶液中会生成亚硫酸,在酸性环境中具有强氧化性,会和发生氧化还原反应,不能共存,故B不选;
C.、、、四种离子之间不反应,且均与二氧化硫不反应,可大量共存,故C选;
D.和会发生反应,不能共存,故D不选;
故选C。
13.D
【详解】A.碳酸钠与Ca(OH)2反应的离子方程式为:+Ca2+=CaCO3↓,若NaHCO3(过量)和Ca(OH)2反应的离子方程式为:2OH-+2 +Ca2+=CaCO3↓++2H2O,二者不同,故A不选,
B.BaCl2溶液与Na2SO4溶液反应的离子方程式为Ba2++=BaSO4↓;Ba(OH)2溶液与NaHSO4溶液反应的离子方程式为Ba2++2OH-+2H++=BaSO4↓+2H2O或Ba2++OH-+H++=BaSO4↓+H2O,故B不选;
C.Na2CO3溶液与硝酸溶液反应的离子方程式为+2H+=H2O+CO2↑;碳酸钙为难溶物不可拆,CaCO3与硝酸溶液反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故C不选;
D.澄清石灰水与盐酸本质为酸碱中和反应,氢氧化钠和硫酸也是酸碱中和反应,反应的离子方程式均为H++OH-=H2O,故D选;
故答案为D。
14.C
【详解】A.溴易挥发,可鼓入热空气或热水蒸气将溴分离出来,故A正确;
B.提溴的浓缩液来自于海水晒盐后的卤水,可使溴离子浓度增大,为浓缩过程,故B正确;
C.海带中无单质碘,存在形式为碘离子,提取碘是利用氧化剂氧化碘离子生成碘单质,萃取分液、蒸馏方法得到,故C错误;
D.氯气具有氧化性,可以氧化Br—、I—生成Br2、I2单质,故D正确;
故选C。
15.C
【分析】由流程可知,海水晒盐分离出粗盐,在苦卤中通入氯气可氧化溴离子生成溴单质,含镁离子的溶液中加沉淀剂为CaO或氢氧化钙等可实现对镁离子的提纯和富集,得到氢氧化镁沉淀,据此解答。
【详解】A.上述过程中,氯气氧化溴离子生成溴单质的反应为氧化还原反应,故A正确;
B.控制水的沸点,可以采用蒸馏法从海中获得淡水,故B正确;
C.由于氢氧化钙比氢氧化钠便宜,工业生产中常选用氢氧化钙作为沉淀剂,故C错误;
D.溴易挥发,先用空气和水蒸气吹出单质溴,再用SO2将其还原为溴化氢,从而达到富集溴的目的,故D正确;
故选:C。
16.(1)D、A
(2)球形干燥管
(3) 浓硫酸 吸收反应生成的CO防止进入空气引起污染
(4)AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑或AlN+NaOH+H2O=NaAlO2+NH3↑
(5)2:1
【分析】C中是饱和NaNO2溶液与NH4Cl溶液共热制氮气,用B装置浓硫酸干燥氮气,在D中氧化铝和氮气反应生成AlN,用E装置处理尾气CO,为防止E中水蒸气进入到D中,用碱石灰干燥CO。
【详解】(1)根据前面分析,先制备氮气,再干燥氮气,再是氮气和氧化铝反应,再防止水蒸气进入D中,最后处理尾气,其气流顺序依次为:C→B→D→A→E;故答案为:D、A。
(2)根据图中信息得到仪器m的名称是球形干燥管;故答案为:球形干燥管。
(3)B装置主要是干燥氮气,因此装置内的X是浓硫酸,CO有毒,会污染环境,因此E中氯化钯溶液的作用是吸收反应生成的CO防止进入空气引起污染;故答案为:浓硫酸;吸收反应生成的CO防止进入空气引起污染。
(4)取上述实验所制得的少量氮化铝于试管中,加入氢氧化钠溶液,得到无色刺激性气味气体即氨气,还得到偏铝酸钠,其发生反应的化学方程式AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑或AlN+NaOH+H2O=NaAlO2+NH3↑;故答案为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑或AlN+NaOH+H2O=NaAlO2+NH3↑。
(5)根据题意溶解氢氧化铝用氢氧化钠溶液体积为10mL,则沉淀铝离子需要氢氧化钠溶液体积为30mL,沉淀镁离子需要氢氧化钠溶液体积为10mL,铝离子和镁离子分别消耗氢氧化钠物质的量为0.03mol、0.01mol,根据关系式Mg2+~2OH-,Al3+~3OH-,则溶液中Al3+、Mg2+两种阳离子的物质的量分别为0.01mol、0.0005mol,则其物质的量浓度之比为2:1;故答案为:2:1。
17.(1)氧化性
(2)Cl2+2I-=I2+2Cl-
(3) 吸收剩余的尾气氯气,防止污染空气 Cl2+2OH-=Cl-+ClO-+H2O
(4)
【详解】(1)二氧化锰和浓盐酸加热反应生成氯气,氯元素化合价升高失电子发生氧化反应,锰元素化合价降低得到电子发生还原反应,二氧化锰作氧化剂具有氧化性,氯化氢作还原剂具有还原性,故答案为:氧化性;
(2)①中溶液由无色变为黄色,是氯气通过碘化钾溶液发生氧化还原反应生成碘单质,发生反应的离子方程式是:Cl2+2I-=I2+2Cl-,故答案为:Cl2+2I-=I2+2Cl-;
(3)②中NaOH溶液的作用是吸收剩余的尾气氯气,防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:吸收剩余的尾气氯气,防止污染空气;Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气比空气重,应用向上排气法收集,导气管长进短出,收集装置为: ,故答案为: 。
18.(1)CE
(2)有
(3)
(4) ①③⑦⑧ ④⑥⑧
(5)
(6)C
(7)
(8) D
【详解】(1)诗中“千锤万凿出深山”所开采的物质是CaCO3,电离产生金属阳离子Ca2+和酸根阴离子CO,由于阴离子中含有氧元素,因此该物质属于盐,是含氧酸盐故合理选项是CE;
(2)“烈火焚烧若等闲”对应的反应为CaCO3高温分解为CaO与CO2,CaCO3为电解质;
(3)诗中涉及的反应中,要留清白在人间,发生反应是:CaO+H2O=Ca(OH)2,“烈火焚烧若等闲”对应的反应为CaCO3高温分解为CaO与CO2,CaCO3,其中摩尔质量最大的为:CaCO3;该物质的物质的量为0.5mol,其中原子的总物质的量为0.5mol×5=2.5mol,总个数为2.5NA;
(4)①铜能导电,是金属单质,既不是电解质也不是非电解质,可导电;
②干冰不能导电,属于非电解质;
③盐酸能导电,是混合物,既不是电解质也不是非电解质;
④不溶于水,熔融状态下导电,属于电解质;
⑤蔗糖不能电离,属于非电解质;
⑥NaHSO4固体不能导电,溶于水导电,属于电解质,
⑦Ba(OH)2溶液能导电,属于混合物,既不是电解质也不是非电解质;
⑧熔融的NaCl能导电,属于电解质;
故能导电的为:①③⑦⑧;电解质为:④⑥⑧;
(5)i. 易分解,除去固体中的固体,除杂时发生的化学方程式为;
ii.写出③的浓溶液和④反应制备氯气的离子方程式:;
(6)所有的置换反应全是氧化还原反应,是被包含和包含的关系,故A是氧化还原反应,B是置换反应,所以C是离子反应;
(7)酸碱反应也会生成沉淀,例如;
(8)根据方程式,有原子守恒,可知X为:;当有(0.2mol)参与反应时,O化合价0→-2该反应转移的电子数目为,S元素的化合价未发生变化,其中既不是氧化剂也不是还原剂,故选D。
19.(1) SO2+Br2+2H2O=4H++ +2Br- 5∶1
(2)A
(3) 萃取 液体分层,上层几乎无色,下层呈紫红色
(4) 5I-+ +6H+=3I2+3H2O 过滤 漏斗 玻璃棒
【分析】海水提溴:苦卤中通入氯气把Br-氧化为Br2,用热空气吹出Br2,用SO2吸收Br2蒸汽生成硫酸和氢溴酸,富集Br元素,通入氯气把Br-氧化为Br2,蒸馏得到液溴。
海带提碘:用氧气把海带浸取液中的I-氧化为I2,用CCl4萃取出I2;I2的CCl4溶液蒸馏可得纯碘;I2的CCl4溶液用浓氢氧化钠溶液反萃取生成NaI、NaIO3,水层加硫酸,NaI、NaIO3发生归中反应生成I2的悬浊液,过滤得到粗碘。
【详解】(1)步骤④是用SO2吸收Br2蒸汽生成硫酸和氢溴酸,反应的离子方程式为SO2+Br2+2H2O=4H++ +2Br-。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,根据得失电子守恒,反应方程式为3Br2+6Na2CO3+3H2O→5NaBr+NaBrO3+6NaHCO3,Br元素化合价由0升高为+5、由0降低为-1,根据得失电子守恒,氧化剂与还原剂的物质的量之比为5:1。
(2)A. 双氧水能把I-氧化为I2,并且还原产物为水,不引入杂质,选A;
B. 氯水能把I-氧化为I2,还原产物为Cl-,易引入杂质离子,不选B;
C. 酸性KMnO4溶液能把I-氧化为I2,还原产物为Mn2+,引入杂质离子,不选C;
D. 氯化铁溶液溶液能把I-氧化为I2,还原产物为Fe2+,引入杂质离子,不选D;
选A。
(3)步骤X是用CCl4萃取出I2,操作后分液漏斗内观察到的现象是液体分层,上层几乎无色,下层呈紫红色。
(4)方案乙中,上层液体中加入H2SO4溶液,NaI、NaIO3发生归中反应生成I2的悬浊液,反应的离子方程式为5I-+ +6H+=3I2+3H2O,其中操作Z是用过滤法分离出碘单质,所用到的玻璃仪器有烧杯、漏斗、玻璃棒。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在指定条件下,下列选项所示的物质间转化能实现的是
A.NO(g)HNO3(aq) B.稀硝酸NO2
C.NO2(g)HNO3(aq) D. (aq) (aq)
2.下列均为在日常生活中能找到的物质,按混合物、碱、盐顺序排列的是
A.白醋、生石灰、食盐 B.冰水混合物、水泥、硝酸铵
C.管道煤气、熟石灰、熟石膏 D.牙膏、纯碱、小苏打
3.NA是阿伏加德罗常数。下列说法正确的是
A.1.2g Mg完全转化为MgO时转移电子数为0.1NA
B.标准状况下,22.4L SO3中含有 SO3的物质的量为1mol
C.2.2g D218O中含有的中子数为NA
D.0.1mol·L-1Na2SO4 溶液中含有的氧原子数为0.4NA
4.合成17 t NH3,放出Q kJ热量。利用浓氨水吸收氯气工业的尾气,同时得到副产品NH4Cl;也可以用FeCl2溶液吸收氯气制得FeCl3溶液,然后制备Fe(OH)3胶体;经实验发现,溶液几乎都有丁达尔效应(粒子对光的散射现象),且丁达尔现象随其浓度升高逐渐增强,胶体的丁达尔现象比溶液的强。现用以下装置区别FeCl3溶液和Fe(OH)3胶体,下列说法不正确的是
A.溶液靠近光源时,溶液和胶体均有明显的丁达尔现象
B.胶体靠近光源时,胶体有明显的丁达尔现象,溶液无明显现象
C.通过溶液、胶体互换位置,出现二次丁达尔现象的为溶液,只出现一次丁达尔现象的为胶体
D.通过溶液、胶体互换位置,只出现一次丁达尔现象的为溶液,出现二次丁达尔现象的为胶体
5.实验室从废定影液(含和等)中回收Ag和的主要步骤流程如下,其中部分操作的装置如图所示(已知苯的密度小于水),下列叙述正确的是
A.用装置甲分离时,用玻璃棒轻轻搅拌
B.用装置乙在空气中高温灼烧制取Ag
C.用装置丙制备用于氧化滤液中的
D.用装置丁分液时从上口倒出有机相
6.设为阿伏加德罗常数的数值,下列说法正确的是
A.1mol/L NaCl溶液中含有个 B.标准状况下,中含有个分子
C.常温下,含有个氧原子 D.铝与足量稀盐酸反应生成个分子
7.设为阿伏加德罗常数的值,下列说法正确的是
A.中含有的电子数为
B.物质的量浓度为的溶液中,含有的数目为
C.重水中含有的质子数为
D.标准状况下,气体中碳原子数为
8.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.标准状况下,2.24L 中分子数为0.1 NA
B.常温常压下,18g 与18g 所含电子数均为10 NA
C.常温常压下,92g的和混合气体含有的原子数为6 NA
D.常温常压下,22.4L氯气与足量的镁粉充分反应,转移的电子数为2 NA
9.反应可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是
A.中子数为9的氮原子: B.分子的结构式:Cl-Cl
C.分子的电子式: D.的结构示意图:
10.化学与生产、生活密切相关。下列说法不正确的是
A.海水资源的综合利用涉及制取镁和溴等,其过程中均涉及氧化还原反应
B.“燃煤固硫”“汽车尾气催化净化”等措施均涉及化学变化
C.北斗卫星导航系统由中国自主研发、独立运行,其所用芯片的主要成分为
D.“神舟13号”宇宙飞船返回舱所用高温结构陶瓷,属于新型无机非金属材料
11.下列关于物质保存的方法错误的是
A.硝酸银溶液保存在棕色细口瓶中 B.氯水保存在棕色细口瓶中
C.液氯保存在干燥的钢瓶中 D.漂白粉可露置在空气中保存
12.将足量通入下列各溶液中,所含离子还能大量共存的是
A.、、、 B.、、、
C.、、、 D.、、、
13.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.碳酸钠与:碳酸氢钠与
B.溶液与溶液:溶液与溶液
C.溶液与硝酸溶液:溶液与硝酸溶液
D.澄清石灰水与盐酸:溶液与硫酸
14.海水提溴和海带提碘都需经过浓缩、氧化、提取三个步骤。有关叙述错误的是
A.提取溴时利用溴的挥发性
B.提溴的浓缩液来自于海水晒盐后的卤水
C.提取碘时利用碘的升华特性
D.氧化步骤都可以通入氯气来实现
15.海水开发利用的部分过程如图所示。下列说法错误的是
A.上述过程涉及氧化还原反应
B.可以采用蒸馏法从海中获得淡水
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
二、实验题
16.氮化铝(AlN)是一种性能优异的新型材料,化学小组模拟工业制氮化铝原理,欲在实验室制备氮化铝并进行相关性质实验。查阅资料:
①实验室用饱和NaNO2溶液与NH4Cl溶液共热制N2:NaNO2+NH4ClNaCl+N2↑+2H2O
②工业制氮化铝:Al2O3+3C+N22AlN+3CO,氮化铝在高温下会与水反应。
③对比实验资料表:
资料编号 反应物 生成物1 生成物2
(1) 铝与氢氧化钠溶液 无色无味气体 相同钠盐
(2) 氮化铝与氢氧化钠溶液 无色刺激性气味气体
I.氮化铝的制备
(1)实验中使用的装置如图所示,请按照氮气气流方向将各装置连接,顺序依次为_______;C→B→_______→_______→E。
(2)仪器m的名称是_______。
(3)B装置内的X是_______,E中氯化钯溶液的作用是_______。
Ⅱ.氮化铝的性质实验
(4)取上述实验所制得的少量氮化铝于试管中,加入氢氧化钠溶液,发生反应的化学方程式_______。
(5)设计实验可将氮化铝转化为AlCl3,再与MgCl2、稀盐酸混合配成溶液,往混合液中逐滴加入0.1 mol·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如图所示。则溶液中Al3+、Mg2+两种阳离子的物质的量浓度之比为_______。
17.某研究小组利用下图所示装置探究卤素的性质。
(1)实验室用MnO2与浓盐酸反应制取Cl2,利用了MnO2的_______ (填“氧化性”或“还原性”)
(2)①中溶液由无色变为黄色,发生反应的离子方程式是_______。
(3)②中NaOH溶液的作用是_______,发生反应的离子方程式是_______。
(4)若用排空气法收集一瓶氯气,可利用方框中的装置代替装置①,请将方框中的收集装置补充完整_____。
三、原理综合题
18.I.阅读古诗回答有关问题。
《石灰吟》
于谦
千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。
(1)从物质分类的角度看,诗中“千锤万凿出深山”所开采的物质属于_______(填字母序号)。
A.酸 B.碱 C.盐 D.无氧酸盐 E.含氧酸盐
(2)关于“烈火焚烧若等闲”发生的反应,反应的产物中有无电解质_______(填写“有”或“无”)。
(3)诗中涉及的物质中,摩尔质量最大的是_______(填化学式),该物质中原子的总数为_______(用表示阿伏加德罗常数的值)。
II.现有物质 ①铜 ②干冰 ③盐酸 ④ ⑤蔗糖 ⑥固体 ⑦溶液⑧熔融的
(4)能导电的是:_______(填序号,下同),属于电解质的是_______。
(5)按要求写出反应的方程式:
i.若要除去固体中的固体,除杂时发生的化学方程式为_______。
ii.写出③的浓溶液和④反应制备氯气的离子方程式_______。
III.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(6)下图为离子反应、氧化还原反应和置换反应三者间的关系,其中表示离子反应的是_______(填字母)。
(7)有同学认为所有酸碱中和反应均可表示为。请举个例子反驳上述观点(用离子方程式表示)_______。
(8)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:。则的化学式是_______。当有参与反应时,该反应转移的电子数目为_______(用表示阿伏加德罗常数的值),其中是该反应的_______(填字母)。
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
四、工业流程题
19.从海水中可以获得淡水、食盐并可提取镁和溴等物质。
实验(一)海水提溴:空方气吹出法是工业规模提溴的常用法,其流程如图:
(1)步骤④反应的离子方程式为___________。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收3molBr2时,氧化剂与还原剂的物质的量之比为___________。
实验(二)碘的制取:另取海带浸取原液,甲、乙两种实验方案如图:
已知:3I2+6KOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
(2)“适量O2”中能代替O2的最佳物质是___________。
A.双氧水 B.氯水 C.酸性KMnO4溶液 D.氯化铁溶液
(3)步骤X的名称是___________,操作后分液漏斗内观察到的现象是___________。
(4)方案乙中,上层液体中加入H2SO4溶液,反应的离子方程式为___________,其中操作Z的名称是___________,所用到的玻璃仪器有烧杯___________、___________。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.NO不与H2O反应,选项A不符合题意;
B.稀HNO3与Cu反应生成NO,3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,选项B不符合题意;
C. 发生反应为3NO2+H2O= 2HNO3+NO,能实现转化,选项C符合题意;
D.中的N为最高价+5价,O3为氧化剂,因此不能生成,选项D不符合题意;
答案选C。
2.C
【详解】A.生石灰为CaO,是氧化物不是碱,食盐中有其他添加剂,属于混合物,A错误;
B.冰水混合物为纯净物,水泥属于混合物,不是碱,B错误;
C.管道煤气中含有一氧化碳、甲烷等气体,属于混合物,熟石灰为氢氧化钙,属于碱,熟石膏为硫酸钙晶体,属于盐,C正确;
D.纯碱为碳酸钠属于盐而不是碱,D错误;
故答案选C。
3.A
【详解】A.每个镁反应转移2个电子,故1.2克镁即0.05mol镁反应转移0.1mol电子,A正确;
B.标况下三氧化硫不是气体 ,不能使用气体摩尔体积进行计算,B错误;
C.2.2g D218O的物质的量为,每个分子中的中子数为1×2+10=12,故物质中含有的中子数为1.2NA,C错误;
D.溶液的体积没有说明,且溶液中水分子含有氧原子,不能计算,D错误;
故选A。
4.C
【详解】A.根据题意,溶液几乎都有丁达尔效应(粒子对光的散射现象),当溶液靠近光源时,溶液和胶体都有明显丁达尔现象,故A正确;
B.胶体靠近光源时,胶体有丁达尔现象,通过胶体后光源变弱,溶液没有明显的丁达尔现象,而故B正确;
C.直接与光源接触光强,溶液有丁达尔响应。但经过溶液后光变弱胶体就无法丁达尔效应了,因此通过溶液、胶体互换位置,出现二次丁达尔现象的为胶体,只出现一次丁达尔现象的为溶液,故C错误;
D.根据C选项分析得到D是正确的,故D正确。
综上所述,答案为C。
5.D
【详解】A.过滤分离 时,用玻璃棒不断搅拌,容易损坏滤纸,选项A不正确;
B.蒸发皿不能用于灼烧,在空气中高温灼烧 会生成 SO2,污染环境,同时生成的 Ag 会被氧化成 Ag2O,选项B不正确;
C.MnO2与浓盐酸需加热才能反应生成 Cl2,选项C不正确;
D.苯的密度小于水,有机层在上层,分液时,先放出水相,再从分液漏斗上口倒出有机相, 选项D 正确;
答案选D。
6.C
【详解】A.题干未告知溶液体积,故无法计算1mol/L NaCl溶液中含有的数目,A错误;
B.标准状况下H2O为液体,故无法计算22.4LH2O中含有H2O的分子数目,B错误;
C.常温下,含有氧原子的数目为=,C正确;
D.根据反应方程式为:2Al+6HCl=2AlCl3+3H2↑可知,铝与足量稀盐酸反应生成3NA个H2分子,D错误;
故答案为:C。
7.D
【详解】A.0.1molAl3+中含有的电子数为,A错误;
B.物质的量浓度为1 mol L 1的BaCl2溶液中,溶液体积未知,无法计算Cl 个数,B错误;
C.18g重水(D2O)中含有的质子数为,C错误;
D.标准状况下,22.4L CO气体物质的量为1mol,因此所含的碳原子数为NA,D正确;
故选D。
8.C
【详解】A.标准状况下,三氧化硫为固态,无法计算2.24L三氧化硫的物质的量和含有的分子数目,故A错误;
B.水和重水的摩尔质量不相等,则18g水和18g重水的物质的量不相等,含有的电子数不相等,故B错误;
C.二氧化氮和四氧化二氮的最简式相同,均为NO2,则92g混合物中含有的原子数目为×3×NAmol—1=6NA,故C正确;
D.常温常压下,气体摩尔体积大于22.4L/mol,则22.4L氯气的物质的量小于1mol,与足量的镁粉充分反应,转移的电子数小于2NA,故D错误;
故选C。
9.B
【详解】A.氮元素的质子数为7 ,中子数为9的氮原子的质量数=质子数+中子数=7+9=16 ,该核素可以表示为:,故A错误;
B.Cl2分子是两个氯原子共用一对电子形成的,结构式为Cl-Cl,故B正确;
C.N2分子是两个氮原子共用三对电子形成的,每个氮原子还有一对未参与成键的电子,其电子式为 ,故C错误;
D.Cl-是Cl得到1个电子形成的,最外层电子数为8,结构示意图为: ,故D错误;
故答案选B。
10.C
【详解】A.镁和溴在海水中都是以化合态形式存在,则海水资源的综合利用涉及制取镁和溴等,其过程中均涉及氧化还原反应,A正确;
B.过程属于物理变化,“燃煤固硫”主要是指把氧化钙或碳酸钙和含硫的煤混合后燃烧,涉及化学变化,“汽车尾气催化净化”是指CO与NO,在催化剂的作用下反应生成无毒的CO2和N2,属于化学变化,B正确;
C.芯片的主要成分为硅,C错误;
D.高温结构陶瓷属于新型无机非金属材料,D正确;
故选C。
11.D
【详解】A.液体药品应该保存在细口瓶中,硝酸银见光易分解,保存在棕色细口瓶中,A项正确;
B.氯水见光易分解,因此保存在棕色细口瓶中,B项正确;
C.液氯与干燥的钢瓶不反应,因此可用钢瓶来储存液氯,C项正确;
D.漂白粉露置于空气中会吸收二氧化碳变成次氯酸,次氯酸见光易分解而变质,D项错误;
答案选D。
12.C
【详解】A.与会发生氧化还原反应生成S单质,不能共存,故A不选;
B.将足量通入溶液中会生成亚硫酸,在酸性环境中具有强氧化性,会和发生氧化还原反应,不能共存,故B不选;
C.、、、四种离子之间不反应,且均与二氧化硫不反应,可大量共存,故C选;
D.和会发生反应,不能共存,故D不选;
故选C。
13.D
【详解】A.碳酸钠与Ca(OH)2反应的离子方程式为:+Ca2+=CaCO3↓,若NaHCO3(过量)和Ca(OH)2反应的离子方程式为:2OH-+2 +Ca2+=CaCO3↓++2H2O,二者不同,故A不选,
B.BaCl2溶液与Na2SO4溶液反应的离子方程式为Ba2++=BaSO4↓;Ba(OH)2溶液与NaHSO4溶液反应的离子方程式为Ba2++2OH-+2H++=BaSO4↓+2H2O或Ba2++OH-+H++=BaSO4↓+H2O,故B不选;
C.Na2CO3溶液与硝酸溶液反应的离子方程式为+2H+=H2O+CO2↑;碳酸钙为难溶物不可拆,CaCO3与硝酸溶液反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故C不选;
D.澄清石灰水与盐酸本质为酸碱中和反应,氢氧化钠和硫酸也是酸碱中和反应,反应的离子方程式均为H++OH-=H2O,故D选;
故答案为D。
14.C
【详解】A.溴易挥发,可鼓入热空气或热水蒸气将溴分离出来,故A正确;
B.提溴的浓缩液来自于海水晒盐后的卤水,可使溴离子浓度增大,为浓缩过程,故B正确;
C.海带中无单质碘,存在形式为碘离子,提取碘是利用氧化剂氧化碘离子生成碘单质,萃取分液、蒸馏方法得到,故C错误;
D.氯气具有氧化性,可以氧化Br—、I—生成Br2、I2单质,故D正确;
故选C。
15.C
【分析】由流程可知,海水晒盐分离出粗盐,在苦卤中通入氯气可氧化溴离子生成溴单质,含镁离子的溶液中加沉淀剂为CaO或氢氧化钙等可实现对镁离子的提纯和富集,得到氢氧化镁沉淀,据此解答。
【详解】A.上述过程中,氯气氧化溴离子生成溴单质的反应为氧化还原反应,故A正确;
B.控制水的沸点,可以采用蒸馏法从海中获得淡水,故B正确;
C.由于氢氧化钙比氢氧化钠便宜,工业生产中常选用氢氧化钙作为沉淀剂,故C错误;
D.溴易挥发,先用空气和水蒸气吹出单质溴,再用SO2将其还原为溴化氢,从而达到富集溴的目的,故D正确;
故选:C。
16.(1)D、A
(2)球形干燥管
(3) 浓硫酸 吸收反应生成的CO防止进入空气引起污染
(4)AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑或AlN+NaOH+H2O=NaAlO2+NH3↑
(5)2:1
【分析】C中是饱和NaNO2溶液与NH4Cl溶液共热制氮气,用B装置浓硫酸干燥氮气,在D中氧化铝和氮气反应生成AlN,用E装置处理尾气CO,为防止E中水蒸气进入到D中,用碱石灰干燥CO。
【详解】(1)根据前面分析,先制备氮气,再干燥氮气,再是氮气和氧化铝反应,再防止水蒸气进入D中,最后处理尾气,其气流顺序依次为:C→B→D→A→E;故答案为:D、A。
(2)根据图中信息得到仪器m的名称是球形干燥管;故答案为:球形干燥管。
(3)B装置主要是干燥氮气,因此装置内的X是浓硫酸,CO有毒,会污染环境,因此E中氯化钯溶液的作用是吸收反应生成的CO防止进入空气引起污染;故答案为:浓硫酸;吸收反应生成的CO防止进入空气引起污染。
(4)取上述实验所制得的少量氮化铝于试管中,加入氢氧化钠溶液,得到无色刺激性气味气体即氨气,还得到偏铝酸钠,其发生反应的化学方程式AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑或AlN+NaOH+H2O=NaAlO2+NH3↑;故答案为:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑或AlN+NaOH+H2O=NaAlO2+NH3↑。
(5)根据题意溶解氢氧化铝用氢氧化钠溶液体积为10mL,则沉淀铝离子需要氢氧化钠溶液体积为30mL,沉淀镁离子需要氢氧化钠溶液体积为10mL,铝离子和镁离子分别消耗氢氧化钠物质的量为0.03mol、0.01mol,根据关系式Mg2+~2OH-,Al3+~3OH-,则溶液中Al3+、Mg2+两种阳离子的物质的量分别为0.01mol、0.0005mol,则其物质的量浓度之比为2:1;故答案为:2:1。
17.(1)氧化性
(2)Cl2+2I-=I2+2Cl-
(3) 吸收剩余的尾气氯气,防止污染空气 Cl2+2OH-=Cl-+ClO-+H2O
(4)
【详解】(1)二氧化锰和浓盐酸加热反应生成氯气,氯元素化合价升高失电子发生氧化反应,锰元素化合价降低得到电子发生还原反应,二氧化锰作氧化剂具有氧化性,氯化氢作还原剂具有还原性,故答案为:氧化性;
(2)①中溶液由无色变为黄色,是氯气通过碘化钾溶液发生氧化还原反应生成碘单质,发生反应的离子方程式是:Cl2+2I-=I2+2Cl-,故答案为:Cl2+2I-=I2+2Cl-;
(3)②中NaOH溶液的作用是吸收剩余的尾气氯气,防止污染空气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:吸收剩余的尾气氯气,防止污染空气;Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气比空气重,应用向上排气法收集,导气管长进短出,收集装置为: ,故答案为: 。
18.(1)CE
(2)有
(3)
(4) ①③⑦⑧ ④⑥⑧
(5)
(6)C
(7)
(8) D
【详解】(1)诗中“千锤万凿出深山”所开采的物质是CaCO3,电离产生金属阳离子Ca2+和酸根阴离子CO,由于阴离子中含有氧元素,因此该物质属于盐,是含氧酸盐故合理选项是CE;
(2)“烈火焚烧若等闲”对应的反应为CaCO3高温分解为CaO与CO2,CaCO3为电解质;
(3)诗中涉及的反应中,要留清白在人间,发生反应是:CaO+H2O=Ca(OH)2,“烈火焚烧若等闲”对应的反应为CaCO3高温分解为CaO与CO2,CaCO3,其中摩尔质量最大的为:CaCO3;该物质的物质的量为0.5mol,其中原子的总物质的量为0.5mol×5=2.5mol,总个数为2.5NA;
(4)①铜能导电,是金属单质,既不是电解质也不是非电解质,可导电;
②干冰不能导电,属于非电解质;
③盐酸能导电,是混合物,既不是电解质也不是非电解质;
④不溶于水,熔融状态下导电,属于电解质;
⑤蔗糖不能电离,属于非电解质;
⑥NaHSO4固体不能导电,溶于水导电,属于电解质,
⑦Ba(OH)2溶液能导电,属于混合物,既不是电解质也不是非电解质;
⑧熔融的NaCl能导电,属于电解质;
故能导电的为:①③⑦⑧;电解质为:④⑥⑧;
(5)i. 易分解,除去固体中的固体,除杂时发生的化学方程式为;
ii.写出③的浓溶液和④反应制备氯气的离子方程式:;
(6)所有的置换反应全是氧化还原反应,是被包含和包含的关系,故A是氧化还原反应,B是置换反应,所以C是离子反应;
(7)酸碱反应也会生成沉淀,例如;
(8)根据方程式,有原子守恒,可知X为:;当有(0.2mol)参与反应时,O化合价0→-2该反应转移的电子数目为,S元素的化合价未发生变化,其中既不是氧化剂也不是还原剂,故选D。
19.(1) SO2+Br2+2H2O=4H++ +2Br- 5∶1
(2)A
(3) 萃取 液体分层,上层几乎无色,下层呈紫红色
(4) 5I-+ +6H+=3I2+3H2O 过滤 漏斗 玻璃棒
【分析】海水提溴:苦卤中通入氯气把Br-氧化为Br2,用热空气吹出Br2,用SO2吸收Br2蒸汽生成硫酸和氢溴酸,富集Br元素,通入氯气把Br-氧化为Br2,蒸馏得到液溴。
海带提碘:用氧气把海带浸取液中的I-氧化为I2,用CCl4萃取出I2;I2的CCl4溶液蒸馏可得纯碘;I2的CCl4溶液用浓氢氧化钠溶液反萃取生成NaI、NaIO3,水层加硫酸,NaI、NaIO3发生归中反应生成I2的悬浊液,过滤得到粗碘。
【详解】(1)步骤④是用SO2吸收Br2蒸汽生成硫酸和氢溴酸,反应的离子方程式为SO2+Br2+2H2O=4H++ +2Br-。除SO2外,步骤④还可以选用Na2CO3溶液吸收溴,根据得失电子守恒,反应方程式为3Br2+6Na2CO3+3H2O→5NaBr+NaBrO3+6NaHCO3,Br元素化合价由0升高为+5、由0降低为-1,根据得失电子守恒,氧化剂与还原剂的物质的量之比为5:1。
(2)A. 双氧水能把I-氧化为I2,并且还原产物为水,不引入杂质,选A;
B. 氯水能把I-氧化为I2,还原产物为Cl-,易引入杂质离子,不选B;
C. 酸性KMnO4溶液能把I-氧化为I2,还原产物为Mn2+,引入杂质离子,不选C;
D. 氯化铁溶液溶液能把I-氧化为I2,还原产物为Fe2+,引入杂质离子,不选D;
选A。
(3)步骤X是用CCl4萃取出I2,操作后分液漏斗内观察到的现象是液体分层,上层几乎无色,下层呈紫红色。
(4)方案乙中,上层液体中加入H2SO4溶液,NaI、NaIO3发生归中反应生成I2的悬浊液,反应的离子方程式为5I-+ +6H+=3I2+3H2O,其中操作Z是用过滤法分离出碘单质,所用到的玻璃仪器有烧杯、漏斗、玻璃棒。
答案第1页,共2页
答案第1页,共2页
同课章节目录
