专题2研究物质的基本方法综合练习-(含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题2研究物质的基本方法综合练习-(含解析)2022——2023学年上学期高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 343.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-06-22 08:13:45 | ||
图片预览




文档简介
专题2研究物质的基本方法综合练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.要鉴别NH4Cl、Na2SO4和(NH4)2SO4三种溶液,可加入下列试剂的
A.NaOH溶液 B.Ba(NO3)2溶液 C.Ba(OH)2溶液 D.AgNO3溶液
2.化学是一门从分子、原子层次上研究物质的性质、组成、结构与变化规律的学科。下列说法不正确的是
A.人们往往需要借助实验观测的事实对假设的正确与否进行检验
B.制陶、冶金及酿酒的过程中,一定都发生了化学变化
C.随着先进仪器的不断使用,研究化学已不再需要通过实验的方法
D.模型研究对科学家探索物质的微观结构有重要意义
3.《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是
A.洗涤 B.粉碎 C.萃取 D.蒸发
4.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是
A.将海带灼烧成灰 B.过滤得含I-溶液
C.放出碘的苯溶液 D.分离碘并回收苯
A.A B.B C.C D.D
5.要除去FeCl2溶液中少量的FeCl3,下列方法可行的是
A.滴入KSCN溶液 B.加入铁粉 C.通入氯气 D.加入铜粉
6.在、、的混合溶液中,、、的物质的量浓度之比为1∶2∶4,现加入适量的铁粉,充分反应后使溶液中三种离子的物质的量浓度之比变为9∶3∶1,则原溶液中的Fe与参与反应的铁粉物质的量比为
A.3∶5 B.4∶5 C.6∶5 D.5∶4
7.在无土栽培液中,每升溶液需用溶液、溶液、溶质作为培养液,若用和三种物质来配制上述营养液,所需三种盐的物质的量是
A. B.
C. D.
8.将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
A.3:2 B.3:5 C.4:3 D.3:4
9.下列叙述错误的个数是
①摩尔是国际单位制中七个基本物理量之一
②1mol任何物质都含有约个分子
③就是阿伏加德罗常数
④氢原子的摩尔质量是1g
⑤物质的量浓度的单位都是
⑥硫酸的摩尔质量与硫酸的相对分子质量在数值上相等
A.3 B.4 C.5 D.6
10.关于0.1 mol·L-1 HNO3溶液的叙述错误的是
A.1 L该溶液中含有HNO3的质量为6.3 g
B.0.5 L该溶液中氢离子的物质的量浓度为0.1 mol·L-1
C.从1 L该溶液中取出100 mL,则取出溶液中HNO3的物质的量浓度为0.01 mol·L-1
D.取该溶液10 mL,加水稀释至100 mL后HNO3的物质的量浓度为0.01 mol·L-1
11.关于下面8种微粒中子数相同的微粒是
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
A.④⑦ B.①②③ C.①② D.④⑥⑦
12.下列叙述正确的是
A.电子的能量越低,运动区域离核越远
B.电子一般总是先从内层排起,当一层充满后再填充下一层
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子
13.下列有关放射性核素氘的表述不正确的是
A.原子核外电子数为1 B.原子核内中子数为3
C.与化学性质基本相同 D.具有放射性
14.下列关于金属元素与非金属元素的叙述中,正确的是
A.非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数
B.非金属元素呈现的最低负化合价,其绝对值等于该元素原子核外最外层电子数
C.若某元素原子核外最外层电子数不超过2,则该元素一定是金属元素
D.若某元素原子核外最外层电子数为5,则该元素一定是非金属元素
15.某核素的质量数为A,其阴离子Xn-核外有x个电子。有关该微粒的描述正确的是
A.Xn-的原子核内一定有(A-x-n)个中子
B.Xn-的原子核内一定有(x-n)个质子
C.Xn-的最外层一定具有8电子稳定结构
D.Xn-的次外层一定排布了8个电子
二、填空题
16.回答下列问题
(1)0.5mol水中含有___________个水分子;9g水与___________g硫酸所含的分子数相等。
(2)100mL0.2mol/LNa2SO4溶液中Na+的物质的量浓度为___________。
(3)标准状况下,和2molNH3含有相同氢原子数的CH4的体积为___________。
(4)从1LAl2(SO4)3溶液中取出100mL,向其中加入200mL0.9mol·L-1的BaCl2溶液恰好使SO完全沉淀,则原溶液中Al3+的物质的量浓度为___________。
(5)12.4gNa2R含0.4molNa+,则Na2R的摩尔质量为___________,R的相对原子质量为___________。
(6)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是___________。
17.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1)Fe原子的核内中子数为___________,该原子的核外电子数为___________。
(2)以下关于Fe的叙述正确的是___________(填序号)。
A.Fe与Fe是两种核素
B.科学家获得了一种新元素
C.Fe的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成Fe
(3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是___________。
三、实验题
18.铝镁合金是飞机制造、建筑等行业的重要材料。为测定某铝镁合金(不含其他元素)中铝的质量分数,将一定量铝镁合金与足量稀硫酸溶液反应,设计了下列实验方案进行探究。填写下列空白:
(1)同学们拟选用下列实验装置完成实验:
你认为最简易的装置其连接顺序是_______→_______→_______;连接好装置首先应进行的操作是_______。
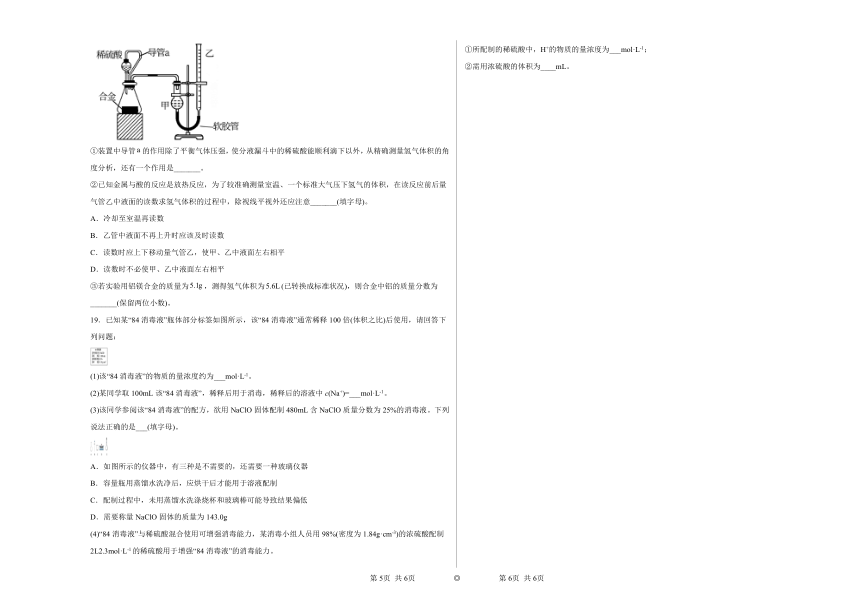
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管的作用除了平衡气体压强,使分液漏斗中的稀硫酸能顺利滴下以外,从精确测量氢气体积的角度分析,还有一个作用是_______。
②已知金属与酸的反应是放热反应,为了较准确测量室温、一个标准大气压下氢气的体积,在读反应前后量气管乙中液面的读数求氢气体积的过程中,除视线平视外还应注意_______(填字母)。
A.冷却至室温再读数
B.乙管中液面不再上升时应该及时读数
C.读数时应上下移动量气管乙,使甲、乙中液面左右相平
D.读数时不必使甲、乙中液面左右相平
③若实验用铝镁合金的质量为,测得氢气体积为(已转换成标准状况),则合金中铝的质量分数为_______(保留两位小数)。
19.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用,请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为___mol·L-1。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是___(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为___mol·L-1;
②需用浓硫酸的体积为____mL。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.溶液与NH4Cl、(NH4)2SO4反应,都生成氨气,现象相同,不能区分,A错误;
B.溶液与Na2SO4、(NH4)2SO4反应,都生成白色沉淀,现象相同,不能区分,B错误;
C.溶液与NH4Cl、Na2SO4、(NH4)2SO4反应,产生的现象分别为气体、沉淀、气体和沉淀,所以能够区分,C正确;
D.溶液与NH4Cl、Na2SO4、(NH4)2SO4反应,都产生白色沉淀,现象相同,不能区分,D错误;
故选C。
2.C
【详解】A.人们往往根据自己的研究目标,依据一-定的理论基础,设计并进行实验再从实验数据或现象中得出假说:通过实验或理论证明假说正确与否,A正确;
B.制陶、冶金及酿酒过程中,都有新物质生成,属于化学变化,B正确;
C.化学是以实验为基础的学科,不会离开实验,C错误;
D.建立模型在科学研究中有着重要的作用,模型可以帮助人们认识和理解一些不能直接观察到的微观结构,D正确;
故选C。
3.C
【详解】水洗净是指洗去固体表面的可溶性污渍、泥沙等,涉及的操作方法是洗涤;细研水飞是指将固体研成粉末后加水溶解,涉及的操作方法是溶解;去石澄清是指倾倒出澄清液,去除未溶解的固体,涉及的操作方法是倾倒;慢火熬干是指用小火将溶液蒸发至有少量水剩余,涉及的操作方法是蒸发;因此未涉及的操作方法是萃取,答案选C。
4.D
【详解】A.灼烧海带应用坩埚,而不能用烧杯,A错误;
B.过滤时应用玻璃棒引流,B错误;
C.苯的密度比水的小,萃取了单质碘的苯层在上层,应从分液漏斗的上口倒出,C错误;
D.蒸馏操作装置正确,冷凝水流向正确,D正确;
故选D。
5.B
【详解】因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe=3FeCl2,故可用铁粉除去FeCl2溶液中的少量氯化铁;
答案选B。
6.A
【详解】依据加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为9:3:1,结合原溶液中 Fe2+、Cu2+、Fe3+的物质的量浓度之比为1:2:4,可知铜离子未参加反应,反应后的铜离子为2时,剩余的三价铁离子根据比值可知为,参加反应的三价铁离子为 4 =,根据反应 2Fe3++Fe=3Fe2+可知反应的Fe3+为,反应的铁粉为,则原溶液中的Fe2+与参与反应的铁粉物质的量比为1:=3:5;
答案选A。
7.A
【详解】1L混合液中,n(NH4Cl)=1L×0.5mol/L=0.5mol,n(KCl)=1L×0.16mol/L=0.16mol,n(K2SO4)=1L×0.24mol/L=0.24mol,故n(Cl-)=n(NH4Cl)+n(KCl)=0.5mol+0.16mol=0.66mol;n(K+)=n(KCl)+2n(K2SO4)=0.16mol+2×0.24mol=0.64mol;n(SO42-)=n(K2SO4)=0.24mol;用KCl、NH4Cl、(NH4)2SO4配制,则:n(KCl)=n(K+)=0.64mol;n(NH4Cl)=n(Cl-)-n(KCl)=0.66mol-0.64mol=0.02mol;n[(NH4)2SO4]=n(SO42-)=0.24mol;
答案选A。
8.D
【详解】设原溶液的体积为vL,设取出Cu后溶液中c(Fe3+):c(Fe2+)=2:3=k,则有:c(Fe3+)=2kmol/L,c(Fe2+)=3kmol/L,原溶液中n(Fe3+)=0.1mol/L×vL=0.1vmol,取出Cu后,n(Fe3+)1=2kmol/L×vL=2kvmol,n(Fe2+)=3kmol/L×VL=3kvmol,根据化学方程式列方程:2Fe3++Cu═Cu2++2Fe2+、n(Fe3+)=n(Fe3+)1+n(Fe2+),0.1vmol=2kvmol+3kvmol,得:k=0.02vmol,则反应后溶液中n(Fe3+)1=0.04vmol,反应前n(Fe3+)=0.1vmol,再根据方程式得n(Cu2+)=0.03vmol,所以n(Cu2+):n(Fe3+)1=0.03vmol:0.04vmol=3:4。
故选D。
9.D
【详解】①物质的量是国际单位制中七个基本物理量之一,而摩尔是物质的量的单位,①错误;
②1mol任何粒子集合体约含有个粒子,该粒子可能是分子或原子等,②错误;
③1mol任何粒子的粒子数叫阿伏加德罗常数,符号为,通常用表示,③错误;
④摩尔质量的单位是,④错误;
⑤物质的量浓度常用单位是,还有mmol/L等,⑤错误;
⑥摩尔质量以为单位时,摩尔质量才和相对分子质量或相对原子质量在数值上相等,⑥错误;
综上所述,本题选D。
【点睛】并不是所有的物质都是由分子构成的,有的物质是由原子或离子等构成的;如金刚石是由碳原子构成的,而NaCl是由和构成的。
10.C
【详解】A.1L该HNO3溶液中含有溶质的物质的量n=cV=0.1mol/L×1L=0.1mol,则其中含有溶质的质量m=0.1mol×63g/mol=6.3g,A项正确;
B.硝酸为一元强酸,则0.5 L该溶液中氢离子的物质的量浓度为0.1 mol·L-1,B项正确;
C.溶液具有均一性,溶液的浓度与其取出的体积大小无关,所以从1L该溶液中取出100mL,则取出的溶液中HNO3的物质的量浓度仍为0.1mol/L,C项错误;
D.溶液在稀释过程中溶质的物质的量不变,所以稀释后溶液的浓度c==0.01mol/L,D项正确;
答案选C。
11.D
【分析】核素的符号中,元素符号左上角的数字表示质量数,左下角的数字表示质子数,中子数=质量数-质子数,据此作答。
【详解】①的中子数=18-8=10,②的中子数=18-9=9,③的中子数=12-6=6,④的中子数=24-12=12,⑤的中子数=25-12=13,⑥的中子数=23-11=12,⑦的中子数=23-11=12,⑧的中子数=35-17=18,由此可知,④⑥⑦的中子数相同,均为12,故选D。
12.B
【详解】A.电子的能量越低,运动区域离核越近,电子的能量越高,运动区域离核越远,A错误;
B.电子在核外排列时,根据能量最低原理,电子先排能量低的然后排能量高的,所以电子一般总是先从内层排起,当一层充满后再填充下一层,B正确;
C.氦为稀有气体元素,其最外层只有2个电子,C错误;
D.由电子的排布规律可知,M层最多排18个电子,但为最外层时,最多可排8个电子,D错误;
答案选B。
13.B
【详解】A.左上角为质量数,左下角为质子数,而原子的质子数=核外电子数,因此原子核外电子数为1,A正确;
B.原子核内中子数=质量数-质子数=3-1=2,B错误;
C.与均是由氢元素组成的氢气,化学性质基本相同,C正确;
D.中有放射性核素氘,因此具有放射性,D正确;
答案选B。
14.A
【详解】A.主族元素的最高正化合价等于该元素原子的最外层电子数,非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数,故A正确;
B.非金属元素呈现的最低负化合价,其绝对值=8-该元素原子核外最外层电子数,故B错误;
C.He原子最外层有2个电子,若某元素原子核外最外层电子数不超过2,则该元素不一定是金属元素,故C错误;
D.若某元素原子核外最外层电子数为5,则该元素不一定是非金属元素,如51号元素锑(Sb)是金属元素,故D错误;
选A。
15.B
【详解】A.X的质子数为x-n,中子数=质量数-质子数=A-(x-n),故A错误;
B.阴离子中质子数=阴离子核外电子数-所带电荷数,则X的质子数=x-n,故B正确;
C.Xn-的最外层也可能有2个电子,为2电子稳定结构,故C错误;
D.若X元素为长周期元素, Xn-的次外层电子数为18,故D错误;
故答案选B。
16.(1) 0.5NA 49g
(2)0.4mol/L
(3)33.6L
(4)1.2mol/L
(5) 62g/mol 16
(6)1:4
【解析】(1)
0.5mol水中含有水分子数为0.5mol×NAmol-1=0.5NA;9g水的物质的量为=0.5mol,分子数为0.5NA,0.5mol硫酸的质量为0.5mol×98g/mol=49g。
(2)
100mL0.2mol/LNa2SO4溶液中Na+的物质的量浓度与溶液体积无关,是硫酸钠浓度的2倍,故Na+的物质的量浓度为0.4mol/L。
(3)
2molNH3的氢原子为6mol,故CH4的物质的量为1.5mol,标准状况下的体积为1.5mol×22.4L/mol=33.6L。
(4)
n(SO)=n(Ba2+)=0.2L×0.9mol/L=0.18mol,所以n(Al3+)=0.18mol×=0.12mol,则100mL溶液中c(Al3+)==1.2mol/L,原溶液中c(AI+)浓度为1.2mol/L。
(5)
Na2R的物质的量为0.2mol,Na2R的摩尔质量为=62g/mol,R的相对原子质量为62-23×2=16。
(6)
在标准状况下,11.2L“人造空气”的物质的量为0.5mol,质量为4.8g,设氧气的物质的量为xmol,氦气的物质的量为ymol,则x+y=0.5mol,32x+4y=4.8g解得x=0.1mol,y=0.4mol,氧气和氦气的分子数之比是1:4。
17.(1) 19 26
(2)AC
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
【详解】(1)Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素,A正确;Fe元素不是一种新元素,B错误;Fe衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的,C正确;Fe衰变放出两个质子后变为Fe,D错误;故选AC。
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
18.(1) E D F 检查装置气密性
(2) 滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差 AC 53%
【分析】装置的组装顺序:合金与酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部;反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积。
【详解】(1)装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(F),故答案为:E、D、F;一套装置组装好后,都要检查装置是否漏气,故答案为:检查装置气密性;
(2)①滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,故答案为:滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②A.反应放热导致温度升高,气压增大,故应冷却后再读取氢气的体积,故A正确;
B.反应放热导致温度升高,所以不能在乙管中液面不再上升时就读数,应冷却到室温后再读取氢气的体积,故B错误;
C.读取实验中生成氢气的体积时应上下移动量气管乙,使甲、乙中液面左右相平,以保证甲中气体压强与大气压相等,故C正确;
D.读取实验中生成氢气的体积时应上下移动量气管乙,使甲、乙中液面左右相平,以保证甲中气体压强与大气压相等,故D错误;
故选AC;
③设5.1g镁铝合金中铝的质量为x,则产生的气体由Mg、Al与稀硫酸反应产生,则由关系式:解得:
解得:,解得x=2.7g,则合金中铝的质量分数为。
19.(1)4
(2)0.04
(3)C
(4) 4.6 250
【详解】(1)该“84消毒液”的物质的量浓度约为=≈4.0mol·L-1,故答案为:4.0;
(2)某同学取100mL该“84消毒液”中Na+浓度为4.0mol·L-1,稀释100倍后用于消毒,故稀释后的溶液中c(Na+)==0.04mol·L-1,故答案为:0.04;
(3)A.用固体配制一定物质的量浓度的溶液需要的仪器分别为:天平(含砝码)、烧杯、玻璃棒、500mL容量瓶和胶头滴管等,故如图所示的仪器中,有A、B两种是不需要的,还需要玻璃棒和胶头滴管两种玻璃仪器,A错误;
B.由于在定容步骤中还需向容量瓶中加入蒸馏水,故容量瓶用蒸馏水洗净后,不一定要烘干后才能用于溶液配制,B错误;
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致溶质的物质的量减少,故使所配溶液的浓度偏低,C正确;
D.需要称量NaClO固体的质量为0.5L×4.0mol·L-1×74.5g/mol=149.0g,D错误;
故答案为:C;
(4)①所配制的稀硫酸中,H+的物质的量浓度为2×2.3mol·L-1=4.6mol·L-1;故答案为:4.6;
②根据配制过程中溶质的量保持不变,设需用浓硫酸的体积为VmL,则有:1.84g·cm-3×VmL×98%=2L×2.3mol·L-1×98g/mol,解得:V=250,故答案为:250。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.要鉴别NH4Cl、Na2SO4和(NH4)2SO4三种溶液,可加入下列试剂的
A.NaOH溶液 B.Ba(NO3)2溶液 C.Ba(OH)2溶液 D.AgNO3溶液
2.化学是一门从分子、原子层次上研究物质的性质、组成、结构与变化规律的学科。下列说法不正确的是
A.人们往往需要借助实验观测的事实对假设的正确与否进行检验
B.制陶、冶金及酿酒的过程中,一定都发生了化学变化
C.随着先进仪器的不断使用,研究化学已不再需要通过实验的方法
D.模型研究对科学家探索物质的微观结构有重要意义
3.《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是
A.洗涤 B.粉碎 C.萃取 D.蒸发
4.从海带中提取碘的实验过程中,涉及下列操作,其中正确的是
A.将海带灼烧成灰 B.过滤得含I-溶液
C.放出碘的苯溶液 D.分离碘并回收苯
A.A B.B C.C D.D
5.要除去FeCl2溶液中少量的FeCl3,下列方法可行的是
A.滴入KSCN溶液 B.加入铁粉 C.通入氯气 D.加入铜粉
6.在、、的混合溶液中,、、的物质的量浓度之比为1∶2∶4,现加入适量的铁粉,充分反应后使溶液中三种离子的物质的量浓度之比变为9∶3∶1,则原溶液中的Fe与参与反应的铁粉物质的量比为
A.3∶5 B.4∶5 C.6∶5 D.5∶4
7.在无土栽培液中,每升溶液需用溶液、溶液、溶质作为培养液,若用和三种物质来配制上述营养液,所需三种盐的物质的量是
A. B.
C. D.
8.将Cu片放入0.1mol/LFeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
A.3:2 B.3:5 C.4:3 D.3:4
9.下列叙述错误的个数是
①摩尔是国际单位制中七个基本物理量之一
②1mol任何物质都含有约个分子
③就是阿伏加德罗常数
④氢原子的摩尔质量是1g
⑤物质的量浓度的单位都是
⑥硫酸的摩尔质量与硫酸的相对分子质量在数值上相等
A.3 B.4 C.5 D.6
10.关于0.1 mol·L-1 HNO3溶液的叙述错误的是
A.1 L该溶液中含有HNO3的质量为6.3 g
B.0.5 L该溶液中氢离子的物质的量浓度为0.1 mol·L-1
C.从1 L该溶液中取出100 mL,则取出溶液中HNO3的物质的量浓度为0.01 mol·L-1
D.取该溶液10 mL,加水稀释至100 mL后HNO3的物质的量浓度为0.01 mol·L-1
11.关于下面8种微粒中子数相同的微粒是
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
A.④⑦ B.①②③ C.①② D.④⑥⑦
12.下列叙述正确的是
A.电子的能量越低,运动区域离核越远
B.电子一般总是先从内层排起,当一层充满后再填充下一层
C.稀有气体元素原子的最外层都排有8个电子
D.当M层是最外层时,最多可排布18个电子
13.下列有关放射性核素氘的表述不正确的是
A.原子核外电子数为1 B.原子核内中子数为3
C.与化学性质基本相同 D.具有放射性
14.下列关于金属元素与非金属元素的叙述中,正确的是
A.非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数
B.非金属元素呈现的最低负化合价,其绝对值等于该元素原子核外最外层电子数
C.若某元素原子核外最外层电子数不超过2,则该元素一定是金属元素
D.若某元素原子核外最外层电子数为5,则该元素一定是非金属元素
15.某核素的质量数为A,其阴离子Xn-核外有x个电子。有关该微粒的描述正确的是
A.Xn-的原子核内一定有(A-x-n)个中子
B.Xn-的原子核内一定有(x-n)个质子
C.Xn-的最外层一定具有8电子稳定结构
D.Xn-的次外层一定排布了8个电子
二、填空题
16.回答下列问题
(1)0.5mol水中含有___________个水分子;9g水与___________g硫酸所含的分子数相等。
(2)100mL0.2mol/LNa2SO4溶液中Na+的物质的量浓度为___________。
(3)标准状况下,和2molNH3含有相同氢原子数的CH4的体积为___________。
(4)从1LAl2(SO4)3溶液中取出100mL,向其中加入200mL0.9mol·L-1的BaCl2溶液恰好使SO完全沉淀,则原溶液中Al3+的物质的量浓度为___________。
(5)12.4gNa2R含0.4molNa+,则Na2R的摩尔质量为___________,R的相对原子质量为___________。
(6)人造空气(氧气和氦气的混合气)可用于减轻某些疾病或供深水潜水员使用。在标准状况下,11.2L“人造空气”的质量是4.8g,其中氧气和氦气的分子数之比是___________。
17.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1)Fe原子的核内中子数为___________,该原子的核外电子数为___________。
(2)以下关于Fe的叙述正确的是___________(填序号)。
A.Fe与Fe是两种核素
B.科学家获得了一种新元素
C.Fe的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成Fe
(3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是___________。
三、实验题
18.铝镁合金是飞机制造、建筑等行业的重要材料。为测定某铝镁合金(不含其他元素)中铝的质量分数,将一定量铝镁合金与足量稀硫酸溶液反应,设计了下列实验方案进行探究。填写下列空白:
(1)同学们拟选用下列实验装置完成实验:
你认为最简易的装置其连接顺序是_______→_______→_______;连接好装置首先应进行的操作是_______。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。
①装置中导管的作用除了平衡气体压强,使分液漏斗中的稀硫酸能顺利滴下以外,从精确测量氢气体积的角度分析,还有一个作用是_______。
②已知金属与酸的反应是放热反应,为了较准确测量室温、一个标准大气压下氢气的体积,在读反应前后量气管乙中液面的读数求氢气体积的过程中,除视线平视外还应注意_______(填字母)。
A.冷却至室温再读数
B.乙管中液面不再上升时应该及时读数
C.读数时应上下移动量气管乙,使甲、乙中液面左右相平
D.读数时不必使甲、乙中液面左右相平
③若实验用铝镁合金的质量为,测得氢气体积为(已转换成标准状况),则合金中铝的质量分数为_______(保留两位小数)。
19.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用,请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为___mol·L-1。
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=___mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下列说法正确的是___(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制2L2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为___mol·L-1;
②需用浓硫酸的体积为____mL。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】A.溶液与NH4Cl、(NH4)2SO4反应,都生成氨气,现象相同,不能区分,A错误;
B.溶液与Na2SO4、(NH4)2SO4反应,都生成白色沉淀,现象相同,不能区分,B错误;
C.溶液与NH4Cl、Na2SO4、(NH4)2SO4反应,产生的现象分别为气体、沉淀、气体和沉淀,所以能够区分,C正确;
D.溶液与NH4Cl、Na2SO4、(NH4)2SO4反应,都产生白色沉淀,现象相同,不能区分,D错误;
故选C。
2.C
【详解】A.人们往往根据自己的研究目标,依据一-定的理论基础,设计并进行实验再从实验数据或现象中得出假说:通过实验或理论证明假说正确与否,A正确;
B.制陶、冶金及酿酒过程中,都有新物质生成,属于化学变化,B正确;
C.化学是以实验为基础的学科,不会离开实验,C错误;
D.建立模型在科学研究中有着重要的作用,模型可以帮助人们认识和理解一些不能直接观察到的微观结构,D正确;
故选C。
3.C
【详解】水洗净是指洗去固体表面的可溶性污渍、泥沙等,涉及的操作方法是洗涤;细研水飞是指将固体研成粉末后加水溶解,涉及的操作方法是溶解;去石澄清是指倾倒出澄清液,去除未溶解的固体,涉及的操作方法是倾倒;慢火熬干是指用小火将溶液蒸发至有少量水剩余,涉及的操作方法是蒸发;因此未涉及的操作方法是萃取,答案选C。
4.D
【详解】A.灼烧海带应用坩埚,而不能用烧杯,A错误;
B.过滤时应用玻璃棒引流,B错误;
C.苯的密度比水的小,萃取了单质碘的苯层在上层,应从分液漏斗的上口倒出,C错误;
D.蒸馏操作装置正确,冷凝水流向正确,D正确;
故选D。
5.B
【详解】因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe=3FeCl2,故可用铁粉除去FeCl2溶液中的少量氯化铁;
答案选B。
6.A
【详解】依据加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为9:3:1,结合原溶液中 Fe2+、Cu2+、Fe3+的物质的量浓度之比为1:2:4,可知铜离子未参加反应,反应后的铜离子为2时,剩余的三价铁离子根据比值可知为,参加反应的三价铁离子为 4 =,根据反应 2Fe3++Fe=3Fe2+可知反应的Fe3+为,反应的铁粉为,则原溶液中的Fe2+与参与反应的铁粉物质的量比为1:=3:5;
答案选A。
7.A
【详解】1L混合液中,n(NH4Cl)=1L×0.5mol/L=0.5mol,n(KCl)=1L×0.16mol/L=0.16mol,n(K2SO4)=1L×0.24mol/L=0.24mol,故n(Cl-)=n(NH4Cl)+n(KCl)=0.5mol+0.16mol=0.66mol;n(K+)=n(KCl)+2n(K2SO4)=0.16mol+2×0.24mol=0.64mol;n(SO42-)=n(K2SO4)=0.24mol;用KCl、NH4Cl、(NH4)2SO4配制,则:n(KCl)=n(K+)=0.64mol;n(NH4Cl)=n(Cl-)-n(KCl)=0.66mol-0.64mol=0.02mol;n[(NH4)2SO4]=n(SO42-)=0.24mol;
答案选A。
8.D
【详解】设原溶液的体积为vL,设取出Cu后溶液中c(Fe3+):c(Fe2+)=2:3=k,则有:c(Fe3+)=2kmol/L,c(Fe2+)=3kmol/L,原溶液中n(Fe3+)=0.1mol/L×vL=0.1vmol,取出Cu后,n(Fe3+)1=2kmol/L×vL=2kvmol,n(Fe2+)=3kmol/L×VL=3kvmol,根据化学方程式列方程:2Fe3++Cu═Cu2++2Fe2+、n(Fe3+)=n(Fe3+)1+n(Fe2+),0.1vmol=2kvmol+3kvmol,得:k=0.02vmol,则反应后溶液中n(Fe3+)1=0.04vmol,反应前n(Fe3+)=0.1vmol,再根据方程式得n(Cu2+)=0.03vmol,所以n(Cu2+):n(Fe3+)1=0.03vmol:0.04vmol=3:4。
故选D。
9.D
【详解】①物质的量是国际单位制中七个基本物理量之一,而摩尔是物质的量的单位,①错误;
②1mol任何粒子集合体约含有个粒子,该粒子可能是分子或原子等,②错误;
③1mol任何粒子的粒子数叫阿伏加德罗常数,符号为,通常用表示,③错误;
④摩尔质量的单位是,④错误;
⑤物质的量浓度常用单位是,还有mmol/L等,⑤错误;
⑥摩尔质量以为单位时,摩尔质量才和相对分子质量或相对原子质量在数值上相等,⑥错误;
综上所述,本题选D。
【点睛】并不是所有的物质都是由分子构成的,有的物质是由原子或离子等构成的;如金刚石是由碳原子构成的,而NaCl是由和构成的。
10.C
【详解】A.1L该HNO3溶液中含有溶质的物质的量n=cV=0.1mol/L×1L=0.1mol,则其中含有溶质的质量m=0.1mol×63g/mol=6.3g,A项正确;
B.硝酸为一元强酸,则0.5 L该溶液中氢离子的物质的量浓度为0.1 mol·L-1,B项正确;
C.溶液具有均一性,溶液的浓度与其取出的体积大小无关,所以从1L该溶液中取出100mL,则取出的溶液中HNO3的物质的量浓度仍为0.1mol/L,C项错误;
D.溶液在稀释过程中溶质的物质的量不变,所以稀释后溶液的浓度c==0.01mol/L,D项正确;
答案选C。
11.D
【分析】核素的符号中,元素符号左上角的数字表示质量数,左下角的数字表示质子数,中子数=质量数-质子数,据此作答。
【详解】①的中子数=18-8=10,②的中子数=18-9=9,③的中子数=12-6=6,④的中子数=24-12=12,⑤的中子数=25-12=13,⑥的中子数=23-11=12,⑦的中子数=23-11=12,⑧的中子数=35-17=18,由此可知,④⑥⑦的中子数相同,均为12,故选D。
12.B
【详解】A.电子的能量越低,运动区域离核越近,电子的能量越高,运动区域离核越远,A错误;
B.电子在核外排列时,根据能量最低原理,电子先排能量低的然后排能量高的,所以电子一般总是先从内层排起,当一层充满后再填充下一层,B正确;
C.氦为稀有气体元素,其最外层只有2个电子,C错误;
D.由电子的排布规律可知,M层最多排18个电子,但为最外层时,最多可排8个电子,D错误;
答案选B。
13.B
【详解】A.左上角为质量数,左下角为质子数,而原子的质子数=核外电子数,因此原子核外电子数为1,A正确;
B.原子核内中子数=质量数-质子数=3-1=2,B错误;
C.与均是由氢元素组成的氢气,化学性质基本相同,C正确;
D.中有放射性核素氘,因此具有放射性,D正确;
答案选B。
14.A
【详解】A.主族元素的最高正化合价等于该元素原子的最外层电子数,非金属元素呈现的最高正化合价不超过该元素原子核外最外层电子数,故A正确;
B.非金属元素呈现的最低负化合价,其绝对值=8-该元素原子核外最外层电子数,故B错误;
C.He原子最外层有2个电子,若某元素原子核外最外层电子数不超过2,则该元素不一定是金属元素,故C错误;
D.若某元素原子核外最外层电子数为5,则该元素不一定是非金属元素,如51号元素锑(Sb)是金属元素,故D错误;
选A。
15.B
【详解】A.X的质子数为x-n,中子数=质量数-质子数=A-(x-n),故A错误;
B.阴离子中质子数=阴离子核外电子数-所带电荷数,则X的质子数=x-n,故B正确;
C.Xn-的最外层也可能有2个电子,为2电子稳定结构,故C错误;
D.若X元素为长周期元素, Xn-的次外层电子数为18,故D错误;
故答案选B。
16.(1) 0.5NA 49g
(2)0.4mol/L
(3)33.6L
(4)1.2mol/L
(5) 62g/mol 16
(6)1:4
【解析】(1)
0.5mol水中含有水分子数为0.5mol×NAmol-1=0.5NA;9g水的物质的量为=0.5mol,分子数为0.5NA,0.5mol硫酸的质量为0.5mol×98g/mol=49g。
(2)
100mL0.2mol/LNa2SO4溶液中Na+的物质的量浓度与溶液体积无关,是硫酸钠浓度的2倍,故Na+的物质的量浓度为0.4mol/L。
(3)
2molNH3的氢原子为6mol,故CH4的物质的量为1.5mol,标准状况下的体积为1.5mol×22.4L/mol=33.6L。
(4)
n(SO)=n(Ba2+)=0.2L×0.9mol/L=0.18mol,所以n(Al3+)=0.18mol×=0.12mol,则100mL溶液中c(Al3+)==1.2mol/L,原溶液中c(AI+)浓度为1.2mol/L。
(5)
Na2R的物质的量为0.2mol,Na2R的摩尔质量为=62g/mol,R的相对原子质量为62-23×2=16。
(6)
在标准状况下,11.2L“人造空气”的物质的量为0.5mol,质量为4.8g,设氧气的物质的量为xmol,氦气的物质的量为ymol,则x+y=0.5mol,32x+4y=4.8g解得x=0.1mol,y=0.4mol,氧气和氦气的分子数之比是1:4。
17.(1) 19 26
(2)AC
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
【详解】(1)Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素,A正确;Fe元素不是一种新元素,B错误;Fe衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的,C正确;Fe衰变放出两个质子后变为Fe,D错误;故选AC。
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
18.(1) E D F 检查装置气密性
(2) 滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差 AC 53%
【分析】装置的组装顺序:合金与酸反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部;反应放热导致氢气的温度偏高,故应冷却后再进行读取氢气的体积,读取实验中生成氢气的体积时上下移动量筒,使其中液面与广口瓶中液面相平,视线与凹液面的最低点水平读取氢气的体积。
【详解】(1)装置的组装顺序:合金与水反应,用排水量气法测定氢气的体积,其中盛水的试剂瓶导管一定要短进长出,利用增大压强原理将水排出,量筒中水的体积就是生成氢气的体积,量筒内导管应伸入量筒底部,故连接顺序为:(A)接(E)(D)接(F),故答案为:E、D、F;一套装置组装好后,都要检查装置是否漏气,故答案为:检查装置气密性;
(2)①滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差,故答案为:滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差;
②A.反应放热导致温度升高,气压增大,故应冷却后再读取氢气的体积,故A正确;
B.反应放热导致温度升高,所以不能在乙管中液面不再上升时就读数,应冷却到室温后再读取氢气的体积,故B错误;
C.读取实验中生成氢气的体积时应上下移动量气管乙,使甲、乙中液面左右相平,以保证甲中气体压强与大气压相等,故C正确;
D.读取实验中生成氢气的体积时应上下移动量气管乙,使甲、乙中液面左右相平,以保证甲中气体压强与大气压相等,故D错误;
故选AC;
③设5.1g镁铝合金中铝的质量为x,则产生的气体由Mg、Al与稀硫酸反应产生,则由关系式:解得:
解得:,解得x=2.7g,则合金中铝的质量分数为。
19.(1)4
(2)0.04
(3)C
(4) 4.6 250
【详解】(1)该“84消毒液”的物质的量浓度约为=≈4.0mol·L-1,故答案为:4.0;
(2)某同学取100mL该“84消毒液”中Na+浓度为4.0mol·L-1,稀释100倍后用于消毒,故稀释后的溶液中c(Na+)==0.04mol·L-1,故答案为:0.04;
(3)A.用固体配制一定物质的量浓度的溶液需要的仪器分别为:天平(含砝码)、烧杯、玻璃棒、500mL容量瓶和胶头滴管等,故如图所示的仪器中,有A、B两种是不需要的,还需要玻璃棒和胶头滴管两种玻璃仪器,A错误;
B.由于在定容步骤中还需向容量瓶中加入蒸馏水,故容量瓶用蒸馏水洗净后,不一定要烘干后才能用于溶液配制,B错误;
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致溶质的物质的量减少,故使所配溶液的浓度偏低,C正确;
D.需要称量NaClO固体的质量为0.5L×4.0mol·L-1×74.5g/mol=149.0g,D错误;
故答案为:C;
(4)①所配制的稀硫酸中,H+的物质的量浓度为2×2.3mol·L-1=4.6mol·L-1;故答案为:4.6;
②根据配制过程中溶质的量保持不变,设需用浓硫酸的体积为VmL,则有:1.84g·cm-3×VmL×98%=2L×2.3mol·L-1×98g/mol,解得:V=250,故答案为:250。
答案第1页,共2页
答案第1页,共2页
